二丙二醇(DPG)是许多广泛使用的商业产品的组成部分。DPG分为LO+和工业级。前者较为昂贵,主要用于化妆品、香料、洗涤剂和食品添加剂等领域所需的优质原料;后者价格较低,被广泛用作生产工业溶剂的原料,如增塑剂、聚酯树脂、聚氨酯多元醇和醇酸树脂,这些溶剂不需要高质量的DPG[1]。TPG是一种无色或微黄色的液体,有氨味,可用作医药原料、保湿剂、抗氧化剂、乳液稳定剂、水溶性涂料基材、合成树脂溶剂,以及染料、纤维处理剂和防腐添加剂等生产中的中间体。它也是紫外光固化单体三丙二醇二丙烯酸酯(TPGD)的主要原料,广泛应用于隧道、大坝、矿山防水封堵和建筑地基加固[2]。
DPG和TPG的生产方式有2种,一种是PO水合制备PG的工艺过程中副产少量的DPG,均相催化剂和非均相催化剂均可用于PO的水合反应,均相催化剂采用硫酸[3]和某些酸盐[4, 5],非均相催化剂采用离子交换树脂[6-8]、固体碱[9]和固体酸[10, 11]催化剂。但该方法产品产量难以控制,不适合工业化生产的需求。另一种是由PO在酸碱条件下与PG缩合开环后得到,此方法是DPG和TPG的主要来源,均相催化剂一般为硫酸[1]、酸性气体[12]和某些碱盐[13, 14]。非均相催化剂一般为固体酸[15]。Levene等[1]发现,在存在微量硫酸的情况下,PO可与PG缩合生成DPG,但是液体酸易腐蚀设备且副产物较多;Britton等[12]使用SO2气体催化合成DPG,但由于反应剧烈、难以控制,二氧化硫是不稳定的,很容易氧化;Harvey等[13]介绍了有机催化剂乙醇胺在低温下催化环氧丙烷开环反应,但环氧丙烷的转化率仅为70%;Ernest等[14]报道了用NaOH和KOH合成DPG,然而该反应需要较高的温度,催化剂会腐蚀设备;梁荣宁自制了SO42-/Fe2O3固体酸,但是反应还需要相转移催化剂的参与,因此其不适用于工业化生产[15]。这些酸碱催化的反应都可以获得较好的结果,但是由于酸和碱都具有腐蚀性,对于设备的材质要求很高。由于是均相反应,在反应结束以后都需要对催化剂进行中和,这样一方面会产生大量的含盐废水,另一方面由于盐的存在对于产品的后续提纯造成了很大的影响。此外,由于中和过程的存在,对于产品的连续化生产也造成了影响。
近年来,固体酸催化剂已经广泛应用于PO与醇的醚化反应[16, 17],且均取得了良好的反应结果。本论文以酸性分子筛[18-20]作为催化剂,探索开发一条绿色合成新路线,对PO和PG合成DPG和TPG的反应进行了研究。酸性催化剂得到的产品质量为LO+级,比碱性催化剂得到的产品品质高,同时使用固体酸作为催化剂避免了催化剂的中和步骤,减少了废水和盐的产生。由于催化剂为非均相催化剂,产物与催化剂的分离变得更加简单易行,同时也为工业化连续生产提供了便利。本论文对H-ZSM-5分子筛催化PO和PG反应进行了研究,建立了动力学模型,并确定了适宜的反应条件,为DPG和TPG的工业化生产提供了理论依据,并对催化剂的失活原因进行了初步探索。
1 实验部分 1.1 材料环氧丙烷(PO,质量分数为99.0%)和丙二醇(PG,质量分数为99.0%)购自希恩斯试剂。乙二醇(EG,质量分数为99.0%)、ZSM-5和13X分子筛[n(硅)/n(铝)为25~30]购自麦克林试剂。
1.2 仪器实验在配有进料罐、加热套、冷却盘管、取样管线和单流搅拌器的500 mL不锈钢高压间歇反应釜中进行。控制器(WHF)用于控制反应釜中的温度和搅拌器速度,采用外接氮气罐控制压力。
1.3 实验过程将预定配比的催化剂和PG加入反应釜中,密闭反应釜后用氮气置换3次后抽真空,最后加热到反应温度。当温度升至设定温度后迅速加入设定配比的PO,开始计时,并在此温度下反应6 h,每间隔1 h取样3 g进行分析,反应完毕后将温度降至室温,然后打开反应釜, 过滤去除催化剂后,对反应产物进行分析。
1.4 分析采用国产GC-9700-2气相色谱仪测定样品中PO、PG、DPG和TPG的浓度,采用HP-INNOWax (30 m×0.32 mm×0.5 μm)高极性毛细管柱分离样品中的化合物,氮气作为载气。进样器和检测器温度分别设定为100和280 ℃。以10 ℃·min-1的速度将柱温从100 ℃保留4 min,升高到250 ℃保留1 min,每次取样体积为0.2 μL。以乙二醇为内标物,以标准品中各组分的相对色谱峰面积为响应值,建立内标定量曲线并计算。PO的转化率(X)、DPG和TPG选择性(S)和产率(Y)的计算公式如式(1)~式(4):
| $ X_{\mathrm{PO}}=\frac{n_0-n(\mathrm{PO})}{n_0} \times 100 \% $ | (1) |
| $ S_{\mathrm{DPG}}=\frac{n(\mathrm{DPG})}{n(\mathrm{PO})-n_0} \times 100 \% $ | (2) |
| $ S_{\mathrm{DPG}+\mathrm{TPG}}=\frac{2 n(\mathrm{DPG})+n(\mathrm{TPG})}{2\left[n(\mathrm{PO})-n_0\right]} \times 100 \% $ | (3) |
| $ Y=X S $ | (4) |
式(1)~式(4)中:XPO为PO的转化率;n0为PO的初始物质的量;n(PO)为PO的最终物质的量;SDPG为DPG的选择性;n(DPG)为DPG的最终物质的量;SDPG+TPG为DPG和TPG的总选择性;n(TPG)为TPG的最终物质的量。
2 结果与讨论 2.1 催化反应机理氢型分子筛的内表面上有许多Bronsted酸中心[21]。反应物被添加到反应釜后,PO分子进入分子筛孔道,由于孔道内表面酸性中心的存在,C—O键上的电子向氧方向移动,导致C原子带正电荷,有利于亲核试剂PG和DPG的进攻。亲核试剂总是从离开基团的后面进攻中心碳原子。PG和DPG分子中的醇羟基攻击具有部分碳正离子特征的一级碳原子、二级碳原子,使C—O键断裂,形成DPG和TPG分子。DPG的形成机理如图 1所示,TPG也是如此。
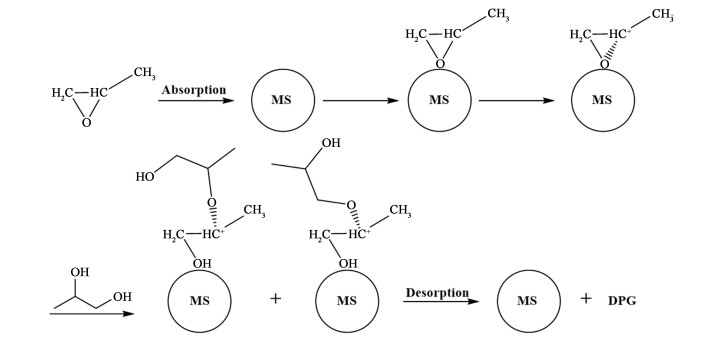
|
| 图 1 DPG的形成机理 Fig.1 The formation mechanism of DPG |
| |
考察了催化剂类型、反应温度、内外扩散阻力、反应物物质的量之比等因素对PO与PG催化缩合反应速率的影响。
2.2.1 催化剂类型的影响该反应在温度为413 K,n(PG)∶n(PO)为1.6∶1.0,催化剂的量为反应物总质量的1%的条件下进行,催化剂为H-ZSM-5和H-13X分子筛。将ZSM-5和13X分子筛活性中心上的Na+用H+进行交换得到H-ZSM-5和H-13X分子筛。ZSM-5和13X分子筛用相同的处理方法进行改性,具体步骤如下:H+在室温下用1 mol·L-1的HCl溶液交换2次,每次交换24 h,然后过滤,用去离子水洗涤至中性,100 ℃干燥12 h。最后在管式炉中以5 ℃·min-1加热至200 ℃保持2 h,再以5 ℃·min-1加热至450 ℃保持6 h,处理后的催化剂被标记为H-ZSM-5和H-13X分子筛。
PO的转化率、DPG和TPG的总选择性如图 2所示。结果表明,与未加催化剂的反应相比,加催化剂的反应的PO的转化率、DPG和TPG的总选择性大大提高,此外,H-ZSM-5的性能优于H-13X。这是一个预期的结果,因为与微孔H-13X相比,介孔H-ZSM-5具有更好的热稳定性、形状选择性和活性,并且对于大分子扩散具有更好的扩散性能。因此,H-ZSM-5分子筛被用作PO与PG缩合的催化剂,并在该催化剂的存在下建立了动力学模型。
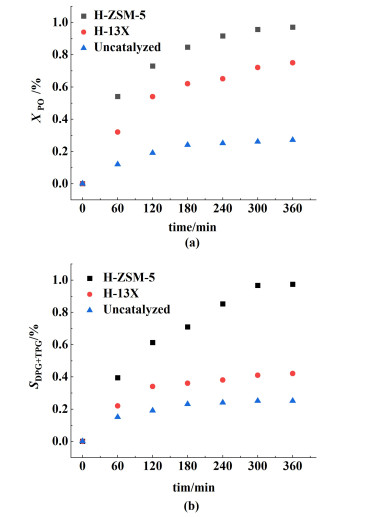
|
| 图 2 (a) 催化剂类型对PO转化率的影响; (b) 催化剂类型对DPG和TPG选择性的影响 Fig.2 (a) Effect of catalyst type on conversion of PO; (b) effect of catalyst type on selectivity of DPG and TPG |
| |
在进行动力学研究之前,物理因素对反应速率扩散的研究是至关重要的,外部传质阻力对反应速率的影响直接与搅拌速度有关。假设反应为稳态反应,反应物在H-ZSM-5分子筛上的扩散速率、表面化学反应速率和产物的扩散速率相等,等于反应的总速率。为了研究扩散对反应速率的影响,实验在413 K,n(PG)∶n(PO)为1.6∶1.0,催化剂量为总反应物质量的1%,压力为0.5 MPa,反应时间360 min,搅拌速度分别340和640 r·min-1的条件下进行,图 3为实验结果。
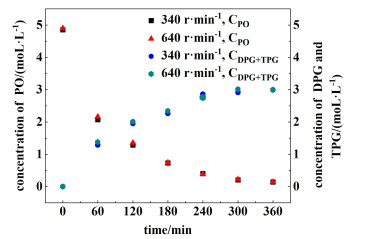
|
| 图 3 搅拌速度对反应物和产物浓度的影响 Fig.3 Effect of stirring speed on the concentration of reactant and product |
| |
从图 3可以看出,反应速率不随搅拌速度的变化而变化,其中扩散过程并不是控制速率的步骤。因此,整个反应可以认为是由化学反应控制的,采用温度准则进行研究,所有实验均在恒定搅拌速度340 r·min-1下进行。
2.2.3 反应物物质的量之比的影响在催化剂用量为反应物总质量的1%,反应温度为413 K,n(PG)∶n(PO)为2.0∶1.0、1.6∶1.0、1.4∶1.0,反应时间为360 min的条件下进行催化反应。结果如图 4所示,结果表明,PO的转化率随着n(PG)∶n(PO)的增加而增加。在规定的条件下,PO的平均反应速率可以用式(5)计算[8]。
| $ -r_{\mathrm{PO}, \text { ave }}=\frac{\int_{c_0}^c-r_{\mathrm{PO}} \mathrm{d} c}{c-c_0} $ | (5) |
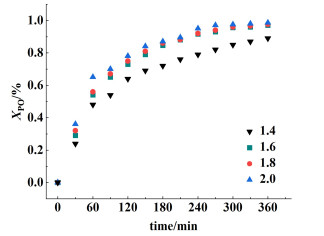
|
| 图 4 PG与PO物质的量之比对反应速率的影响 Fig.4 Effect of PG/PO mole ratio on reaction rate |
| |
式(5)中:rPO,ave为PO的平均反应速率; c为PO的最终物质的量浓度; c0为PO的初始物质的量浓度; -rPO为PO的反应速率,可由PO物质的量浓度随时间变化的曲线的斜率求得,
图 5显示了反应时间360 min内DPG和TPG的总选择性以及在规定反应条件下计算的平均反应速率值。从图 5可以看出,随着n(PG)∶n(PO)的增加,DPG和TPG的总选择性先增大后减小。结果与预期一致,因为当n(PG)∶n(PO)过高时,PO浓度过低,方程式(6)和式(7)中的反应会被抑制。根据2条线的交点如图 5所示,合适的n(PG)∶n(PO)为1.53∶1.00。
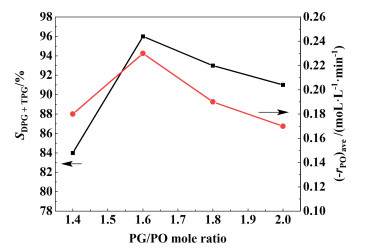
|
| 图 5 n(PG)∶n(PO)对平均反应速率的影响 Fig.5 Effect of n(PG)∶n(PO) on the average reaction rate |
| |
实验在高压间歇反应釜中进行,观察各参数对反应速率的影响。在每个实验中,研究参数是变化的,而其他条件保持不变。
实验数据表明,在没有催化剂的情况下,TPG的形成是可以忽略的,但在催化反应中DPG和TPG都会生成。因此,PO与PG的缩合反应,对于非催化反应,可以认为是一步反应,对于催化反应,可以认为是两步连续反应。
| $ \mathrm{PO}+\mathrm{PG} \xrightarrow{k_1} \mathrm{DPG} $ | (6) |
| $ \mathrm{PO}+\mathrm{DPG} \xrightarrow{k_2} \mathrm{TPG} $ | (7) |
如果方程(6)和(7)给出的反应为不可逆、双分子和恒密度反应,所以反应速率表达式为:
| $ \begin{gathered} r_{\mathrm{P} 0}=\frac{-\mathrm{d} c(\mathrm{PO})}{\mathrm{d} t}=k_1 c(\mathrm{PO}) c(\mathrm{PG})+ \\ k_2 c(\mathrm{PO}) c(\mathrm{DPG}) \end{gathered} $ | (8) |
| $ r_{\mathrm{PG}}=\frac{-\mathrm{d} c(\mathrm{PG})}{\mathrm{d} t}=k_1 c(\mathrm{PO}) c(\mathrm{PG}) $ | (9) |
| $ \begin{gathered} r_{\mathrm{DPG}}=\frac{\mathrm{d} c(\mathrm{DPG})}{\mathrm{d} t}=k_1 c(\mathrm{PO}) c(\mathrm{PG})- \\ k_2 c(\mathrm{PO}) c(\mathrm{DPG}) \end{gathered} $ | (10) |
| $ r_{\mathrm{TPG}}=\frac{\mathrm{d} c(\mathrm{TPG})}{\mathrm{d} t}=k_2 c(\mathrm{PO}) c(\mathrm{DPG}) $ | (11) |
式(8)~式(11)中:k1、k2是反应速率常数;rPO、rPG、rDPG和rTPG分别为PO、PG、DPG和TPG的反应速率;c(PO)、c(PG)、c(DPG)和c(TPG)分别为不同时间下PO、PG、DPG和TPG的物质的量浓度。利用Matlab R2019a软件对方程式(8)~式(11)中实验数据进行非线性回归分析。
2.4 反应动力学常数的测定根据文献[22],催化剂催化PO与醇之间的反应为SN2反应,该反应一般为二级反应,反应速率受PO浓度和PG浓度的影响。
假设:反应器为全混流反应器;每步反应都按照基元反应考虑;不考虑其它可能发生的副反应。PO的总消耗速率方程式(4)已给出。
通过实验确定了不同温度和时间下各组分浓度随时间的变化,如图 6展示了在413 K,催化剂用量为1%、n(PG)∶n(PO)为1.53∶1.00的条件下反应液中各组分的浓度随时间的变化,任何温度下不同时间的总消耗方程可以写成:
| $ \begin{aligned} Y_{(i)}= & k_1 c(\mathrm{PO})_{(i)} c(\mathrm{PG})_{(i)}+k_2 c(\mathrm{PO})_{(i)} c(\mathrm{DPG})_{(i)} \\ & i=0, 60, 120, 180, \cdots, 360 \text { (取样点) } \end{aligned} $ | (12) |
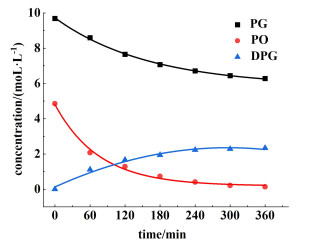
|
| 图 6 反应液中各组分的浓度随时间的变化 Fig.6 The variation of the concentration of each component in the reaction solution over time |
| |
式(12)中:k1、k2是反应速率常数;i为每个时间的取样点;Y(i)=- dc(PO)/dt|t=i,可由PO物质的量浓度随时间变化的曲线的斜率求得;c(PO)(i)为i时刻下的PO物质的量浓度;c(PG)(i)为i时刻下的PG物质的量浓度;c(DPG)(i)为i时刻下的DPG物质的量浓度。
公式(12)实际上包含2个未知数k1和k2,并且可以使用最小二乘法获得超定方程组的最优解。计算得到的每个温度点的k1和k2值如表 1所示。
| 温度/K | k1/(103 mol·L-1·min-1) | k2/(103 mol·L-1·min-1) |
| 383 | 3.729 | 0.900 |
| 393 | 5.831 | 1.811 |
| 403 | 8.454 | 3.802 |
| 413 | 11.600 | 4.601 |
| 423 | 18.731 | 6.101 |
将lnk对1/T作图,见图 7,每一步反应的活化能(Ea)和频率因子(k0)可以根据直线的斜率和纵轴的截距计算得出,然后反应速率方程就得以求解。活化能(Ea)和频率因子(k0)的值列于表 2中。
| $ k=k_0 \exp \left(-E_{\mathrm{a}} / R T\right) $ | (13) |
| $ \ln k=-E_\alpha / R T+\ln k_0 $ | (14) |

|
| 图 7 速率常数与温度的关系 Fig.7 The relationship between lnk and 1/T |
| |
| Reaction step | k0/(10-4mol·L-1·min-1) | Ea/(kJ·mol-1) |
| k1 | 1.208 0 | 47.389 7 |
| k2 | 46.999 0 | 77.137 3 |
式(13)~式(14)中:k为反应速率常数;R为摩尔气体常数,8.314 J·moL-1·K-1;T为反应温度;lnk为反应速率常数k的对数值;lnk0为频率因子k0的对数值。
由图 7可以看出,5个温度点的相关系数均大于0.99,lnk和1/T也呈良好的线性关系,说明上述假设能够成立。
应用阿伦尼乌斯方程(13)和(14),使用表 2中给出的值,反应速率常数k与温度T的函数关系如式(15)和式(16):
| $ k_1=\exp (9.40-5700 / T) $ | (15) |
| $ k_2=\exp (13.06-9278 / T) $ | (16) |
所以PO与PG缩合生成DPG和TPG反应的宏观动力学模型可以写成:
| $ \begin{gathered} \frac{-\mathrm{d} c(\mathrm{PO})}{\mathrm{d} t}=\exp \left(9.40-\frac{5700}{T}\right) c(\mathrm{PO}) c(\mathrm{PG})+ \\ \quad \exp (13.06-9278 / T) c(\mathrm{PO}) c(\mathrm{DPG}) \end{gathered} $ | (17) |
式(17)中:c(PO)、c(PG)和c(DPG)分别为t时刻下的PO、PG和DPG的物质的量浓度,
将表 1中得到的每一步反应的速率常数代入方程式(8)~式(11),可以得到不同温度下的三元一阶线性非齐次微分方程组。方程组初始条件如式(18):
| $ \begin{gathered} \left.c(\mathrm{PO})\right|_{t=0}=c(\mathrm{PO})_0, \left.c(\mathrm{PG})\right|_{t=0}=c(\mathrm{PG})_0, \\ \left.c(\mathrm{DPG})\right|_{t=0}=\left.c(\mathrm{TPG})\right|_{t=0}=0 \end{gathered} $ | (18) |
式(18)中:c(PO)|t=0、c(PO)0为PO的初始物质的量浓度;c(PG)|t=0、c(PG)0为PG的初始物质的量浓度;c(DPG)|t=0、c(TPG)|t=0=0分别为DPG的TPG初始物质的量浓度。
方程(8)~式(11)具有非常复杂的形式,且单纯通过方程难以计算,因此使用数值方法求解方程组非常重要。本研究采用一阶龙格-库塔法[23]求解该方程组。在一定的n(PG)∶n(PO) (为1.53∶1.00)下,催化剂用量为总反应物质量的1%,通过在383~423 K范围内改变温度获得相应的k值,然后可以得到适宜条件下的各物质浓度随时间变化的图。各物质在适宜条件下的浓度拟合曲线如图 8所示。
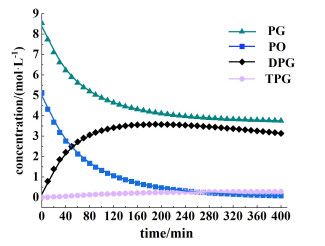
|
| 图 8 适宜条件下各物质浓度的拟合曲线 Fig.8 The fitting curve of the concentration of each substance under the proper condition |
| |
从图 8中可以得出,当温度为408 K时,DPG和TPG的浓度在200 min时最大值为3.812 7 mol·L-1,其中DPG的浓度在190 min时最大值为3.578 7 mol·L-1。
在适宜的反应条件下,即413 K时,催化剂用量为总反应物质量的1%,n(PG)∶n(PO)为1.53∶1.00,根据模型通过数值积分计算每种物质随时间变化的浓度曲线,实验点如图 9所示。
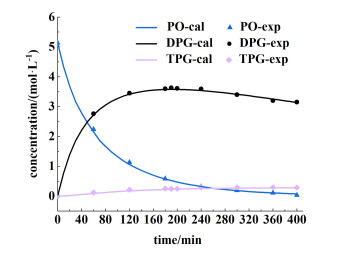
|
| 图 9 实验点和动力学模型计算曲线 Fig.9 Experimental points and calculated curves from kinetic model |
| |
由图 9可以看出,计算得到的曲线和实验点之间有很好的一致性。在200 min时PO的转化率为98.8%,DPG和TPG的总选择性最高为97.2%,其中DPG的选择性在190 min达到最高为91.3%。
2.6 催化剂失活的原因在上述适宜条件下反应多个周期,H-ZSM-5分子筛催化剂的活性在7个反应周期后显著降低,DPG和TPG的总收率从96.0%降至51.6%。因此,选择新鲜催化剂和第7个反应循环后的催化剂作为研究对象。所研究的催化剂分别标记为Fresh和Used。
2.6.1 催化剂的表征使用日本Rigaku smartlab自动X射线衍射仪对粉末状样品的物相进行检测,检测条件为:Cu_Kα辐射源,管电压100 kV,管电流40 mA,扫描范围2θ为5°~35°,扫描速率8(°)·min-1,扫描步长为0.02°[24]。
使用美国麦克公司Micromeritics ASAP 2460自动吸附仪测量样品的比表面积、孔体积等结构性质进行测量。在测试之前,样品在300 ℃的真空条件下活化6 h,然后在-196 ℃下静态吸附氮气进行分析。通过BET方法和单点吸附法测定总表面积和体积,微孔体积和面积由t-plot法获得,BJH解吸累积法用于获得介孔体积和面积,孔径由BJH解吸平均孔径法确定[25]。
使用德国Bruker公司TENSOR 27型吡啶吸附红外光谱仪测量样品的酸位分布和酸量。在真空环境下以5 ℃·min-1的速率升至400 ℃保持5 h,降至100 ℃后吡啶吸附1 h,之后以5 ℃·min-1的速率升至350 ℃进行测定吡啶吸附红外光谱图。根据公式cB/L=(BAB/L)/δB/Lm来计算各类型酸量。式中:cB/L为B酸或L酸酸量;B为样品片的面积;AB/L为B酸或L酸的吡啶吸附曲线的峰面积;δB/L为B酸或L酸的消光系数;m为样品的质量[26]。
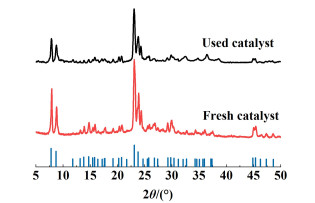
2.6.2 XRD结果图 10展示了新制备催化剂和使用过的催化剂的XRD图谱。
|
| 图 10 新制备的和使用过的H-ZSM-5的XRD谱图 Fig.10 XRD patterns of fresh and used H-ZSM-5 molecular sieves |
| |
7°和10°之间的2个衍射峰和22.5°和25.0°之间的3个衍射峰是H-ZSM-5分子筛(MFI结构)的特征峰[27-31]。从图 10可以明显地看出,新制备的催化剂和失活的催化剂与H-ZSM-5标准卡片相比,仍然具有H-ZSM-5特征峰,且结晶度也较好,这意味着催化剂虽然失活,但是晶体结构没有被破坏。结果表明,积碳是催化剂失活的主要原因。
2.6.3 氮气吸附和脱附测量结果H-ZSM-5分子筛的比表面积和孔体积如表 3所示。由表 3可以看出,失活后的催化剂的比表面积和孔体积显著降低,因此可以推断失活的原因可能是活性中心被覆盖或孔道被堵塞。
| Sample | Specific surface area/(m2·g-1) | Pore volume/(cm3·g-1) | Pore diameter/nm | |||||
| STotal | SMeso | SMicro | VTotal | VMeso | VMicro | |||
| Fresh | 436 | 327 | 109 | 0.25 | 0.19 | 0.06 | 3.195 0 | |
| Used | 55 | 33 | 22 | 0.09 | 0.08 | 0.01 | 5.091 0 | |
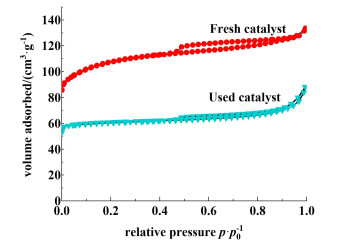
新鲜的和使用过的H-ZSM-5分子筛的N2吸附-脱附等温线如图 11所示。
|
| 图 11 新制备的和使用过的H-ZSM-5样品的N2吸附-脱附等温线 Fig.11 N2 adsorption-desorption isotherms of fresh and used H-ZSM-5 |
| |
由图 11可以看出,在相对压力p/p0小于0.45时,新鲜和使用过的催化剂的N2吸附-脱附等温线几乎平行于X轴,这是微孔结构的典型特征。然而,滞后环是介孔度的指示,这表明新鲜和使用过的H-ZSM-5分子筛之间存在介孔,有利于反应体系中的物质在孔道内扩散,且失活催化剂的氮气吸收量明显低于新鲜催化剂。由表 3可知,新鲜催化剂的介孔比表面积为80 m2·g-1,占总比表面积的18.3%。失活后,催化剂的BET比表面积从436下降到55 m2·g-1,下降了87.4%。失活催化剂的微孔比表面积占总比表面积的60%,表明尽管在催化剂失活过程中微孔和介孔同时积炭,但微孔的炭沉积程度远大于介孔。
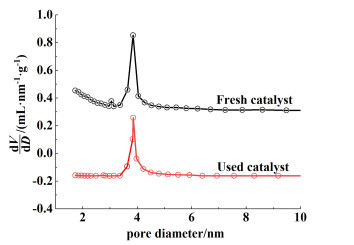
H-ZSM-5样品的孔径分布如图 12所示。明显可以看出,微孔和介孔的体积均有所减小,小于3.4 nm的孔径基本消失。这也进一步证明了微孔的积炭程度远大于中孔。
|
| 图 12 H-ZSM-5分子筛的孔径分布图 Fig.12 The mesopore size distribution of fresh and used H-ZSM-5 samples |
| |
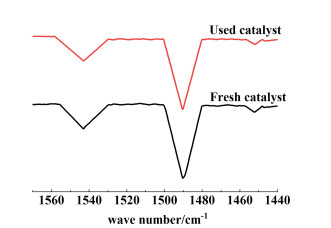
通过Py-FTIR表征,测定了新制备的和使用过的H-ZSM-5分子筛的酸量和酸类型。使用前后H-ZSM-5分子筛的Py-FTIR谱图如图 13所示,同时,其酸量分布如表 4所示。波数1 540~1 554 cm-1处是吡啶在B酸性位点上的化学吸附,波数1 490 cm-1处是吡啶同时在L和B酸性位点上的化学吸附,波数1 450 cm-1处是吡啶在L酸性位点上的化学吸附。
|
| 图 13 H-ZSM-5分子筛的吡啶吸附红外光谱图 Fig.13 Py-FTIR spectra of fresh and used H-ZSM-5 |
| |
| Sample | Acid amounts/(mmol·g-1) | ||
| L | B | Total acid | |
| Fresh | 2.16 | 3.51 | 5.72 |
| Used | 2.10 | 3.39 | 3.47 |
由图 13可知,新制备的和使用过的H-ZSM-5均存在L酸和B酸性位点,且由表 4可以看出与新鲜催化剂相比,失活催化剂的酸量几乎没有降低。因此,可以推断,失活的原因不是活性部位被覆盖,而是孔道被堵塞。
分子尺寸可以根据分子的范德华半径来进行考虑,并且每个物质的分子直径可以通过高斯软件和Multiwfn软件进行计算,计算结果如表 5所示。
| 组分 | 直径/nm |
| PO | 0.675 0 |
| PG | 0.721 8 |
| DPG | 1.025 0 |
| TPG | 1.331 2 |
| 三缩四丙二醇 | 3.215 0 |
由图 12和表 5可以明显看出,三缩四丙二醇的分子直径大于H-ZSM-5分子筛的部分孔的孔径。所以可以推断是三缩四丙二醇堵塞了H-ZSM-5分子筛的孔道[32, 33]。
3 结论在H-ZSM-5分子筛作用下,PO与PG的缩合反应遵循串联不可逆反应机理,该反应为二级动力学反应,DPG和TPG的活化能(Ea)分别为47和77 kJ·mol-1。使用数值分析方法,经过优化确定了生成DPG和TPG适宜的反应条件如下:n(PG)∶n(PO)为1.53∶1.00,温度为408 K,反应时间为200 min,其中在190 min时DPG的浓度达到最大值。在此条件下,DPG和TPG的总收率在200 min时达到最大值96.03%,其中DPG在190 min时达到最大值88.38%。新制备的和使用过的催化剂表征结果表明,失活催化剂的晶体结构并未发生根本改变,催化剂失活的主要原因不是活性中心被覆盖,而是孔道积炭,导致孔道堵塞,反应物的扩散受到抑阻,导致活性下降,根据反应体系中各物质的分子直径,积炭物种可能是三缩四丙二醇。
| [1] |
LEVENE P A, WALTI A. On condensation products of propylene oxide and of glycidol[J]. Journal of Biological Chemistry, 1927, 75(1): 325-336. DOI:10.1016/S0021-9258(18)84205-3 |
| [2] |
FIUME M M, BERGFELD W F, BELSITO D V, et al. Safety assessment of propylene glycol, tripropylene glycol, and PPGs as used in cosmetics[J]. International Journal of Toxicology, 2012, 31(5 Suppl): 245S-260S. |
| [3] |
BENHAM A L, KURATA F. Kinetics of the catalyzed and uncatalyzed liquid-phase hydration of propylene oxide[J]. AIChE Journal, 1955, 1(1): 118-124. DOI:10.1002/aic.690010118 |
| [4] |
MASUDA T, ASANO K, HORI N, et al. Method for preparing ethylene glycol and/or propylene glycol: US 4937393A[P]. 1990-06-26
|
| [5] |
KOZLOVSKY I A, KOZLOVSKY R A, KOUSTOV A V, et al. Kinetics and products distribution of selective catalytic hydration of ethylene- and propylene oxides in concentrated aqueous solutions[J]. Organic Process Research & Development, 2002, 6(5): 660-664. |
| [6] |
JAGANATHAN R, CHAUDHARI R V, RAMACHANDRAN P A. Hydration of propylene oxide using ion-exchange resin catalyst in a slurry reactor[J]. AIChE Journal, 1984, 30(1): 1-7. DOI:10.1002/aic.690300102 |
| [7] |
REMAN W G, KRUCHTEN E V. Process for the preparation of alkylene glycols: US5488184A[P]. 1996-01-30
|
| [8] |
AKYALCIN S. Kinetic study of the hydration of propylene oxide in the presence of heterogeneous catalyst[J]. Chemical Industry and Chemical Engineering Quarterly, 2017, 23(4): 573-580. DOI:10.2298/CICEQ170203011A |
| [9] |
刘卓, 吴功德, 孙楠楠, 等. 固体强碱绿色催化环氧丙烷水解合成1, 2-丙二醇[J]. 精细化工, 2008, 25(11): 1132-1134, 1144. LIU Zhuo, WU Gongde, SUN Nannan, et al. Synthesis of propylene glycol from propylene oxide by hydrolysis over green catalyst of solid strong base[J]. Fine Chemicals, 2008, 25(11): 1132-1134, 1144. DOI:10.3321/j.issn:1003-5214.2008.11.022 (in Chinese) |
| [10] |
LIU J, YANG J, LI C, et al. Catalytic applications of sulfonic acid functionalized mesoporous organosilicas with different fraction of organic groups in the pore wall[J]. Journal of Porous Materials, 2009, 16(3): 273-281. DOI:10.1007/s10934-008-9197-8 |
| [11] |
HORBATENKO Y, PÉREZ J P, HERNÁNDEZ P, et al. Reaction mechanisms for the formation of mono- and dipropylene glycol from the propylene oxide hydrolysis over ZSM-5 zeolite[J]. The Journal of Physical Chemistry C, 2014, 118(38): 21952-21962. DOI:10.1021/jp504432a |
| [12] |
BRITTON E C, SEXTON A R. Method of preparing glycols and monoethers of glycols: US2807651[P]. 1957-09-24
|
| [13] |
HARVEY R. Preparation of reaction products of propylene oxide and alcohols: US2053708A[P]. 1936-09-08
|
| [14] |
ERNEST J, LANGDON W K, LEVIS J, et al. Substituted morpholines: US3154544A[P]. 1964-10-27
|
| [15] |
梁荣宁. 相转移催化法合成一缩二丙二醇的工艺研究[D]. 山东青岛: 青岛科技大学, 2008 LIANG Rongning. Synthesis of dipropylene glycol by phase transfer catalysis[D]. Shandong Qingdao: Qingdao University of Science & Technology, 2008 (in Chinese) |
| [16] |
王立军, 李军. β沸石催化精馏合成丙二醇单乙醚的研究[J]. 精细石油化工, 2003, 20(5): 17-19. WANG Lijun, LI Jun. Study on synthesis of propylene glycol monoethyl ether with β zeolite as catalyst by catalytic distillation[J]. Speciality Petrochemicals, 2003, 20(5): 17-19. (in Chinese) |
| [17] |
朱俊健, 黄鑫, 孙昊, 等. 连续管式反应制备丙二醇丁醚的研究[J]. 现代化工, 2017, 37(5): 181-184. ZHU Junjian, HUANG Xin, SUN Hao, et al. Study on preparation of propylene glycol butyl ether by continuous tube reaction[J]. Modern Chemical Industry, 2017, 37(5): 181-184. (in Chinese) |
| [18] |
CHEN L, SUN M, WANG Z, et al. Hierarchically structured zeolites: From design to application[J]. Chemical Reviews, 2020, 120(20): 11194-11294. DOI:10.1021/acs.chemrev.0c00016 |
| [19] |
GACKOWSKI M, DATKA J. Acid properties of hierarchical zeolites Y[J]. Molecules, 2020, 25(5): 1044. DOI:10.3390/molecules25051044 |
| [20] |
ATES A. The modification of aluminium content of natural zeolites with different composition[J]. Powder Technology, 2019, 344: 199-207. DOI:10.1016/j.powtec.2018.12.018 |
| [21] |
YANG H, CHEN Z. Exploring the mechanism and counterion activity regulation in the CoⅢ(salen)-catalyzed hydration of propylene oxide[J]. Physical Chemistry Chemical Physics: PCCP, 2020, 22(39): 22417-22425. DOI:10.1039/D0CP03996A |
| [22] |
GUIBERT R M, PLANK C A, GERHARD E R. Kinetics of propylene oxide-oxypropylated glycerol reaction[J]. Industrial & Engineering Chemistry Process Design and Development, 1971, 10(4): 497-500. |
| [23] |
LARRAÑAGA O, DE CÓZAR A, COSSÍO F P. Mono- and di-alkylation processes of DNA bases by nitrogen mustard mechlorethamine[J]. Chemphyschem: a European Journal of Chemical Physics and Physical Chemistry, 2017, 18(23): 3390-3401. DOI:10.1002/cphc.201700937 |
| [24] |
GUAN L, HUANG C, HAN D, et al. HZSM-5 zeolite cross-linked with ultrathin siliceous layer for intensifying catalytic cracking and diffusion of n-butane[J]. Fuel, 2022, 315: 123252. |
| [25] |
GORZIN F, DARIAN J T, YARIPOUR F, et al. Novel hierarchical HZSM-5 zeolites prepared by combining desilication and steaming modification for converting methanol to propylene process[J]. Journal of Porous Materials, 2019, 26(5): 1407-1425. |
| [26] |
李君华, 王丽娜, 张丹, 等. ZSM-5酸改性对甲醇芳构化性能的影响[J]. 燃料化学学报, 2019, 47(8): 957-963. LI Junhua, WANG Lina, ZHANG Dan, et al. Effect of ZSM-5 acid modification on aromatization performance of methanol[J]. Journal of Fuel Chemistry and Technology, 2019, 47(8): 957-963. (in Chinese) |
| [27] |
LI J, HAN D, ZI Z, et al. The synthesis of H[Fe, Al]ZSM-5 zeolites with uniform nanocrystals for dimethyl ether to gasoline reaction[J]. Fuel, 2022, 313: 122643. |
| [28] |
WANG Z, ZHANG R, WANG J, et al. Hierarchical zeolites obtained by alkaline treatment for enhanced n-pentane catalytic cracking[J]. Fuel, 2022, 313: 122669. |
| [29] |
BOSNAR S, RAC V, STOŠIĆ D, et al. Overcoming phase separation in dual templating: A homogeneous hierarchical ZSM-5 zeolite with flower-like morphology, synthesis and in-depth acidity study[J]. Microporous and Mesoporous Materials, 2022, 329: 111534. |
| [30] |
QURESHI Z S, ELLOUH M, AITANI A, et al. Efficient conversion of light paraffinic naphtha to aromatics over metal-modified Mo/MFI catalysts[J]. Journal of Porous Materials, 2022, 29(3): 683-692. |
| [31] |
LIU H, WANG Y, YE T, et al. Fully utilizing seeds solution for solvent-free synthesized nanosized TS-1 zeolites with efficient epoxidation of chloropropene[J]. Journal of Solid State Chemistry France, 2022, 307: 122844. |
| [32] |
ROOHOLLAHI H, HALLADJ R, ASKARI S. Catalytic longevity of hierarchical SAPO-34/AlMCM-41 nanocomposite molecular sieve in methanol-to-olefins process[J]. Combinatorial Chemistry & High Throughput Screening, 2021, 24(4): 521-533. |
| [33] |
TONUTTI L, DECOLATTI H, QUERINI C, et al. Hierarchical H-ZSM-5 zeolite and sulfonic SBA-15: The properties of acidic H and behavior in acetylation and alkylation reactions[J]. Microporous and Mesoporous Materials, 2020, 305(prepublish): 110284. |
 2024, Vol. 41
2024, Vol. 41





