2. 陕西省黄金与资源重点实验室, 西安 710055
2. Shaanxi key Laboratory of Gold and Resources, Xi'an 710055, China
含氰废水普遍产生于工业领域,具有成分复杂、含盐量高、毒性大、处理难度大等特点[1],我国仅黄金生产企业每年需要处理的含氰废水量可达到1.2×108 m3,处理不好不仅很大程度上的限制了企业的可持续发展,而且给人类的生存环境带来潜在危险[2]。氰化提金废水的处理方法按照污染物去向可分为破坏法和综合回收法。破坏法有氧化法和微生物法,综合回收法实现工业应用的方法有酸化法和沉淀法等,但存在腐蚀性高、产生HCN有毒气体、生成残渣多、易塞管道等问题[3],其他方法仍然处于实验室研究阶段[4]。因此,寻找一种短流程、高效低耗的处理方法是黄金冶炼企业关注的重点。
絮凝能够使水或液体中悬浮微粒集聚变大或形成絮团,从而加快粒子的聚沉,达到固-液分离。无机絮凝剂如PFC水解会产生大量的聚合阳离子[5, 6],这些阳离子可以通过电荷中和、吸附架桥、沉淀网捕等方法发挥其混凝作用[7-9]。有研究表明该方法处理氰化废水效果并不理想,Mamelkina等[10]在采用混凝法处理氰化废水时发现,在化学混凝中,即便添加铁盐或者铝盐用以增大金属絮体对金属氰络合离子的吸附能力,氰化物去除率也只有25%。电化学氧化法常用于氰化废水的处理,去除氰化物效果良好[11-15]。赵玲玲等[2]采用沉淀-电解氧化联合技术处理高铁氰化提金废水,在电压6 V,极板间距15 mm,电解时间5 h,初始浓度60%的条件下,CNT和CN-的去除率达到99.76%和99.90%。电絮凝法是铁、铝等牺牲阳极通过失电子作用溶出金属离子,水解产生金属氢氧化物具有絮凝作用,从而除去废水中的污染物[16]。Das等[17]采用集成臭氧辅助电絮凝法去除钢铁工业废水中的氰化物,在臭氧生成率1.33 mg ·L-1、臭氧氧化时间40 min、电流密度100 A ·m-2的和电解时间30 min的条件下,总氰浓度由150降为0.1 mg ·L-1(达到国家标准),虽然去除率达到99.93%,但存在处理废水浓度较低的问题。可见,絮凝法不能直接用于处理氰化废水,电化学氧化法虽然处理效果好但仍存在电解质投加量大,处理后余氯浓度高等问题,成本高且含氯废水处理难度更大,电絮凝法在处理废水过程中,普遍存在阳极钝化的问题,阳极产生氧化膜阻碍了阳极溶解以及电化学体系中的电子传递过程[18]。采用联合工艺既能降低电解质添加量,又能提高处理效果的开发是一种新的思路。
因此,研究微电解-絮凝沉淀对氰化废水中重金属离子和氰化物过程的影响及反应机理,对氰化提金废水的治理具有重要的理论和实践意义。
1 材料与方法 1.1 原料分析实验所用的氰化提金废水主要成分及含量如表 1所示。此废水中CNT、CN-和Zn的含量均较高,其中CNT浓度大于800 mg ·L-1,属于高质量浓度的氰化提金废水,Zn元素含量高达672.80 mg ·L-1。
| 离子种类 | 质量浓度/(mg·L-1) |
| CNT | 1 600.20 |
| Cl- | 850.80 |
| CN- | 439.74 |
| Cu(CN)32- | 257.35 |
| Fe(CN)64- | 0.36 |
| Zn(CN)42- | 672.80 |
PFC(工业级)来源:巩义市泉源水处理材料有限公司,所用其他化学试剂均为分析纯。
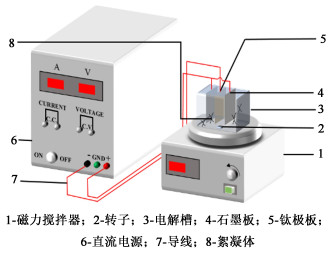
1.2 实验步骤微电解-絮凝实验:本实验先采用PFC为絮凝剂,置于一定量氰化提金废水中,采用3电极体系(1阴2阳)进行电解氧化实验。具体微电解-絮凝实验装置如图 1所示。
|
| 图 1 微电解-絮凝实验装置图 Fig.1 Micro-electrolysis-flocculation sedimentation experimental device diagram |
| |
取100 mL的氰化提金废水置于定制电解槽中,将电极与导线连接,3电极相距一定距离固定于烧杯中,中间电极与阴极相连,两端电极与阳极相连,各极板保持在同一水平面,在不同的电压、电解时间、极板间距、温度、PFC添加量下,开启电源进行微电解-絮凝实验,实验后固液分离,阴极板和沉淀物采用去离子水洗至pH值为7左右置于电热恒温鼓风干燥箱中于60 ℃烘干。
1.3 分析表征采用硝酸银容量法(HJ 484-2009)分析测定CN-、CNT的含量,采用原子吸收光谱仪分析测定Cu、Fe和Zn离子的含量,并根据式(1)计算各离子的去除率。采用硝酸银滴定法(GB 11896-89)分析测定Cl-的含量,采用D/MAX2200型X射线衍射仪分析阴极板和沉淀物。
离子去除率按式(1)计算。
| $ E_i=\frac{C_{0, i}-C_{\mathrm{e}, i}}{C_{0, i}} \times 100 \% $ | (1) |
式(1)中:Ei为对应i离子的去除率,%;C0, i为i离子的初始浓度,mg ·L-1;Ce, i为沉淀或电解氧化处理后溶液中i离子的浓度,mg·L-1。
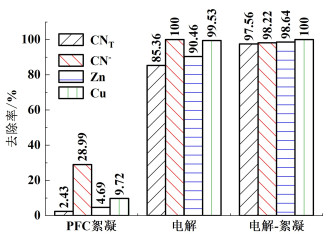
2 结果与讨论 2.1 PFC絮凝、电解与微电解-絮凝处理氰化提金废水对比常温条件下,取电压为4.5 V,极板间距10 mm,PFC添加量0.1 g进行电解及微电解-絮凝实验;在PFC添加量0.1 g,120 r ·min-1快速搅拌30 s,60 r ·min-1慢速搅拌10 min,沉降时间3 h条件下进行PFC絮凝实验,结果如图 2所示。PFC絮凝对各离子去除率较低,微电解-絮凝、电解对各离子去除率均有大幅度提升。微电解-絮凝相较于电解,CN-、Cu离子的去除率变化不大,CNT、Zn离子的去除率有所上升,CNT和Zn离子浓度分别降低了195.23和55.04 mg ·L-1。
|
| 图 2 PFC絮凝、电解与电解-絮凝处理反应后各离子的去除率 Fig.2 Removal rate of each ion after PFC flocculation, electrolysis and electrolysis-flocculation treatment |
| |
絮凝过程中,氰化物的去除方式主要是絮凝剂的吸附作用[10],通电情况下,氰化物的去除方式主要是电解氧化作用[14, 15]。微电解-絮凝相较于电解,CNT、Zn离子的去除率有所上升,原因可能是PFC([Fe2(OH)nCl6-n]m)水解产生带正电荷的Fe(OH)2+、Fe(OH)2+、Fe(OH)3等物质[16, 19],通过电中和作用,吸附废水中呈负电性的Cu(OH)2、Zn(CN)2、CuCN等沉淀物[20]。同时,PFC加入废水中,释放出一定量的Cl-,能够促进电解氧化反应,电解反应消耗Cl-,促进PFC水解。因此微电解-絮凝比电解去除率高。微电解-絮凝后CNT、CN-浓度分别为39.08和7.81 mg ·L-1,属于低浓度氰化废水,可返回浸出系统。
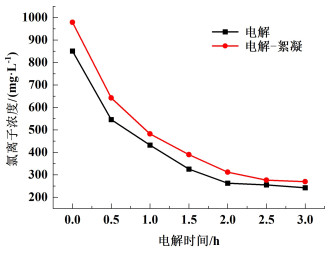
2.2 电解与微电解-絮凝体系Cl-浓度对比常温条件下,取电压为4.5 V,极板间距10 mm,PFC添加量0.1 g进行电解及微电解-絮凝实验,考察了体系中Cl-浓度随电解时间的变化,结果如图 3所示。随着电解时间的增加,废水中Cl-浓度呈现下降的趋势,2.0 h达到最小值,随后不再发生明显变化。微电解-絮凝过程Cl-浓度始终大于电解过程,2.5 h时Cl-剩余浓度几乎持平,电解、微电解-絮凝体系分别为255.24和276.51 mg ·L-1,PFC水解释放出一定量的Cl-,反应方程如式(2)和式(3),电解过程中,Cl-在阳极被氧化为Cl2,使得Cl-浓度降低,根据水解反应平衡原理,随着电解过程消耗Cl-,PFC水解是一个不断释放Cl-的过程,Cl-的增加促进电解氧化反应,Cl2溶于水产生的ClO-氧化CN-、Cu(CN)32-和Zn(CN)42-时又转化为Cl-,直至反应达到平衡。因此微电解-絮凝与PFC水解互相促进,且剩余Cl-浓度差不多。因此,后续采用微电解-絮凝进行实验。
|
| 图 3 体系中Cl-浓度变化 Fig.3 Changes of Cl- concentration in the system |
| |
| $ \begin{aligned} & n \leqslant 4: \\ & 2\left[\mathrm{Fe}_2(\mathrm{OH})_n \mathrm{Cl}_{6-n}\right]_m+m(9-2 n) \mathrm{OH}^{-} \rightarrow \\ & m \mathrm{Fe}(\mathrm{OH})^{2+}+m \mathrm{Fe}(\mathrm{OH})_2^{+}+2 m \mathrm{Fe}(\mathrm{OH})_3+ \\ & \quad 2 m(6-n) \mathrm{Cl}^{-} \end{aligned} $ | (2) |
| $ \begin{aligned} & n>4: \\ & 2\left[\mathrm{Fe}_2(\mathrm{OH})_n \mathrm{Cl}_{6-n}\right]_m \rightarrow m \mathrm{Fe}(\mathrm{OH})^{2+}+ \\ & m \mathrm{Fe}(\mathrm{OH})_2^{+}+2 m \mathrm{Fe}(\mathrm{OH})_3+m(9-2 n) \mathrm{OH}^{-}+ \\ & 2 m(6-n) \mathrm{Cl}^{-} \end{aligned} $ | (3) |
常温条件下,取电解时间为3 h,极板间距10 mm,PFC添加量0.1 g电压分别为3.0、3.5、4.0、4.5和5.0 V进行实验,结果如图 4所示。随着电压的增加,CNT、CN-、Cu和Zn的去除率均逐渐增大,4.5 V时,CNT、CN-、Cu和Zn的去除率分别为97.56%、97.63%、99.81%和96.54%。电压为4.5 V时,pH值在1.5 h时从9降至7,而后不在发生变化。这是因为随着电压增大,电流效率变大,有利于析氯析氧反应的发生,CN-被O2氧化为CNO-,CNO-再被O2氧化为N2和CO2等气体[式(4)~式(6)],Cl2溶于水产生ClO-,ClO-的间接氧化使得大部分氰化物被氧化为N2和CO2[(式(7)~式(11)],从而提高去除率。因此,选取较适宜电压4.5 V。
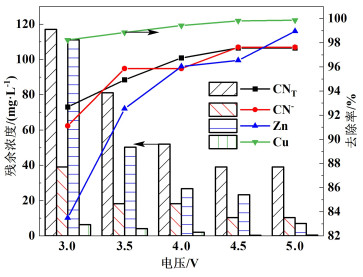
|
| 图 4 电压对去除率的影响及各离子含量变化 Fig.4 Influence of voltage on removal rate and change of ions content |
| |
| $ 4 \mathrm{OH}^{-}-4 \mathrm{e}^{-} \rightarrow 2 \mathrm{H}_2 \mathrm{O}+\mathrm{O}_2 $ | (4) |
| $ 2 \mathrm{CN}^{-}+\mathrm{O}_2-2 \mathrm{e}^{-} \rightarrow 2 \mathrm{CNO}^{-} $ | (5) |
| $ 2 \mathrm{CNO}^{-}+\mathrm{O}_2-2 \mathrm{e}^{-} \rightarrow 2 \mathrm{CO}_2+\mathrm{N}_2 $ | (6) |
| $ 2 \mathrm{Cl}^{-}-2 \mathrm{e}^{-} \rightarrow \mathrm{Cl}_2 \uparrow $ | (7) |
| $ \mathrm{Cl}_2+4 \mathrm{OH}^{-}-2 \mathrm{e}^{-} \rightarrow 2 \mathrm{ClO}^{-}+2 \mathrm{H}_2 \mathrm{O} $ | (8) |
| $ \begin{gathered} 2 \mathrm{CN}^{-}+2 \mathrm{ClO}^{-}+6 \mathrm{OH}^{-}+3 \mathrm{Cl}_2 \rightarrow 2 \mathrm{CO}_2 \uparrow+ \\ \mathrm{N}_2 \uparrow+4 \mathrm{H}_2 \mathrm{O}+8 \mathrm{Cl}^{-} \end{gathered} $ | (9) |
| $ \mathrm{Cu}(\mathrm{CN})_3^{2-}+\mathrm{ClO}^{-} \rightarrow \mathrm{Cu}^{2+}+3 \mathrm{CNO}^{-}+3 \mathrm{Cl}^{-} $ | (10) |
| $ \mathrm{Zn}(\mathrm{CN})_4^{2-}+4 \mathrm{ClO}^{-} \rightarrow \mathrm{Zn}^{2+}+4 \mathrm{CNO}^{-}+4 \mathrm{Cl}^{-} $ | (11) |
电解电压为4.5 V,电解时间分别为2.0、3.0、4.0、5.0和6.0 h的条件下进行实验,结果如图 5所示。随着电解时间的增大,溶液中CNT、CN-、Cu和Zn的去除率先逐渐升高,后趋于平缓。3.0 h时CNT、CN-、Cu和Zn去除率分别为97.56%、97.04%、99.71%和98.96%。这是因为随着电解时间的增加,传输的电量越大,参与电化学反应的电子总数就越多,阳极电解氧化产生的ClO-和PFC水解产生的Fe(OH)2+、Fe(OH)2+和Fe(OH)3的量逐渐增大,使氰化物的电解氧化程度更加完全,Cu和Zn在阴极发生电沉积的量增大,CNT、CN-、Cu和Zn去除率随之增大。随着反应时间的增加,阴极由于极化作用导致过电位降低,反应逐渐减弱直至停止[21]。电解时间过长会增加能耗,因此,选取较适宜电解时间3.0 h。
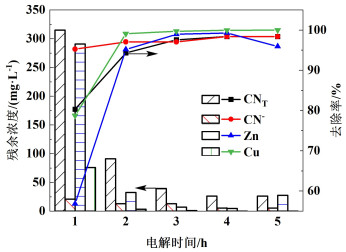
|
| 图 5 电解时间对去除率的影响及各离子含量变化 Fig.5 Influence of electrolysis time on removal rate and change of ions content |
| |
取电解时间为3 h,在极板间距分别为10、15、20、25和30 mm条件下进行实验,结果如图 6所示。随着极板间距的增大,CNT、CN-、Cu和Zn的去除率呈下降趋势,当极板间距为10 mm时,CNT、CN-、Cu和Zn离子去除率分别为97.56%、98.22%、99.71%和98.49%。因为随着极板间距增加,电子传递距离增加,电能损耗增加,极板间的电场强度减小,极板间带电离子Cu(CN)32-和Zn(CN)42-的迁移速率减小,且电解过程中产生的Cl2和ClO-等强氧化物质的扩散距离增长,从而降低各离子的去除效率。因此,选择极板间距为10 mm。
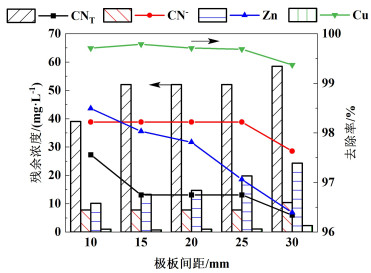
|
| 图 6 极板间距对去除率的影响及各离子含量变化 Fig.6 Influence of plate spacing on removal rate and change of ions content |
| |
取极板间距为10 mm,温度分别为25、35、45、55和65 ℃条件下进行实验,结果如图 7所示。随着温度的升高,CNT、CN-、Cu和Zn的去除率主要呈上升趋势。35 ℃时,CNT、CN-、Cu和Zn去除率分别为96.75%、97.63%、99.74%和97.26%。升高温度CNT、CN-、Cu和Zn去除率虽然略有增大,但当温度过高时,氰化物随着溶液的挥发进入空气中造成空气污染,同时增加能耗。因此,出于环境保护和节约成本的考虑,实验应选择在室温下进行。
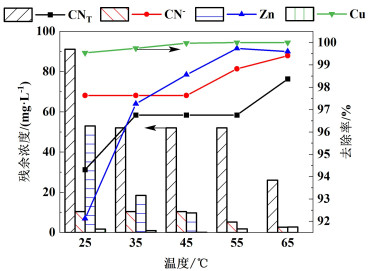
|
| 图 7 温度对去除率的影响及各离子含量变化 Fig.7 Influence of temperature on removal rate and change of ions content |
| |
常温条件下,PFC添加量分别为250、500、750、1 000和1 250 mg ·L-1进行实验,结果如图 8所示。随着PFC添加量的增加,氰化提金废水中CNT、CN-、Cu和Zn的去除率先逐渐增大后趋于平缓。750 mg ·L-1时,溶液中CNT、CN-、Cu和Zn去除率分别为97.56%、98.22%、100%和98.64%。这是因为随着PFC添加量的增加,离解出的Cl-、Fe(OH)2+、Fe(OH)2+和Fe(OH)3增加,Cl-增强了氧化作用,Fe(OH)2+、Fe(OH)2+和Fe(OH)3通过电中和、吸附和絮凝作用有助于沉淀物Cu(OH)2、Zn(CN)2及CuCN的快速沉淀。因此,PFC添加量选取750 mg ·L-1。
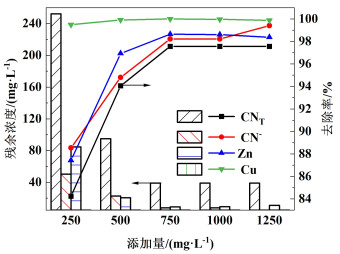
|
| 图 8 PFC添加量对去除率的影响及各离子含量变化 Fig.8 Effect of PFC addition on removal rate and changes of ions content |
| |
常温条件下,取电压为4.5 V、电解时间3 h、极板间距10 mm、PFC添加量750 mg ·L-1进行验证实验,结果如表 2所示。从3组平行实验所测得的结果来看,CNT、CN-、Cu和Zn的去除率相对稳定,平均去除率分别为97.29%、97.83%、99.36%和98.74%,说明采用微电解-絮凝处理氰化提金废水的技术是有效可行的。
| 序号 | 去除率/% | |||
| CNT | CN- | Cu | Zn | |
| 1 | 97.56 | 98.22 | 99.71 | 98.96 |
| 2 | 97.56 | 97.04 | 99.29 | 98.64 |
| 3 | 96.75 | 98.82 | 99.09 | 98.62 |
| 平均值 | 97.29 | 97.83 | 99.36 | 98.74 |
对电解和微电解-絮凝产生的沉淀物和阴极板进行XRD分析表征,结果如图 9和图 10所示。
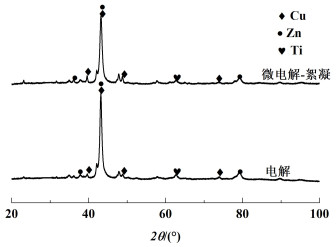
|
| 图 9 电解后阴极板XRD图谱 Fig.9 XRD pattern of cathode plate after electrolysis |
| |
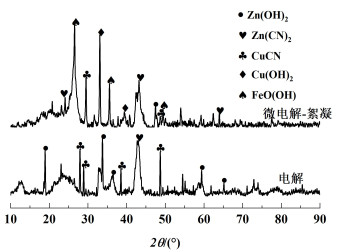
|
| 图 10 电解后沉淀物XRD图谱 Fig.10 XRD patterns of precipitates after electrolysis |
| |
由图 9可以看出,微电解-絮凝与电解沉积物没有较大区别,阴极的主要沉积物为Cu和Zn,是因为阳极氧化得到的Cu2+和Zn2+在阴极发生还原反应[式(12)~式(14)]。由图 10可以看出,沉淀物的基本组成为Zn(CN)2、CuCN、Zn(OH)2、Cu(OH)2及FeO(OH)。电解主要为Zn(OH)2、CuCN的吸收峰,微电解-絮凝时,Zn(OH)2的吸收峰基本消失,出现了FeO(OH)、Zn(CN)2和Cu(OH)2的吸收峰,这是因为PFC水解产生的Fe(OH)2+发生了脱水反应,生成FeO(OH)过程中消耗大量OH-[式(15)~式(16)],根据反应(8),OH-浓度降低,ClO-的量会减小,因此先发生Cu(CN)32-的电解反应[式(10)],后发生Zn(CN)42-的电解反应[式(11)],产生的Cu2+结合OH-生成Cu(OH)2沉淀[式(17)],以至于没有足量的OH-可供Zn2+结合,因此Zn2+会与废水中Cu(CN)32-等离子发生共沉淀反应[式(18)]。而纯电解过程,pH值相对较高,产生的ClO-量更大,因此先发生Zn(CN)42-的电解反应[式(11)],而后Zn2+结合OH-生成Zn(OH)2,同时与废水中的Cu(CN)32-发生共沉淀反应[式(16)]。因此,电解与微电解-絮凝过程中离子的反应顺序不同。
| $ 2 \mathrm{H}_2 \mathrm{O}+2 \mathrm{e}^{-} \rightarrow \mathrm{H}_2 \uparrow+2 \mathrm{OH}^{-} $ | (12) |
| $ \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} $ | (13) |
| $ \mathrm{Zn}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Zn} $ | (14) |
| $ \mathrm{Fe}(\mathrm{OH})_2^{+} \rightarrow \mathrm{FeO}^{+}+\mathrm{H}_2 \mathrm{O} $ | (15) |
| $ \mathrm{FeO}^{+}+\mathrm{OH}^{-} \rightarrow \mathrm{FeO}(\mathrm{OH}) $ | (16) |
| $ \mathrm{Cu}^{2+}+2 \mathrm{OH}^{-} \rightarrow \mathrm{Cu}(\mathrm{OH})_2 \downarrow $ | (17) |
| $ \mathrm{Zn}^{2+}+\mathrm{Cu}(\mathrm{CN})_3^{2-} \rightarrow \mathrm{Zn}(\mathrm{CN})_2 \downarrow+\mathrm{CuCN} \downarrow $ | (18) |
| $ \mathrm{Zn}^{2+}+2 \mathrm{OH}^{-} \rightarrow \mathrm{Zn}(\mathrm{OH})_2 \downarrow $ | (19) |
微电解-絮凝处理氰化提金废水过程反应机理示意图如图 11所示。PFC水解产生Fe(OH)2+、Fe(OH)2+和Fe(OH)3等聚羟基络合物和Cl-。阳极发生氧化反应,在电场作用下,PFC水解产生的Cl-, 以及废水中的OH-、CN-、Cl-、Cu(CN)32-和Zn(CN)42-等阴离子迁移至阳极,Cl-在阳极发生氧化反应,生成的Cl2、ClO-将Cu(CN)32-、CN-和Zn(CN)42-间接氧化为N2和CO2,释放出Cu2+和Zn2+。一部分Cu2+和Zn2+迁移至阴极发生电沉积反应被还原为Cu和Zn单质,部分Cu2+被反应为Cu(OH)2,Zn2+与Cu(CN)32-发生共沉淀反应生成CuCN和Zn(CN)2沉淀。PFC水解产生的Fe(OH)2+、Fe(OH)2+和Fe(OH)3通过吸附、絮凝作用有助于沉淀物的快速沉降。
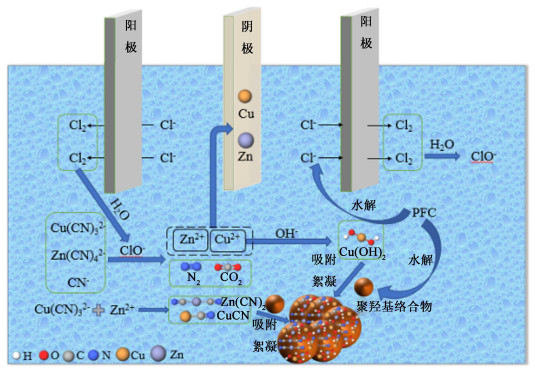
|
| 图 11 微电解-絮凝机理图 Fig.11 Scheme of microelectrolytic-flocculation mechanism |
| |
采用微电解-絮凝处理氰化提金废水的技术是有效可行的,PFC添加量为750 mg ·L-1,电压4.5 V,时间3.0 h,极板间距10 mm时,废水中CNT、CN-、Cu和Zn离子的去除率分别为97.29%、97.83%、99.36%和98.74%,处理后CNT、CN-浓度分别为43.37和9.54 mg ·L-1,可直接返回浸出系统。
微电解-絮凝与PFC水解互相促进,水解产生的氢氧化物与多核羟基络合物通过吸附、絮凝作用有助于沉淀物的快速沉降。
微电解-絮凝过程,废水中的氰化物被Cl2和ClO-氧化成N2和CO2,释放出的Cu2+和Zn2+部分在阴极还原成金属单质,部分Cu2+会以Cu(OH)2沉淀形式存在,Zn2+与Cu(CN)32-发生共沉淀以Zn(CN)2及CuCN沉淀形式存在。
| [1] |
SYED S. Silver recovery aqueous techniques from diverse sources: Hydrometallurgy in recycling[J]. Waste Management, 2016, 50: 234-256. DOI:10.1016/j.wasman.2016.02.006 |
| [2] |
赵玲玲, 宋永辉, 曾鑫辉, 等. 沉淀-电解氧化法处理高铁氰化废水[J]. 环境工程学报, 2020, 14(12): 3426-3434. ZHAO Lingling, SONG Yonghui, ZENG Xinhui, et al. Precipitation-electrolytic oxidation method to treat high-iron cyanide wastewater[J]. Journal of Environmental Engineering, 2020, 14(12): 3426-3434. DOI:10.12030/j.cjee.202001096 (in Chinese) |
| [3] |
黄爱华. 提金含氰废水处理工艺研究现状及发展趋势分析[J]. 黄金科学技术, 2014, 22(2): 83-89. HUANG Aihua. Analysis of the research status and development trend of cyanide-containing wastewater treatment process of gold extraction[J]. Gold science and technology, 2014, 22(2): 83-89. (in Chinese) |
| [4] |
SONG Y, LEI S, YIN N, et al. Treatment of cyanide wastewater dynamic cycle test by three-dimensional electrode system and the reaction process analysis[J]. Environmental Technology, 2021, 42(11): 1693-1702. DOI:10.1080/09593330.2019.1677783 |
| [5] |
MAYERS J J, LANDELS A R, ALLEN M J, et al. An energy and resource efficient alkaline flocculation and sedimentation process for harvesting of Chromochloris zofingiensis biomass[J]. Bioresource Technology Reports, 2020, 9: 100358. DOI:10.1016/j.biteb.2019.100358 |
| [6] |
SHAYLINDA M Z N, HAMIDI A A, MOHD N A, et al. Optimization of composite coagulant made from polyferric chloride and tapioca starch in landfill leachate treatment[J]. Journal of Physics: Conference Series, 2018, 995(1): 012019. |
| [7] |
ZAREI M T, EHRAMPOUSH M H, TALEBI P, et al. Comparison of poly ferric chloride and poly titanium tetrachloride in coagulation and flocculation process for paper and cardboard wastewater treatment[J]. Environmental science and pollution research international, 2021, 28(21): 27262-27272. DOI:10.1007/s11356-021-12675-6 |
| [8] |
TOUFIK M. Removal of Hg (II) ions from industrial wastewaters using aluminum sulfate[J]. International Journal of Engineering Research in Africa, 2021, 53: 200-211. DOI:10.4028/www.scientific.net/JERA.53.200 |
| [9] |
XUE J, PELDSZUS S, VAN DYKE M I, et al. Removal of polystyrene microplastic spheres by alum-based coagulation-flocculation-sedimentation (CFS) treatment of surface waters[J]. Chemical Engineering Journal, 2021, 422: 130023. DOI:10.1016/j.cej.2021.130023 |
| [10] |
MAMELKINA M A, HERRAIZ-CARBONÉ M, COTILLAS S, et al. Treatment of mining wastewater polluted with cyanide by coagulation processes: A mechanistic study[J]. Separation and Purification Technology, 2020, 237: 116345. DOI:10.1016/j.seppur.2019.116345 |
| [11] |
LEI S, SONG Y. Comparative Study on Electrochemical Treatment of Cyanide Wastewater[J]. Frontiers in Chemistry, 2021, 9: 598228. DOI:10.3389/fchem.2021.598228 |
| [12] |
FELIPE R P, ACHILLES J B D. Copper removal from diluted cyanide wastewater by electrolysis[J]. Environmental Progress & Sustainable Energy, 2013, 32(1): 52-59. |
| [13] |
SHA'ARANI S, AZIZAN S N F, MD AKHIR F N, et al. Removal efficiency of Gram-positive and Gram-negative bacteria using a natural coagulant during coagulation, flocculation, and sedimentation processes[J]. Water science and technology, 2019, 80(9): 1787-1795. DOI:10.2166/wst.2019.433 |
| [14] |
曾鑫辉, 宋永辉, 李一凡, 等. 电解氧化法处理金矿废水[J]. 化学工程, 2022, 50(2): 9-14. ZENG Xinhui, SONG Yonghui, LI Yifan, et al. Treatment of gold mine wastewater by electrolytic oxidation[J]. Chemical Engineering (China), 2022, 50(2): 9-14. DOI:10.3969/j.issn.1673-5854.2022.02.002 (in Chinese) |
| [15] |
尹宁, 宋永辉, 雷思明, 等. 采用三维电吸附体系处理氰化废水的对比研究[J]. 化学工程, 2019, 47(9): 1-6. YIN Ning, SONG Yonghui, LEI Siming, et al. Comparative study on treatment of cyanide wastewater by three-dimensional electrosorption system[J]. Chemical Engineering (China), 2019, 47(9): 1-6. DOI:10.3969/j.issn.1005-9954.2019.09.001 (in Chinese) |
| [16] |
DIDAR-UL ISLAM S M. Electrocoagulation (EC) technology for wastewater treatment and pollutants removal[J]. Sustainable Water Resources Management, 2019, 5(1): 359-380. DOI:10.1007/s40899-017-0152-1 |
| [17] |
DAS P P, MONDAL P, SINHA A, et al. Integrated ozonation assisted electrocoagulation process for the removal of cyanide from steel industry wastewater[J]. Chemosphere, 2021, 263: 128370. DOI:10.1016/j.chemosphere.2020.128370 |
| [18] |
MOUEDHEN G, FEKI M, DE PETRIS WERY M, et al. Behavior of aluminum electrodes in electrocoagulation process[J]. Journal of Hazardous Materials, 2008, 150(1): 124-135. DOI:10.1016/j.jhazmat.2007.04.090 |
| [19] |
ZHU S, CHEN H. Unraveling the role of polyferric chloride in anaerobic digestion of waste activated sludge[J]. Bioresource Technology, 2022, 346: 126620. DOI:10.1016/j.biortech.2021.126620 |
| [20] |
VU H P, NGUYEN L N, EMMERTON B, et al. Factors governing microalgae harvesting efficiency by flocculation using cationic polymers[J]. Bioresource Technology, 2021, 340: 125669. DOI:10.1016/j.biortech.2021.125669 |
| [21] |
雷思明. 电化学法深度处理低浓度贵金属贫液的研究[D]. 西安: 西安建筑科技大学, 2016 LEI Siming. Study on advanced treatment of low concentration noble metal lean solution by electrochemical method[D]. Xi'an: Xi'an University of Architecture and Technology, 2016 (in Chinese) |
 2024, Vol. 41
2024, Vol. 41