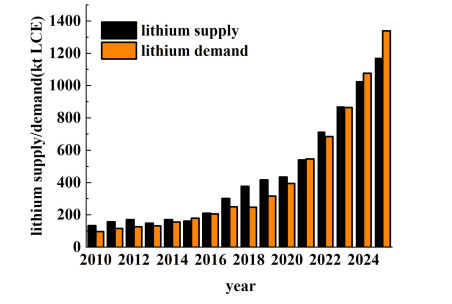
在政策与市场的双重推动下,新能源汽车及锂离子电池迎来重要发展机遇期[1]。根据中国汽车工业协会数据显示,2020年全球新能源汽车为320万辆,2022年全球新能源车销量超过1 000万辆,预计2023年销量将增至1 360万辆,且纯电车占比约为75%。我国新能源汽车已进入全面市场化拓展期,2022年全年销量688.7万,市场占有率提升至25.6%,全球销量占比超过60%,预计2023年仍将保持较快增长态势[2]。随着新能源产业的快速发展,锂资源已成为与能源安全相关的重要战略资源[3]。全球对锂的需求急剧增加,导致原材料需求成比例增加。当前世界锂资源需求与供应如图 1所示[4],2021年全球锂资源需求量为61万t碳酸锂当量(Lithium carbonate equivalent,LCE),2022年全球锂资源结构与2021年接近,约为75万t。其中中国锂供应量为57.84万t LCE,锂辉石提锂占比58.91%,大约为34.07万t LCE,盐湖提锂占比24.35%,锂云母提锂占比15.57%,废料回收有所增长,为6 748 t LCE[5, 6]。
自2014年起中国的锂电池报废量逐年递增,“报废潮”随之而来,据SMM数据调研,2021年锂电池回收量23.6万t,2022年回收量30万t,同比略增。退役锂电池中含有大量的有价金属,如废旧锂离子电池三元正极材料中含Li 2%~5%、Ni 5%~12%、Co 5%~20%、Mn 7%~10%[7, 8]。目前,中国已建成一批规模化的废旧锂离子电池三元正极材料回收处理生产线,回收工艺多采用“还原酸浸-碳酸化沉淀”的方法,可以协同回收锂、镍、钴和锰等能源金属[9-11]。基于碳酸锂的微溶特性,其在“碳酸化沉淀”阶段存在一定量的损失,主要富集于回收锂后排放的沉锂母液中,其溶液通常为高钠含锂溶液,锂含量0.01~5.00 g ·L-1、钠含量20.0~120.0 g ·L-1[12-14]。若处理不当,不仅会造成有机物、粉尘以及重金属污染,还会造成资源浪费,与退役锂电池回收废液成分类似的还有沉锂母液、电池萃余液等,因此从退役锂电池回收废液中回收锂资源不仅可以减轻环境污染,还能避免锂资源浪费,拓宽中国锂资源的来源,缓解锂资源供应压力,具有极大的战略性意义。
退役锂电池回收废液中2价离子浓度低,锂离子和钠离子性质相似,锂离子回收难度高,当前废液的钠锂比主要在10~150之间[15]。从溶液中回收锂资源的传统方法是将溶液蒸发至约20 g ·L-1的锂浓度,然后用碳酸钠沉淀提锂。青海盐湖工业的何永平等[16]通过将废液减压蒸发、酸化、减压蒸发、冷冻结晶、离心分离等步骤,得到碳酸锂湿料、氯化钠晶体和氯化锂溶液,锂经过2种形式(锂的碳酸盐和锂的盐酸盐/硫酸盐)、分阶段进行了回收,该工艺回收率高,化学试剂加入量少,但是步骤繁琐。对锂不断增长的需求促使行业开发了提锂的各种创造性方法,主要有沉淀法、吸附法、萃取法等[17-19]。
孙建之[17]以青海东台盐湖提钾提锂老卤为原料,使用碳酸钠沉淀、过滤、磷酸钠沉淀、调节pH值、水热,在温和的条件下得到粒度均匀、产率在90%以上的磷酸锂产品。Zhang等[18]采用β-二酮逆流法,以HBTA-TOPO-煤油为萃取体系,从钠锂比为8的碱性卤水中萃取锂离子,经过7级萃取过程,锂离子浓度从0.288 g ·L-1浓缩至15 g ·L-1,平均锂提取率可达96%。Çelebi等[10]建立了Mextral EOL/Cyanex 923/煤油SSX萃取系统,用于从电池萃余液中提取锂,发现A/O比和pH值对锂萃取率影响最大,在初始钠锂比为20~50情况下,得到锂的最高产率为91.0%以上,钠的最高产率为4.70%以下。西安蓝晓的李岁党等[19]采用连续离子交换装置,以锂钠分离树脂为吸附剂,经过吸附锂离子组、转型组、解析组、置换组这4个装置回收沉锂母液中的锂离子,其中置换组将树脂上残存的钠用锂置换,以达到提高解析合格液中锂钠比的目的,在最适宜条件下,该方式能将锂浓度从2提高至10 g ·L-1。
磷酸锂具有独特的光学性能、催化性能和电化学性能,常用于生产彩色荧光粉、化学反应催化剂、锂离子电池正极材料等,制备溶解度低、价值高的磷酸锂能够实现锂的有效利用[20]。赣锋锂业[21]曾通过磷酸沉淀、酸化转型、固液分离等步骤,令锂钠合金废料与洗液反复利用,形成封闭循环,使磷酸锂沉淀完全,锂回收率高,但是多次调节溶液pH值,增大了酸碱消耗。张小霞[22]以磷酸为沉淀剂对电池回收的高盐废液进行沉淀提锂,遵循“3R”原则(the rules of 3R: Reduce,Reuse,Recycle),将废液转化为高附加值的磷酸锂,研究各条件对锂收率的影响,最优条件下锂回收率达96.82%,满足磷酸锂行业标准。伍德佑[23]采用磷酸钠沉淀从废旧锂电池回收废液中制备磷酸锂,研究发现磷酸钠加入量为理论量110%、反应温度为为95 ℃、磷酸钠浓度为100 g ·L-1、反应时间为30 min,溶液pH值为4以上时,磷酸锂制备条件最适宜,沉淀率为98.7%。
本研究以磷酸钠为沉淀剂,采用结晶反应法从退役锂电池回收废液中分离制备磷酸锂,系统研究反应温度、磷酸钠用量、磷酸钠浓度、加料速率、搅拌速率、钠离子影响和水洗条件对磷酸锂回收率、粒径和纯度的影响,以期能全面评价磷酸锂产品的性质,制备收率高、粒径均一、纯度高的磷酸锂,为沉锂母液等低浓度锂资源回收提供一定的参考价值。
1 实验 1.1 试剂与仪器试剂:Li2SO4(AR)、Na2SO4(AR)、Na3PO4 ·12H2O(AR)、HNO3(AR)、NaOH(AR),均购自国药集团化学试剂有限公司,使用前未进一步精制。
仪器:玻璃夹套四口反应器、低温恒温槽、高温恒温槽、电动搅拌器、蠕动泵、磁力加热搅拌台、分析天平、砂芯装置、鼓风干燥箱、马尔文粒度分析仪、离子色谱仪、扫描电镜、X-射线多晶衍射仪、电感耦合等离子体光谱仪、紫外分光光度计。
1.2 实验方法磷酸钠沉淀法的原理是锂离子和磷酸根反应生成磷酸锂沉淀,其主要方程式为:
| $ \begin{equation*} 3 \mathrm{Li}^{+}+\mathrm{PO}_{4}^{3-} \rightarrow \mathrm{Li}_{3} \mathrm{PO}_{4} \downarrow \end{equation*} $ | (1) |
根据退役锂电池回收过程得到的高钠含锂废液的成分,配制了模拟溶液,主要化学成分如表 1所示。
| 分析项目 | 单位 | 值 |
| c(Li+) | g·L-1 | 2.5 |
| c(Na+) | g·L-1 | 80.986 |
| c(Ca2+) | g·L-1 | 0.005 |
| c(Mg2+) | g·L-1 | 0.005 |
| c(Mn2+) | g·L-1 | 0.001 |
| c(SO42-) | g·L-1 | 187.5 |
| c(Cl-) | g·L-1 | 0.004 |
| pH值 | 13~14 | |
| c(Na2+)/c(Li+) | 32.329 |
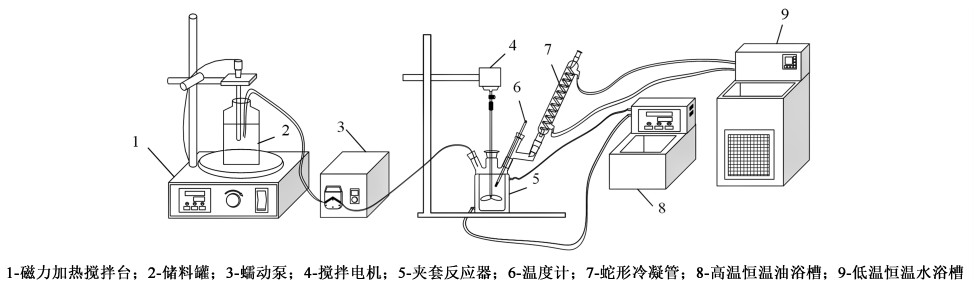
实验装置如图 2所示,该装置主要由储料罐、蠕动泵、玻璃夹套四口反应器、恒温油浴和恒温水浴5个部分组成。反应结晶在玻璃夹套四口反应釜中进行。取一定量的原料液加入反应器,开启搅拌,采用恒温油浴槽将其加热到一定温度。按一定配比量取特定浓度的磷酸钠溶液,为维持体系温度不变,磷酸钠溶液在进料前需预热至相同温度,进料过程需保持稳定温度,将其用蠕动泵按一定速率转移至至反应器中。蛇形冷凝管和低温恒温水浴用于防止反应体系过热。进料完毕后保持体系温度直至反应结束;采用真空抽滤进行固液分离,滤饼用去离子水洗涤,于120 ℃烘箱内烘干8 h,干燥后用于后续表征与分析。
|
| 图 2 反应结晶装置 Fig.2 Reaction crystallization device |
| |
收率使用液相中锂离子浓度计算,锂离子浓度使用电感耦合等离子体光谱仪(ICP-OES)测定,溶液体积使用量筒测量,收率表示为初始溶液中锂离子的沉淀率,可以表示为:
| $ \begin{equation*} Y_{\mathrm{Li}_{3} \mathrm{PO}_{4}}=\left(1-\frac{c_{\mathrm{Li}^{+}} V_{1}}{c_{0} V_{0}}\right) \times 100 \% \end{equation*} $ | (2) |
式(2)中:YLi3PO4表示溶液中锂收率,%;c0表示原料液中锂离子的质量浓度,g ·L-1;cLi+表示反应分离后溶液中锂离子的质量浓度,g ·L-1;V0表示实验所取的模拟含锂溶液的体积,mL;V1表示将反应分离后溶液体积,mL。
纯度采用产品中锂离子浓度计算,可以表示为:
| $ \begin{equation*} P_{\mathrm{L}_{1} \mathrm{PP}_{4}}=\frac{c_{\mathrm{a}} V}{m} \times 100 \% \end{equation*} $ | (3) |
式(3)中:PLi3PO4表示产品锂纯度,%;ca表示溶解后的磷酸锂溶液中锂离子的实际质量浓度,g ·L-1;m表示溶解的磷酸锂质量,g;V表示溶解磷酸锂所用的稀硝酸体积,L。
产品锂损失量采用淋洗滤液中锂浓度计算,可以表示为:
| $ \begin{equation*} D_{\mathrm{Li}_{3} \mathrm{PO}_{4}}=\frac{c_{1} V_{1}}{m_{0}} \end{equation*} $ | (4) |
式(4)中:DLi3PO4表示产品锂损失量,mg ·g-1;cl表示滤液中锂离子浓度,mg ·L-1;Vl表示淋洗滤液体积,L;m0表示生成的磷酸锂总质量,g。
产品粒度衡量判断的指标通常有体积平均粒径D[4, 3]和变异系数C.V.值。D[4, 3]以体积为基准表示粒径,指质量距体积平均粒径,将每1个粒径区间两端粒径值取平均,再与这个区间对应的粒度分布含量百分数相乘,将各区间的积累加。变异系数反映单位均值的离散程度。其中,D[4, 3]值越小,表明颗粒粒径越小;C.V.值越小,表明颗粒离散程度越小,粒径越均一。
| $ D[4, 3]=\sum\limits_{i=1}^{76} f_{i} D_{i} $ | (5) |
| $ \text { C. V. }=\frac{d(0.84)-d(0.16)}{2 d(0.50)} $ | (6) |
式(5)和式(6)中:fi表示第i个粒径区间百分含量;Di表示第i个粒径区间平均粒径;d(0.16)、d(0.50)和d(0.84)分别表示累计粒度百分数分别达到16%、50%和84%时对应的粒径值。
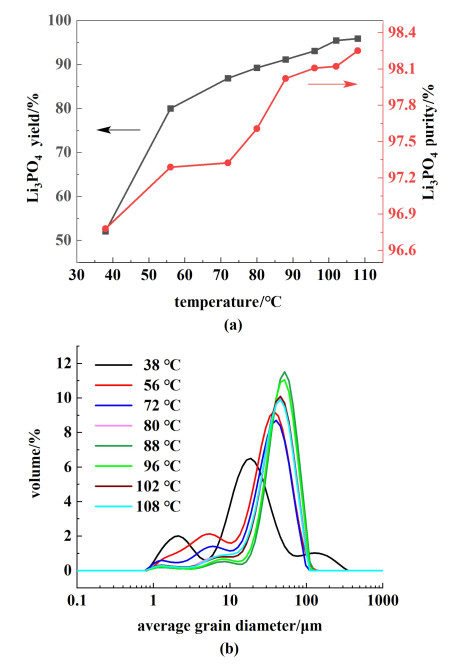
2 结果与讨论 2.1 反应温度影响反应温度是结晶过程中的一个重要参数。由于沉锂反应是个吸热反应,故理论上升高温度有利于磷酸锂沉淀生成。选取锂初始浓度为2.5 g ·L-1,磷酸钠用量为110%(理论化学计量数的1.1倍,余同),十二水磷酸钠浓度300 g ·L-1,加料速率为5 mL ·min-1,搅拌速率为300 r ·min-1,考察反应温度在38、56、72、80、88、97、102和108 ℃下磷酸锂的收率、纯度和粒径的变化,结果如图 3(a)所示。随着反应温度的升高,磷酸锂的收率不断增加。温度为38 ℃时,磷酸锂收率较低,只有52.10%;随着温度上升至72 ℃,磷酸锂收率达到86.89%,温度升高至102 ℃时,收率达到95.48%,较96 ℃时增加2.42%;温度继续增长磷酸锂收率变化不大,趋于稳定。
|
| 图 3 反应温度对磷酸锂的影响(a)收率和纯度;(b)粒度分布 Fig.3 Effect of reaction temperature on lithium phosphate (a) yield, purity; (b) particle size distribution |
| |
反应温度对磷酸锂纯度的影响如图 3(a)所示。随着反应温度的增加,磷酸锂纯度增加。温度为38 ℃时,纯度为96.78%,温度上升至88 ℃时,锂纯度为98.02%,温度继续增长磷酸锂纯度变化不大,均在98%以上。反应温度对磷酸锂粒度分布的影响结果如图 3(b)所示。不同反应温度条件下所得磷酸锂晶体的平均粒径分别为35.50、31.80、36.30、44.70、52.40、49.90、44.20和43.70 μm,变异系数(C.V.)分别为1.08、0.80、0.69、0.54、0.44、0.47、0.52和0.54。从整体来看,反应温度提高,晶体的粒度先增大后减小、粒径分布先变窄后变宽。
黏度、粒子运动能、溶剂结构和溶解度都会受到反应温度的影响,进而导致反应速率、微晶聚集速率以及产物的最终粒径大小的变化。受到反应温度影响最大的为物质溶解度,温度的改变通过影响反应结晶过程中的过饱和度,从而控制反应结晶过程。随着温度的升高,诱导期持续时间缩短,成核速率逐渐提升,晶体生长速率加快,一开始晶体生长速率的影响大于成核速率影响,平均粒径逐渐变大,分布变窄;到达96 ℃后,成核速率的影响大于晶体生长影响,大量细小晶体生成,平均粒径减小,分布变宽。当温度大于102 ℃时,升高温度所带来的能耗成本大于收率效益,且体系黏度逐渐增大,容易造成产品损失,综合考虑将102 ℃作为最适宜反应温度。
2.2 磷酸钠用量影响选取锂初始浓度为2.5 g ·L-1,温度为102 ℃,十二水磷酸钠浓度300 g ·L-1,加料速率为5 mL ·min-1,搅拌速率为300 r ·min-1,选取十二水磷酸钠用量分别为为化学计量比的1.0、1.1、1.2、1.3、1.4和1.5倍时,考察磷酸锂的收率、纯度和粒径随着磷酸钠用量的变化规律。
磷酸钠用量对磷酸锂收率和纯度的影响结果如图 4(a)所示。随着磷酸钠用量从化学计量比的1.0倍逐渐增大到1.5倍,磷酸锂收率从90.62%增长到96.79%,总体呈上升趋势。当用量从化学剂量比的1.0倍提升至1.1倍时,磷酸锂收率增加2.60%;后续用量每增加0.1倍,磷酸锂收率分别增加0.53%、1.04%、1.47%和0.53%。磷酸钠用量的提高使溶液中磷酸根离子含量增加,反应向正方向进行,磷酸锂的收率有所上升;磷酸钠用量的提升对溶液中磷酸根浓度影响不大,磷酸锂纯度变化不大。
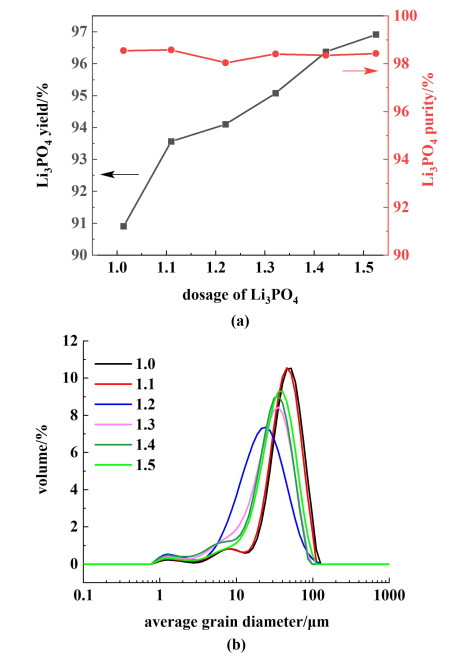
|
| 图 4 磷酸钠用量对磷酸锂的影响(a)收率和纯度;(b)粒度分布 Fig.4 Effect of sodium phosphate dosage on lithium phosphate (a) yield, purity; (b) particle size distribution |
| |
由图 4(b)可知,磷酸钠用量对磷酸锂晶体粒径分布的影响,不同磷酸钠用量条件下所得磷酸锂晶体的平均粒径分别为49.70、46.60、27.00、32.90、32.60和38.20 μm,变异系数(C.V.)分别为0.49、0.50、0.75、0.65、0.60和0.57。总体来讲,磷酸钠用量从1.0增加至1.3时,平均粒径减小,分布变宽;从1.3增长至1.5时,平均粒径增大,分布变窄。磷酸钠用量为1.3倍时,产品平均粒径最小,为27.00 μm。这是由于磷酸钠用量增大,造成溶液过饱和度升高,容易发生局部成核现象,磷酸钠用量进一步增大时,晶体生长速度加快。
综合以上结果考虑,磷酸钠的加入一方面能在一定程度上提高收率,另一方面容易增加成本且使晶体粒径分布不均匀,在磷酸钠用量从1.1增长至1.2时,磷酸锂收率仅增长0.53%,物料消耗成本大于收率效益,因此选择化学剂量比的1.1倍作为最适宜用量。
2.3 磷酸钠浓度影响选取锂初始浓度为2.5 g ·L-1,温度为102 ℃,磷酸钠用量为110%,加料速率为5 mL ·min-1,搅拌速率为300 r ·min-1,选取十二水磷酸钠浓度为120、170、200、270、350和400 g ·L-1时,考察磷酸锂的收率、纯度和粒径随着磷酸钠浓度的变化规律。
磷酸钠浓度对磷酸锂收率、纯度和粒径分布的影响结果如图 5所示。磷酸钠浓度对磷酸锂晶体粒径分布的影响,不同磷酸钠用量条件下所得磷酸锂晶体的平均粒径分别为46.30、52.00、39.70、39.00、39.90和38.90 μm,变异系数(C.V.)分别为0.40、0.40、0.49、0.46、0.45和0.56。总体上看,磷酸钠浓度提高,磷酸锂收率增长,纯度不变,平均粒径先增长,后降低,随后保持不变。十二水磷酸钠浓度从120提高至170 g ·L-1,磷酸锂收率从91.01%增加至91.96%,增加0.95%,平均粒径增加;从170提高至200 g ·L-1,磷酸锂收率增加0.84%,平均粒径减小;随着磷酸锂浓度的进一步提高,平均粒径保持不变,收率增加幅度逐渐缓慢,从350提高至400 g ·L-1时,收率从93.67%增加至93.77%,收率几乎不变,仅增加0.1%。随着溶液浓度的提高,反应向正方向推动,磷酸锂晶体生长速度加快,在溶液浓度趋于饱和的过程中,溶液处于介稳态的时间缩短,在达到一定过饱和度时,自发形成晶核,过饱和度越大,晶核越多;溶液达到饱和时,浓度受到溶解度的影响,溶解度小,“相对稳定”的饱和度范围窄,环境条件稍有改变就会严重的影响这个体系的稳定性,形成更多的晶核。因此,综合考虑下选择350 g ·L-1作为十二水磷酸钠的最适宜浓度。
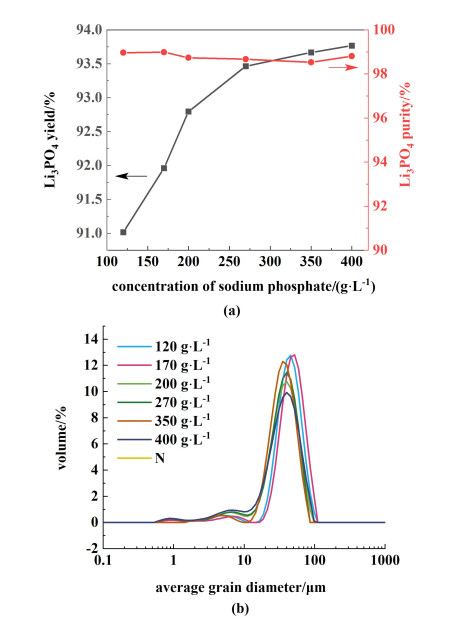
|
| 图 5 磷酸钠浓度对磷酸锂的影响(a)收率和纯度;(b)粒度分布 Fig.5 Effect of sodium phosphate concentration on lithium phosphate (a) yield, purity; (b) particle size distribution |
| |
选取锂初始浓度为2.5 g ·L-1,温度为102 ℃,磷酸钠用量为110%,十二水磷酸钠浓度350 g ·L-1,搅拌速率为300 r ·min-1,考察加料速率在1、5、10、15和20 mL ·min-1时磷酸锂的收率、纯度和粒径的变化规律,结果如图 6所示。加料速率下所得磷酸锂晶体的平均粒径分别为69.00、47.20、34.90、30.30和25.70 μm,变异系数(C.V.)分别为0.43、0.55、0.57、0.68和0.68。
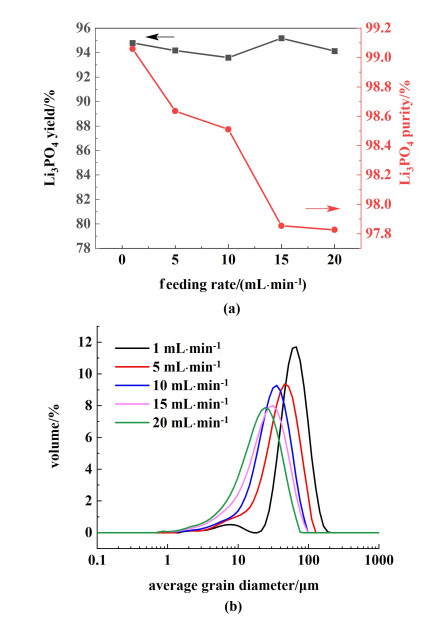
|
| 图 6 加料速率对磷酸锂的影响(a)收率和纯度;(b)粒度分布 Fig.6 Effect of stirring rate on lithium phosphate (a)yield, purity; (b)particle size distribution |
| |
总体来看,加料速率对收率无较大影响,在94.35%上下浮动,加料速率影响结晶反应发生的快慢,加料速率越快,反应越快,当反应平衡时,收率不变。纯度和平均粒径随着加料速率的加快而减小,变异系数随着加料速率的加快而增大。当加料速率为1 mL ·min-1时,纯度高达99.06%,平均粒径为69.00 μm,C.V.为0.43;加料速率加快至5 mL ·min-1时,纯度降低0.42%,为98.64%,平均粒径降低为47.20 μm,C.V.增大至0.55,分布变宽;加料速率加快至10 mL ·min-1时,纯度为97.99%,小于98%,平均粒径降低为34.90 μm,C.V.增大至0.57,分布变宽;继续加快加料速率达到20 mL ·min-1,磷酸锂纯度仅为97.68%,平均粒径为25.70 μm,分布最宽,峰值最低。根据公式(7),成核速率与温度、过饱和系数和结晶物质的物理性质有关。加料速率越快,体系中局部过饱和度越高,成核速率急剧增大,容易造成局部爆发成核,导致细晶粒生成,进而引起粒径分布均匀性变差,即变异系数增大,也容易裹带杂质粒子,造成磷酸锂晶体纯度降低。因此选择5 mL ·min-1为适宜的加料速率,以期获得纯度高、粒径较小且均匀的磷酸锂晶体。
| $\begin{equation*} \dot{N}=k_{\mathrm{N}} \exp \left[-\frac{k \sigma^{3} v^{2}}{(k T)^{3}(\ln s)^{2}}\right] \end{equation*} $ | (7) |
式(7)中:
溶液搅拌的影响与体系中物质的传质条件有关,通常促进晶体生长,但是,只有考虑到过饱和度的一定范围,才能谈搅拌对成核速率的影响。当反应体系处于第1介稳区时,在搅拌不把结晶活性中心带进溶液,则搅拌不影响成核;在第2介稳区时,搅拌会加速成核过程。在二次成核中,搅拌时碰撞次数和冲击能增加,对二次晶核数都有很大影响。选取锂初始浓度为2.5 g ·L-1,温度为102 ℃,磷酸钠用量为110%,十二水磷酸钠浓度350 g ·L-1,加料速率为5 mL ·min-1,考察搅拌速率在100、300、500、700、900 r ·min-1磷酸锂的收率、纯度和粒径的变化规律,结果如图 7所示。不同搅拌速率下所得磷酸锂晶体的平均粒径分别为35.70、44.70、39.90、33.90和30.00 μm,变异系数(C.V.)分别为0.81、0.44、0.45、0.48和0.67。
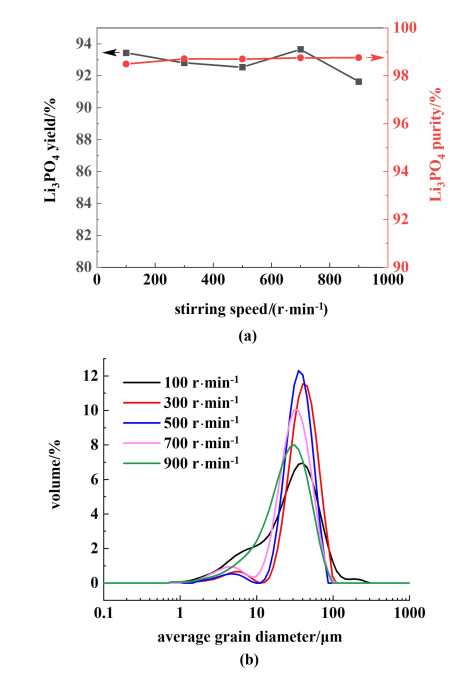
|
| 图 7 搅拌速率对磷酸锂的影响(a)收率和纯度;(b)粒度分布 Fig.7 Effect of stirring rate on lithium phosphate (a) yield, purity; (b) particle size distribution |
| |
随着搅拌速率的增加,磷酸锂收率和纯度无明显变化,分别在92.82%和98.68%左右;平均粒径在100到300 r ·min-1之间,搅拌速率越快,粒径越大,分布越窄;300到900 r ·min-1之间,搅拌速率越快,粒径越小,分布越宽。在搅拌速率为100 r ·min-1时,磷酸锂平均粒径较小,为35.70 μm,分布不均匀,变异系数大。这是因为搅拌速率过低时,溶液在反应器中混合不均匀,容易使局部过饱和度偏大,出现初级成核现象,在反应器中出现明显的黏壁效应,影响设备的同时导致粒径分布不均匀。搅拌速率为300 r ·min-1时,平均粒径最大。随着搅拌速率的增加,反应体系充分混合,晶体粒径逐渐减小,均一程度逐渐增大至稳定。搅拌速率为900 r ·min-1时,平均粒径最小,为30.00 μm,均一性较差。在该搅拌速率下,转速过大,反应器内对晶体的剪切强度和碰撞强度更大,容易造成晶体破碎,使刚生成的颗粒沉淀后又溶解,导致磷酸锂晶体粒度减小。因此综合考虑选择500 r ·min-1为最适宜搅拌速率。
2.6 钠离子浓度影响选取锂初始浓度为2.5 g ·L-1,温度为102 ℃,磷酸钠用量为110%,十二水磷酸钠浓度350 g ·L-1,加料速率为5 mL ·min-1,搅拌速率为500 r ·min-1,考察杂质钠离子浓度在0、20、40、60、80和100 g ·L-1时磷酸锂的收率、纯度和粒径的变化规律,结果如图 8所示。

|
| 图 8 钠离子浓度对磷酸锂的影响(a)收率和纯度;(b)粒度分布 Fig.8 Effect of sodium ion concentration on lithium phosphate (a)yield, purity; (b) particle size distribution |
| |
磷酸锂收率和纯度变化规律如图 8(a)所示,随着钠离子浓度的升高而降低。含锂溶液中钠离子浓度从0提升至20 g ·L-1时,磷酸锂收率从97.66%降至94.81%,降低幅度高达2.85%;纯度从90.68%降至99.40%。继续提升钠离子浓度至60和100 g ·L-1时,磷酸锂收率分别降低3.10%和1.36%;纯度分别降低0.45%和0.21%。随着钠离子浓度增加,可以看出钠离子浓度对合成磷酸锂反应具有很大的影响,其浓度升高会抑制磷酸锂生成,降低磷酸锂收率和纯度。
钠离子浓度用量对磷酸锂粒度分布的影响结果如图 8(b)所示。原料中不同钠离子浓度条件下所得磷酸锂晶体的平均粒径(D[4, 3])分别为24.50、39.10、40.90、39.70、38.90和35.90 μm,变异系数(C.V.)分别为0.61、0.44、0.47、0.49、0.56和0.58。溶液中不含杂质钠离子时的磷酸锂晶体粒径远小于含钠离子时制得的晶体。杂质对成核速率的影响既取决于溶解度变化,又取决于杂质与所生成的新相晶粒的直接作用。杂质钠离子对磷酸锂晶体平均粒径的影响分为2个阶段,第1阶段随着钠离子的增加而增大,第2阶段随着钠离子的增加而减小。在第1阶段,部分结晶中心的形成可能是由于杂质表面存在活性中心,直接参与核前缔合物的成长过程或吸附于结晶中心表面。在第2阶段,钠离子的存在,使体系过饱和度降低,抑制了磷酸锂晶体的生长。
2.7 洗涤方式与条件影响钠离子、碳酸根离子等是因为母液夹带而进入磷酸锂产品的,洗涤是脱除夹带母液的关键工序。洗涤选用淋洗的方式,有利于去除滤饼中夹带的大量母液,且造成的锂损失少。分别选择冷水、热水和乙醇作为洗涤剂,测试磷酸锂在这3种条件下的纯度和锂损失。锂纯度结果如图 9(a)所示,选用冷水与热水洗涤对磷酸锂产品的纯度无较大影响,其趋势一致。产品总量3.9 g,在采用1 L冷水和热水淋洗时,磷酸锂纯度已达到98.21%;采用5 L冷水和热水淋洗时,磷酸锂产品纯度为98.46%和98.56%。这是由于磷酸锂在20和60 ℃下的溶解度分别为3.821×10-2和1.650×10-4 g,同等温度下碳酸锂的溶解度分别为1.33和1.01 g,磷酸锂的溶解度在20和60 ℃下均远小于碳酸锂,因此,冷水淋洗和热水淋洗对纯度的影响不大。而采用乙醇淋洗1 L时,纯度仅为82.96%;5 L时,纯度增加1%,为83.96%。这是因为在用乙醇淋洗时,碳酸钠发生盐析,杂质离子未随着乙醇被带走,因此乙醇洗效果差。
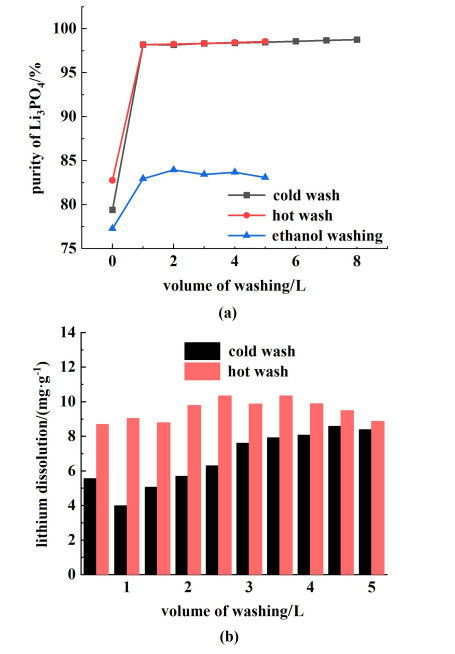
|
| 图 9 洗涤方式与条件对磷酸锂的影响(a)纯度;(b)锂损失量 Fig.9 Effect of washing methods and conditions on lithium phosphate (a)yield, purity; (b) lithium loss |
| |
图 9(b)为冷水洗和热水洗下的锂损失量,由结果可知,冷水洗下平均锂损失为6.70 mg ·g-1,热水洗下平均锂损失为9.50 mg ·g-1,冷水淋洗条件下锂损失小于热水淋洗,根据图 10可知水洗会冲击磷酸锂晶体表面,使其形貌破碎,水洗量越大,温度越高,表面破碎越严重。因此,综合选择用冷水淋洗1 L作为最适宜洗涤条件。
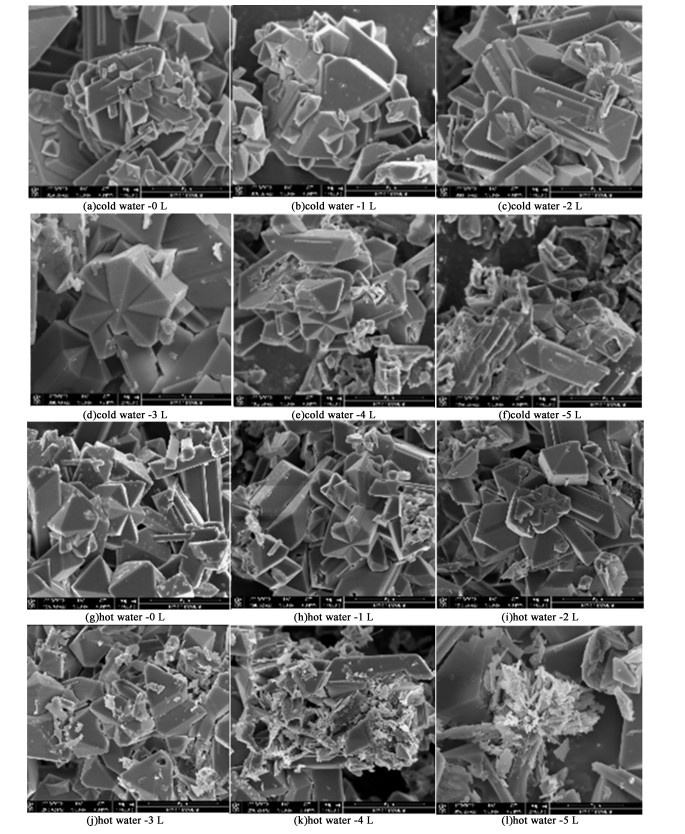
|
| 图 10 不同洗涤方式与条件下磷酸锂产品形貌 Fig.10 Morphology of lithium phosphate products under different washing methods and conditions |
| |
根据实验选取适宜条件,合成制备磷酸锂晶体进行分析评价,结果表明反应温度为102 ℃,磷酸钠1.1倍理论用量,磷酸钠浓度350 g ·L-1,加料速率5 mL ·min-1,搅拌速率500 r ·min-1,冷水洗1 L。在此条件下做验证实验,锂回收率达到92.54%。产品中磷酸锂含量及主要杂质如下表 2所示。与彩色荧光粉用磷酸锂行业标准YS/T 637-2007(表 3)对比发现产品符合FCLi3PO4-2标准。
| 项目 | w(主成分)/% | w(杂质)/% | ||||||||
| Li3PO4 | Na+ | Mg2+ | Ca2+ | Fe3+ | Pb2+ | Ni2+ | SO42- | Cl- | ||
| 磷酸锂产品 | 98.810 0 | 0.390 0 | 0.000 1 | 0.000 7 | 0.000 1 | ≤0.000 1 | ≤0.000 1 | 0.790 0 | 0.008 3 | |
| 牌号 | w(Li3PO4)/ % | w(Mg)/ % | w(Ca)/ % | w(Cl)/ % |
| FCLi3PO4-1 | 99.9 | 0.001 | 0.002 | 0.08 |
| FCLi3PO4-2 | 98.0 | 0.001 | 0.002 | 0.10 |
| FCLi3PO4-3 | 95.0 | 0.002 | 0.004 | 0.50 |
将磷酸锂沉淀进行X射线衍射分析、SEM电镜分析和粒径分析。将XRD分析测试结果[图 11(a)]与标准卡片比较发现,磷酸锂产品与结构式为Li3PO4的磷酸锂标准数据(PDF25-1030)两者数据基本一致,由此确定制得的磷酸锂的结构式为Li3PO4,产品晶相纯净。从粒径分析结果看[图 11(b)],最适宜条件下磷酸锂产物的平均粒径(D[4, 3])为38.9 μm,磷酸锂晶体粒径分布集中,粒度均匀。从磷酸锂样品的SEM图谱[图 11(c)]可以看出:磷酸锂结晶度好,晶胞结构完整,晶体结构有序性好,团聚成类球状,表面为整齐有序的不规则棱角。

|
| 图 11 最适宜条件下磷酸锂性能(a)XRD图谱;(b)粒度分布和(c)SEM图 Fig.11 Performance of lithium phosphate under optimal conditions (a) XRD patterns; (b) particle size distribution and (c) SEM patterns |
| |
对退役锂电池回收废液提锂制备磷酸锂过程进行研究,得到了产物收率最高的适宜条件:反应温度为102 ℃,磷酸钠1.1倍理论用量,磷酸钠浓度350 g ·L-1,加料速率5 mL ·min-1,搅拌速率500 r ·min-1,冷水洗1 L。此条件下,锂收率为92.63%,锂纯度为98.81%,达到彩色荧光粉用磷酸锂行业标准二级要求。该方法工艺简单,操作方便,可行有效,为退役锂电池回收溶液等高钠含锂溶液回收锂资源提供了一定的参考价值。
| [1] |
左世全. 解读《新能源汽车产业发展规划(2021-2035)》[J]. 智能网联汽车, 2020(6): 21-23. ZUO Shiquan. Interpretation of the "New Energy Vehicle Industry Development Plan (2021-2035)"[J]. Intelligent Connected Vehicles, 2020(6): 21-23. (in Chinese) |
| [2] |
钱海峰, 王尧峰. 中国汽车行业争议解决年度观察(2022)[J]. 北京仲裁, 2022(2): 77-114. QIAN Haifeng, Wang Yaofeng. An annual look at dispute resolution in China's automotive industry[J]. Beijing Arbitration, 2022(2): 77-114. (in Chinese) |
| [3] |
CHEN Y, DOU A, ZHANG Y. A review of recycling status of decommissioned lithium batteries[J]. Frontiers in Materials, 2021, 8: 12. |
| [4] |
王万航. 新型杂多酸类共萃剂用于盐湖卤水萃取提锂的应用基础研究[D]. 北京: 北京化工大学, 2023 WANG Wanhang. Application fundamental research on lithium extraction from salt lake brines with novel heteropoly acid co-extraction agent[D]. Beijing: Beijing University of Chemical Technology, 2023 (in Chinese) |
| [5] |
王浩, 黄根红, 陈瑞英, 等. 全球锂资源供需展望及锂产品价格预测[J]. 中国有色冶金, 2022, 51(6): 1-11. WANG Hao, HUANG Genhong, CHEN Ruiying, et al. Supply and demand outlook of lithium resources and price forecast of lithium products[J]. China Nonferrous Metallurgy, 2022, 51(6): 1-11. (in Chinese) |
| [6] |
亓树茂. 锂离子筛纳米纤维毡的制备及其盐湖提锂性能研究[D]. 西宁: 青海师范大学, 2024 QI Shumao. Preparation of lithium ion-sieve nanofiber mats and property research of lithium extraction from salt-lake[D]. Xining: Qinghai Normal University, 2024(in Chinese) |
| [7] |
ZOU H, GRATZ E, APELIAN D, et al. A novel method to recycle mixed cathode materials for lithium ion batteries[J]. Green Chemistry, 2013, 15(5): 1183-1191. DOI:10.1039/c3gc40182k |
| [8] |
李培岭, 李转玲. 退役动力锂电池正极有价金属的浸出与纯化研究进展[J]. 当代化工研究, 2022(22): 80-82. LI Peiling, LI Zhuanling. Leaching and purification of valuable metals in cathode of decommissioned power lithium batteries[J]. Modern Chemical Research, 2022(22): 80-82. (in Chinese) |
| [9] |
何艳君. 废旧锂离子电池三元正极材料的回收利用综述[J]. 新疆有色金属, 2022, 45(6): 56-57. HE Yanjun. Review on recycling of ternary cathode materials for waste lithium ion batteries[J]. Xinjiang Nonferrous Metals, 2022, 45(6): 56-57. (in Chinese) |
| [10] |
ÇELEBI E E, ÖNCEL M S, KOBYA M, et al. Extraction of lithium from wastewaters using a synergistic solvent extraction system consisting of Mextral EOL and Cyanex 923[J]. Hydrometallurgy, 2019, 185: 46-54. |
| [11] |
SONG Y, ZHAO Z. Recovery of lithium from spent lithium-ion batteries using precipitation and electrodialysis techniques[J]. Separation and Purification Technology, 2018, 206: 335-342. |
| [12] |
熊福军, 陈星宇, 张许, 等. 钛系锂离子筛在沉锂母液锂回收上的连续离子交换工艺研究[J]. 广东化工, 2022, 49(3): 8-11. XIONG Fujun, CHEN Xingyu, ZHANG Xu, et al. Study on continuous ion exchange process of titanium lithium ion sieve for lithium recovery from mother liquor of lithium precipitation[J]. Guangdong Chemical Industry, 2022, 49(3): 8-11. (in Chinese) |
| [13] |
杨事成. 离子液体基萃取体系用于沉锂母液提锂的基础研究[D]. 北京: 北京化工大学, 2019 YANG Shicheng. Research on the mechanism of ionic liquid-based system for lithium extraction from lithium deposition mother liquor[D]. Beijing: Beijing University of Chemical Technology, 2019 (in Chinese) |
| [14] |
蓝碧波, 黄怀国, 陈华标, et al. 从沉锂母液中回收锂的方法: CN114853037A[P]. 2022-08-05 LAN Bibo, HUANG Huaiguo, CHEN Huabiao, et al. Recovery method of lithium from mother liquor: CN, 114853037A[P]. 2022-08-05 (in Chinese) |
| [15] |
李汝杰. 从盐湖卤水与沉锂母液选择性萃取提锂新工艺的开发与研究[D]. 北京: 北京化工大学, 2022 LI Rujie. Development and research on new technologies for selective extraction of lithium from salt lake brines and lithium precipitation mother liquor[D]. Beijing: Beijing University of Chemical Technology, 2022 (in Chinese) |
| [16] |
何永平, 刘发贵, 景海德, et al. 一种沉锂母液处理的方法和装置: CN111268704A[P]. 2020-06-12 HE Yongping, LIU Fagui, JING Haide, et al. Method and device for treating lithium mother liquor: CN, 111268704A[P]. 2020-06-12. (in Chinese) |
| [17] |
孙建之. 单分散微米磷酸锂的制备[J]. 化工矿物与加工, 2008, 37(8): 4-5. SUN Jianzhi. Preparation of monodisperse micron lithium phosphate[J]. Industrial Minerals & Processing, 2008, 37(8): 4-5. (in Chinese) |
| [18] |
ZHANG L, LI L J, SHI D, et al. Recovery of lithium from alkaline brine by solvent extraction with β-diketone[J]. Hydrometallurgy, 2018, 175: 35-42. |
| [19] |
李岁党, 燕护道, 余佳, 等. 一种用于沉锂母液中锂回收的方法: CN112717468A[P]. 2021-04-30 LI Suidang, YAN Hudao, YU Jia, et al. Method for recycling lithium in lithium precipitation mother liquor: CN112717468A[P]. 2021-04-30 (in Chinese) |
| [20] |
李丽君, 刘程琳, 宋兴福, 等. 碱性溶液体系制备磷酸锂结晶过程优化[J]. 华东理工大学学报(自然科学版), 2020, 46(5): 598-607. LI Lijun, LIU Chenglin, SONG Xingfu, et al. Optimization of crystallization process for preparation of lithium phosphate in alkaline solution system[J]. Journal of East China University of Science and Technology, 2020, 46(5): 598-607. (in Chinese) |
| [21] |
石钰川. 赣锋锂业新能源电池企业价值评估[D]. 山东青岛: 青岛科技大学, 2023 SHI Yuchuan. Enterprise value evaluation of ganfeng lithium new energy lithiumbattery[D]. Shandong Qingdao: Qingdao University of Science and Technology, 2023 (in Chinese) |
| [22] |
张小霞. 低浓度含锂废液生产磷酸锂的工艺研究[J]. 无机盐工业, 2020, 52(5): 68-70. ZHANG Xiaoxia. Study on process of producing lithium phosphate by low-concentration lithium-containing waste liquid[J]. Inorganic Chemicals Industry, 2020, 52(5): 68-70. (in Chinese) |
| [23] |
伍德佑, 潘湛昌, 刘志强. 从废旧锂离子电池中回收制备磷酸锂的工艺研究[J]. 材料研究与应用, 2020, 14(4): 312-316, 343. WU Deyou, PAN Zhanchang, LIU Zhiqiang. Study on the process for recycling lithium phosphate from spent Li-ion batteries[J]. Materials Research and Application, 2020, 14(4): 312-316, 343. (in Chinese) |
 2024, Vol. 41
2024, Vol. 41