随着日常生活中电子产品的普及和电动汽车市场的扩大,开发高性能电池是满足电池寿命长、安全性高、成本低等需求的主要途径。负极是电池的重要组成部分。具有尖晶石结构的LTO负极材料其充放电平台约为1.55 V,不易产生锂枝晶和SEI膜,安全性高[1]。尖晶石结构的LTO是一种“零应变”材料,在Li+嵌入和脱嵌的过程中体积变化很小。这一特性有助于保持Li4+xTi5O12的结构稳定性和充放电过程中的颗粒疲劳强度,可以提供更好的循环寿命和倍率性能[2-5]。但是,LTO材料在实际应用中也存在一些缺点。一方面,Li+嵌入的初始能量较高(超过0.58 eV)[6]。另一方面,LTO具有较低的电子电导率(约10-13 S ·cm-1)和较低的Li+扩散系数(约10-9~10-13 cm2 ·s-1)[7-9],使LTO电池的能量密度和倍率性能受到限制。
为了提高LTO电池的能量密度和倍率性能,已经采用了相当多的策略,例如:制造纳米结构[10, 11]和制备复合材料[12-14]。此外,LTO材料还可以进行离子掺杂以提高电池性能。阳离子掺杂包括Na+、Ka+、Mg2+、Ca2+、Fe3+和Co3+等阳离子掺杂[15-20]。阴离子掺杂包括F-、Cl-、Br-和PO43-等阴离子掺杂[21-24]。
Br-掺杂LTO材料可以有效提高材料的电子电导率和离子传输速率,有利于电池的可逆性和倍率能力[25]。Wang等使用十六烷基四甲基氢氧化铵辅助水热法和进一步煅烧,合成具有微纳米级结构的Br-掺杂的LTO。在掺杂样品中,掺杂了20%的Br-的LTO样品在10 C下循环1 000次后,它们的容量保持率仍能达到87.8%,高于纯LTO的76.5%[26]。然而,在之前对Br-掺杂LTO的研究中,Br使用量相对较小,且制备过程需要高温加热,比容量的提高也有限。相关研究已经表明,CuBr改性铜箔可以显着提高锂离子电池的放电容量[27]。在本研究中,我们使用过量的溴化锂(LiBr)作为Br源,LiBr与LTO的质量比分别为0.5/9.5、1/9、2/8和3/7。改性LTO复合电极在电极制备过程中一步完成,不需要高温加热,操作相对简单。当Br使用量较大时,在电极片制备过程中铜箔集流体表面形成了1层溴化亚铜(CuBr)颗粒。预计改性的LTO复合电极样品在Br掺杂和CuBr改性的共同作用下将表现出更好的电化学性能。
1 实验部分 1.1 试剂与仪器醋酸锂(CH3COOLi,98%,阿达玛斯试剂有限公司)、钛酸四丁酯(C16H36O4Ti,99%,武汉梦奇科技有限公司)、柠檬酸一水合物(C6H10O8,AR,江苏彤晟化学试剂有限公司)、乙醇(≥99.7%,通用试剂有限公司)、溴化锂(LiBr,99.55%,阿达玛斯试剂有限公司)、N-甲基吡咯烷酮(NMP,AR,国药集团化学试剂有限公司)、Super-P(粒度40 nm,瑞士特米高有限公司)、PVDF(AR,国药集团化学试剂有限公司)。
X射线衍射仪(型号:X Perp PRO),荷兰帕纳科公司;扫描电子显微镜(型号:S-4800),日本日立公司。电化学工作站(型号:CHI660E),上海辰华仪器有限公司;充放电测试仪(型号:CT2001A),武汉蓝电电池测试有限公司;管式炉(型号:OTF-1200X),合肥科晶材料技术有限公司;真空手套箱(型号:Universal(2440/750),米开罗那(中国)有限公司;扣式电池封口机(型号:MSK-110),深圳科晶智达科技有限公司;电热鼓风干燥箱(型号:SK101),上海圣科仪器设备有限公司;自动涂膜烘干机(型号:AFA-III),合肥科晶材料技术有限公司;真空干燥箱(型号:DZF-6050),合肥科晶材料技术有限公司;磁力搅拌机(型号:B11-3),上海司乐仪器有限公司。
1.2 实验过程首先,称取醋酸锂、钛酸四丁酯、柠檬酸一水合物和乙醇并混合,其中n(醋酸锂)与n(钛酸四丁酯)为1.04/1.00,将混合溶液在磁力搅拌器上以600 r ·min-1的转速搅拌1 h,形成透明溶胶。之后,将溶胶放入80 ℃鼓风干燥箱中干燥24 h以去除水分,然后用玛瑙研钵将其研磨成粉末。最后将研磨好的粉末放入氩气管式炉中,以5 ℃ ·min-1的加热速度升温至800 ℃,恒温12 h,自然冷却后取出,用玛瑙研钵研磨成粉末,即得到Li4Ti5O12。
称取一定量的PVDF粉末加入装有N-甲基吡咯烷酮(NMP)溶液的烧杯中,在磁力搅拌器上搅拌2 h,制成20 g ·L-1的黏合剂溶液。然后称取一定量的溴化锂、LTO和Super P加入制备好的溶液中。实验中5组实验m(LiBr) ∶m(LTO)Vm(Super P) ∶m(PVDF)分别为0 ∶8.0 ∶1.0 ∶1.0、0.4 ∶7.6 ∶1.0 ∶1.0、0.8 ∶7.2 ∶1.0 ∶1.0、1.6 ∶6.4 ∶1.0 ∶1.0和2.4 ∶5.6 ∶1.0 ∶1.0。根据LiBr与LTO的质量比,5组实验样品分别命名为Pristine LTO、0.5/9.5LBLTO、1/9LBLTO、2/8LBLTO和3/7LBLTO。将悬浮液再次在磁力搅拌器上搅拌3 h以形成均匀浆液。用涂布机将浆料均匀涂布在铜箔上,将涂布后的电极片放入鼓风干燥箱中80 ℃干燥2 h后放入真空干燥箱80 ℃再干燥24 h使其充分干燥。改性LTO复合电极是在电极制备过程中完成的。最后,对完全干燥的电极片进行切片,然后在真空手套箱中组装成纽扣电池进行测试。
1.3 材料表征与电化学测试原始LTO样品和改性LTO复合样品的组成和晶体结构主要通过X射线衍射(XRD)进行分析。样品的形貌和元素分布采用扫描电子显微镜(SEM)结合能谱仪(EDS)分析。
实验中,在充放电测试仪下完成充放电循环测试,电压设置为1.0~2.6 V。实验中的循环伏安(CV)测试使用电化学工作站进行,电压为1.0~2.6 V,扫描速率为0.6 mV ·s-1。实验中的电化学阻抗谱(EIS)测试是使用电化学工作站以0.01 Hz~1 MHz的频率完成的。
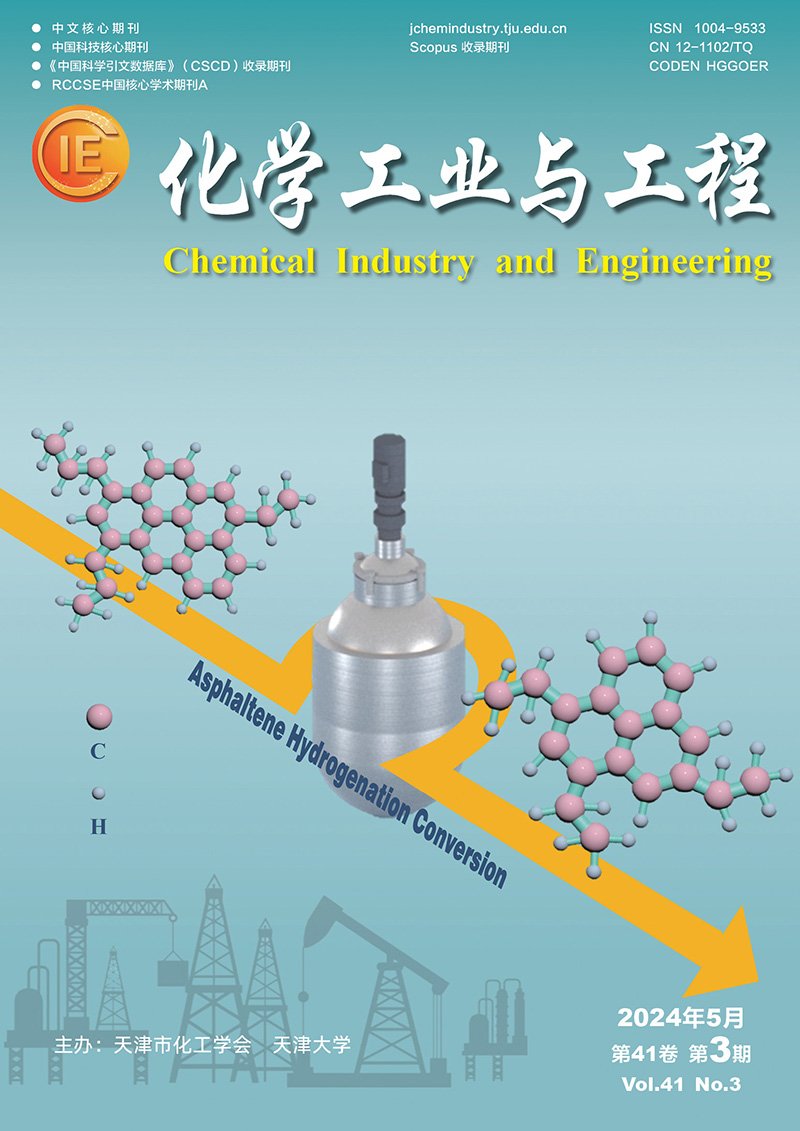
2 结果与讨论 2.1 改性LTO复合电极的表征图 1(a)为1/9LBLTO和原始LTO的XRD谱图。位于18.3°、47.4°和66.1°的衍射峰对应于Fd-3m空间群的尖晶石LTO相。位于43.2°、50.5°和74.1°的衍射峰对应铜(Cu)。1/9LBLTO的衍射峰包含了原始LTO的衍射峰,说明混合LiBr对LTO的晶体结构没有严重影响。从图 1(b)可以看出,与原始LTO相比,1/9LBLTO的LTO的峰略有左移,说明掺杂Br-对LTO的内部晶格参数有影响。这是因为较大的半径Br-取代LTO上的O2-,会影响LTO的晶格参数,但不会改变LTO的结构[28]。位于27.0°、45.0°和53.3°的衍射峰与CuBr的衍射峰对应。CuBr衍射峰的出现,表明CuBr是在电极片制备过程中产生的。
|
| 图 1 (a) 1/9LBLTO和原始LTO的XRD图;(b)Li4Ti5O12峰的局部放大图 Fig.1 (a) XRD of 1/9LBLTO and Pristine LTO; (b) Magnified peaks of Li4Ti5O12 |
| |
图 2为1/9LBLTO和原始LTO的SEM图像。从图 2(a)和图 2(b)可以清楚地看到具有较大颗粒的尖晶石结构的LTO和具有较小颗粒的Super-P。对比图 2(c)和图 2(d)可以看出,改性LTO的粒径几乎没有变化,表面的一些小颗粒可能是过量的LiBr。根据实验中的Mapping图,可以看出电极材料中Br-的含量[图 2(e)]。通过Mapping图中Br元素的分布可以看出,Br-均匀分布在1/9LBLTO电极中[图 2(f)]。

|
| 图 2 (a) 和(c)原始LTO的SEM;(b)和(d)1/9LBLTO的SEM;(e)和(f)1/9LBLTO的mapping图 Fig.2 (a) and (c) SEM of Pristine LTO; (b) and (d) SEM of 1/9LBLTO; (e) and (f) mapping of 1/9LBLTO |
| |
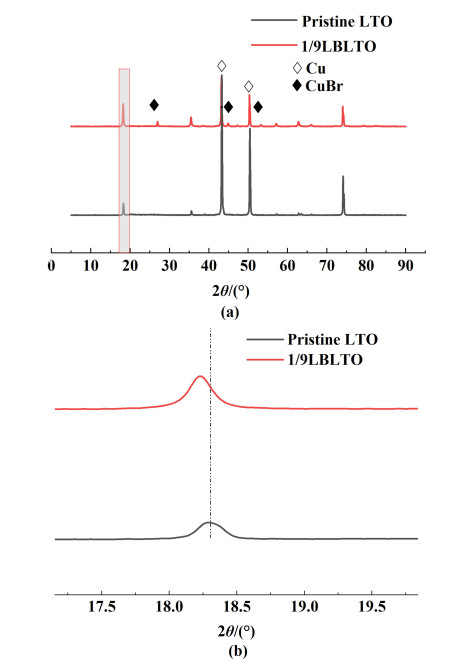
图 3展示了改性LTO复合电极的倍率性能测试。室温下以不同倍率充放电,电压范围为1.0~2.6 V。
|
| 图 3 LBLTO和原始LTO的倍率性能测试 Fig.3 Rate performance test of LBLTO and Pristine LTO |
| |
从图 3可以看出,改性LTO电极的比容量与原始LTO电极相比有明显提高。在0.1 C倍率下,原始LTO、0.5/9.5LBLTO、1/9LBLTO、2/8LBLTO和3/7LBLTO的首周循环比容量分别为159.42、91.79、222.88、191.67和218.42 mAh ·g-1。随着倍率的增加,5个样本的放电比容量均有所下降,1/9LBLTO的改性复合样品在0.1 C倍率时容量下降趋向平稳,比容量比其他几个样品都较大,0.5/9.5LBLTO、2/8LBLTO和3/7LBLTO在0.1 C倍率下,趋向平稳,变化基本一致,效果也比原始LTO电极要好,在0.2和0.3 C倍率时,比值2/8LBLTO和3/7LBLTO的放电克容量下降幅度较1/9LBLTO大。在测试中,1/9LBLTO样品在倍率性能测试中比容量最大,0.5/9.5LBLTO样品在倍率性能测试中性能最稳定。从图 3可以看出,1/9LBLTO和2/8LBLTO在0.1 C下前10个循环的平均比容量分别达到208.68和194.37 mAh ·g-1。对比原始LTO样品比容量有了明显的提升。结合XRD图谱,LBLTO电极中存在CuBr,根据Zhang等[27]的研究成果,推测CuBr参与了脱锂/锂化过程。由于CuBr化学性质不稳定,遇光易分解,在空气中易氧化,因此几乎没有直接将CuBr用作电池负极材料的研究。本研究电极中的CuBr是由Cu箔表面的Br和Cu生成的,因此推测电极片中的CuBr应该主要存在于Cu箔和电极浆料的接合处,这里有隔绝氧气和光线的环境,使CuBr得以存在。此外,Cl和I都是卤素元素,而CuCl和CuI已被用作电池负极材料,并显示出相当好的容量[29, 30]。因此,CuBr应该具有相似的脱锂/锂化的能力,也可以用作负极活性物质。
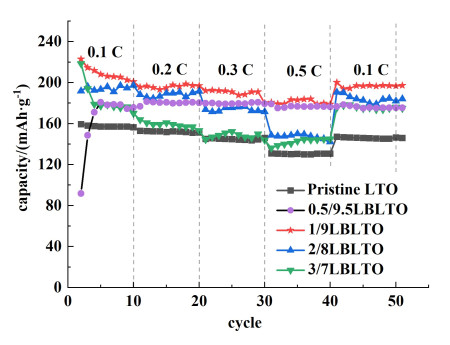
为了测试原始LTO电极和改性LTO复合电极样品的循环稳定性,对5个样品进行了恒电流充放电测试。首先以0.1 C的倍率循环10周,然后以1.0 C的倍率循环90周。循环测试结果如图 4(a)所示,原始LTO样品前10周的平均比容量在0.1 C倍率下为160.4 mAh ·g-1,再在1.0 C倍率下循环90周后比容量为127.6 mAh ·g-1,容量保持率为79.6%。0.5/9.5LBLTO、1/9LBLTO、2/8LBLTO和3/7LBLTO在0.1 C倍率下前10周的平均比容量分别为179.9、243.9、180.0和190.1 mAh ·g-1。以0.1 C的倍率循环10次后,4组改性LTO样品再以1.0 C的倍率循环90周。最终比容量分别为155.5、181.6、155.7和156.5 mAh ·g-1,容量保持率分别为86.4%、74.4%、86.5%和82.3%。0.5/9.5LBLTO样品的循环稳定性在5个样品中表现最好。原始LTO样品和改性LTO样品在第1、8和100周循环时的充放电曲线如下图 4(b)、图 4(c)和图 4(d)。
|
| 图 4 (a) LBLTO的循环测试;(b)、(c)和(d)第1周、第8周和第100周循环充放电曲线 Fig.4 (a)Cycling test of LBLTO; (b), (c) and (d) The 1st, 8th and 100th cycle charge-discharge curves |
| |
图 5展示了原始LTO电极样品和1/9LBLTO复合电极样品在0.6 mV ·s-1扫描速率下的循环伏安(CV) 测试曲线。原始LTO样品和1/9LBLTO样品的氧化还原峰差值分别为0.303和0.248 V。这表明1/9LBLTO样品的极化小于原始LTO样品的极化。根据维加德定律,当较大半径的离子取代较小半径的离子时,晶胞参数会增加。Br的掺杂使钛酸锂中半径较大的Br-取代了半径较小的O2-,这将增加晶胞参数[25]。因此,Br-掺杂可以提高复合电极中钛酸锂的离子传输速度和电子电导率。如上所述,Br-改性的LTO复合电极的比容量有了明显的提升,推测是CuBr作为一种新物质参与了Li+的嵌入/脱出过程。CV曲线只显示了LTO的氧化还原峰。结合Ding等[31]在铜箔集流体表面上的CuBr改性石墨负极的实验,CuBr可能在1.5 V处有1个还原峰。我们使用的LTO材料的还原峰也在1.5 V,因此CuBr和LTO材料的还原峰极有可能重叠,拓宽了测试样品的还原峰,从而提高了放电比容量。
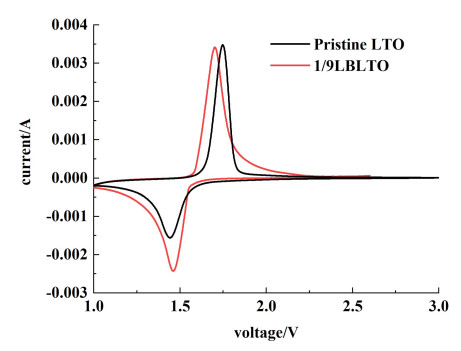
|
| 图 5 1/9LBLTO和原始LTO的CV测试图 Fig.5 CV of 1/9LBLTO and Pristine LTO |
| |
为了进一步研究实验样品的电化学性能,对原始LTO样品和1/9LBLTO样品进行EIS测试。如图 6所示,高频区的半圆为电极中电荷转移引起的电荷转移电阻Rct,低频区的直线代表Warburg阻抗,这是由于Li+在电极活性材料中的扩散引起的阻抗[32]。拟合EIS后,1/9LiBr/LTO样品的Rct(33.31 Ω)小于原始LTO样品(63.71 Ω),1/9LiBr/LTO样品的Warburg阻抗(0.68 Ω)也小于原始LTO样品(7.75 Ω)。这表明掺Br-的1/9LBLTO复合样品的电导率和离子扩散速率优于原始LTO样品,这与充放电循环曲线以及CV曲线的结果一致。
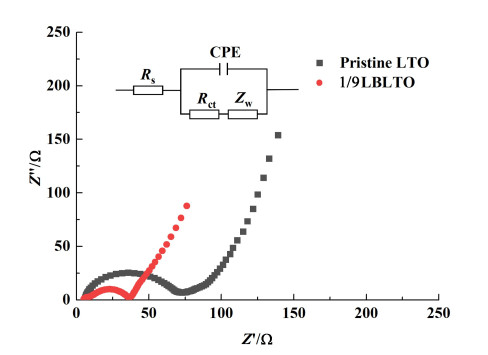
|
| 图 6 1/9LBLTO和原始LTO的EIS测试图 Fig.6 EIS characterization of 1/9LBLTO and Pristine LTO |
| |
在电极制备过程中,使用大量的LiBr制备改性LTO复合电极。LiBr作为Br源,LiBr和LTO的质量比分别为0.5/9.5、1/9、2/8和3/7。通过溶液混合法,在电极制备过程中一步完成改性LTO复合电极的制备,操作简单、成本较低。充放电测试结果表明,改性LTO复合电极样品的比容量显著提高。主要原因可以归结为两点。首先,部分Br-取代了O2-,扩大了晶格,拓宽了离子通道,降低了电荷转移阻力,改善了Li+的扩散。其次,XRD显示改性LTO样品中存在CuBr,CuBr参与了Li+的嵌入和脱出过程。实验结果表明,Br改性后的LTO复合电极的电化学性能显著提高。
| [1] |
KOSTLÁNOVÁ T, DĚDEČEK J, KRTIL P. The effect of the inner particle structure on the electronic structure of the nano-crystalline Li-Ti-O spinels[J]. Electrochimica Acta, 2007, 52(5): 1847-1856. DOI:10.1016/j.electacta.2006.07.048 |
| [2] |
FERG E, GUMMOW R J, DE KOCK A, et al. Spinel anodes for lithium-ion batteries[J]. Journal of the Electrochemical Society, 1994, 141(11): L147-L150. DOI:10.1149/1.2059324 |
| [3] |
REALE P, PANERO S, SCROSATI B, et al. A safe, low-cost, and sustainable lithium-ion polymer battery[J]. Journal of the Electrochemical Society, 2004, 151(12): A2138. DOI:10.1149/1.1819790 |
| [4] |
CHRISTENSEN J, SRINIVASAN V, NEWMAN J. Optimization of lithium titanate electrodes for high-power cells[J]. Journal of the Electrochemical Society, 2006, 153(3): A560. DOI:10.1149/1.2172535 |
| [5] |
LU W, BELHAROUAK I, LIU J, et al. Electrochemical and thermal investigation of Li4/3Ti5/3O4 spinel[J]. Journal of the Electrochemical Society, 2007, 154(2): A114. DOI:10.1149/1.2402117 |
| [6] |
WILKENING M, AMADE R, IWANIAK W, et al. Ultraslow Li diffusion in spinel-type structured Li4Ti5O12—A comparison of results from solid state NMR and impedance spectroscopy[J]. Physical Chemistry Chemical Physics, 2007, 9(10): 1239-1246. DOI:10.1039/B616269J |
| [7] |
ZHAO L, HU Y, LI H, et al. Porous Li4Ti5O12 coated with N-doped carbon from ionic liquids for Li-ion batteries[J]. Advanced Materials, 2011, 23(11): 1385-1388. DOI:10.1002/adma.201003294 |
| [8] |
MENG W, XU Y, YAN B, et al. Titanium-modified Li4Ti5O12 with a synergistic effect of surface modifying, bulk doping, and size reducing[J]. Ionics, 2018, 24(4): 1019-1027. DOI:10.1007/s11581-017-2278-4 |
| [9] |
PENDER J P, JHA G, YOUN D H, et al. Electrode degradation in lithium-ion batteries[J]. ACS Nano, 2020, 14(2): 1243-1295. DOI:10.1021/acsnano.9b04365 |
| [10] |
LIU Y, XIAO R, FANG Y, et al. Three-dimensional oxygen-deficient Li4Ti5O12 nanospheres as high-performance anode for lithium ion batteries[J]. Electrochimica Acta, 2016, 211: 1041-1047. DOI:10.1016/j.electacta.2016.06.125 |
| [11] |
LI L, JIA X, ZHANG Y, et al. Li4Ti5O12 quantum dot decorated carbon frameworks from carbon dots for fast lithium ion storage[J]. Materials Chemistry Frontiers, 2019, 3(9): 1761-1767. DOI:10.1039/C9QM00259F |
| [12] |
ZHU Z, CHENG F, CHEN J. Investigation of effects of carbon coating on the electrochemical performance of Li4Ti5O12/C nanocomposites[J]. Journal of Materials Chemistry A, 2013, 1(33): 9484-9490. DOI:10.1039/c3ta00114h |
| [13] |
SHA Y, XU X, LI L, et al. Hierarchical carbon-coated acanthosphere-like Li4Ti5O12 microspheres for high-power lithium-ion batteries[J]. Journal of Power Sources, 2016, 314: 18-27. DOI:10.1016/j.jpowsour.2016.02.084 |
| [14] |
ZHAO S, ZHANG M, WANG Z, et al. Enhanced high-rate performance of Li4Ti5O12 microspheres/multiwalled carbon nanotubes composites prepared by electrostatic self-assembly[J]. Electrochimica Acta, 2018, 276: 73-80. DOI:10.1016/j.electacta.2018.04.173 |
| [15] |
REALE P, PANERO S, RONCI F, et al. Iron-substituted lithium titanium spinels: Structural and electrochemical characterization[J]. Chemistry of Materials, 2003, 15(18): 3437-3442. DOI:10.1021/cm034122c |
| [16] |
WANG W, JIANG B, XIONG W, et al. A nanoparticle Mg-doped Li4Ti5O12 for high rate lithium-ion batteries[J]. Electrochimica Acta, 2013, 114: 198-204. DOI:10.1016/j.electacta.2013.10.035 |
| [17] |
ZHANG Q, ZHANG C, LI B, et al. Preparation and electrochemical properties of Ca-doped Li4Ti5O12 as anode materials in lithium-ion battery[J]. Electrochimica Acta, 2013, 98: 146-152. DOI:10.1016/j.electacta.2013.03.006 |
| [18] |
YI T, YANG S, LI X, et al. Sub-micrometric Li4-xNaxTi5O12 (0≤x≤0.2) spinel as anode material exhibiting high rate capability[J]. Journal of Power Sources, 2014, 246: 505-511. DOI:10.1016/j.jpowsour.2013.08.005 |
| [19] |
GUO Q, WANG Q, CHEN G, et al. Molten salt synthesis of transition metal oxides doped Li4Ti5O12 as anode material of Li-ion battery[J]. ECS Transactions, 2016, 72(9): 11-23. DOI:10.1149/07209.0011ecst |
| [20] |
FANG G. Electrochemical performances of Li4-xTi5O12 (x=0.02, 0.04, 0.06) as anode materials for lithium ion battery[J]. Advanced Materials Research, 2013, 712: 313-316. |
| [21] |
QI Y, HUANG Y, JIA D, et al. Preparation and characterization of novel spinel Li4Ti5O12-xBrx anode materials[J]. Electrochimica Acta, 2009, 54(21): 4772-4776. DOI:10.1016/j.electacta.2009.04.010 |
| [22] |
HUANG Y, QI Y, JIA D, et al. Synthesis and electrochemical properties of spinel Li4Ti5O12-x[J]. Journal of Solid State Electrochemistry, 2012, 16(5): 2011-2016. DOI:10.1007/s10008-011-1611-5 |
| [23] |
HAN D, PAN G, LIU S, et al. PO43- doped Li4Ti5O12 hollow microspheres as an anode material for lithium-ion batteries[J]. RSC Advances, 2015, 5(112): 92354-92360. DOI:10.1039/C5RA17144J |
| [24] |
CHEN Y, QIAN C, ZHANG P, et al. Fluoride doping Li4Ti5O12 nanosheets as anode materials for enhanced rate performance of lithium-ion batteries[J]. Journal of Electroanalytical Chemistry, 2018, 815: 123-129. DOI:10.1016/j.jelechem.2018.02.058 |
| [25] |
LI Y, GAO H, YANG W. Enhancements of the structures and electrochemical performances of Li4Ti5O12 electrodes by doping with non-metallic elements[J]. Electrochimica Acta, 2022, 409: 139993. DOI:10.1016/j.electacta.2022.139993 |
| [26] |
WANG J, ZHAO S, XIE J, et al. Enhanced high-rate performance of Br-doping Li4Ti5O12 microspheres as anode materials for lithium-ion batteries[J]. Journal of Solid State Chemistry, 2021, 303: 122479. DOI:10.1016/j.jssc.2021.122479 |
| [27] |
ZHANG H. Petal-shaped copper(I) bromide modified copper/graphite as current collector for lithium ion batteries[J]. International Journal of Electrochemical Science, 2022, 17(3): 22037. DOI:10.20964/2022.03.09 |
| [28] |
GAO L, LIU R, HU H, et al. Carbon-decorated Li4Ti5O12/rutile TiO2 mesoporous microspheres with nanostructures as high-performance anode materials in lithium-ion batteries[J]. Nanotechnology, 2014, 25(17): 175402. DOI:10.1088/0957-4484/25/17/175402 |
| [29] |
LIU S, HOU H, HU W, et al. Binder-free integration of insoluble cubic CuCl nanoparticles with a homologous Cu substrate for lithium ion batteries[J]. RSC Advances, 2016, 6(5): 3742-3747. DOI:10.1039/C5RA21020H |
| [30] |
MENG J L, YANG Z, CHEN L, et al. The investigation on the electrochemical performance of CuI as cathode material for zinc storage[J]. Electrochimica Acta, 2020, 338: 135915. DOI:10.1016/j.electacta.2020.135915 |
| [31] |
DING K, QU R, ZHOU L, et al. Preparation of CuBr nanoparticles on the surface of the commercial copper foil via a soaking method at room temperature: Its unexpected facilitation to the discharge capacity of the commercial graphite electrode[J]. Journal of Electroanalytical Chemistry, 2020, 877: 114626. DOI:10.1016/j.jelechem.2020.114626 |
| [32] |
YAMADA H, MATSUMOTO K, KURATANI K, et al. Preface for the 66th special feature "novel aspects and approaches to experimental methods for electrochemistry"[J]. Electrochemistry, 2022, 90(10): 102000. DOI:10.5796/electrochemistry.22-66113 |
 2024, Vol. 41
2024, Vol. 41