熔点等于或低于室温的熔融盐被称为离子液体(ILs)[1, 2],离子液体具有可忽略的蒸气压、低熔点、难挥发性、合适的黏度和高的热稳定性等独特的物理性质[3]。离子液体这些优良的特性使其在工业和学术领域有广泛的应用,可用来溶解生物质中的纤维素[4];溶解或吸收SO2、CO2[5, 6];也应用于有机合成[7, 8]等。目前,功能化离子液体是离子液体研究领域中一个非常热点的话题。在阳离子中引入特定的官能团,可以显著改变离子液体的物理化学性质[9],这些具有特定功能的官能团可以满足离子液体对特定应用的要求。醚基功能化离子液体就是向离子液体中引入醚基得到的功能化离子液体,可以有效降低离子液体的熔点和黏度,调节离子液体的极性和疏水性使其有能力溶解分子[10],还可以提高离子液体的应用价值,例如,在锂离子电池应用中,具有低黏度的醚基功能化离子液体,可以改善锂离子电池的电化学性能,促进锂离子的扩散[11];并且离子液体中引入醚基也可以提高CO2等的溶解度[12, 13]。
Coadou等[14]测定基于5种含双三氟甲基磺酰亚胺[NTf2]-阴离子的醚官能化砜阳离子的密度、黏度和离子电导率等性质,这些离子液体均显示出较大的液相温度、较低的黏度和良好的电导率,通过结合DFT计算和电化学表征,这些新型离子液体显示出良好的电化学稳定性窗口,适合作为电化学储能装置中的电解质材料。Liu等[15]合成了疏水性离子液体1-(2-甲氧基乙基)-3-乙基咪唑双三氟甲基磺酰亚胺盐[C22O1IM][NTf2],并测定了[C22O1IM][NTf2]与甲醇和乙醇二元体系在15~45 ℃下的密度和黏度,介绍了混合物的相对体积Vr,并将其与相对黏度ηr相结合,得出了混合物黏性流动的无量纲吉布斯活化能等于混合物相对体积Vr乘积的对数,得到了相对黏度ηr。Wei等[16]测量醚基功能化离子液体[C22O1IM][TfO]与乙醇、1-丙醇和2-丙醇二元混合物在15~45 ℃下的黏度,分别用VTF方程和Arrhenius方程拟合溶液的黏度随温度的变化关系。发现VTF方程更适合描述二元体系[C22O1IM][TfO]+醇。并且计算了黏度偏差Δη和混合物相对黏度的吉布斯活化能ΔGr≠,在整个浓度范围内始终为负值,表明离子液体中的离子与醇分子之间存在较强的溶剂化作用。
[C22O1IM][NTf2][结构见图 1(a)]作为疏水性醚基功能化离子液体引起了越来越多的关注。有机溶剂FA[结构见图 1(b)]具有活泼的反应性和特殊的溶解能力,可用作有机合成原料,也是优良的有机溶剂,医药方面的用途居多;另外一种有机溶剂DMF[结构见图 1(c)]是一种用途广泛的化工原料和溶剂,用作聚氨酯、聚氯乙烯等的溶剂,亦用作萃取剂,医药和农药杀虫剂的原料。[C22O1IM][NTf2]、FA和DMF的重要性日益增加,然而目前很少有文献对[C22O1IM][NTf2]+FA/DMF组成的二元体系进行报道,因此本工作实验测定了其二元体系的密度、声速和黏度,并计算了它们的衍生性质。本论文所研究的离子液体二元体系的物理化学性质测定,既丰富了离子液体体系的体积性质、光学性质和传质性质,也为离子液体的绿色化工过程奠定一定的实验和理论基础。
|
| 图 1 [C22O1IM][NTf2],FA,DMF结构示意图 Fig.1 Structural diagram of [C22O1IM][NTf2], FA and DMF |
| |
甲酰胺(FA,阿拉丁试剂有限公司,AR,质量分数为99%);二甲基甲酰胺[DMF,阿拉丁试剂有限公司,质量分数>99.9%(GC)];无水乙醇(国药集团,质量分数≥99.7%);1-(2-甲氧基乙基)-3-乙基咪唑双三氟甲基磺酰亚胺盐([C22O1IM][NTf2],上海复捷化学有限公司,质量分数为99%,[C22O1IM][NTf2]的核磁氢谱见支持信息图S1),经卡尔费休水分测定仪检测[C22O1IM][NTf2]的水含量低于0.1%;实验室所用水均为去离子水[电阻率为18.25 MΩ ·cm(25 ℃)]。
Anton Paar DSA 5000M型密度声速仪(密度和声速的精度分别为0.000 001 g ·cm-3,0.01 m ·s-1);Anton Paar Lovis 2000M型微量黏度模块(精度为0.001 mPa ·s);梅特勒-托利多ME 204型分析天平(精度为0.000 1 g)。
1.2 制备及测试 1.2.1 二元混合物的制备离子液体[C22O1IM][NTf2]与甲酰胺(FA)/二甲基甲酰胺(DMF)二元混合物溶液采用质量法进行配置。采用梅特勒-托利多ME204型分析天平分别称量[C22O1IM][NTf2](1)和FA/DMF(2)的质量,配置全浓度范围内(即摩尔分数x1在0~1.00)二元混合物。配制过程时间尽量短,避免空气中的水分混入造成误差。配置好后,盖好盖子密封,搅拌振荡30 min,直至混合均匀。
1.2.2 密度、声速测量使用Anton Paar DSA5000型密度声速仪测定纯组分及[C22O1IM][NTf2]+FA/DMF二元混合物的密度ρ和声速u,测样前需开机预热至少30 min,并用大量去离子水和无水乙醇清洗仪器并吹干,在20 ℃和大气压下,用去离子水对密度声速仪进行校准。用注射器抽取约2.5 mL样品并排出气泡,向U型管缓慢匀速注样防止产生气泡,出口处有液体溢出即可,进样完毕后注射器不可拔出,然后开始测量二元混合物在15~50 ℃每隔5 ℃时的密度和声速值。密度和声速测量值的不确定度分别为0.000 2 g ·cm-3和2 m ·s-1。测得纯组分的密度、声速值列于支持信息表S1,并与文献[17-23]对照,显示出本实验的测量值与文献值吻合良好。混合物的密度、声速值列于支持信息表S2和S3。
1.2.3 黏度测量使用Anton Paar Lovis 2000M微量黏度模块测定纯组分及[C22O1IM][NTf2]+FA/DMF二元混合物的黏度η,测样前需使用标准品对Lovis 2000M微量黏度模块进行水平校正和测量系统的校正。校正完毕后,选择合适的毛细管,填充并安装毛细管,需用大量去离子水和无水乙醇清洗毛细管并吹干方可注样,注样时需缓慢匀速防止产生气泡,并翻转毛细管排出气泡。将装填好的毛细管从前面慢慢插入凹槽中,最后将前面的螺帽旋紧,设置好后开始测量[C22O1IM][NTf2]与FA/DMF二元混合物在15~50 ℃每隔5 ℃时的黏度值。黏度测量值的不确定度为5%。测得纯组分的黏度值列于支持信息表S1,并与文献[19-23]对照,显示出本实验的测量值与文献值吻合良好。混合物的黏度值列于支持信息表S2和表S3。
2 结果与讨论 2.1 组成对[C22O1IM][NTf2]+FA/DMF密度、声速、黏度的影响如图 2和图 4所示,[C22O1IM][NTf2](1)+FA/DMF (2)的密度和黏度值均随着x1的增大而增大;而[C22O1IM][NTf2](1)+FA/DMF(2)的声速值随着x1的增大而减小,趋势如图 3所示。

|
| 图 2 15~50 ℃下二元混合物密度ρ随x1的变化关系图 Fig.2 Variation of density ρ of binary mixture with x1 at 15—50 ℃ |
| |

|
| 图 3 15~50 ℃下二元混合物声速u随x1的变化关系图 Fig.3 Variation of sound velocity u of binary mixture with x1 at 15—50 ℃ |
| |
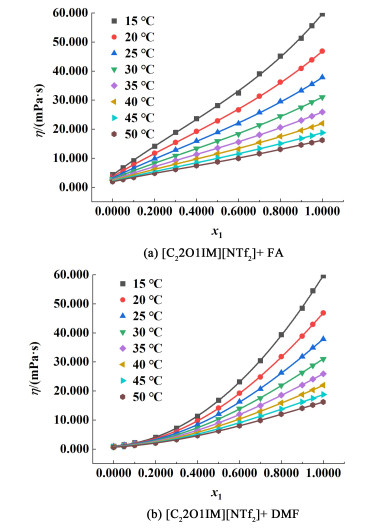
|
| 图 4 15~50 ℃下二元混合物黏度η随x1的变化关系图 Fig.4 Variation of sound viscosity η of binary mixture with x1 at 15—50 ℃ |
| |
从如图 2~图 4中可以看出,二元混合物的密度、声速和黏度与摩尔分数x1的变化关系是非线性的,并且二元混合物的密度、声速和黏度与摩尔分数x1之间具有良好的相关性。
2.2 [C22O1IM][NTf2]+FA/DMF超额摩尔体积支持信息表S2和表S3中收集了[C22O1IM][NTf2](1)+FA/DMF(2)二元混合物的密度实验值和超额摩尔体积计算值。超额摩尔体积的值使用式(1)[25]计算。
| $ V_{\mathrm{m}}^{\mathrm{E}}=\frac{M_1 x_1+M_2 x_2}{\rho}-\left(\frac{M_1 x_1}{\rho_1}+\frac{M_2 x_2}{\rho_2}\right) $ | (1) |
式(1)中:ρ为二元混合物的密度;Mi,xi,ρi分别为纯组分的相对分子质量、摩尔分数、密度。
二元混合物的超额摩尔体积采用Redlich-Kister方程[25] [式(2)]进行拟合,拟合结果如支持信息表S4所示。
| $ Y=x(1-x) \sum\limits_{i=0}^{i=3} A_i(1-2 x)^i $ | (2) |
如图 5所示,在整个组成范围和所有研究温度下,二元混合物[C22O1IM][NTf2](1)+FA(2)的VmE值在整个摩尔分数范围内均为正值。VmE为正值主要是由于在FA和[C22O1IM][NTf2]的混合过程中破坏了纯组分形成的氢键结构和静电相互作用。再者,FA分子与[C22O1IM][NTf2]分子的体积相似,分子紧密堆积的可能性很小[27]。然而,在所研究的温度范围内,当x1 < 0.3时,二元混合物[C22O1IM][NTf2]+DMF的VmE为负,这是由于[C22O1IM][NTf2]离子液体网络空隙容纳了DMF分子所致,此外,VmE变为正,主要是由于破坏纯组分间的相互作用占优势所导致。

|
| 图 5 15~50 ℃下二元混合物超额摩尔体积VmE随x1的变化关系图 Fig.5 Variation of excess molar volume VmE of binary mixture with x1 at 15—50 ℃ |
| |
支持信息表S2和S3中收集了[C22O1IM][NTf2] (1)+FA/DMF(2)二元混合物的密度和声速实验值和等熵压缩系数偏差计算值。等熵压缩系数偏差的值使用式(3)和式(4)[28]计算。
| $ \begin{gathered} \kappa_{\mathrm{s}}=\frac{1}{\rho u^2} \end{gathered} $ | (3) |
| $ \Delta \kappa_{\mathrm{s}}=\kappa_{\mathrm{s}}-\left(\sum\limits_{i=1}^{i=2} x_i \kappa_{\mathrm{s} i}\right) $ | (4) |
式(3)和式(4)中:ρ和u分别为二元混合物的密度和声速,κs是二元混合物的等熵压缩系数。κsi和xi分别是纯组分的等熵压缩系数和摩尔分数。
二元混合物的等熵压缩系数偏差采用Redlich-Kister方程[25][式(2)]进行拟合,拟合结果如支持信息表S5所示。
如图 6所示,在整个组成范围和所有研究温度下,[C22O1IM][NTf2]+FA二元混合物的Δκs为正值。这表明该二元混合物比理想混合物的可压缩性好,主要是由于在FA和[C22O1IM][NTf2]的混合过程中破坏了纯组分形成的氢键结构和静电相互作用,由此可见,等熵压缩系数偏差Δκs的行为与超额摩尔体积VmE的行为非常相似[29]。而[C22O1IM][NTf2]+DMF二元体系在整个组成范围和所有研究温度下Δκs为负值,该二元混合物比理想混合物的可压缩性差,因为混合物体系内形成了更有效的分子堆积。
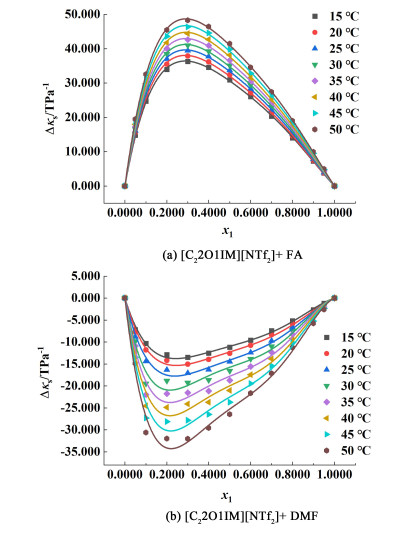
|
| 图 6 15~50 ℃下二元混合物等熵压缩系数偏差Δκs随x1的变化关系图 Fig.6 Variation of isentropic compression coefficient deviation Δκs of binary mixture with x1 at 15—50 ℃ |
| |
支持信息表S2和表S3中收集了[C22O1IM][NTf2] (1)+FA/DMF(2)二元混合物的黏度实验值和黏度偏差计算值。黏度偏差的值使用式(5)[25]计算。
| $ \Delta \eta=\eta-\left(\eta_1 x_1+\eta_2 x_2\right) $ | (5) |
式(5)中:η为二元混合物的黏度;xi、ηi分别为纯组分的摩尔分数和黏度。
二元混合物的黏度偏差采用Redlich-Kister方程[25] [式(2)]进行拟合,拟合结果如支持信息表S6所示。
图 7显示了所研究二元混合物的黏度偏差相对于摩尔分数的变化。很明显,在整个组成范围和所有研究温度下,所有混合物的黏度偏差值都是负值,这一结果表明,由于有机溶剂的加入,离子液体的阳离子[C22O1IM]+和阴离子[NTf2]-间的相互作用力变弱,这会增加离子溶剂化,从而削弱离子-离子间的相互作用[30],导致混合物的黏度显著降低,通常黏度的偏差可以通过以下2个因素来解释:(1)组成分子的大小和形状的差异;(2)由于离子-离子、离子-偶极、偶极-偶极或偶极诱导的偶极相互作用所产生的强分子引力的存在,导致所研究的体系都偏离了理想状态[31]。对于[C22O1IM][NTf2]+FA/DMF二元混合物黏度偏差为负值主要是由于混合物的2个组分之间没有强烈的相互作用。

|
| 图 7 15~50 ℃下二元混合物黏度偏差Δη随x1的变化关系图 Fig.7 Variation of viscosity deviation Δη of binary mixture with x1 at 15—50 ℃ |
| |
报道了[C22O1IM][NTf2]+FA/DMF二元混合物在整个组成范围和所有研究温度15~50 ℃下的密度、声速和黏度的实验值,由这些实验值计算了超额摩尔体积VmE、等熵压缩系数偏差Δκs和黏度偏差Δη,并用Redlich-Kister多项式进行了关联。结果表明在[C22O1IM][NTf2]与FA混合过程中主要破坏了纯组分形成的可能的氢键结构和静电相互作用。对于[C22O1IM][NTf2]+DMF二元混合物,其可压缩性变差,说明[C22O1IM][NTf2]和DMF二元混合物内形成了更有效的分子堆积,混合物的2个组分之间没有强烈的相互作用。
| [1] |
ZHANG J, FANG S, QU L, et al. Synthesis, characterization, and properties of ether-functionalized 1, 3-dialkylimidazolium ionic liquids[J]. Industrial & Engineering Chemistry Research, 2014, 53(43): 16633-16643. |
| [2] |
JIN Y, FANG S, ZHANG Z, et al. C-2 functionalized trialkylimidazolium ionic liquids with alkoxymethyl group: Synthesis, characterization, and properties[J]. Industrial & Engineering Chemistry Research, 2013, 52(22): 7297-7306. |
| [3] |
何丽娟, 黄艳伟, 袁致林, 等. 离子液体[emim][Tf2N]的表面张力、密度、黏度及电导率实验测定[J]. 化学工业与工程, 2018, 35(4): 17-23. HE Lijuan, HUANG Yanwei, YUAN Zhilin, et al. Experimental determination on the surface tension, density, viscosity and conductivity of ionic liquid 1-ethyl-3-methylimidazolium bis[(trifluoromethyl) sulfonyl]imide[J]. Chemical Industry and Engineering, 2018, 35(4): 17-23. (in Chinese) |
| [4] |
YANG F, FENG P. Densities and viscosities of ionic liquid with organic solvents[J]. Applied Sciences, 2020, 10(23): 8342. DOI:10.3390/app10238342 |
| [5] |
PÉREZ E, DE PABLO L, SEGOVIA J J, et al. Solubility of CO2 in three cellulose-dissolving ionic liquids[J]. AIChE Journal, 2020, 66(7): e16228. DOI:10.1002/aic.16228 |
| [6] |
MONDAL A, BALASUBRAMANIAN S. Understanding SO2 capture by ionic liquids[J]. The Journal of Physical Chemistry B, 2016, 120(19): 4457-4466. DOI:10.1021/acs.jpcb.6b02553 |
| [7] |
QURESHI Z S, DESHMUKH K M, BHANAGE B M. Applications of ionic liquids in organic synthesis and catalysis[J]. Clean Technologies and Environmental Policy, 2014, 16(8): 1487-1513. DOI:10.1007/s10098-013-0660-0 |
| [8] |
高歌, 靳海波. 咪唑类离子液体催化合成碳酸丙烯酯[J]. 化学工业与工程, 2014, 31(1): 14-18, 62. GAO Ge, JIN Haibo. Synthesis of propylene carbonate in the presence of catalysts of N, N'-dialkylimidazolium-based ionic liquids[J]. Chemical Industry and Engineering, 2014, 31(1): 14-18, 62. DOI:10.13353/j.issn.1004.9533.2014.01.003 (in Chinese) |
| [9] |
FANG S, YANG L, WANG J, et al. Ionic liquids based on functionalized guanidinium cations and TFSI anion as potential electrolytes[J]. Electrochimica Acta, 2009, 54(17): 4269-4273. DOI:10.1016/j.electacta.2009.02.082 |
| [10] |
龚燕燕, 刘海春, 张朵, 等. 醚基功能化离子液体[MOEMIm]CI和[EOEMIm]CI热力学性质[J]. 物理化学学报, 2019, 35(11): 1224-1231. GONG Yanyan, LIU Haichun, ZHANG Duo, et al. Thermodynamic properties of the ether-based functionalized ionic liquids[MOEMIm]CI and[EOEMIm]CI[J]. Acta Physico-Chimica Sinica, 2019, 35(11): 1224-1231. DOI:10.3866/PKU.WHXB201901072 (in Chinese) |
| [11] |
WANG G, SHEN S, FANG S, et al. New ether-functionalized pyrazolium ionic liquid electrolytes based on the bis(fluorosulfonyl)imide anion for lithium-ion batteries[J]. RSC Advances, 2016, 6(75): 71489-71495. DOI:10.1039/C6RA16348C |
| [12] |
CUI G, WANG C, ZHENG J, et al. Highly efficient SO2 capture by dual functionalized ionic liquids through a combination of chemical and physical absorption[J]. Chemical Communications, 2012, 48(20): 2633-2635. DOI:10.1039/c2cc16457d |
| [13] |
KANAKUBO M, MAKINO T, TANIGUCHI T, et al. CO2 solubility in ether functionalized ionic liquids on mole fraction and molarity scales[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(2): 525-535. |
| [14] |
COADOU E, GOODRICH P, NEALE A R, et al. Synthesis and thermophysical properties of ether-functionalized sulfonium ionic liquids as potential electrolytes for electrochemical applications[J]. ChemPhysChem, 2016, 17(23): 3992-4002. DOI:10.1002/cphc.201600882 |
| [15] |
PAN Y, YANG Y, CHANG N, et al. A new theoretical model-The ionic molar surface Gibbs free energy and its application[J]. The Journal of Chemical Thermodynamics, 2018, 116: 107-113. DOI:10.1016/j.jct.2017.08.035 |
| [16] |
LIU J, QI X, LI L, et al. Physical properties and its estimation of binary mixtures of ether-functionalized ionic liquids[C22O1IM][NTF2]with alcohols[J]. Journal of Chemical & Engineering Data, 2020, 65(11): 5176-5183. |
| [17] |
HOGA H E, OLIVIERI G V, TORRES R B. Experimental measurements of volumetric and acoustic properties of binary mixtures of 1-butyl-3-methylimidazolium hexafluorophosphate with molecular solvents[J]. Journal of Chemical & Engineering Data, 2020, 65(7): 3406-3419. |
| [18] |
EGOROV G I, MAKAROV D M. Densities and molar isobaric thermal expansions of the water+formamide mixture over the temperature range from 274.15 to 333.15 K at atmospheric pressure[J]. Journal of Chemical & Engineering Data, 2017, 62(4): 1247-1256. |
| [19] |
CHAUDHARY N, NAIN A K. Densities, speeds of sound, viscosities, refractive indices, excess and partial molar properties of binary mixtures of 1-butyl-3-methylimidazolium tetrafluoroborate with formamide at temperatures from 293.15 to 318.15 K[J]. Journal of Molecular Liquids, 2020, 305: 112816. DOI:10.1016/j.molliq.2020.112816 |
| [20] |
WARMIŃSKA D, ŚIECHOWSKI M. Thermophysical study of the binary mixtures of triethyl phosphate with N-methylformamide, N, N-dimethylformamide and N, N-dimethylacetamide-Experimental and theoretical approach[J]. Journal of Molecular Liquids, 2020, 304: 112778. DOI:10.1016/j.molliq.2020.112778 |
| [21] |
UMAPATHI R, NAIDOO P, RAMJUGERNATH D, et al. Investigation of temperature and composition dependence of molecular interactions between phosphonium-based ionic liquid + N, N-dimethylformamide: A study of thermophysical properties[J]. Journal of Molecular Liquids, 2019, 291: 110987. DOI:10.1016/j.molliq.2019.110987 |
| [22] |
SHARMA V K, KATARIA J, BHAGOUR S. Thermodynamic investigations of 1-ethyl-3-methylimidazolium tetrafluoroborate and cycloalkanone mixtures[J]. Journal of Thermal Analysis and Calorimetry, 2014, 118(1): 431-447. DOI:10.1007/s10973-014-3978-x |
| [23] |
NAIN A K. Densities, ultrasonic speeds, viscosities and excess properties of binary mixtures of methyl methacrylate with N, N-dimethylformamide and N, N-dimethylacetamide at different temperatures[J]. The Journal of Chemical Thermodynamics, 2013, 60: 105-116. DOI:10.1016/j.jct.2013.01.013 |
| [24] |
KESHAPOLLA D, SINGH V, GARDAS R L. Volumetric, acoustic and transport properties of binary mixtures of benzyldimethylammonium based ionic liquids with N, N-dimethylformamide at temperature from 293.15 to 328.15 K[J]. Journal of Molecular Liquids, 2014, 199: 330-338. DOI:10.1016/j.molliq.2014.09.030 |
| [25] |
ALMASI M. Thermodynamic properties of binary mixtures containing N, N-dimethylformamide+2-alkanol: Cubic and statistical associating fluid theory-based equation of state analysis[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(2): 365-371. DOI:10.1016/j.jtice.2013.06.006 |
| [26] |
SYAMALA V, RAJA SEKHAR D, SIVA KUMAR K, et al. Volumetric, ultrasonic and transport properties of binary liquid mixtures containing dimethyl formamide at 303.15 K[J]. Chinese Journal of Chemistry, 2007, 25(1): 32-43. DOI:10.1002/cjoc.200790013 |
| [27] |
CHAUDHARY N, KUMAR NAIN A. Volumetric, acoustic and viscometric studies of intermolecular interactions in polyethylene glycol 400+alkyl acrylate binary mixtures at temperatures from 293.15 to 318.15 K[J]. Physics and Chemistry of Liquids, 2020, 58(6): 736-759. DOI:10.1080/00319104.2019.1636378 |
| [28] |
ZAREI H, KELEY V. Density and speed of sound of binary mixtures of ionic liquid 1-ethyl-3-methylimidazolium tetrafluoroborate, N, N-dimethylformamide, and N, N-dimethylacetamide at temperature range of 293.15-343.15 K: Measurement and PC-SAFT modeling[J]. Journal of Chemical & Engineering Data, 2017, 62(3): 913-923. |
| [29] |
ZAFARANI-MOATTAR M T, SHEKAARI H. Volumetric and speed of sound of ionic liquid, 1-butyl-3-methylimidazolium hexafluorophosphate with acetonitrile and methanol at T=(298.15 to 318.15) K[J]. Journal of Chemical & Engineering Data, 2005, 50(5): 1694-1699. |
| [30] |
WEI J, LU D, JIANG C, et al. Experimental determination of viscosity for the binary mixtures of the ether-functionalized ionic liquids[C22O1IM][TfO]with monohydric alcohols[J]. Journal of Molecular Liquids, 2020, 313: 113538. DOI:10.1016/j.molliq.2020.113538 |
| [31] |
FATIMA U, MONTES-CAMPOS H, VARELA L M. Experimental and MD simulation investigation on thermophysical properties of binary/ternary mixtures of 1-butyl-3-methylimidazolium rifluoromethanesulfonate with molecular solvents[J]. Journal of Molecular Liquids, 2020, 302: 112481. DOI:10.1016/j.molliq.2020.112481 |
 2023, Vol. 40
2023, Vol. 40





