全球范围内,面积大于0.01 km2的湖水库有2 700万余个,其二者总面积约470万km2,是重要的生态和经济资源[1]。然而,在气候变动和人为干扰的影响下,近些年来,全球湖泊水质呈下降趋势,以致水华(Algal Blooms,ABs)激增。一些藻类能够产生有毒化合物和嗅味物质,导致饮用水和休闲水域的水质超标,对人类和动植物的健康构成严重的威胁[2]。2021年我国进行营养状态监测的209个重要湖泊(水库),有9座处于中度富营养化状态,48座处于轻度富营养化状态[3]。虽然近些年我国采取许多修复生态的措施,整体水质也有所改善,但有害Abs仍是水环境污染问题中亟需解决的问题之一[4]。
目前,国际上处理有害ABs最广泛的方法为化学氧化法,常用氧化剂有过氧化氢(H2O2)、臭氧(O3)、二氧化氯(ClO2)和硫酸铜(CuSO4)等。其中,臭氧具有强氧化性,溶于水可分解成氧化性更强的羟基自由基(·OH)[5],·OH是一种非选择性和高活性强氧化剂,可与藻细胞壁脂质反应,氧化细胞内酶[6],从而有效控制藻华爆发且不会产生二次污染[7]。臭氧因其高效、安全、绿色无污染等特点在除藻方面具有显著优势。Coral等[8]利用臭氧杀灭细胞密度为2.5×105和1.5×106 cell·mL-1的铜绿微囊藻和鱼腥藻悬浮液,在臭氧暴露量低于0.2 mg·min·L-1时,尽管藻细胞总量没有显著变化,但所有细胞迅速失活。武钦凯等[9]使用4 mg·L-1臭氧水灭活针尖杆藻,处理30 min时灭藻率为50%。目前实验室大多使用间歇式制备臭氧水灭藻,一般水处理中臭氧水浓度仅为0.1~4.0 mg·L-1[10],难以超过8.5 mg·L-1[11],且灭藻时间较长。
基于上述研究,本工作以小球藻为研究对象,采用实验室自主搭建高浓度臭氧水循环装置进行灭藻试验。主要研究臭氧水平衡浓度、反应时间、初始藻细胞光密度和初始反应温度数对臭氧水灭藻效果的影响,并通过对试验数据进行一级动力学与二级动力学拟合分析,为高浓度臭氧水灭藻的实际应用提供试验依据。
1 材料与方法 1.1 藻种选择与培养选择单细胞小球藻为研究对象,单细胞小球藻结构简单、易于培养,且试验结果便于检测。采用BG-11培养基进行批量培养,并将其置于温度为25 (±2) ℃,光照强度为2 500 lx, 光照时间为16 h·d-1的生化培养箱中培养,培养至对数期时开始进行试验。由于淡水中的水华现象多由蓝藻引起,蓝藻无细胞核,细胞中间有核物质,无核膜和核仁,其结构比具有细胞核结构的小球藻简单,若本文的试验对小球藻具有良好的去除作用,则处理蓝藻效果会更好[12]。
1.2 主要仪器设备XFS-280型手提式压力蒸汽灭菌锅(浙江新丰医疗机械有限公司);SPX-200型生化培养箱(上海跃进医疗器械有限公司);UV-1800型紫外分光光度计(日本岛津公司);CENTER-309型温度计(衢州艾普计量仪器有限公司);主要设备:FL-820A型臭氧发生器(深圳市飞立电器科技有限公司);LZB-6WB型流量计(上海仪表集团公司);ORS25-10型可调节离心泵(重庆恒格尔泰机电有限公司);螺旋切割器(自制)。
试验装置如图 1所示,以氧气为气源经过臭氧发生器制得臭氧气体,臭氧气体与液体经射流器和螺旋切割器充分混合制备成臭氧水。通过调节氧气流量可改变臭氧在水中的平衡浓度,通过连续通气方式可维持臭氧在水中的溶解度。
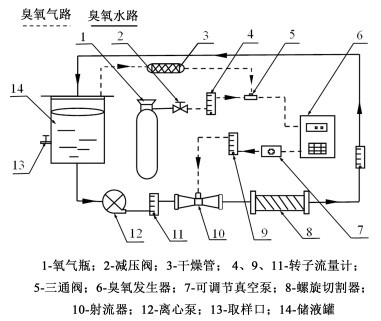
|
| 图 1 新型臭氧水循环灭藻试验装置示意图 Fig.1 The schematic diagram of a novel ozonation water cycle test device for algal killing |
| |
将处于对数生长期的藻液,离心去除培养基,再用去离子水将藻液稀释到所需浓度。取约1 500 mL一定浓度的藻液注入储液罐,试验时先打开离心泵,通过流量计将液体流量调节至所需值,待藻液形成稳定的循环回路时,通入氧气并打开臭氧发生器使其产生臭氧气体。臭氧气体与藻液经射流器初步混合后,再进入螺旋切割器中实现高效分散溶解形成高溶解度臭氧水溶液,从而实现高浓度臭氧水循环灭藻。自臭氧气体稳定产生后开始计时,分别在0、2、4、6、8、10、12 min时在取样口取样,取样后立即检测藻密度并计算灭藻率。试验均重复3次,取平均值。
1.3.2 小球藻细胞密度的测定血球计数板法得到的小球藻细胞密度与其在波长680 nm处的光密度(OD) 值之间具有良好线性关系[13, 14], 其线性方程为:
| $ y=14.61429 x-0.33286, R^2=0.9982 $ | (1) |
式(1)中:x为光密度值; y为小球藻细胞密度(106个·mL-1)。
因此,可采用藻细胞光密度(OD)作为指标来间接表征小球藻细胞密度。
1.3.3 灭藻率的计算灭藻率(η)以小球藻液在波长为680 nm处的测得的光密度值计算,其公式为:
| $ \eta=\frac{{\rm{OD}} _0-{\rm{OD_t}}}{{\rm{OD}}_0} \times 100 \% $ | (2) |
式(2)中:OD0和ODt分别表示试验初始时刻藻细胞光密度值和反应t时刻藻细胞光密度值。
1.3.4 液相臭氧浓度测定液相溶解臭氧浓度采用靛蓝二磺酸钠(IDS)分光光度法测定[15, 16]。由文献[17]可知,由于臭氧气体不断供给,液相中溶解臭氧浓度先随臭氧气体通入逐渐升高,随后达到一个平衡值。
2 结果与讨论 2.1 不同工艺参数对臭氧水除藻效果的影响 2.1.1 不同臭氧水平衡浓度对灭藻率的影响臭氧水具有高效灭藻效果,本小节探究高浓度臭氧水(浓度一般高于5 mg·L-1)对小球藻的灭活效果。在初始反应温度为20(±2) ℃和初始藻细胞光密度为0.4(藻细胞密度约5.5×106个·mL-1)的试验条件下,选取不同臭氧水平衡浓度(5、7、9、11 mg·L-1)进行藻细胞灭活试验。不同臭氧水平衡浓度下灭藻率随反应时间变化情况如图 2所示。
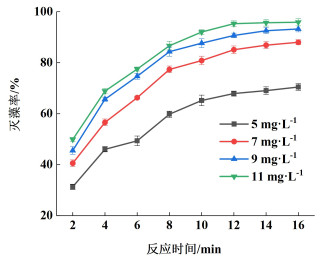
|
| 图 2 不同臭氧水平衡浓度对灭藻率的影响 Fig.2 Effect of different equilibrium concentration ozone water on algal removal rate |
| |
由图 2可知,随着臭氧水平衡浓度和反应时间的增加,灭藻率整体呈现显著上升趋势。当臭氧水饱和浓度从5增加至9 mg·L-1,反应时间16 min,灭藻率从70.45%上升至93.25%,增加了22.8个百分点;而当臭氧水平衡浓度从9增加至11 mg·L-1时,灭藻率从93.25%增加至95.87%,仅增加2.62个百分点,灭藻率增加不显著。
此现象是因为随着臭氧在水中溶解度的增加,同时也逐渐累积产生高浓度的羟基自由基·OH[18-20],系一种高度活性氧化剂,其可加速臭氧灭藻进程,从而灭藻率也相应提高。但由于藻细胞浓度有限,当臭氧水饱和浓度继续增加时,臭氧水灭藻能力趋于饱和,故再提升臭氧水饱和浓度对灭藻效果不再显著增加。考虑到臭氧产生成本及本试验结果,臭氧水饱和浓度为9~11 mg·L-1范围内可达到良好的灭藻效果,因此,后续试验中均控制臭氧平衡浓度在9 mg·L-1,此时氧气流量为2 L·min-1,故后续试验均保持此氧气流量不变。
2.1.2 不同初始藻细胞密度对灭藻率的影响现有研究[21]表明藻细胞密度对臭氧水灭藻影响较大。一般局部爆发水华时藻细胞密度可达到105~106个·mL-1,本小节选择藻细胞密度大于106个·mL-1的藻液考察其对臭氧水灭藻的影响。在初始反应温度为20(±2) ℃和氧气流量为2 L·min-1的试验条件下,选取不同藻细胞光密度分别为0.4、0.5、0.6和0.7(对应的藻细胞密度分别约为5.5×106、7.0×106、8.4×106和9.9×106个·mL-1)进行藻细胞灭活试验,不同初始藻细胞光密度下灭藻率随时间变化情况如图 3所示。
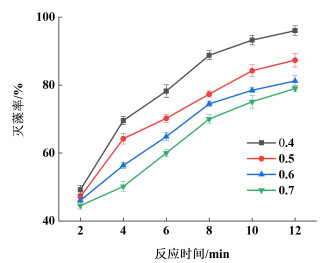
|
| 图 3 不同初始藻细胞光密度对灭藻率的影响 Fig.3 Effect of different initial optical density of algal cells on algal removal rate |
| |
由图 3可知,在其它试验条件不变的情况下,灭藻率随反应时间增加呈逐渐上升的趋势,而随初始藻细胞光密度的增加却逐渐降低。当初始藻细胞光密度为0.4,处理时间12 min时,灭藻率可达96.02%,小球藻细胞灭活效果较好。同等条件下,当初始藻细胞光密度为0.5、0.6和0.7时,灭藻率分别为84.25%、74.48%和70.19%。由试验数据可知,此臭氧水循环灭藻装置对光密度低的藻细胞处理效果要好于光密度高的藻细胞,但灭藻效果整体仍表现良好。
在其他试验参数不变情况下,此装置相同时间内藻液中溶解的臭氧分子以及臭氧在溶液中分解产生·OH氧化活性粒子的数量一定,虽然藻细胞光密度增加,藻细胞与活性粒子接触机会增多,但由于单位体积内小球藻细胞基数过大,以致臭氧灭藻效果随初始藻细胞光密度增加而有所下降。
2.1.3 初始反应温度对灭藻率的影响根据亨利定律可知,反应温度会影响臭氧在水中的溶解,因此,本小节在保证反应温度范围对小球藻的生长性能影响最小(10~30 ℃)[22]的情况下,考察反应温度对臭氧水对小球藻灭活影响。在初始藻细胞光密度为0.4和氧气流量为2 L·min-1的实验条件下,选取不同初始反应温度(10、15、20、25和30 ℃)进行藻细胞灭活试验,不同初始反应温度下灭藻率随时间变化情况如图 4所示。

|
| 图 4 初始反应温度对灭藻率的影响 Fig.4 Effect of initial reaction temperature on algal removal rate |
| |
由图 4可知,初始反应温度对臭氧灭活小球藻有一定的影响。在试验所取的温度范围内,随反应时间延长,灭藻率也逐步的提高。当初始反应温度在10~25 ℃时,灭藻率随温度上升而逐渐提高。其中,初始反应温度为25 ℃、反应时间12 min时,小球藻去除率最高达到96.02%。然而当初始反应温度继续升高时,灭藻率却随着初始反应温度的升高而出现降低现象。
其原因主要是随着初始反应温度的上升,一方面可激发臭氧分解出更多的·OH[23],从而提高臭氧灭藻效果;另一方面,升高温度可增加小球藻活性,使其更容易与水中·OH和臭氧分子发生反应。然而,由于臭氧在溶液中的稳定性较差,当温度继续升高时,其分解成氧气的速率加快,故臭氧在水中溶解度降低,从而导致臭氧灭藻能力减弱,相应地表现为灭藻率下降。
2.2 臭氧水除藻动力学分析 2.2.1 臭氧水平衡浓度对反应速率常数的影响在初始藻细胞光密度为0.4和初始反应温度为20(±2) ℃的条件下,考察不同臭氧水平衡浓度对臭氧水灭活小球藻反应速率常数k的变化。分别以ln(C/C0)、1/C-1/C0与反应时间作图,其线性拟合图及对应参数见图 5和表 1。其中,C0为初始藻细胞光密度,C为不同反应时间下的藻细胞光密度。
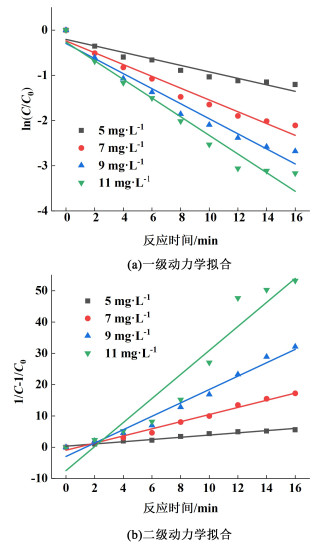
|
| 图 5 不同臭氧水平衡浓度下灭藻动力学拟合曲线(a)一级动力学拟合(b)二级动力学拟合 Fig.5 Kinetic fitting curve of algal removal under different equilibrium concentration of ozone water (a) First order kinetic linear fitting (b) Second order kinetic linear fitting |
| |
| 臭氧水平衡浓度/(mg·L-1) | 一级 | 二级 | |||
| k/min1 | R2 | k/min1 | R2 | ||
| 5 | 0.071 8 | 0.901 9 | 0.355 2 | 0.973 8 | |
| 7 | 0.130 5 | 0.959 9 | 1.140 0 | 0.987 6 | |
| 9 | 0.166 5 | 0.961 6 | 2.138 0 | 0.987 4 | |
| 11 | 0.206 2 | 0.963 1 | 3.838 2 | 0.921 7 | |
由表 1可知,一级动力学与二级动力学拟合的反应速率常数k均随着臭氧水平衡浓度的提高而逐渐增大,且两者拟合结果都较好,相关系数R2均大于0.901 9。其中,臭氧水平衡浓度在11 mg·L-1高浓度下一级动力学拟合结果较好,相关系数R2可达到0.963 1。在臭氧水平衡浓度低于11 mg·L-1时,二级动力学的拟合效果更好,相关系数R2均大于0.97,且均大于一级动力学拟合的相关系数R2。所以,当臭氧水平衡浓度高于11 mg·L-1时,臭氧水灭藻反应更符合二级动力学响应;当臭氧水平衡浓度低于11 mg·L-1时,臭氧水灭藻反应更符合一级动力学响应。
2.2.2 初始藻细胞密度对反应速率常数的影响试验在初始反应温度为20(±2) ℃和氧气流量为2 L·min-1条件下,调节初始藻细胞光密度分别为0.4、0.5、0.6和0.7,考察不同初始藻细胞光密度下臭氧灭藻时对k值的影响,以ln(C/C0)、1/C-1/C0与反应时间的线性拟合及相关参数如图 6和表 2所示。
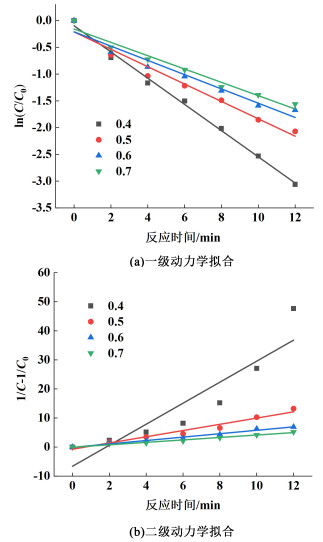
|
| 图 6 不同初始藻细胞光密度下灭藻动力学拟合曲线(a)一级动力学拟合(b)二级动力学拟合 Fig.6 Fitting curve of algal removal kinetics at different initial optical density of algal cells (a) First order kinetic linear fitting (b) Second order kinetic linear fitting |
| |
| 初始藻细胞光密度 | 一级 | 二级 | |||
| k/min1 | R2 | k/min1 | R2 | ||
| 0.4 | 0.244 8 | 0.994 8 | 3.615 7 | 0.841 1 | |
| 0.5 | 0.162 2 | 0.968 5 | 1.070 3 | 0.962 9 | |
| 0.6 | 0.133 3 | 0.954 1 | 0.587 5 | 0.983 3 | |
| 0.7 | 0.124 5 | 0.969 4 | 0.420 4 | 0.981 9 | |
从图 6和表 2可知,一级动力学与二级动力学拟合的k值随着初始藻细胞光密度的增加而减小,k与初始藻细胞光密度成负相关。因此,初始藻细胞光密度对臭氧灭活藻细胞的反应速率有一定影响,初始藻细胞密度低更有利于提高反应速率。当初始藻细胞光密度低于0.5时,一级动力学模型拟合效果较好,其中,R2最高达到0.994 8。当初始藻细胞光密度高于0.5时,二级动力学拟合的R2均大于一级动力学拟合的R2,此时,臭氧水灭藻反应更符合二级动力学反应。
2.2.3 初始反应温度对反应速率常数的影响温度是影响臭氧在水中溶解度、·OH产生浓度以及小球藻活性的因素之一。因此,考察不同的初始反应温度对臭氧灭藻时k值的影响。在初始藻细胞光密度为0.4和氧气流量为2 L·min-1的条件下,调节初始反应温度分别为10、15、20、25和30 ℃,以ln(C/C0)、1/C-1/C0与反应时间作线性拟合,结果如图 7和表 3所示。

|
| 图 7 不同初始反应温度灭藻下的动力学拟合曲线 Fig.7 Kinetic curve fitting of algal removal at different initial reaction temperatures (a) First order kinetic linear fitting (b) Second order kinetic linear fitting |
| |
| 初始反应温度/℃ | 一级 | 二级 | |||
| k/min1 | R2 | k/min1 | R2 | ||
| 10 | 0.115 7 | 0.921 0 | 0.699 4 | 0.985 5 | |
| 15 | 0.134 5 | 0.923 0 | 0.924 6 | 0.987 4 | |
| 20 | 0.244 0 | 0.995 2 | 3.613 6 | 0.840 7 | |
| 25 | 0.258 9 | 0.995 1 | 4.196 1 | 0.861 8 | |
| 30 | 0.174 9 | 0.973 3 | 1.586 8 | 0.955 2 | |
从图 7和表 3可知,一级动力学与二级动力学拟合的反应速率常数随着初始反应温度增加均是先增大再减小,且均在25 ℃时达到最大,分别为0.258 9和4.196 1 min-1。升高反应温度能够提高活化分子的平均动能[24],增加活化分子与藻细胞的有效接触机率,从而提高臭氧灭藻的反应速率。但当温度继续增加时,k值出现下降,因为温度继续升高时,臭氧在水中溶解度受到温度影响较大,温度愈高, 臭氧越易恢复为初始形成它的氧气,因此减弱了臭氧水灭藻的能力。当初始反应温度低于15 ℃时,二级动力学拟合的R2均大于一级动力学拟合的R2。当初始反应温度高于15 ℃时,一级动力学拟合的R2均大于二级动力学拟合的R2,且均大于0.973 3,拟合结果较好。所以,当初始反应温度低于15 ℃时使用二级动力学进行拟合,当初始反应温度高于15 ℃时使用一级动力学进行拟合比较符合臭氧水灭藻条件下藻细胞灭活规律。
3 结论高浓度臭氧水循环装置对小球藻灭活具有良好效果,其灭藻效果受到臭氧水饱和浓度、反应时间、初始藻细胞光密度和初始反应温度的影响。臭氧水饱和浓度越大,灭藻率越高;初始藻细胞密度越大,灭藻率越低;在一定温度范围内,初始反应温度越高臭氧水灭藻能力越强。在臭氧水饱和浓度9 mg·L-1、初始藻细胞光密度0.4(藻细胞密度约为5.5×106个·mL-1)、初始反应温度25 ℃、反应时间为12 min时,臭氧水循环灭藻装置对小球藻去除率可达到96.02%。
通过对一级动力学与二级动力学拟合参数的比较,一级动力学与二级动力学拟合的反应速率常数k均随着臭氧水平衡浓度的提高而逐渐增大;随着初始藻细胞光密度的增加而减小;随着初始反应温度增加均是先增大再减小,且均在25 ℃时达到最大,分别为0.258 9和4.196 1 min-1。在臭氧水平衡浓度不低于11 mg·L-1、初始藻细胞光密度不高于0.5、初始反应温度不低于20 ℃时,臭氧水灭藻反应更符合一级动力学响应特征。而在臭氧水平衡浓度低于11 mg·L-1、初始藻细胞光密度高于0.5、初始反应温度低于20 ℃时,臭氧水灭藻反应更符合二级动力学响应特征。
| [1] |
PEKEL J F, COTTAM A, GORELICK N, et al. High-resolution mapping of global surface water and its long-term changes[J]. Nature, 2016, 540(7633): 418-422. DOI:10.1038/nature20584 |
| [2] |
FANG C, SONG K, PAERL H W, et al. Global divergent trends of algal blooms detected by satellite during 1982—2018[J]. Global Change Biology, 2022, 28(7): 2327-2340. DOI:10.1111/gcb.16077 |
| [3] |
2021年《中国生态环境状况公报》(摘录)[J]. 环境保护, 2022, 50(12): 61-74 China Ecological Environment Status Bulletin 2021(Excerpt)[J]. Environmental Protection, 2022, 500(12): 61-74(in Chinese) |
| [4] |
辛华荣, 朱广伟, 王雪松, 等. 2009—2018年太湖湖泛强度变化及其影响因素[J]. 环境科学, 2020, 41(11): 4914-4923. XIN Huarong, ZHU Guangwei, WANG Xuesong, et al. Variation and driving factors of black water event intensity in Lake Taihu during 2009 to 2018[J]. Environmental Science, 2020, 41(11): 4914-4923. (in Chinese) |
| [5] |
刘新宇, 张博文, 崔政伟. 新型静态混合器强化臭氧水产生羟基自由基[J]. 食品与机械, 2021, 37(11): 1-5, 240. LIU Xinyu, ZHANG Bowen, CUI Zhengwei. Enhancing hydroxyl radical production in ozone water by new type static mixer[J]. Food & Machinery, 2021, 37(11): 1-5, 240. (in Chinese) |
| [6] |
PLUMMER J D, EDZWALD J K. Effect of ozone on disinfection by-product formation of algae[J]. Water Science and Technology, 1998, 37(2): 49-55. DOI:10.2166/wst.1998.0101 |
| [7] |
刘仲明, 陈伟兴, 封伟, 等. 臭氧高级氧化技术在废水处理中的研究进展[J]. 染料与染色, 2021, 58(4): 57-61, 54. LIU Zhongming, CHEN Weixing, FENG Wei, et al. Research progress of advanced ozonation technology in wastewater treatment[J]. Dyestuffs and Coloration, 2021, 58(4): 57-61, 54. (in Chinese) |
| [8] |
CORAL L A, ZAMYADI A, BARBEAU B, et al. Oxidation of Microcystis aeruginosa and Anabaena flos-aquae by ozone: Impacts on cell integrity and chlorination by-product formation[J]. Water Research, 2013, 47(9): 2983-2994. DOI:10.1016/j.watres.2013.03.012 |
| [9] |
武钦凯, 夏霆, 陶巍, 等. 臭氧对河道典型藻类的影响研究[J]. 环境污染与防治, 2018, 40(8): 913-916. WU Qinkai, XIA Ting, TAO Wei, et al. Effect of ozone on typical algae in river[J]. Environmental Pollution and Control, 2018, 40(8): 913-916. (in Chinese) |
| [10] |
陈悦, 崔政伟. 高浓度臭氧水对巨大芽孢杆菌的杀菌效果及动力学模型[J]. 包装与食品机械, 2020, 38(1): 1-7. CHEN Yue, CUI Zhengwei. Effect and kinetic models of high concentration ozone water on inactivation of bacillus megaterium[J]. Packaging and Food Machinery, 2020, 38(1): 1-7. (in Chinese) |
| [11] |
何华名, 栗亚飞, 耿鑫辉, 等. 不同制备方式臭氧水溶解规律及喷雾特性研究[J]. 沈阳农业大学学报, 2013, 44(5): 678-682. HE Huaming, LI Yafei, GENG Xinhui, et al. On different ozone water generation systems and its spray characteristics[J]. Journal of Shenyang Agricultural University (Social and Edition), 2013, 44(5): 678-682. (in Chinese) |
| [12] |
代淑文, 冯德仁. 宽带电磁场除藻技术的试验研究[J]. 电气工程学报, 2020, 15(1): 110-116. DAI Shuwen, FENG Deren. Experimental study of algae removal technology with broadband electromagnetic field[J]. Journal of Electrical Engineering, 2020, 15(1): 110-116. (in Chinese) |
| [13] |
WANG W, FAN W, HUO M, et al. Hydroxyl radical generation and contaminant removal from water by the collapse of microbubbles under different hydrochemical conditions[J]. Water, Air, & Soil Pollution, 2018, 229(3): 86. |
| [14] |
MATOUKE M M, ELEWA D T, ABDULLAHI K. Binary effect of titanium dioxide nanoparticles (nTiO2) and phosphorus on microalgae (Chlorella 'Ellipsoides Gerneck, 1907)[J]. Aquatic Toxicology, 2018, 198: 40-48. |
| [15] |
蒋丽春, 唐绍明, 游青, 等. 靛蓝二磺酸钠褪色分光光度法测定水中臭氧[J]. 理化检验-化学分册, 2011, 47(2): 180-182. JIANG Lichun, TANG Shaoming, YOU Qing, et al. Spectrophotometric determination of ozone in water by the color-fading reaction of sodium indigo disulfonate[J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis), 2011, 47(2): 180-182. (in Chinese) |
| [16] |
卢凤华, 陈滢, 刘敏, 等. 靛蓝二磺酸钠分光光度法和碘滴定法测定水中臭氧含量适用条件的比较[J]. 理化检验-化学分册, 2014, 50(6): 778-780. LU Fenghua, CHEN Ying, LIU Min, et al. Comparison of suitable conditions for determination of ozone content in water by Indigo disulfonate sodium spectrophotometry and iodine titration[J]. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2014, 50(6): 778-780. (in Chinese) |
| [17] |
缪恒锋. 太湖富营养化水体中典型污染物的臭氧氧化研究[D]. 江苏无锡: 江南大学, 2008 MIAO Hengfeng. Study on ozone oxidation of typical pollutants in eutrophic water of Taihu Lake[D]. Jiangsu Wuxi: Jiangnan University, 2008 (in Chinese) |
| [18] |
杨茂林, 刘新宇, 马威, 等. 光催化辅助高浓度臭氧循环工艺降解对氯苯酚及协同机理[J]. 化学工业与工程, 2021, 38(4): 64-72. YANG Maolin, LIU Xinyu, MA Wei, et al. Degradation of p-chlorophenol with high-concentration ozone cycle assisted by photocatalysis and its synergy mechanism[J]. Chemical Industry and Engineering, 2021, 38(4): 64-72. (in Chinese) |
| [19] |
HUBER M M, CANONICA S, PARK G Y, et al. Oxidation of pharmaceuticals during ozonation and advanced oxidation processes[J]. Environmental Science & Technology, 2003, 37(5): 1016-1024. |
| [20] |
VOLK C, ROCHE P, JORET J C, et al. Comparison of the effect of ozone, ozone-hydrogen peroxide system and catalytic ozone on the biodegradable organic matter of a fulvic acid solution[J]. Water Research, 1997, 31(3): 650-656. |
| [21] |
汪小雄, 姜成春, 朱佳, 等. 臭氧灭活水中铜绿微囊藻影响因素研究[J]. 中国环境科学, 2012, 32(4): 653-658. WANG Xiaoxiong, JIANG Chengchun, ZHU Jia, et al. Effect of various factors on ozone inactivating Microcystis aeruginosa in water[J]. China Environmental Science, 2012, 32(4): 653-658. (in Chinese) |
| [22] |
GONZÁLEZ-CAMEJO J, APARICIO S, RUANO M V, et al. Effect of ambient temperature variations on an indigenous microalgae-nitrifying bacteria culture dominated by Chlorella[J]. Bioresource Technology, 2019, 290: 121788. |
| [23] |
HUANG X, QUAN X, CHENG W, et al. Enhancement of ozone mass transfer by stainless steel wire mesh and its effect on hydroxyl radical generation[J]. Ozone: Science & Engineering, 2020, 42(4): 347-356. |
| [24] |
林晓璇, 王如意. 臭氧/过硫酸氢钾体系降解酮洛芬的动力学研究[J]. 广州化工, 2022, 50(6): 55-57, 71. LIN Xiaoxuan, WANG Ruyi. Study on ketoprofen degradation kinetics under ozone/potassium peroxy monosulfate[J]. Guangzhou Chemical Industry, 2022, 50(6): 55-57, 71. (in Chinese) |
 2023, Vol. 40
2023, Vol. 40





