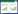蚕丝作为一种动物纤维,是目前已知人类最早利用的天然高分子材料,在我国具有五千多年的历史。由于它具有特殊的光泽、透气性好、吸湿性强、手感佳及强度高等优点,被誉为“纤维皇后”并一直广泛应用于纺织领域[1]。丝素蛋白(Silk fibroin, SF)是从蚕丝中提取的天然高分子纤维蛋白,含量约占蚕丝的70%~80%,具有半结晶结构,可提供硬度和强度,构成了蚕丝的核心纤维,对其优异的力学性能起到了关键作用[2]。丝素溶液通过简单地处理可以得到丝素膜,但丝素膜脆性大,因此需要对丝素蛋白进行改性制备丝素蛋白复合膜从而提高其力学性能。本论文对丝素蛋白的结构、性能以及丝素蛋白复合膜的制备方法及其应用进行了综述和展望。
1 丝素蛋白的结构和制备 1.1 丝素蛋白的结构丝素蛋白由重链(Mw~390 kDa)、轻链(Mw~ 26 kDa) 和糖蛋白P25组成,3者比例约为6∶6∶1[3]。重链和轻链之间由二硫键连接,然后再与糖蛋白P25通过疏水键等共价作用结合[4]。丝素蛋白由18种氨基酸组成,主要晶体结构是Silk Ⅰ和Silk Ⅱ[5]。在空气/水界面处的再生丝素蛋白溶液中也存在少量且不稳定的Silk Ⅲ结构[6]。Silk Ⅰ包括α-螺旋及无规卷曲的构象,该结构为水溶性的,不稳定;而Silk Ⅱ结构主要指反向平行的β-折叠构象,不溶于水,稳定性好[7](图 1)。
丝素蛋白作为蚕丝的一部分,可以直接从家蚕中剥离得到,也可以通过化学方法处理得到。科学研究中通常采用化学方法将丝素蛋白与丝胶蛋白分离,并除去其他物质,此时得到的丝素蛋白称为再生丝素。丝素蛋白再生溶液的获取主要经过生丝脱胶——溶解——透析过程得到。Na2CO3脱胶法[9]是应用最为广泛的生丝脱胶方法,将天然蚕丝或蚕茧放入一定浓度的Na2CO3溶液中煮沸实现脱胶,接着将脱胶后的丝素蛋白纤维溶解于高浓度的中性盐溶液中,常用的中性盐主要包括LiBr[10]、CaCl2[11]和LiSCN[12],最后对溶解后获得的溶液进行脱盐便可得到一定浓度的再生丝素蛋白溶液。目前实验室常用的脱盐方法是透析袋脱盐,所采用的透析袋截留值一般为8 KD[13],透析2~3 d即可。该方法操作简单但是产量较小且制备周期长,耗水量大,主要适用于小规模研究。有研究发现,采用凝胶过滤的方法可在4 h内从脱胶后的蚕丝中获得丝素蛋白溶液[14]。
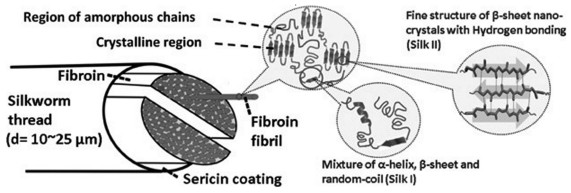
2 丝素蛋白的性能 2.1 丝素蛋白的力学性能天然丝素蛋白纤维具有300~740 MPa的极限拉伸强度[15],4%~26%的断裂应变和70~78 MJ·m-3的韧性,力学性能远超凯夫拉尔等合成纤维[16]。表 1列出了丝素蛋白与其它天然纤维和合成纤维的相关力学性能数据。丝素蛋白的强度和刚度主要由β-折叠含量决定,β-折叠中的氢键以及链间范德华力和疏水作用有利于结构的稳定性;而无规卷曲和α-螺旋则决定了丝素蛋白的弹性[17]。与天然丝素纤维相比,再生丝素材料力学性能有所下降,其主要原因是在脱胶过程中所用到的高浓度中性盐会破坏丝素蛋白分子中原有的部分结构[18],同时,在制备丝素膜时,一般会加入醇类等试剂使其不溶化,而此类物质会使得丝素蛋白更偏向于形成稳定的β-折叠结构,从而导致所制备的丝素膜柔软性、延展性和弹性都变差[19]。He等[20, 21]研究不同温度、压力条件下丝素蛋白的构象[如图 2(a)和图 2(b)],发现丝素蛋白中的β-折叠随着压力的增加而增加,无规卷曲、α-螺旋和β-转角减少并转化为β-折叠,温度影响与此类似。Yadav等[22]利用红外光谱法探究了金属氧化物纳米颗粒对丝素蛋白构象的影响,发现ZnO、CuO、TiO2等的加入均会抑制丝素蛋白β-折叠结构的形成并促进其向无规卷曲转变[如图 2(c)]。这表明可以通过改变膜形成时的物理和化学条件来改变丝素蛋白的构象从而改变膜的力学性能。
| Material | Stiffness, Einit/GPa | Strength, σmax/GPa | Strain/% at break | Toughness/ (MJ·m-3) | Ref |
| Cocoon silk (Bombyx mori) | 10~17 | 300~740 | 4~26 | 70~78 | [15] |
| Spider silk (Nephila clavipes) | 10.9 | 875 | 16.7 | [23] | |
| Spider silk (Nephila edulis) | 1 300 | 38 | 200 | [24] | |
| Wool, 100%RH | 0.5 | 200 | 50 | 60 | [16] |
| Nylon fiber | 1.8~5 | 430~950 | 18 | 80 | [17] |
| Kevlar 49 fiber | 130 | 3 600 | 2.7 | 50 | [16] |
| Carbon fiber | 300 | 4 000 | 1.3 | 25 | [16] |
|
| 图 2 不同物理化学因素对丝素蛋白构象的影响: (a) 压力[21]; (b) 温度[20]; (c) 不同金属氧化物纳米颗粒[22] Fig.2 Effects of different physical and chemical factors on the conformation of silk fibroin: (a) Pressure[21], Copyright 2018, Proteins; (b) Temperature[20], Copyright 2017, Analytical Chemistry; (c) Different metal oxide nanoparticles[22], Copyright 2021, Polymer Testing |
| |
蚕丝作为缝合线已经使用了几百年了,无论是以生物安全性还是以生物功能性来评价[25],其生物相容性都是公认比较好的。而丝素蛋白是从蚕丝中提取的天然纤维蛋白,同样也具有优异的生物相容性。Guo等[26]采用体外细胞培养方法对丝素蛋白3D支架的生物相容性进行评价,实验表明细胞可以在该材料上黏附生长和增殖,具有良好的生物相容性。而利用丝素蛋白制备的很多复合材料也具有良好的生物相容性。Lin等[27]使用软骨细胞(ADTC-5)评估了不同比例的丝素蛋白/Ⅱ型胶原复合膜的生物相容性,其中SF70表现出合适的形态、稳定的物理性质和促进软骨细胞增殖的生物学性能。但研究同时也发现,当丝素蛋白材料以纳米颗粒形式存在时会对细胞的生长产生一些不利影响。
2.3 丝素蛋白的生物降解性根据美国药典对于可吸收(缝线)生物材料的定义,在体内60 d失去大部分拉伸强度的称为可降解材料,而蚕丝缝线在体内植入60 d后保留了超过50%的拉伸强度,故被认为是不可降解材料[28, 29]。但越来越多的研究表明,丝素蛋白作为一种蛋白质,是可以被某些酶降解的,并且植入人体内也会最终被吸收,只是降解时间相对较长。一般来说,蚕丝纤维在体内1 a左右就会失去大部分拉伸强度,而在2 a左右就基本降解完全了[30]。Hu等[31]制备了4组具有不同二级结构的多孔丝素支架并对其降解速度进行了研究,发现可能通过控制材料中片状结构的含量从而控制丝素支架的降解速率。Kambe等[32]通过对15种不同浓度和相对分子质量的丝素蛋白水凝胶进行评定,也发现β-折叠的含量和材料的生物降解显著相关。这些研究都表明,通过控制制备条件改变丝素蛋白所含有的二级结构进而有效改变丝素蛋白材料的降解速度。
2.4 丝素蛋白的分离性能丝素蛋白材料除了具有较好的力学性能、生物相容性和生物降解性之外,也体现出较好的分离性能。如:Minoura等[33]用含体积分数为50%的甲醇水溶液处理丝素蛋白膜后,发现其具有很好的透氧气性能和水蒸气透过性,可以用于隐形眼镜材料的制备;丝素蛋白同时也具有适宜的离子导电性,Pereira[34]采用冻干法和静电纺丝法分别制备了海绵状丝素蛋白SF-L和丝素蛋白膜SF-E,20 ℃时两者离子电导率为1.0和0.32 mS·cm-1,进一步的研究表明其原因在于SF-L中的β折叠构象分率更高;由于丝素蛋白富含的氨基和羧基可与重金属离子发生相互作用,丝素蛋白表现出很好的重金属离子吸附性能,Gao等[35]用希夫碱改性的对丝素蛋白共混膜处理含铅离子溶液,对铅离子的去除率达到82%。而Pilley等[36]用丝素蛋白粉末吸附含铁离子水溶液,铁离子的去除率达98%,分析吸附机理发现丝素蛋白中的脂肪族和芳香环的羟基(酪氨酸的酚基)与铁离子发生了反应。
3 丝素蛋白复合膜材料 3.1 天然大分子/丝素蛋白复合膜壳聚糖(CS)是天然多糖中唯一的碱性多糖,它因良好的止血性和抗菌性成为制备创伤敷料的优良选择,研究表明,通过将丝素蛋白与适量的壳聚糖混合,丝素蛋白可以利用刚性的壳聚糖链作为模板,利用丝素蛋白与壳聚糖之间的氢键从而形成β折叠结构,从而改善复合膜的力学性能[37, 38]。壳聚糖/丝素蛋白复合膜不仅可以作为伤口敷料的生物材料,也有研究表明其具有良好的金属离子渗透性能。Du等[39]制备了致密的壳聚糖/丝素蛋白复合膜,当CS质量分数为70%时,复合膜的溶胀率随CS含量的增加而增加。实验表明,K+通过复合膜的渗透系数比纯CS膜高2~4倍,比纯SF膜高10倍。丝胶蛋白与丝素蛋白同源,也是蚕丝的一部分,对丝素蛋白起保护和胶黏作用,但因其本身具有一定的免疫源性,以及水溶性,大多以粉状作为功能性添加剂进行应用。Lin等[40]制备丝素蛋白和丝胶蛋白静电纺丝纤维膜,结果表明,丝胶蛋白与丝素蛋白比例为3∶7时具有较好的性能,纤维结构细腻均匀,表面亲水性好,水蒸气透过率高。同时,有研究表明,丝胶蛋白可以有效防止细胞凋亡,增强多种细胞的附着和增殖,作为培养基进行使用。Kim等[41]对所制备的不同丝胶蛋白含量的透明丝素膜进行研究,发现兔角膜内皮细胞在复合膜上生长良好,并可维持自身生物学特性。细菌纤维素是一种由细菌产生的具有生物可降解性的天然纳米结构高分子材料,与丝素蛋白的共混可以制备出不溶于水的复合膜,并且在制备过程中,膜的机械性能随着自身含水量变化而变化[42]。Hosakun等[43]制备了细菌纤维素/丝素蛋白复合膜,研究发现用丝素蛋白修饰细菌纤维素膜可以增加膜与CO2相互作用的活性位点数量,使得复合膜对于CO2的渗透率在低温低压的进料条件下也可达到2.69 GPU。
3.2 纳米碳材料/丝素蛋白复合膜碳纳米管、石墨烯等纳米碳材料由于其独特的结构以及优良的力学性能,经常被作为力学增强掺杂剂使用。Wang等[44]用单壁碳纳米管和石墨烯喂食家蚕幼虫,发现部分喂食的碳纳米管材料被转移到初生丝纤维中。研究还表明,纳米碳的加入阻碍了丝素蛋白从无规卷曲和α-螺旋到β-折叠的构象转变,有助于提高断裂伸长率和韧性,这表明通过纳米碳材料的掺杂可有效改善丝素蛋白材料的力学性能。Kim等[45]在再生丝素蛋白溶液中掺杂少量(0.2%,质量分数)多壁碳纳米管(MWCNTs)制备出了不含β折叠构象的水稳定性薄膜,与纯丝素膜相比,掺入MWCNTs的复合薄膜的拉伸模量和强度分别提高了108%和51%。Choi等[46]利用乙二胺官能化的氧化石墨烯(GO-NH3+)与SF之间的相互作用,采用自动喷雾辅助逐层组装(LbL)技术制备了GO-NH3+/SF多层纳米涂层,该膜在甲醇处理后丝素蛋白的二级结构中β-折叠含量提高,使得膜中丝素蛋白氨基与CO2的作用更强,分离N2/CO2的选择性达10.02。
3.3 合成聚合物/丝素蛋白复合膜丝素蛋白膜本身致密无孔,柔软性、弹性和伸长性都较差,导致其应用受限,而通过与聚合物共混是提高其性能的有效途径。聚乙二醇由于其本身属于醇类,可作为凝固浴在制备丝素材料中使用,研究发现,聚乙二醇的使用并不能在规定时间内诱导丝素蛋白构象转变,但会在一定程度上改善其力学性能[47]。Mann等[48]将天然丝素蛋白膜与用聚乙二醇(PEG)化学修饰的丝素蛋白膜进行比较,发现经PEG和辣根过氧化物酶(HRP)修饰的复合膜含水量达(59±1.5)%,对NaCl的渗透性能大幅提高[渗透系数达(95.7±2.8)×10-8 cm2·s-1],其中HRP的交联能力提高了膜的抗压强度,PEG提高了膜的渗透性。3-羟基丁酸与3-羟基己酸共聚酯(PHBHHx)作为一种生物塑料,是由微生物合成的可完全降解的高分子材料,同时,其优异的力学性能也拓宽了它的应用领域。Ang等[49]采用静电纺丝方法实现了PHBHHx与丝素蛋白的结合,并用乙醇等低介电常数的有机溶剂处理复合膜,处理后复合膜所含丝素蛋白分子的构象由α-螺旋和无规卷曲转变为β-折叠结构,结晶结构转变为Silk Ⅱ,结晶度提高,实验表明该膜具有良好的亲水性,并表现出优于丝素蛋白复合前的生物相容性,可作为生物材料应用于骨组织工程。聚氨酯(PU)具有良好的稳定性和力学性能。将聚氨酯与丝素蛋白结合,可以有效阻止丝素蛋白大分子链段之间产生过多的氢键结合,从而降低复合膜的结晶度,增加膜的柔软性和弹性[50, 51]。Park等[52]制备了不同质量比的SF/PU共混膜并研究其力学性能,发现随着SF含量的增加,膜的表面粗糙度会增加,而膜的极限拉伸强度随着SF的增加而降低,刚度增强。Watcharajittanont等[53]采用静电纺丝与自组装相结合的技术,逐层电纺将丝素蛋白与聚氨酯进行复合,所制备的逐层电纺膜随着芯层厚度的增加,最大载荷增加,最大应变减小,具有更好的力学性能。
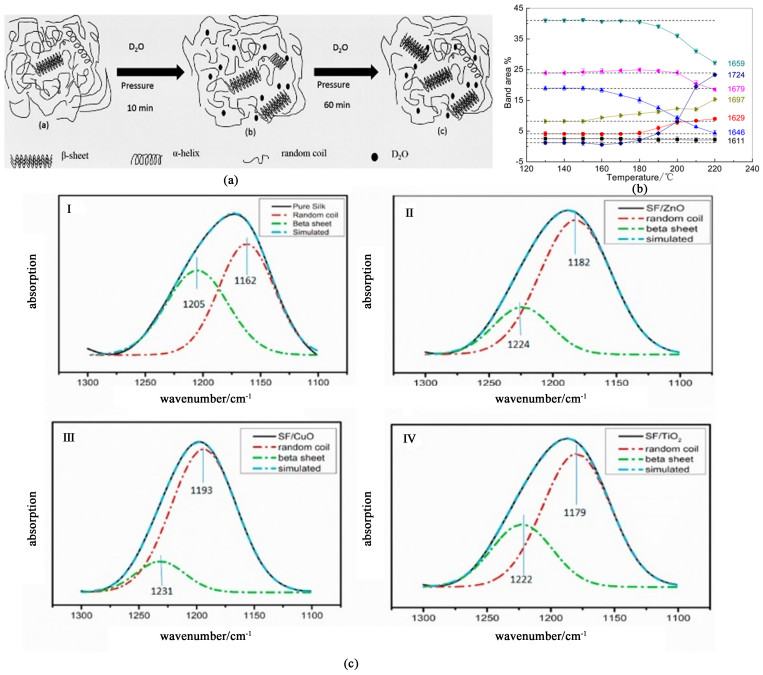
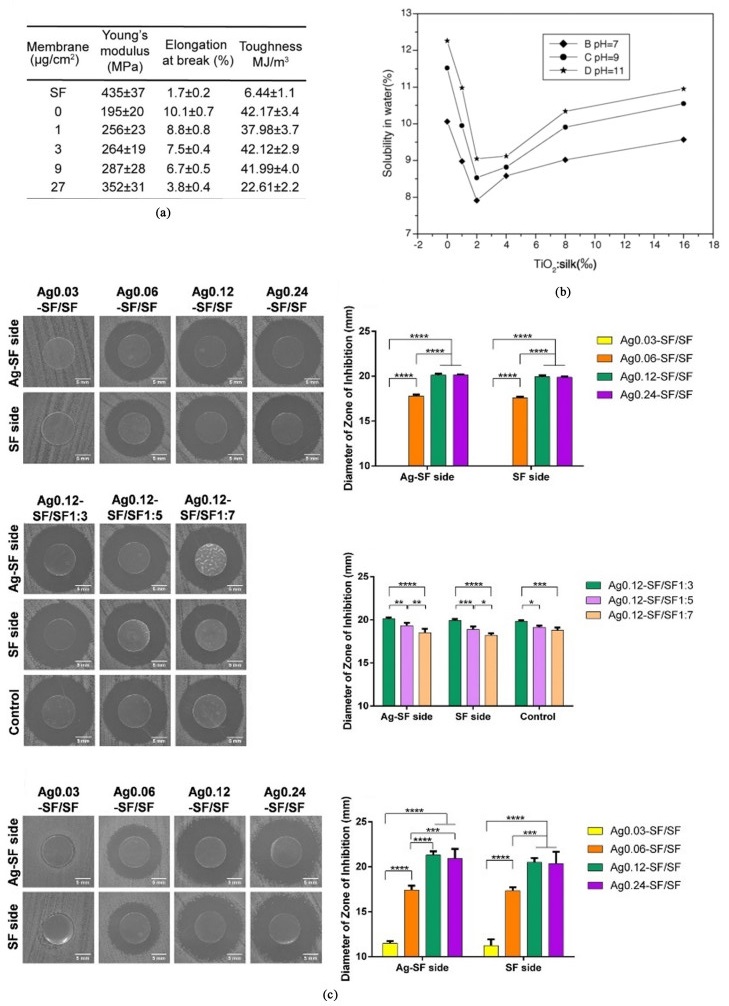
3.4 纳米金属及金属氧化物/丝素蛋白复合膜纳米金是指直径在1~100 nm之间的微小金颗粒,具有高电子密度、介电特性和催化作用,能与多种生物大分子结合且不影响其生物活性[54]。Zhu等[55]制备了以金纳米颗粒和丝素蛋白为原料的复合膜,如图 3(a)所示,纯SF膜的杨氏模量、断裂伸长率和韧性分别为435 MPa、1.7%和6.44 MJ·m-3,这与丝素膜本身的脆性一致。在抗菌金纳米颗粒加入前后,膜的韧性无明显变化,而随着金纳米颗粒含量的增加,膜的杨氏模量增加,断裂伸长率降低。Ranjana等[56]采用金盐(HAuIIICl4·H2O)还原成金纳米颗粒(AuNPs)的方法制备了AuNPs/SF复合膜,FT-IR光谱法表明AuNPs浓度的增加使得SF中无定形构象含量增加,同时,通过评估膜的直流导电率发现AuNPs的存在对纯SF膜的导电性能有明显改善,随着AuNPs的产生,膜的直流电导率从1.48×10-9增加至7.12×10-9 S·cm-1,这为丝素蛋白应用领域的进一步拓展提供了基础。在众多纳米金属中,纳米银由于其出色的抗菌性能,被广泛用于医疗、包装、电子等行业中。将丝素蛋白与纳米银结合可以制备出具有抗菌性能的伤口敷料,但过量的Ag会导致细胞毒性对伤口愈合起到反作用[57]。Shao等[58]制备了Ag-SF/SF双层膜并研究其性能,测试结果如图 3(c)所示,SF侧和Ag-SF侧表现出相似的抗菌性能,与膜两侧厚度比无关,同时该膜的SF侧还能有效促进创面愈合。该研究实现了银的单侧分布,制备出了一种双功能复合膜,为皮肤高效愈合研究提供了新方法。TiO2作为一种n型半导体材料,具有良好的紫外线掩蔽作用,常用于制作防晒化妆品和涂料[59]。Cai等[60]通过给家蚕喂食TiO2发现,纳米TiO2粒子的存在会限制丝素蛋白由无规卷曲/α-螺旋向β-折叠构象转变,降低材料的结晶度,但材料的力学性能和抗紫外性能有很大幅度的提高。Feng等[61]将丝素蛋白/纳米TiO2复合膜与纯SF膜进行对比,如图 3(b)所示,也发现过量的纳米TiO2颗粒会破坏SF的晶体结构,从而增加SF在水中的溶解度,但适量的TiO2会诱导丝素蛋白向Silk Ⅱ转变,同时提高其硬度以及结晶度,改善其机械性能和力学性能。
|
| 图 3 几种纳米金属及金属氧化物/丝素蛋白复合膜: (a) DAPT-Au NPs/SF膜[55]; (b) SF/纳米TiO2膜[61]; (c) Ag-SF/SF膜[58] Fig.3 Several nano metal or metal oxide/silk fibroin composite membrane: (a) DAPT-Au NPs/SF membrane[55], Copyright 2021, ACS Biomaterials Science and Engineering; (b) SF/nano TiO2 membrane[61], Copyright 2007, International Journal of Biological Macromolecules; (c) Ag-SF/SF membrane[58], Copyright 2021, ACS Omega |
| |
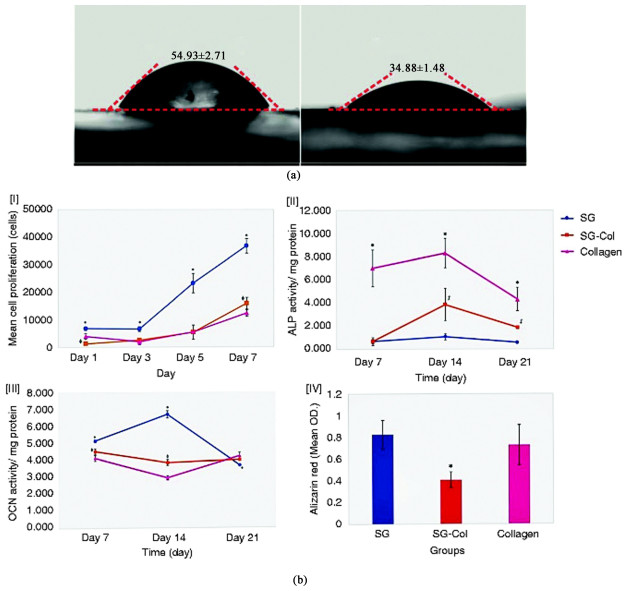
丝素蛋白有着极好的理化性质、可降解性、优异的相容性和低炎症反应性,且具有良好的成膜性能,因此,在生物医药领域再生丝素膜常用于药物输送、角膜的修复和再生、疫苗的包裹与释放、生物传感器和促进血管生成等方向。但是单独的丝素蛋白膜离子渗透性能不是很强[38, 62],力学性能会在制备过程中有所降低[18],同时内部非极性氨基酸对其亲水性会产生影响[2],这些都限制了纯SF膜的性能,而通过与其他材料复合可以有效改善这一点。Zhang等[62]采用丙酰胺与丝素蛋白复合制备透明丝素蛋白膜用于角膜的修复研究,结果显示丙酰胺的加入大大提高了膜的离子渗透率,具有良好的细胞相容性和稳定的光学透明性,适于用作角膜修复材料。Zhang等[63]通过在纤维电纺丝素蛋白膜(ESF)上形成聚多巴胺(PDA)涂层制备了PESF膜,如图 4(b)所示,PESF膜的水接触角为(34.88±1.48)°,低于ESF膜的水接触角(54.93±2.71)°,这说明PDA涂层可以增强膜的亲水性。进一步研究发现,膜的蛋白质吸附能力也有一定幅度增加,同时用PESF膜处理的伤口中羟脯氨酸(胶原蛋白成分)含量的增加进一步证明了PESF膜在伤口愈合和皮肤再生领域有很大潜力。丝素蛋白的脆性是其用作屏障膜的缺点,半可吸收屏障膜比可吸收屏障膜保持功能的时间更长。Pripatnanont等[64]制备了基于丝素蛋白和甘油复合的半吸收屏障膜,研究表明,其具有良好的力学性能,有利于成骨细胞的增殖和分化[如图 4(b)],具有实际应用价值。Tang等[65]用PDMS模具制备了微凸点状丝素蛋白膜,研究了膜对人脐静脉内皮细胞(HUVECs)血管生成因子增殖、黏附和表达的影响,结果显示表面含有2 899个凸点·mm-2的丝素蛋白膜可促进HUVECs的血管生成,为组织工程植入物表面设计提供了一种新的血管生成促进策略。
|
| 图 4 (a) ESF膜和PESF膜的水接触角[63]; (b) 丝素蛋白-甘油膜(SG)、丝素蛋白-甘油-胶原膜(SG-Col)和胶原膜(Collagen)的细胞增殖和分化性能测试结果[64] Fig.4 (a) Water contact angle of ESF membrane and PESF membrane[63], Copyright 2019, Biomaterials Science; (b) Cell proliferation and differentiation performance test results of silk fibroin glycerol membrane (SG), silk fibroin glycerol collagen membrane (SG-Col) and collagen membrane[64], Copyright 2021, Journal of Biomaterials Applications |
| |
近年来,随着科技发展,市场不再满足于传统硅基电子产品的物理刚性,而对器件的柔性具有了一定的需求。目前常用的柔性材料有聚四氟乙烯、聚酰亚胺、硅橡胶等[66],但是大多不能满足穿戴式和植入式柔性器件所需要的生物相容性和生物降解性。而来源于天然蚕茧的丝素蛋白不仅具有优异的力学性能,同时其生物相容性极为出色,还具有一定的生物降解性,但丝素蛋白本身光电性能不强[56],需要将丝素蛋白与高性能的光电材料进行复合以满足其在传感、制动、光学器件、能量收集和储能等领域的应用。Reizabal等[67]利用NaCl盐淋洗方法制备了不同孔径的SF膜,结果表明,随着孔径的增大,β-折叠构象含量增加,从而导致电解质吸收变强,同时,该膜具有较高的放电容量(131.3 mAh·g-1)。Park等[68]将具有良好透明性和柔韧性的纳米银线嵌入丝素蛋白作为电极研究了复合膜的性能,结果表明该电极具有85.1%的光透射率和1 mm的临界弯曲半径,极低的电阻使其在低电压下也可用于快速加热,同时,该电极具有优异的柔韧性,在经过10 000次折叠测试后没有电阻变化也没有表面裂纹。Zhou等[69]用明胶-丝素蛋白复合膜制备了高性能瞬态锌离子电池,该电池可提供稳定输出电压,具有高比容量和优异的循环稳定性,并且具有良好的生物降解性,在酶消化下45 d内被降解。Wang等[70]通过将新型二维层状纳米材料MXenes与丝素蛋白复合,制备了SF/MXene压力传感薄膜,该薄膜具有良好的机械性能和压力传感性能,包括较小的弹性模量(1.22 MPa),良好的灵敏度(25.5 kPa-1) 和较短的响应/恢复时间(40/35 ms)以及优异的重复性(>3 500次循环),在人造皮肤和个人保健可穿戴设备方面具有巨大的潜力。
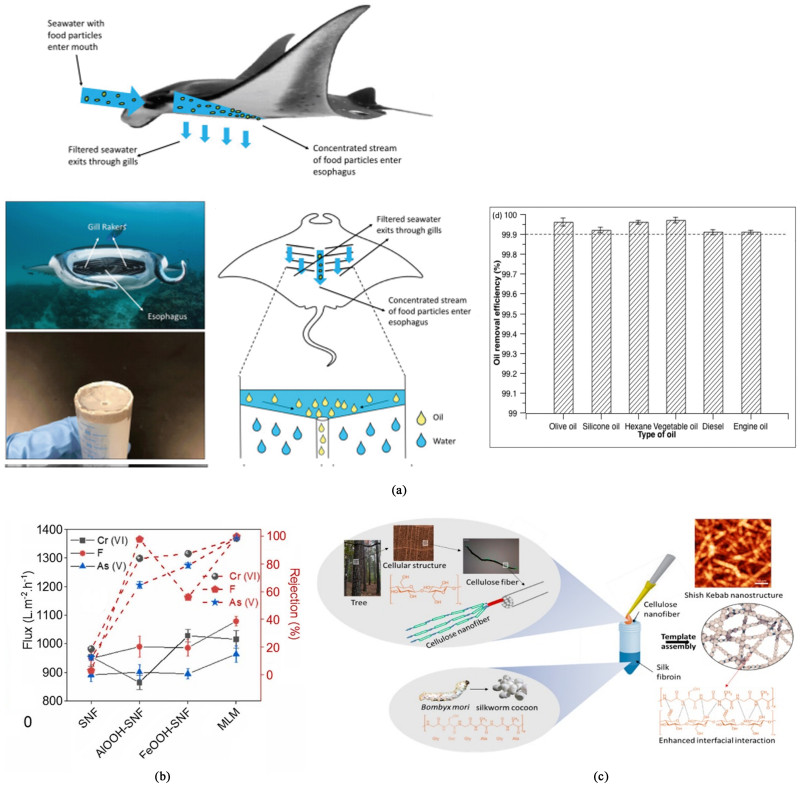
4.3 化工分离领域膜分离技术是化工领域常用的分离技术,具有高效率、低能耗、分离系数大、操作简单、不会产生二次污染等优点。丝素蛋白具有较好的成膜性,含有丰富的可用于改性的基团(氨基和羧基等),一定的离子导电性,对重金属离子有较好的吸附性等。这使得丝素蛋白材料在很多膜分离领域如油水分离、废水处理等的研究中受到关注。另一方面人工合成的高分子膜材料由于其不可降解性可能导致环境问题,这也使得丝素蛋白在膜分离中的应用得到进一步重视[71]。但由于单纯的丝素蛋白膜强度不好,同样需要将丝素蛋白与其他材料复合成膜。如表 2所示,丝素蛋白复合膜的水接触角均小于90°,表现出良好的亲水性,同时纯水通量都较高。Li等[72]通过静电纺丝法仿生蝠鲼鱼鳃制备了丝基纳米纤维膜(平均直径~106 nm)用于连续油水分离,具体制备方法如图 5(a)所示。该膜具有超亲水性(WCA~0°)和超疏油性(OCA~154°),从分离性能测试图中可以看到,该膜对于各种油-水混合物均具有极高的分离率,平均分离率为99.90%。Mruthunjayappa等[73]用活性铁基和铝基金属氢氧化物对丝素纳米纤维进行功能化得到SNF-FeOOH和SNF-AlOOH,然后逐层由层层自组装法制备了多层膜,研究了其污水处理性能,1 μm厚的SNF膜水通量高达5 950 L·h-1·m-2,如图 5(b)所示,SNF膜对于氟离子的去除率只有3%,但SNF-AlOOH膜高达98%,而SNF-FeOOH和SNF-AlOOH自组装形成的多层膜的氟离子去除率可高达99.9%。如图 5(c)所示,Xiong等[74]通过模板定向法组装制备了丝素蛋白和纳米纤维素复合膜(SF-CNF),丝素蛋白结构沿着纤维素的纳米纤维直线周期状排列,呈现出“烤串”(Shish kebab)形态。厚度为50 nm的复合膜水通量高达3.5×104 L·h-1·m-2·bar-1,含30%CNF复合膜的机械性能最好,极限应力和杨氏模量分别为260 MPa和30 GPa。Ling等[75]以丝素纳米纤维为模板,原位生长羟基磷灰石(HAP)后进行抽滤制备得到了SNF/HAP复合膜,该膜表现出良好的机械性能,0.3 μm厚的SNF/HAP膜的水通量为8 355 L·h-1·m-2·bar-1,用于去除水中重金属离子、染料等污染物的效果很好,对Ni2+的吸附容量达132.5 mg·g-1。用丝素蛋白所制备的复合膜也可应用于气体分离,Prasad等[76]利用壳聚糖和丝素蛋白混合制备了用于CO2气体分离的膜,通过研究发现,对于含有质量分数为45% SF和CS的复合膜(SF45),在90 ℃和0.05 mL·min-1的吹扫流速下,CO2渗透率为140 GPU,CO2/N2选择性达103。
| Material | Thickness | Water contact angle | Pure water flux/Gas separation performance | Application | Ref. |
| SF(mimicking manta ray gills) | 0° | Oil-water separation | [72] | ||
| SNF | 1 μm | 88(±2.5)° | 5 950 L·h-1·m-2 | ||
| SNF-AlOOH | 24(±3.4)° | Wastewater treatment | [73] | ||
| SNF-FeOOH | 29(±2)° | ||||
| SNF/AlOOH/SNF/FeOOH | 1.9 μm | 14(±3.5)° | 2 625 L·h-1·m-2 | ||
| SF-CNF | 50 nm | 3.5×104 L·h-1·m-2 | Dye removal | [74] | |
| SNF/HAP | 0.3 μm | 3.5×104 L·h-1·m-2 | Dye and heavy metal removal | [75] | |
| SF/CS | ~0.3 μm | 72.4° | CO2 permeability: 140 GPU | Gas separation | [76] |
| LiNbO3/SF | Smoke filtration efficiency: 92% | Air filtration | [77] | ||
| SNF(dealt with PAN) | 8° | PM10-2.5:99% | Air filtration | [78] |
|
| 图 5 (a) 仿生蝠鲼鱼鳃的丝基纳米纤维膜的制备方法及油水分离性能[72]; (b) SNF、AlOOH-SNF、FeOOH-SNF及MLM膜的除氟能力[73]; (c) 丝素蛋白和纳米纤维素的定向组装[74] Fig.5 (a) Preparation method and oil-water separation performance of silk based nanofiber membrane of bionic manta ray gill[72], Copyright 2018, Environmental Science-Nano; (b) Defluorination capacity of SNF, ALOOH-SNF, FEOOH-SNF and MLM membranes[73], Copyright 2022, Journal of Hazardous Materials; (c) Directional assembly of silk fibroin and nano cellulose[74], Copyright 2017, ACS Nano |
| |
作为一种生物材料,丝素蛋白具有良好的力学性能、生物相容性和生物降解性。此外,丝素蛋白具有较好的透氧和透水蒸汽性能,适当的离子传导性,对重金属离子有较好的吸附性,并且丝素蛋白含有丰富的氨基和羧基使得其性质易于调变。这些特点使得丝素蛋白在很多不同领域的应用受到关注。
然而,丝素蛋白本身的特性不稳定,经过再生得到的丝素蛋白力学性能受溶剂影响会有所下降,而丝素蛋白的生物相容性和生物降解性也会因处理方法不同而改变,这对丝素蛋白的应用会有影响。如果将丝素蛋白与其他材料进行复合成膜可以有效地改善丝素蛋白的性能,进一步拓展丝素蛋白复合膜在生物医药、光电、化工分离等领域的应用。
(1) 目前丝素蛋白复合膜在生物医药领域的应用研究已经十分广泛,可用于角膜修复、皮肤再生、促进骨细胞生长等方向。利用纳米金属对丝素蛋白进行改性将成为丝素蛋白复合膜在生物医药领域新的研究方向之一。将纳米金属与丝素蛋白结合不但不会影响丝素蛋白的生物活性,还会对丝素蛋白的构象产生影响,从而增强膜的力学性能。纳米银还能使膜具有一定的抗菌性能,有利于促进丝素蛋白复合膜在伤口愈合、细胞再生领域的进一步发展。另一方面,应对丝素蛋白的实际应用形式进行控制,以防止其可能产生的危害,这是丝素蛋白复合膜在生物医药领域应用面临的挑战。
(2) 可穿戴设备是智能化电子材料的发展趋势,因而电子器件对柔性材料的需求变强,这使得丝素蛋白在光电领域的应用逐渐受到重视。目前,已有研究表明将丝素蛋白复合材料应用于光电领域可得到性能良好、稳定且可降解的电池,丝素蛋白与碳材料的结合可用于制备高性能电极。与此同时,丝素蛋白的结构易受环境因素影响是进一步发展丝素蛋白复合膜在该领域的应用要解决的问题。
(3) 丝素蛋白具有的分离性能使得其在化工分离领域崭露头角,已有较多研究表明丝素蛋白复合膜在油水分离、含不同污染物的废水处理和气体分离等领域具有很好的发展潜力。未来要使丝素蛋白复合膜在化工分离领域真正得到实际应用,必须要发展规模化的丝素蛋白复合膜制备方法。
| [1] |
ZHOU C, LU J, WANG J, et al. Research and application progress of silk fibroin membranes[J]. Asian Agricultural Research, 2021, 13(12): 43-48. |
| [2] |
ASAKURA T, SUGINO R, YAO J, et al. Comparative structure analysis of tyrosine and valine residues in unprocessed silk fibroin (silk Ⅰ) and in the processed silk fiber (silk Ⅱ) from Bombyx Mori using solid-state (13)C, (15)N, and (2)H NMR[J]. Biochemistry, 2002, 41(13): 4415-4424. DOI:10.1021/bi0119013 |
| [3] |
HAKIMI O, KNIGHT D P, VOLLRATH F, et al. Spider and mulberry silkworm silks as compatible biomaterials[J]. Composites Part B: Engineering, 2007, 38(3): 324-337. DOI:10.1016/j.compositesb.2006.06.012 |
| [4] |
ASAKURA T, OKUSHITA K, WILLIAMSON M P. Analysis of the structure of Bombyx mori Silk fibroin by NMR[J]. Macromolecules, 2015, 48(8): 2345-2357. DOI:10.1021/acs.macromol.5b00160 |
| [5] |
YAMANE T, UMEMURA K, NAKAZAWA Y, et al. Molecular dynamics simulation of conformational change of poly(ala-gly) from silk Ⅰ to silk Ⅱ in relation to fiber formation mechanism of Bombyx mori silk fibroin[J]. Macromolecules, 2003, 36(18): 6766-6772. DOI:10.1021/ma034466o |
| [6] |
VALLUZZI R, GIDO S P, ZHANG W, et al. Trigonal crystal structure of Bombyx mori silk incorporating a threefold helical chain conformation found at the air-water interface[J]. Macromolecules, 1996, 29(27): 8606-8614. DOI:10.1021/ma9517759 |
| [7] |
HE S, VALLUZZI R, GIDO S P. Silk Ⅰ structure in Bombyx mori silk foams[J]. International Journal of Biological Macromolecules, 1999, 24(2/3): 187-195. |
| [8] |
VOLKOV V, FERREIRA A V, CAVACO-PAULO A. On the routines of wild-type silk fibroin processing toward silk-inspired materials: A review[J]. Macromolecular Materials and Engineering, 2015, 300(12): 1199-1216. DOI:10.1002/mame.201500179 |
| [9] |
LIU Z, WAN Y, DOU H, et al. Effect of Na2CO3 degumming concentration on LiBr-formic acid-silk fibroin solution properties[J]. Thermal Science, 2016, 20(3): 985-991. DOI:10.2298/TSCI1603985L |
| [10] |
YIN C, HAN X, LU Q, et al. Rhein incorporated silk fibroin hydrogels with antibacterial and anti-inflammatory efficacy to promote healing of bacteria-infected burn wounds[J]. International Journal of Biological Macromolecules, 2022, 201: 14-19. DOI:10.1016/j.ijbiomac.2021.12.156 |
| [11] |
KOPP A, SCHUNCK L, GOSAU M, et al. Influence of the casting concentration on the mechanical and optical properties of FA/CaCl2-derived silk fibroin membranes[J]. International Journal of Molecular Sciences, 2020, 21(18): 6704. DOI:10.3390/ijms21186704 |
| [12] |
ROZET S, TAMADA Y. An improved process for stably preparing of Antheraea pernyi fibroin aqueous solution[J]. The Journal of Silk Science and Technology of Japan, 2019, 27(0): 23-31. |
| [13] |
WANG Z, LUO X, SUN J, et al. Investigation of chip formation mechanism in ultra-precision diamond turning of silk fibroin film[J]. Journal of Manufacturing Processes, 2022, 74: 14-27. DOI:10.1016/j.jmapro.2021.11.061 |
| [14] |
WÖLTJE M, KÖLBEL A, AIBIBU D, et al. A fast and reliable process to fabricate regenerated silk fibroin solution from degummed silk in 4 hours[J]. International Journal of Molecular Sciences, 2021. DOI:10.3390/ijms221910565 |
| [15] |
VEPARI C, KAPLAN D L. Silk as a biomaterial[J]. Progress in Polymer Science, 2007, 32(8/9): 991-1007. |
| [16] |
GOSLINE J M, GUERETTE P A, ORTLEPP C S, et al. The mechanical design of spider silks: From fibroin sequence to mechanical function[J]. The Journal of Experimental Biology, 1999, 202(Pt 23): 3295-3303. |
| [17] |
KOH L D, CHENG Y, TENG C, et al. Structures, mechanical properties and applications of silk fibroin materials[J]. Progress in Polymer Science, 2015, 46: 86-110. DOI:10.1016/j.progpolymsci.2015.02.001 |
| [18] |
DAMODARAN S, KINSELLA J E. The effects of neutral salts on the stability of macromolecules. A new approach using a protein-ligand binding system[J]. Journal of Biological Chemistry, 1981, 256(7): 3394-3398. DOI:10.1016/S0021-9258(19)69621-3 |
| [19] |
SAGNELLA A, PISTONE A, BONETTI S, et al. Effect of different fabrication methods on the chemo-physical properties of silk fibroin films and on their interaction with neural cells[J]. RSC Advances, 2016, 6(11): 9304-9314. DOI:10.1039/C5RA20684G |
| [20] |
HE Z, ZHAO T, ZHOU X, et al. Sequential order of the secondary structure transitions of proteins under external perturbations: Regenerated silk fibroin under thermal treatment[J]. Analytical Chemistry, 2017, 89(10): 5534-5541. DOI:10.1021/acs.analchem.7b00592 |
| [21] |
HE Z, LIU Z, ZHOU X, et al. Low pressure-induced secondary structure transitions of regenerated silk fibroin in its wet film studied by time-resolved infrared spectroscopy[J]. Proteins, 2018, 86(6): 621-628. DOI:10.1002/prot.25488 |
| [22] |
YADAV R, PURWAR R. Influence of metal oxide nanoparticles on morphological, structural, rheological and conductive properties of mulberry silk fibroin nanocomposite solutions[J]. Polymer Testing, 2021. DOI:10.1016/j.polymertesting.2020.106916 |
| [23] |
CUNNIFF P M, FOSSEY S A, AUERBACH M A, et al. Mechanical and thermal properties of dragline silk from the spider Nephila clavipes[J]. Polymers for Advanced Technologies, 1994, 5(8): 401-410. DOI:10.1002/pat.1994.220050801 |
| [24] |
SHAO Z, VOLLRATH F. Surprising strength of silkworm silk[J]. Nature, 2002. DOI:10.1038/418741a |
| [25] |
MOZAFARI M. Handbook of Biomaterials Biocompatibility: Chapter 1-Principles of bio-compatibility[M]. Cambridge: Sawston, 2020.
|
| [26] |
GUO X, LIN N, LU S, et al. Preparation and biocompatibility characterization of silk fibroin 3D scaffolds[J]. ACS Applied Bio Materials, 2021, 4(2): 1369-1380. DOI:10.1021/acsabm.0c01239 |
| [27] |
LIN X, GAO L, LI R, et al. Mechanical property and biocompatibility of silk fibroin-collagen type Ⅱ composite membrane[J]. Materials Science and Engineering: C, 2019. DOI:10.1016/j.msec.2019.110018 |
| [28] |
US PHARMACOPEIA. The United States Pharmacopeia/National Formulary[M]. New York: United States Pharmacopeia, 2007.
|
| [29] |
HORAN R L, ANTLE K, COLLETTE A L, et al. In vitro degradation of silk fibroin[J]. Biomaterials, 2005, 26(17): 3385-3393. DOI:10.1016/j.biomaterials.2004.09.020 |
| [30] |
ALTMAN G H, DIAZ F, JAKUBA C, et al. Silk-based biomaterials[J]. Biomaterials, 2003, 24(3): 401-416. DOI:10.1016/S0142-9612(02)00353-8 |
| [31] |
HU Y, ZHANG Q, YOU R, et al. The relationship between secondary structure and biodegradation behavior of silk fibroin scaffolds[J]. Advances in Materials Science and Engineering, 2012, 2012: 1-5. |
| [32] |
KAMBE Y, MIZOGUCHI Y, KUWAHARA K, et al. Beta-sheet content significantly correlates with the biodegradation time of silk fibroin hydrogels showing a wide range of compressive modulus[J]. Polymer Degradation and Stability, 2020. DOI:10.1016/j.polymdegradstab.2020.109240 |
| [33] |
MINOURA N, TSUKADA M, NAGURA M. Physico-chemical properties of silk fibroin membrane as a biomaterial[J]. Biomaterials, 1990, 11(6): 430-434. DOI:10.1016/0142-9612(90)90100-5 |
| [34] |
PEREIRA R F P, BRITO-PEREIRA R, GONÇALVES R, et al. Silk fibroin separators: A step toward lithium-ion batteries with enhanced sustainability[J]. ACS Appl. Mater. Interfaces, 2018, 10: 5385-5394. DOI:10.1021/acsami.7b13802 |
| [35] |
GAO A, XIE K, SONG X, et al. Removal of the heavy metal ions from aqueous solution using modified natural biomaterial membrane based on silk fibroin[J]. Ecological Engineering, 2017, 99: 343-348. DOI:10.1016/j.ecoleng.2016.11.008 |
| [36] |
PILLEY S, KAUR H, HIPPARGI G, et al. Silk fibroin: A promising bio-material for the treatment of heavy metal-contaminated water, adsorption isotherms, kinetics, and mechanism[J]. Environmental Science and Pollution Research International, 2022, 29(37): 56606-56619. DOI:10.1007/s11356-022-19833-4 |
| [37] |
LIANG C, HIRABAYASHI K. Studies on the mechanical properties of silk fibroin membranes. (Part 3). The mechanical properties of fibroin-chitosan membranes[J]. Sen'i Gakkaishi, 1991, 47(7): 334-338. DOI:10.2115/fiber.47.7_334 |
| [38] |
CHEN X, LI W, YU T. Conformation transition of silk fibroin induced by blending chitosan[J]. Journal of Polymer Science Part B: Polymer Physics, 1997, 35(14): 2293-2296. DOI:10.1002/(SICI)1099-0488(199710)35:14<2293::AID-POLB9>3.0.CO;2-X |
| [39] |
DU C, ZHU B, CHEN J, et al. Metal ion permeation properties of silk fibroin/chitosan blend membranes[J]. Polymer International, 2006, 55(4): 377-382. DOI:10.1002/pi.1995 |
| [40] |
LIN N, ZUO B. Silk sericin/fibroin electrospinning dressings: A method for preparing a dressing material with high moisture vapor transmission rate[J]. Journal of Biomaterials Science, Polymer Edition, 2021, 32(15): 1983-1997. DOI:10.1080/09205063.2021.1952383 |
| [41] |
KIM E Y, TRIPATHY N, PARK J Y, et al. Silk fibroin film as an efficient carrier for corneal endothelial cells regeneration[J]. Macromolecular Research, 2015, 23(2): 189-195. DOI:10.1007/s13233-015-3027-z |
| [42] |
JUNG R, JIN H. Preparation of silk fibroin/bacterial cellulose composite films and their mechanical properties[J]. Key Engineering Materials, 2007, 342/343: 741-744. DOI:10.4028/www.scientific.net/KEM.342-343.741 |
| [43] |
HOSAKUN Y, HALÁSZ K, HORVÁTH M, et al. ATR-FTIR study of the interaction of CO2 with bacterial cellulose-based membranes[J]. Chemical Engineering Journal, 2017, 324: 83-92. DOI:10.1016/j.cej.2017.05.029 |
| [44] |
WANG Q, WANG C, ZHANG M, et al. Feeding single-walled carbon nanotubes or graphene to silkworms for reinforced silk fibers[J]. Nano Letters, 2016, 16(10): 6695-6700. DOI:10.1021/acs.nanolett.6b03597 |
| [45] |
KIM H S, PARK W I, KIM Y, et al. Silk fibroin films crystallized by multiwalled carbon nanotubes[J]. International Journal of Modern Physics B, 2008, 22(9n11): 1807-1812. DOI:10.1142/S0217979208047456 |
| [46] |
CHOI M, HEO J, KIM H, et al. Control of gas permeability by transforming the molecular structure of silk fibroin in multilayered nanocoatings for CO2 adsorptive separation[J]. Journal of Membrane Science, 2019, 573: 554-559. DOI:10.1016/j.memsci.2018.12.011 |
| [47] |
LING S, ZHOU L, ZHOU W, et al. Conformation transition kinetics and spinnability of regenerated silk fibroin with glycol, glycerol and polyethylene glycol[J]. Materials Letters, 2012, 81: 13-15. DOI:10.1016/j.matlet.2012.04.136 |
| [48] |
MANN A, LYDON F, TIGHE B J, et al. A study of the permeation and water-structuring behavioural properties of PEG modified hydrated silk fibroin membranes[J]. Biomedical Physics & Engineering Express, 2021. DOI:10.1088/2057-1976/abfd82 |
| [49] |
ANG S L, SHAHARUDDIN B, CHUAH J A, et al. Electrospun poly(3-hydroxybutyrate-co-3-hydroxyhexanoate)/silk fibroin film is a promising scaffold for bone tissue engineering[J]. International Journal of Biological Macromolecules, 2020, 145: 173-188. DOI:10.1016/j.ijbiomac.2019.12.149 |
| [50] |
LUO Z, ZHANG Y, ZHOU H, et al. A one-pot preparation of silk fibroin modified with polyurethane micro-particles[J]. New Journal of Chemistry, 2013, 37(10): 3109-3115. DOI:10.1039/c3nj00501a |
| [51] |
VENKATESAN H, HU J, CHEN J. Bioinspired fabrication of polyurethane/regenerated silk fibroin composite fibres with tubuliform silk-like flat Stress-Strain behaviour[J]. Polymers, 2018. DOI:10.3390/polym10030333 |
| [52] |
PARK H S, GONG M, PARK J H, et al. Silk fibroin-polyurethane blends: Physical properties and effect of silk fibroin content on viscoelasticity, biocompatibility and myoblast differentiation[J]. Acta Biomaterialia, 2013, 9(11): 8962-8971. DOI:10.1016/j.actbio.2013.07.013 |
| [53] |
WATCHARAJITTANONT N, PUTSON C, PRIPATNANONT P, et al. Layer-by-layer electrospun membranes of polyurethane/silk fibroin based on mimicking of oral soft tissue for guided bone regeneration[J]. Biomedical Materials (Bristol, England), 2019. DOI:10.1088/1748-605x/ab3502 |
| [54] |
FULLER M A, KÖPER I. Biomedical applications of polyelectrolyte coated spherical gold nanoparticles[J]. Nano Convergence, 2019. DOI:10.1186/s40580-019-0183-4 |
| [55] |
ZHU G, SUN Z, HUI P, et al. Composite film with antibacterial gold nanoparticles and silk fibroin for treating multidrug-resistant E. coli-infected wounds[J]. ACS Biomaterials Science & Engineering, 2021, 7(5): 1827-1835. |
| [56] |
RANJANA R, PARUSHURAM N, HARISHA K S, et al. Fabrication and characterization of conductive silk fibroin-gold nanocomposite films[J]. Journal of Materials Science: Materials in Electronics, 2020, 31(1): 249-264. DOI:10.1007/s10854-019-02485-5 |
| [57] |
LIAO C, LI Y, TJONG S C. Bactericidal and cytotoxic properties of silver nanoparticles[J]. International Journal of Molecular Sciences, 2019. DOI:10.3390/ijms20020449 |
| [58] |
SHAO J, CUI Y T, LIANG Y, et al. Unilateral silver-loaded silk fibroin difunctional membranes as antibacterial wound dressings[J]. ACS Omega, 2021, 6(27): 17555-17565. DOI:10.1021/acsomega.1c02035 |
| [59] |
PARRINO F, POMILLA F R, CAMERA-RODA G, et al. Properties of titanium dioxide. Titanium Dioxide (TiO2) and Its Applications[M]. Amsterdam: Elsevier, 2021.
|
| [60] |
CAI L, SHAO H, HU X, et al. Reinforced and ultraviolet resistant silks from silkworms fed with titanium dioxide nanoparticles[J]. ACS Sustainable Chemistry & Engineering, 2015, 3(10): 2551-2557. |
| [61] |
FENG X, ZHANG L, CHEN J, et al. Preparation and characterization of novel nanocomposite films formed from silk fibroin and nano-TiO2[J]. International Journal of Biological Macromolecules, 2007, 40(2): 105-111. DOI:10.1016/j.ijbiomac.2006.06.011 |
| [62] |
ZHANG S, LI J, YIN Z, et al. Silk fibroin composite membranes for application in corneal regeneration[J]. Journal of Applied Polymer Science, 2015. DOI:10.1002/app.42407 |
| [63] |
ZHANG Y, LU L, CHEN Y, et al. Polydopamine modification of silk fibroin membranes significantly promotes their wound healing effect[J]. Biomaterials Science, 2019, 7(12): 5232-5237. DOI:10.1039/C9BM00974D |
| [64] |
PRIPATNANONT P, CHANKUM C, MEESANE J, et al. Physical and biological performances of a semi-resorbable barrier membrane based on silk fibroin-glycerol-fish collagen material for guided bone regeneration[J]. Journal of Biomaterials Applications, 2021, 36(5): 930-942. DOI:10.1177/08853282211025781 |
| [65] |
TANG Z, WANG X, YANG J, et al. Microconvex dot-featured silk fibroin films for promoting human umbilical vein endothelial cell angiogenesis via enhancing the expression of bFGF and VEGF[J]. ACS Biomaterials Science & Engineering, 2021, 7(6): 2420-2429. |
| [66] |
WEN D, SUN D, HUANG P, et al. Recent progress in silk fibroin-based flexible electronics[J]. Microsystems & Nanoengineering, 2021, 7(1): 1-25. |
| [67] |
REIZABAL A, GONÇALVES R, FIDALGO-MARIJUAN A, et al. Tailoring silk fibroin separator membranes pore size for improving performance of lithium ion batteries[J]. Journal of Membrane Science, 2020. DOI:10.1016/j.memsci.2019.117678 |
| [68] |
PARK J H, SEOK H J, KAMARAJ E, et al. Highly transparent and flexible Ag nanowire-embedded silk fibroin electrodes for biocompatible flexible and transparent heater[J]. RSC Advances, 2020, 10(53): 31856-31862. DOI:10.1039/D0RA05990K |
| [69] |
ZHOU J, LI Y, XIE L, et al. Humidity-sensitive, shape-controllable, and transient zinc-ion batteries based on plasticizing gelatin-silk protein electrolytes[J]. Materials Today Energy, 2021. DOI:10.1016/j.mtener.2021.100712 |
| [70] |
WANG D, WANG L, LOU Z, et al. Biomimetic, biocompatible and robust silk Fibroin-MXene film with stable 3D cross-link structure for flexible pressure sensors[J]. Nano Energy, 2020. DOI:10.1016/j.nanoen.2020.105252 |
| [71] |
GORE P M, NAEBE M, WANG X, et al. Progress in silk materials for integrated water treatments: Fabrication, modification and applications[J]. Chemical Engineering Journal, 2019, 374: 437-470. DOI:10.1016/j.cej.2019.05.163 |
| [72] |
LI Z, TAN C, TIO W, et al. Manta ray gill inspired radially distributed nanofibrous membrane for efficient and continuous oil-water separation[J]. Environmental Science: Nano, 2018, 5(6): 1466-1472. DOI:10.1039/C8EN00258D |
| [73] |
MRUTHUNJAYAPPA M H, KOTRAPPANAVAR N S, MONDAL D. Bioinspired engineering protein nanofibrils-based multilayered self-cleaning membranes for universal water purification[J]. Journal of Hazardous Materials, 2022. DOI:10.1016/j.jhazmat.2021.127561 |
| [74] |
XIONG R, KIM H S, ZHANG S, et al. Template-guided assembly of silk fibroin on cellulose nanofibers for robust nanostructures with ultrafast water transport[J]. ACS Nano, 2017, 11(12): 12008-12019. DOI:10.1021/acsnano.7b04235 |
| [75] |
LING S, QIN Z, HUANG W, et al. Design and function of biomimetic multilayer water purification membranes[J]. Science Advances, 2017. DOI:10.1126/sciadv.1601939 |
| [76] |
PRASAD B, MANDAL B. Moisture responsive and CO2 selective biopolymer membrane containing silk fibroin as a green carrier for facilitated transport of CO2[J]. Journal of Membrane Science, 2018, 550: 416-426. DOI:10.1016/j.memsci.2017.12.061 |
| [77] |
WANG Z, CUI Y, FENG Y, et al. A versatile Silk Fibroin based filtration membrane with enhanced mechanical property, disinfection and biodegradability[J]. Chemical Engineering Journal, 2021. DOI:10.1016/j.cej.2021.131947 |
| [78] |
GAO X, GOU J, ZHANG L, et al. A silk fibroin based green nano-filter for air filtration[J]. RSC Advances, 2018, 8(15): 8181-8189. DOI:10.1039/C7RA12879G |
 2023, Vol. 40
2023, Vol. 40