2. 四川大学新能源与低碳研究室, 成都 610207
2. Institute of New Energy and Low-Carbon Technology, Sichuan University, Chengdu 610207, China
CO2为主的温室气体排放带来的如全球气候变暖、海平面升高与极端天气频发等环境问题已经对人类生存环境造成了极大危害[1]。化学吸收法具有成本低廉、吸收高效的优势,是目前商业化应用最广的CO2捕集技术[2, 3],但是存在解吸能耗高(传统MEA每解吸1 t CO2能耗为3.6~4.0 GJ)、吸收剂易腐蚀降解等问题[4-6]。吸收-矿化工艺耦合了化学吸收法与CO2矿化过程[7, 8],避免了有机胺溶剂在热解吸过程中的巨大能耗与高温下的腐蚀降解问题[9, 10]。但是目前该工艺受限于钙源成本与溶剂循环稳定性而无法实现大规模应用[11]。
本研究拟采用高钙高硫型的固废脱硫渣对4种工业常用有机胺溶剂包括乙醇胺(MEA)、二乙醇胺(DEA)、N-甲基二乙醇胺(MDEA)和2-氨基2-甲基丙醇(AMP)进行解吸矿化。对脱硫渣矿化解吸有机胺溶剂工艺的可行性进行了探究,考察了不同固液比对溶剂解吸率与循环负载量的影响。优选出AMP作为脱硫渣吸收矿化工艺的吸收剂。考察了脱硫渣粒度、搅拌转速、有机胺浓度与反应温度对反应转化率的影响。采用表面覆盖模型对实验值进行拟合,结合产物表征验证了矿化反应机理。对比了脱硫渣吸收矿化工艺与热再生工艺的能耗成本,证明了提出的工艺具有一定经济价值与环保意义。
1 实验试剂与方法 1.1 实验试剂所用到的有机胺试剂均为分析纯,主要试剂MEA(C2H7NO, 质量分数为99%)、DEA(C4H11NO2, 质量分数为99%)、MDEA(C5H13NO2, 质量分数为95%)和AMP(C4H11NO, 质量分数为95%)购于成都市科隆化学品有限公司;气体CO2(体积分数为99.9%)与N2(体积分数为99.9%)购于成都双流广源气体公司;固废脱硫渣来自于西昌蓝鼎环保有限公司。
实验所用到的仪器包括气体质量流量计(CS200,北京七星华创电子股份有限公司);恒温磁力搅拌水浴锅(DF-101S,科瑞仪器有限公司);CO2红外气体分析仪(FN316B,陕西菲恩特仪器有限公司);pH计(PHS-3C,上海仪电科学仪器有限公司)。
1.2 脱硫渣CO2负载量测定用移液管取2 mL有机胺溶液至锥形瓶中,加入一定量的去离子水稀释并滴加1~2滴甲基橙指示剂[12]。打开三通阀使锥形瓶、排液管与大气连通,检查排液管内液面是否与分液漏斗平齐,读取刻度管示数V1。关闭三通阀使锥形瓶与排液管连通但不与大气相通,缓慢滴加1 mol ·L-1的盐酸至指示剂由橙色变为粉红色,此时盐酸用量为V0。轻微摇晃锥形瓶使CO2气体充分释放,上下移动分液漏斗使刻度管中液面与分液漏斗中液面平齐,读取刻度管示数V2。同时记录实验操作时的温度T和压力P,按式(1)计算CO2负载量。
| $ c=\frac{\left(V_2-V_1-V_0\right)}{22.4 \times V} \times \frac{273.15}{273.15+T} \times \frac{P}{101325} $ | (1) |
脱硫渣中物相种类通过帕纳科锐影(Empyrean)公司XRD仪器分析,辐射源为Cu靶(λ=5.154 nm),测试时将2~3 g样品平铺在玻璃片上,并将玻璃片放置在仪器夹板中心处,扫描步长0.06,扫描角度10°~80°。脱硫渣比表面积与孔容孔径等物理结构通过麦克仪器公司的物理吸附仪(Micromeritics Tristar)上进行测试,首先取0.1 g样品在200 ℃下脱气24 h,然后使用液氮作为载气检测样品在不同压力下的氮气吸附量。脱硫渣矿化前后粒度变化由JL-6000干湿两用激光粒度仪检测,实验时将少量样品分散在去离子水中,经超声2 h后迅速进行检测。脱硫渣表面形貌和元素分布由日本电子(JEOL)生产的扫描电子显微镜(JSM-7500F)进行测试,取微量待测粉末均匀涂抹在导电胶表面放置在仪器样品台上,设置加速电压为15 kV,分辨率为200 nm。
1.4 吸收矿化实验吸收实验:CO2流量为80 mL ·min-1,N2流量为450 mL ·min-1,恒温槽温度为40 ℃。在500 mL三口烧瓶中装入250 mL浓度为1 mol ·L-1的有机胺溶液,冷凝水温度设置为10 ℃,磁力搅拌速度为600 r ·min-1。开始1 h每隔10 min,后面每隔30 min取2 mL样品并记录溶液pH值,采用酸式滴定方式检测溶液中的CO2负载量。
矿化实验:在玻璃反应器中进行,反应温度为25 ℃,磁力搅拌速度维持在600~800 r ·min-1。将200 mL饱和胺溶液倒入反应器中搅拌,待溶液温度与水浴锅水温平衡时,加入固液比为100~600 g ·L-1的脱硫渣。反应变量为颗粒粒径(>125, 75~125, 50~75和 < 50 μm)、搅拌转速(200、400、600、800和1 000 r ·min-1)、有机胺浓度(1、2、3和4 mol ·L-1) 和反应温度(20、30、40、50和60 ℃)。
2 实验结果与讨论 2.1 脱硫渣性质图 1为脱硫渣粒径分布、比表面积、物相组成和微观形貌表征结果。脱硫渣颗粒粒径较细,中位径为14.63 μm。在相对压力较低情况下氮气吸附量较低,在相对压力升高到0.9时吸附量明显上升,说明脱硫渣中孔结构较少,一般为微孔结构,根据BET方法计算得到脱硫渣的比表面积为15.92 m2 ·g-1。脱硫渣中物相由硫酸钙、亚硫酸钙、碳酸钙和氢氧化钙组成,硫酸钙有2种水合物而碳酸钙仅存在方解石晶型。脱硫渣的微观形貌有3种:直型棒状结构、立方型结构和微球状结构,结合EDS能谱结果可知它们分别对应脱硫渣中氢氧化钙、碳酸钙和硫酸钙形貌。
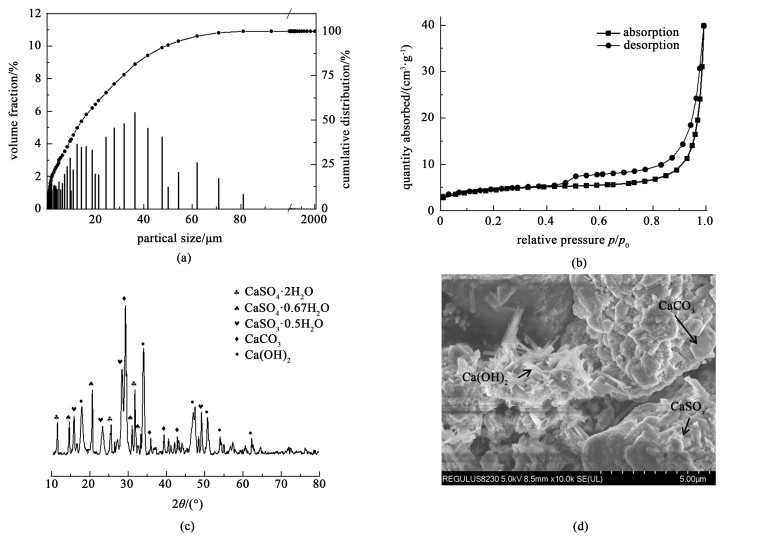
|
| 图 1 脱硫渣(a)粒径分布; (b)氮气吸脱附曲线; (c) XRD谱图; (d) SEM扫描 Fig.1 (a) Particle size distribution; (b) nitrogen adsorption and desorption curve; (c) XRD characterization; (d) SEM scanning spectrum of DFS |
| |
表 1对脱硫渣化学物理性质进行了总结,从中可以发现脱硫渣拥有较细的粒径与较大的比表面积,在物理性质方面有利于液固相矿化反应。化学组成含27.4%硫酸钙、20.0%亚硫酸钙、16.4%氢氧化钙和26.7%碳酸钙,其中硫酸钙与氢氧化钙是可以解吸矿化有机胺的钙源,而脱硫渣能够提供的最大理论矿化量可以达到167 kg CO2。因此,脱硫渣是一种极具潜力的矿化原料,具有利于矿化反应的颗粒粒径、比表面积和化学组成。
| 项目 | 单位 | 值 | |
| 物理性质 | D[4, 3] | μm | 19.8 |
| D[3, 2] | μm | 2.66 | |
| D10 | μm | 1.03 | |
| D50 | μm | 14.6 | |
| D90 | μm | 46.4 | |
| 比表面积 | m2·g-1 | 15.9 | |
| 总孔容 | mm3·g-1 | 61.7 | |
| 平均孔径 | nm | 25.9 | |
| 化学性质 | CaSO4·2H2O | % | 27.4 |
| CaSO3·0.5H2O | % | 20.0 | |
| Ca(OH)2 | % | 16.4 | |
| CaCO3 | % | 26.7 | |
| 理论矿化量 | kg·t-1 | 167 |
图 2为4种有机胺溶剂的吸收速率与吸收容量对比。对于MEA、DEA和AMP,这3种胺溶剂具有相近的吸收速度,初始吸收速率为0.008 mol ·min-1 ·L-1,在2 h后基本能达到吸收饱和。MEA和DEA的吸收容量相近,分别为0.73和0.72 mol ·mol-1,AMP的吸收容量0.79 mol ·mol-1。MDEA吸收速率十分缓慢,初始吸收速率仅有0.002 mol ·min-1 ·L-1,在吸收12 h之后仍未达到饱和,在12 h时的吸收量为0.88 mol ·mol-1。低浓度有机胺溶液单位吸收量要比工业常用浓度为5 mol ·L-1的溶剂吸收量要高[13],可能是因为有机胺的浓度较低,两性离子更容易被水分子而不是胺分子夺去氢质子,理论吸收量更偏向于1.0 mol ·mol-1而不是0.5 mol ·mol-1。上述过程的反应式见式(2)和(3)。
| $ 2 \mathrm{R}_1 \mathrm{R}_2 \mathrm{NH}+\mathrm{CO}_2 \rightarrow \mathrm{R}_1 \mathrm{R}_2 \mathrm{NH}_2^{+}+\mathrm{R}_1 \mathrm{R}_2 \mathrm{NCOO}^{-} $ | (2) |
| $ \mathrm{R}_1 \mathrm{R}_2 \mathrm{NH}+\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{R}_1 \mathrm{R}_2 \mathrm{NH}_2^{+}+\mathrm{HCO}_3^{-} $ | (3) |
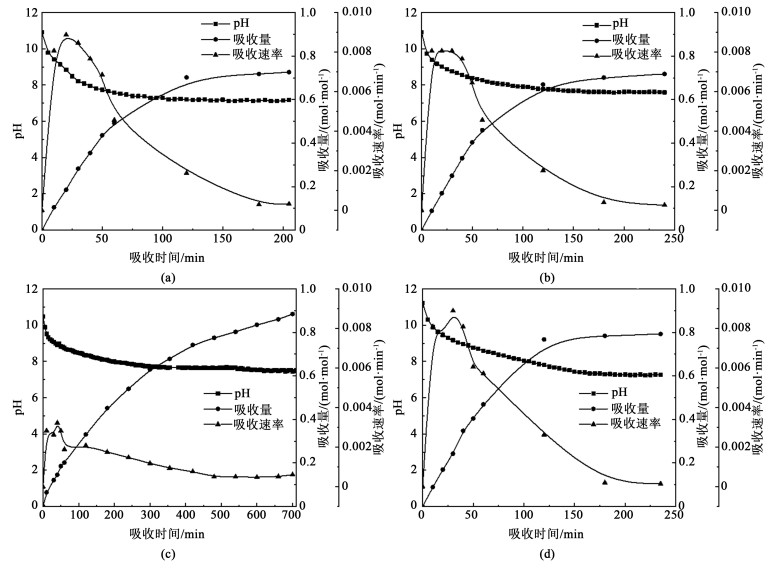
|
| 图 2 1 mol ·L-1有机胺溶剂吸收速率与吸收量:(a) MEA; (b) DEA; (c) MDEA; (d) AMP Fig.2 The absorption rate and capacity of 1 mol ·L-1 (a) MEA; (b) DEA; (c) MDEA; (d) AMP |
| |
图 3为不同脱硫渣投入量条件下有机胺溶剂的CO2解吸量与二次负载量。随着脱硫渣的加入,MEA与DEA溶液中CO2负载量迅速降低。在固液比为200 g ·L-1时,2者的CO2负载稳定在0.2 mol ·L-1,而固液比进一步增加CO2负载量不变。溶液的二次负载量随固液比的投入可以进一步上升,在固液比为300 g ·L-1时,2者的二次负载量为0.6 mol ·L-1[见图 3(a)和图 3(b)]。MDEA与AMP随着脱硫渣的加入,溶液中CO2可以得到完全解吸,这可能与有机胺溶液吸收CO2后完全生成碳酸氢根有关。在固液比为300 g ·L-1时溶液中CO2负载量仅有0.02 mol ·L-1。MDEA在固液比为400 g ·L-1时二次负载量为0.61 mol ·L-1,而AMP在固液比500 g ·L-1时二次负载量为0.68 mol ·L-1[见图 3(c)和图 3(d)]。溶液的二次负载量与首次负载量有所差距,可能是因为在矿化反应和二次吸收过程中的胺浓度降低。
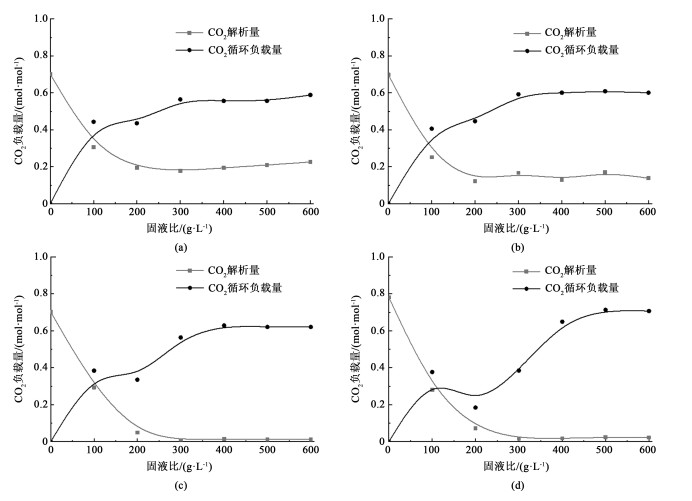
|
| 图 3 不同固液比条件下有机胺溶剂CO2负载量与循环负载量(a) MEA; (b) DEA; (c) MDEA; (d) AMP Fig.3 CO2 loading and cyclic capacity of amine solvents under different solid-liquid ratios (a) MEA; (b) DEA; (c) MDEA; (d) AMP |
| |
根据2.2节结果,AMP拥有优异的吸收速率、吸收容量与解吸率,是良好的吸收矿化工艺的工作溶剂。故选择AMP作为吸收剂,进一步探究颗粒粒径、搅拌转速、有机胺浓度与反应温度对反应转化率的影响,结果见图 4。
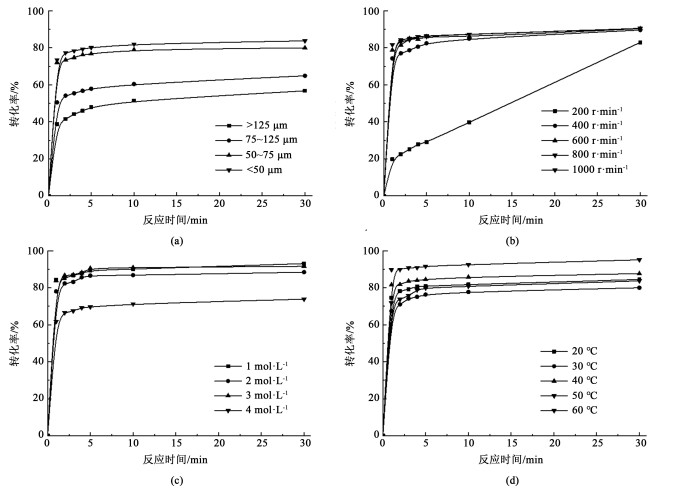
|
| 图 4 AMP矿化反应条件影响:(a)颗粒粒径;(b)搅拌转速;(c)有机胺浓度;(d)反应温度 Fig.4 The effects of different reaction conditions on calcium conversion (a) particle size; (b) stirring rate; (c) amine concentration; (d) reaction temperature |
| |
从图 4(a)中可以看出,当脱硫渣粒径大于>125 μm时,矿化反应速率较慢且反应平衡转化率较低。随着粒径的减小,反应的转化率提高且到达平衡时间缩短,这是由于不同粒径脱硫渣中化学成分可能不同。图 4(b)中显示,当转速为200 r ·min-1时,反应转化率随时间呈线性关系,可能是因为反应极大的受传质影响,因此随着转速的提高,体系内物质混合程度提高,反应转化率上升。从图 4(c)中可知,胺浓度在1、2和3 mol ·L-1时矿化反应速率相差不大,而在4 mol ·L-1时平衡转化率下降明显,可能是因为胺浓度上升会导致溶液中碳酸氢根含量下降,氨基甲酸根含量上升。图 4(d)结果表明,反应温度对转化率影响较为复杂,一方面,温度的升高有利于分子的热运动和碳酸氢根的解离,另一方面,温度升高不利于氢氧化钙与CO2的溶解[14]。在30与50 ℃时,反应转化率分别为80.0%和83.7%,温度对矿化反应表现为抑制作用,而在40 ℃和60 ℃时,转化率分别为87.7%和95.1%,温度对矿化反应表现为促进作用。
反应温度对矿化产物的影响较大,故选择了不同矿化温度下的固相产物进行分析,结果见图 5。从图 5(a)中可以看出原料的粒径分布较宽,而矿化后粒径分布变窄。在20和30 ℃时中位径分别为13.33和13.85 μm。随着温度升高固相粒径逐渐增大,而在60 ℃时粒径减小。从图 5(b)中可以看出,矿化产物中含有方解石与球霰石2种碳酸钙晶型。随着温度的升高,固相中方解石峰强减弱,球霰石峰强升高,说明随着反应温度的提高,矿化产物晶型逐渐向球霰石转移。当温度上升到40 ℃时,开始出现氢氧化钙的振动峰,说明此时氢氧化钙参与反应程度降低,硫酸钙反应程度增加。图 5(c)为矿化产物电镜扫描图,矿化产物表面均覆盖方解石与球霰石型碳酸钙颗粒。碳酸钙的粒径在200 nm左右,而其团聚后的微粒粒径在10 μm左右。
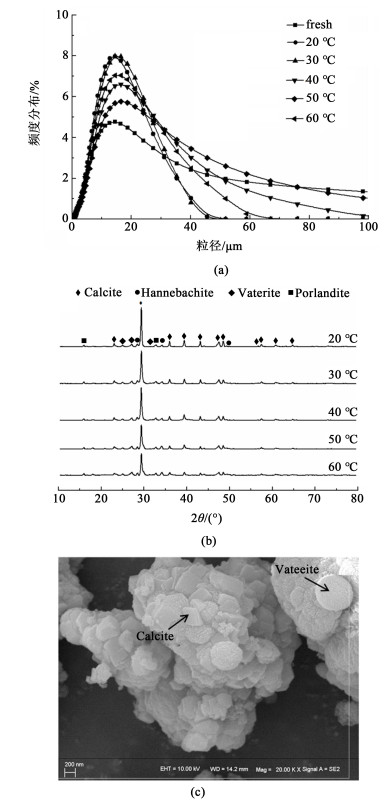
|
| 图 5 不同反应温度矿化产物表征 Fig.5 Characterization of mineralized products at different reaction temperatures |
| |
针对矿化反应不同的速控步骤,尝试应用多种数学模型进行拟合,比较后发现表面覆盖模型对于大多数反应条件下的矿化反应具有更高的匹配度。表面覆盖模型(Surface coverage model) 是Shih等在1999年提出的动力学模型,模型最早用于低温下Ca(OH)2与CO2/SO2的气固相反应,提出碳化反应形成的沉淀物会包裹反应物颗粒表面的活性部位,从而阻碍颗粒内部反应物的扩散和反应,其动力学模型如式(4):
| $ \delta=\left[1-\exp \left(-k_1 k_2 t\right)\right] / k_2 $ | (4) |
式(4)中:δ为反应转化率;k1为反应速率常数;k2为活性表面比例。
表 2为不同反应条件下表面覆盖模型拟合参数,ks代表矿化反应速率,kp代表产物惰性层覆盖在反应物表面的比例,kskp代表产物在表面覆盖的速率[15]。
| 变量 | ks/(10-3·mol·min-1·m-2) | kp/(103·m2·mol-1) | k1/min-1 | k2 | kskp/min-1 | R2 | |
| 粒径/μm | >125 | 0.345 7 | 3.600 | 0.615 | 2.023 | 1.244 | 0.937 4 |
| 75~125 | 0.600 4 | 3.026 | 1.068 | 1.701 | 1.817 | 0.974 4 | |
| 50~75 | 1.164 0 | 2.314 | 2.071 | 1.300 | 2.694 | 0.993 4 | |
| < 50 | 1.084 0 | 2.213 | 1.929 | 1.243 | 2.399 | 0.994 8 | |
| 搅拌速度/(r·min-1) | 200 | 0.042 6 | 2.057 | 0.076 | 1.156 | 0.088 | 0.886 0 |
| 400 | 1.004 0 | 2.152 | 1.786 | 1.209 | 2.161 | 0.981 3 | |
| 600 | 1.164 0 | 2.071 | 2.071 | 1.164 | 2.412 | 0.993 4 | |
| 800 | 1.363 0 | 2.050 | 2.425 | 1.152 | 2.795 | 0.996 0 | |
| 1 000 | 1.372 0 | 2.058 | 2.441 | 1.156 | 2.823 | 0.994 5 | |
| 胺浓度/(mol·L-1) | 1 | 1.438 0 | 2.002 | 2.559 | 1.125 | 2.880 | 0.993 7 |
| 2 | 1.129 0 | 2.075 | 2.008 | 1.166 | 2.342 | 0.995 8 | |
| 3 | 1.385 0 | 1.992 | 2.464 | 1.119 | 2.759 | 0.996 4 | |
| 4 | 0.811 2 | 2.541 | 1.443 | 1.428 | 2.061 | 0.992 1 | |
| 温度/℃ | 20 | 1.125 0 | 2.194 | 2.002 | 1.233 | 2.469 | 0.995 7 |
| 30 | 0.879 6 | 2.336 | 1.565 | 1.313 | 2.055 | 0.991 1 | |
| 40 | 1.555 0 | 2.102 | 2.766 | 1.181 | 3.269 | 0.996 3 | |
| 50 | 1.001 0 | 2.248 | 1.782 | 1.263 | 2.252 | 0.987 6 | |
| 60 | 1.933 0 | 1.937 | 3.439 | 1.088 | 3.744 | 0.997 3 |
在颗粒粒径减小时ks增大,说明颗粒粒径减小矿化速率增加。颗粒表面覆盖速率上升但是总的表面覆盖度降低,在粒径低于50 μm后矿化速率接近一致。在转速改变的情况下,反应的kp值几乎不变,说明此时产物表面覆盖程度一致,而矿化反应速率加快导致表面覆盖速率同样加快。胺浓度对于反应影响主要在于CO2的存在形式,在1~3 mol ·L-1条件下,CO2完全以碳酸氢根形式存在,而在胺浓度增大至4 mol ·L-1,胺负载量为0.2 mol ·mol-1时,氨基甲酸根浓度上升导致矿化反应速率和表面惰性层覆盖速率降低。在反应温度为20 ℃时,矿化反应速率为1.125×10-3 mol ·min-1 ·m-2。在30与50 ℃时ks降低,可能是由于氢氧化钙的溶解降低并且表面覆盖度较高导致。
为了进一步验证矿化产物表面覆盖机理,利用聚焦离子束对1个粒径5 μm左右的颗粒进行切割和EDS线扫,结果如图 6所示,颗粒表面的碳元素含量较高而钙含量较低,在颗粒内部碳元素含量较低而钙元素含量升高。氧元素与硫元素含量沿线扫方向并未有太大改变。表征表明有碳酸钙产物覆盖在反应物表面,而颗粒内部仍然有少量未反应的氢氧化钙与硫酸钙,这与表面覆盖模型假设一致。
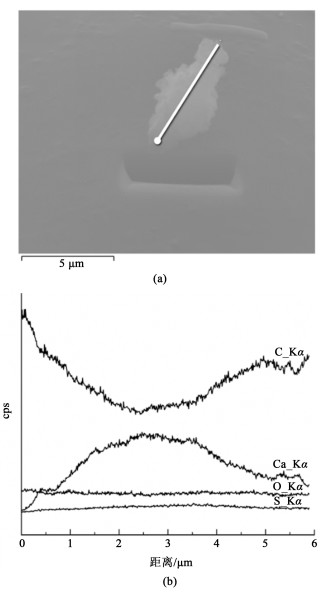
|
| 图 6 矿化产物聚焦离子束分析 Fig.6 FIB analysis of mineralized products |
| |
表 3为工艺整体的物料与能量衡算。根据课题项目需求,设置烟气处理量为11.3 t ·h-1,CO2矿化量为1.8 t ·h-1,每年运行时间为8 000 h时,总的CO2矿化量可达14 400 t ·a-1。脱硫渣的用量为16.5 t ·h-1,年处理量为13.2万t,可以得到14.7万t富碳酸钙产品。有机胺溶剂的损失量为0.16 t ·h-1,主要为吸收塔内气相逃逸。该工艺能耗主要集中于吸收塔的冷凝器上,占总体能耗的43.8%。水洗过滤机的能耗为9.6 kWh ·t-1,流程内压降损失带来的能耗为27 kWh ·t-1。工艺单位碳捕集能耗为0.23 GJ,相比热解吸每1 t CO23.6 GJ具有较大优势[16]。
| 物料 | 单位CO2消耗量/(t·h-1) | 能量 | 单位CO2消耗量/(kWh·t-1) |
| CO2矿化量 | 1.80 | 水洗过滤 | 9.6 |
| 脱硫渣用量 | 16.5 | 冷凝 | 28.6 |
| 固体产品量 | 18.4 | 风机 | 12.0 |
| AMP循环量 | 115 | 泵 | 15.0 |
| AMP补充量 | 0.16 | 总能耗 | 65.2 |
| 工艺水用量 | 6.50 |
提出利用半干法脱硫渣对有机胺溶剂进行化学解吸,实现吸收剂解吸再生的同时得到了富碳酸钙产品,具有良好的经济价值与环保意义。对比了4种工业常用有机胺吸收剂包括MEA、DEA、MDEA和AMP的吸收矿化性能,优选的AMP溶剂具有较快的吸收速率和较高的循环负载量(0.7 mol ·L-1)。围绕AMP矿化影响因素,对颗粒粒径、搅拌转速、有机胺浓度和反应温度进行了分析。利用表面覆盖模型对实验数据进行了拟合,结合矿化产物的FIB表征探究了脱硫渣与有机胺矿化反应的机理。对工艺整体物料与能耗进行了衡算,半干法脱硫渣与AMP溶剂的吸收矿化耦合工艺的单位碳捕集能耗为每1 t CO2 0.23 GJ,相比传统热解吸工艺每1 t CO2 3.6 GJ具有较大优势。因此,脱硫渣矿化解吸工艺是一种低成本、低能耗、环保绿色的CO2捕集工艺。
| [1] |
ROCHELLE G T. Amine scrubbing for CO2 capture[J]. Science, 2009, 325(5948): 1652-1654. DOI:10.1126/science.1176731 |
| [2] |
CHANG J, HOU C, WAN D, et al. Enhanced CO2 adsorption capacity of bi-amine co-tethered flue gas desulfurization gypsum with water of hydration[J]. Journal of CO2 Utilization, 2020, 35: 115-125. DOI:10.1016/j.jcou.2019.09.009 |
| [3] |
ALI S B Z, GAO H, HUANG Y, et al. Enhancing CO2 desorption performance in rich MEA solution by addition of SO42-/ZrO2/SiO2 bifunctional catalyst[J]. Applied Energy, 2019. DOI:10.1016/j.apenergy.2019.113440 |
| [4] |
NWAOHA C, SMITH D W, IDEM R, et al. Process simulation and parametric sensitivity study of CO2 capture from 115 MW coal-fired power plant using MEA-DEA blend[J]. International Journal of Greenhouse Gas Control, 2018, 76: 1-11. DOI:10.1016/j.ijggc.2018.06.006 |
| [5] |
SHANGGUAN W J, SONG J, YUE H, et al. An efficient milling-assisted technology for K-feldspar processing, industrial waste treatment and CO2 mineralization[J]. Chemical Engineering Journal, 2016, 292: 255-263. DOI:10.1016/j.cej.2016.02.031 |
| [6] |
BENHELAL E, RASHID M I, RAYSON M S, et al. Study on mineral carbonation of heat activated lizardite at pilot and laboratory scale[J]. Journal of CO2 Utilization, 2018, 26: 230-238. DOI:10.1016/j.jcou.2018.05.015 |
| [7] |
JI L, YU H, YU B, et al. Integrated absorption-mineralisation for energy-efficient CO2 sequestration: Reaction mechanism and feasibility of using fly ash as a feedstock[J]. Chemical Engineering Journal, 2018, 352: 151-162. DOI:10.1016/j.cej.2018.07.014 |
| [8] |
JI L, YU H, LI K, et al. Integrated absorption-mineralisation for low-energy CO2 capture and sequestration[J]. Applied Energy, 2018, 225: 356-366. DOI:10.1016/j.apenergy.2018.04.108 |
| [9] |
YU B, YU H, LI K, et al. A diamine-based integrated absorption-mineralization process for carbon capture and sequestration: Energy savings, fast kinetics, and high stability[J]. Environmental Science & Technology, 2018, 52(22): 13629-13637. |
| [10] |
YU B, YU H, YANG Q, et al. Postcombustion capture of CO2 by diamines containing one primary and one tertiary amino group: Reaction rate and mechanism[J]. Energy & Fuels, 2019, 33(8): 7500-7508. |
| [11] |
LIU M, GADIKOTA G. Single-step, low temperature and integrated CO2 capture and conversion using sodium glycinate to produce calcium carbonate[J]. Fuel, 2020. DOI:10.1016/j.fuel.2020.117887 |
| [12] |
ZHANG W, LI J, WANG Q, et al. Desorption and mineralization of CO2 in amine-based solution by Ca(OH)2[J]. International Journal of Greenhouse Gas Control, 2020. DOI:10.1016/j.ijggc.2020.103056 |
| [13] |
AROONWILAS A, VEAWAB A. Integration of CO2 capture unit using blended MEA-AMP solution into coal-fired power plants[J]. Energy Procedia, 2009, 1(1): 4315-4321. DOI:10.1016/j.egypro.2009.02.244 |
| [14] |
PAN S, CHIANG P, CHEN Y, et al. Kinetics of carbonation reaction of basic oxygen furnace slags in a rotating packed bed using the surface coverage model: Maximization of carbonation conversion[J]. Applied Energy, 2014, 113: 267-276. DOI:10.1016/j.apenergy.2013.07.035 |
| [15] |
CHANG E, CHIU A C, PAN S, et al. Carbonation of basic oxygen furnace slag with metalworking wastewater in a slurry reactor[J]. International Journal of Greenhouse Gas Control, 2013, 12: 382-389. DOI:10.1016/j.ijggc.2012.11.026 |
| [16] |
DASH S K, SAMANTA A N, BANDYOPADHYAY S S. Simulation and parametric study of post combustion CO2 capture process using (AMP+PZ) blended solvent[J]. International Journal of Greenhouse Gas Control, 2014, 21: 130-139. DOI:10.1016/j.ijggc.2013.12.003 |
 2023, Vol. 40
2023, Vol. 40





