2. 天津市化工过程安全与装备技术重点实验室, 天津 300072
2. Tianjin Key Laboratory of Chemical Process Safety and Equipment Technology, Tianjin 300072, China
Gemini表面活性剂分子由2个单疏水链和单亲水头基构成的表面活性剂分子组成,它们的头基通过化学键连接在一起[1]。Gemini表面活性剂广泛应用于水性涂料、黏合剂、洗涤剂、化妆品和造纸等行业。一般认为,Gemini表面活性剂的性能取决于溶液中分子的聚集行为,因此有必要了解表面活性剂的分子结构和溶液中聚集过程的动力学机理,只有这样才能更好地开发和应用表面活性剂[2-4]。
分子模拟能够在保证精度的同时模拟数百万甚至数千万个原子的运动。耗散粒子动力学(Dissipative Particle Dynamics,DPD)是由Hoogerbrugge和Koelman[5]研究并发展起来的一种介观分子模拟方法。它非常适用于模拟表面活性剂溶液中分子的聚集行为研究[6],并且已成为研究表面活性剂物化性质的重要手段[7-9]。近几十年来,许多学者利用DPD模拟表面活性剂分子的聚集状态[10-12],比如Cao等[13]用DPD模拟3种嵌段共聚物的聚集行为;Zhou等[14]研究了季铵盐Gemini表面活性剂在纯水、水-乙醇和水-油混合溶液3种体系中的聚集过程。此外,许多学者将实验与理论相结合,共同解释表面活性剂分子的溶液行为。Tan等[15]利用动态光散射(Dynamic Light Scattering,DLS)和透射电子显微镜(Transmission Electron Microscope,TEM)相结合的方法研究了胶束的晶体跃迁动力学,并利用DPD法研究了胶束球向棒状跃迁的机理。
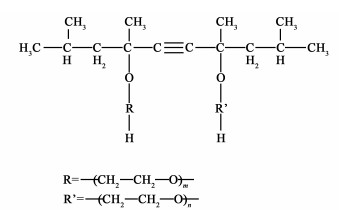
α,α′-[2,4,7,9-四甲基-5-癸炔-4,7-二醇]双[ω-羟基-聚(环氧乙烷)]是一种非离子型Gemini表面活性剂,其分子结构如图 1所示。取代基R和R′为聚环氧乙烷(Polyethylene Oxide,PEO),m和n分别代表它们的聚合度。本研究所使用的表面活性剂称为S系列表面活性剂:S-(m+n) (比如S-10每个分子有10个环氧乙烷单体,即m+n=10)。为了便于模拟,在本研究中假设m=n。Sato[16-23]研究了S-10在水溶液中的热力学和黏度、渗透系数和活性系数、胶束的形成和相互作用、胶束的聚集数、核磁共振波谱、胶束中银和金的形成及其拉曼散射。还有一些学者针对S系列表面活性剂的性能进行了研究,比如S-0/4/10/20/30的润湿和吸附[24],S-10/20/30水溶液的结构相[1]。他们观察到了S-10的单体-胶束之间的转化,计算出S-10胶束的平均聚集数为12.8。然而,这一转变的机制和过程尚未得到阐述,团簇和胶束的形态还没有直接观察到。
|
| 图 1 α,α′-[2, 4, 7, 9-四甲基-5-癸炔-4, 7-二醇]双[ω-羟基-聚(环氧乙烷)]的分子结构 Fig.1 Molecular structure of α, α′-[2, 4, 7, 9-tetramethyl-5-decyne-4, 7-diyl]bis[ω-hydroxyl-poly(oxyethylene)] |
| |
大部分DPD模拟相关研究主要通过模拟来进行机理解释,缺少相应的实验对照,并且对聚氧乙烯型表面活性剂的研究甚少,对于胶束是怎样形成的、过程如何?形态是如何转变的、机理如何?在水-气界面是如何分布的?这些问题还有待进行更深层次的研究。本研究以S-4、S-10和S-30为试剂,结合实验和DPD模拟研究了S系列表面活性剂的胶束行为和水-气界面分布。应用动态光散射仪和表面张力仪研究了S系列表面活性剂的临界胶束浓度(Critical Micelle Concentration,CMC)和分子聚集行为;通过透射电子显微镜观察了表面活性剂胶束和团簇的形貌;结合DPD模拟和实验结果,探讨了S系列表面活性剂在水溶液中胶束的形成机理和表面张力下降的原因,为今后DPD模拟非离子类型的表面活性剂做参考。
1 实验方法与模型 1.1 试样S-4、S-10和S-30表面活性剂购自Evonik,Inc.,不经进一步处理即可使用。用超纯水和表面活性剂配制成以mmol·L-1为浓度单位的水溶液,缓慢搅拌,静置24 h。用直径为0.45 μm的过滤器过滤后用于动态光散射测定。
1.2 实验仪器与方法 1.2.1 表面张力仪表面张力仪为Kruss公司的K100C型表面张力仪,精度为0.01 mN·m-1,测量原理是威廉氏板法。威廉板是一种面积为几平方厘米的板材,通常由滤纸、玻璃或铂制成,可以经过粗化以确保完全润湿。
1.2.2 动态光散射仪动态光散射仪是Wyatt公司的DynaPro Nano Star。激光波长为658 nm,入射角为90°,流体动力半径范围为0.2~2 500 nm。它能很好地检测胶束和团簇。
1.2.3 透射电子显微镜透射电子显微照片使用JEM-1400Flash电子显微镜,在100 kV下操作。将5滴特定浓度的表面活性剂溶液滴在200目涂有碳膜的铜网格上,多余的溶液立即用滤纸除去,然后将样品风干,最后用于透射电子显微镜观察。
1.3 耗散粒子动力学 1.3.1 理论方法在DPD模拟中,通常将不同的分子划分成等体积的粗粒颗粒。粗粒颗粒之间的相互作用运动符合牛顿方程[25],如式(1)和式(2)所示。
| $ \frac{{{\rm{d}}{r_i}}}{{{\rm{d}}t}} = {\mathit{\boldsymbol{v}}_i} $ | (1) |
| $ {m_i}\frac{{{\rm{d}}{v_i}}}{{{\rm{d}}t}} = {\mathit{\boldsymbol{F}}_i} $ | (2) |
式(1)和式(2)中:ri,vi,mi,Fi分别代表第i个珠子的位置矢量、速度矢量、质量和总力,t代表时间。总力的计算如式(3)所示。
| $ {\mathit{\boldsymbol{F}}_i} = \sum\nolimits_{i \ne j} {\mathit{\boldsymbol{F}}_{ij}^{\rm{C}}} + \sum\nolimits_{i \ne j} {\mathit{\boldsymbol{F}}_{ij}^{\rm{D}}} + \sum\nolimits_{i \ne j} {\mathit{\boldsymbol{F}}_{ij}^{\rm{R}}} $ | (3) |
式(3)中:FijC,FijD,FijR分别代表第i个和第j个珠子(i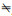
| $ \mathit{\boldsymbol{F}}_{ij}^{\rm{C}} = \left\{ {\begin{array}{*{20}{c}} {{\alpha _{ij}}\left( {1 - {r_{ij}}} \right){{\hat r}_{ij}}, }&{{r_{ij}} < {r_c}}\\ {0, }&{{r_{ij}} > {r_c}} \end{array}} \right. $ | (4) |
| $ \mathit{\boldsymbol{F}}_{ij}^{\rm{D}} = \left\{ {\begin{array}{*{20}{c}} { - \lambda {\omega ^D}\left( {{r_{ij}}} \right)\left( {{{\hat r}_{ij}}{\mathit{\boldsymbol{v}}_{ij}}} \right), }&{{r_{ij}} < {r_c}}\\ {0, }&{{r_{ij}} > {r_c}} \end{array}} \right. $ | (5) |
| $ \mathit{\boldsymbol{F}}_{ij}^{\rm{R}} = \left\{ {\begin{array}{*{20}{c}} {\sigma {\omega ^R}\left( {{r_{ij}}} \right){\xi _{ij}}{\mathit{\boldsymbol{r}}_{ij}}}&{{r_{ij}} < {r_c}}\\ {0, }&{{r_{ij}} > {r_c}} \end{array}} \right. $ | (6) |
式(4)~式(6)中:rij=|ri-rj|,
| $ {\omega ^D}(r) = {\left[ {{\omega ^R}(r)} \right]^2} $ | (7a) |
| $ {\sigma ^2} = 2\lambda {k_{\rm{B}}}T $ | (7b) |
式(7a)和式(7b)中:kB是玻尔兹曼常数,T是绝对温度。
1.3.2 模型和相互作用参数本研究用Materials Studio 7.0软件中的DPD模块进行模拟[14]。DPD模拟系统包括非离子Gemini表面活性剂S-4、S-10和S-30的分子、水和氮气,依据等体积原则将分子模型简画为由珠子和弹簧构成的粗粒度模型,如图 2所示,表面活性剂分子由A、S、EO和EOH 4种珠子构成。S珠子代表间隔基团(C2H2),A珠子代表疏水基团(C3H8),EO珠子(C2H5OH)和EOH珠子(HOCH2CH2OH)代表亲水基团,令m′=n′以便于模拟(比如,S-10中m′=n′=4,加上2个EOH珠子共10个亲水珠子)。W珠子和N珠子分别代表水和空气,每个珠子的体积大约是0.08 nm3并且包含3个分子(比如W珠子代表 3个水分子)。在此模拟系统中,截止半径、粒子质量和DPD温度都设置为1(DPD单位),时间步长Δt设置为0.05(DPD单位),γ设置为4.5,模拟密度ρ设置为3,不同珠子之间的弹簧常数设置为4.0[26]。
|
| 图 2 表面活性剂的DPD模型 Fig.2 DPD model of surfactant |
| |
由式(4)可知,最重要的待确定参数是珠子i和珠子j之间的最大斥力αij[25],可以由Flory-Huggins参数可以计算得到,如式(8)和式(9)所示[14]。
| $ {a_{ij}} = {a_{ii}} + 4.329{\chi _{ij}} $ | (8) |
| $ {a_{ii}} = \frac{{\left( {16{N_{\rm{m}}} - 1} \right){k_{\rm{B}}}T}}{{0.2\rho }} $ | (9) |
式(8)和式(9)中:Nm表示每个W珠子含有的水分子数(本研究中Nm=3),χij代表Flory-Huggins参数。本研究中,每个珠子含有3个水分子,所以根据式(9)可以计算出aii=78。χij参数可以通过Materials Studio的Blend模块计算混合能量得到,使用COMPASS力场且χij可以用方程式(10)和式(11)计算[27]。
| $ {\chi _{ij}} = ZV\frac{{{E_{{\rm{mix }}}}(T)}}{{RT}} $ | (10) |
| $ {E_{{\rm{mix }}}}(T) = \frac{1}{2}\left( {\sum\nolimits_{i \ne j} {{Z_{ij}}} {E_{ij}}(T) - \sum\nolimits_{i = j} {{Z_{ij}}} {E_{ij}}(T)} \right) $ | (11) |
式(10)和式(11)中:Eij(T)是珠子i和珠子j在温度T下的相互作用能,Zij是配位数,V是单个珠子的体积,R是气体常数。每个珠子之间计算得到的相互作用参数aij如表 1所示。
| A | S | EO | EOH | W | |
| A | 78 | ||||
| S | 80.4 | 78 | |||
| EO | 117.1 | 102.8 | 78 | ||
| EOH | 117.0 | 97.8 | 78.8 | 78 | |
| W | 137.0 | 104.3 | 48.5 | 65.4 | 78 |
在DPD模拟系统中,
|
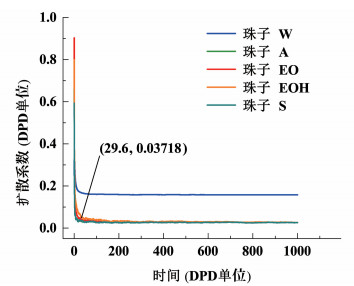
| 图 3 10 mmol·L-1的S-10表面活性剂溶液模拟扩散曲线 Fig.3 Diffusion curves of beads of S-10 with the increasing simulation steps at 10 mmol·L-1 |
| |
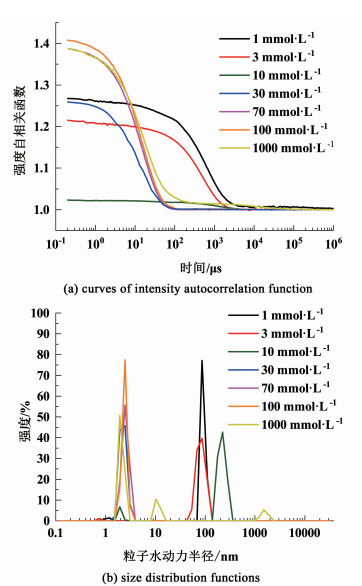
胶束大小一般在纳米级,DLS可以检测其粒径分布。由于S-4在水中溶解度低于临界胶束浓度,所以只测定不同浓度下S-10和S-30的粒径分布。选取具有代表性的浓度:1、3、10、30、70、100、1 000 mmol·L-1,得到强度-粒子水动力半径和强度自相关函数-时间如图 4和图 5。
|
| 图 4 不同浓度的S-10溶液的DLS数据 Fig.4 DLS data of S-10 at different concentrations |
| |
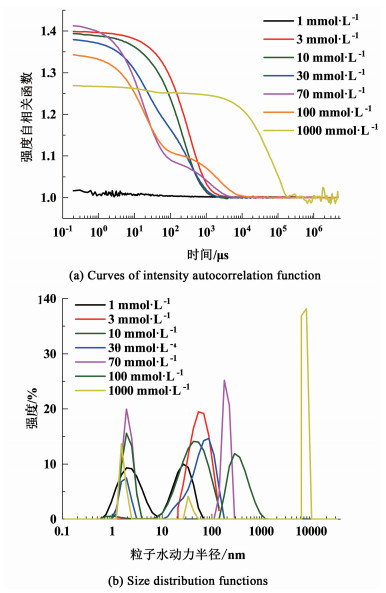
|
| 图 5 不同浓度的S-30溶液的DLS数据 Fig.5 DLS data of S-30 at different concentrations |
| |
参照动态光散射仪给出的测量原理,由强度自相关函数公式(12)可知,随着时间的增加,光强自相关函数衰减得越快意味着扩散系数越大,由公式(13)可知,扩散系数与粒径成反比。因此,快速衰减的函数意味着大的扩散系数,意味着散射系统中小粒子居多,反之则意味着颗溶液中是大颗粒居多。
| $ {g^2}(t) = 1 + \beta {e^{ - 2{D_{\rm{t}}}{q^2}t}} $ | (12) |
| $ {D_{\rm{t}}} = \frac{{{k_{\rm{B}}}T}}{{6{\rm{ \mathsf{ π} }}\eta {R_{\rm{h}}}}} $ | (13) |
式(12)和式(13)中:g2(t)是强度自相关值,q是散射矢量,和β一样是仪器的相关常量,t是时间,Dt是扩散系数,kB是玻尔兹曼常数、T是绝对温度,η是溶剂黏度(本研究中溶剂是水),Rh是粒子的水动力半径。如图 4(a)所示,当浓度为1~10 mmol·L-1时强度函数会随着时间的增加而缓慢下降,意味此时溶液中的大颗粒团簇居多;当浓度超过10 mmol·L-1时,强度系数随相关时间的增加而迅速衰减,说明此时系统中以小尺寸胶束为主,团簇几乎消失不见,这也说明S-10的CMC在10 mmol·L-1左右,自此浓度之后溶液中的粒径分布以小粒径胶束为主(2.5 nm左右)。从图 4(b)可以看出,当浓度小于10 mmol·L-1时,小颗粒的粒径基本在1 nm左右,这时的小颗粒基本是二聚体/三聚体,大颗粒团簇尺寸在100 nm左右;浓度超过10 mmol·L-1的时候,粒径主要分布在2.5 nm,此时的颗粒主体是球状胶束,随着浓度的增大胶束的粒径也随着增大;当浓度达到1 000 mmol·L-1时,虽然强度相关曲线下降迅速,但回归x轴所需时间最长,意味着存在大颗粒胶束,从图 4(b)中也可以明显看出,在该浓度下,出现了约2.5 nm、10 nm和1 500 nm的3个粒径分布峰,结合后文的DPD模拟图和TEM图来看,此时的2.5 nm峰应是小型的球状胶束,而10 nm应是球状胶束聚集而形成的稍大一些的球状胶束和棒状胶束,虽然没有直接观察到1 500 nm左右的胶束形貌,但推测应是大颗粒团簇。
S-30的强度-粒子水动力半径曲线和强度自相关系数-时间曲线如图 5(a)和5(b)所示。与S-10的窄峰不同,S-30的强度-半径分布峰较宽,粒径均一性不高,这表明表面活性剂分子在S-30溶液中具有复杂的聚集状态,这也妨碍找到S-30的CMC。从图 5(b)可以看出,在1 000 mmol·L-1处出现半径在2、200和6 000 nm左右的粒子,说明S-30溶液中也是球状胶束和棒状胶束共存的情况,DPD模拟和TEM图同样也验证了这一点,同样也可能存在个别的大颗粒团簇。
2.2 DPD模拟和透射电子显微镜分析胶束形貌DLS结果表明,S表面活性剂的聚集状态随浓度的增加而变化,为了进一步了解胶束的聚集规律和机理,采用耗散粒子动力学模拟的方法研究了不同浓度下S-10和S-30水溶液的胶束聚集状态。为了便于观察,隐藏W、EO和EOH珠子并将模拟单元用5%和10%的阴影填满,绿色的珠子代表A珠子;黄色的珠子代表S珠子,模拟浓度为20、200、1 000和2 000 mmol·L-1的S-10和S-30溶液。
以S-10为例,分析了不同浓度下的胶束形态,如图 6(a)~图 6(d)所示。6(a)当浓度为20 mmol·L-1时,球状胶束与多聚体共存。6(b)当浓度增加到200 mmol·L-1时,由于单位体积表面活性剂数量的增加,导致分子纠缠在一起,系统中只存在球状胶束。6(c)当浓度增加到1 000 mmol·L-1时,球状胶束与棒状胶束共存,因为聚集数相同时棒状胶束相比于球状胶束可以减小与水分子的接触面积,具有更小的接触面、更低的能量和更高的热力学稳定性,所以部分球状胶束聚集成棒状胶束。6(d)当浓度增加1倍至2 000 mmol·L-1时,体系中只存在棒状胶束,棒状胶束的长度也明显增加。S-30也表现出几乎相同的胶束转化过程,与S-10溶液的不同之处在于,当浓度为2 000 mmol·L-1时,S-30水溶液中的胶束仍处于球棒状胶束共存状态且球状胶束为多数。

|
| 图 6 S-10溶液的胶束形貌 Fig.6 Micelle morphologies in S-10 solution |
| |
图 6(e)、图 6(f)和图 7(e)、图 7 (f)分别是200和1 000 mmol·L-1浓度下S-10和S-30溶液的TEM图像,其中S、R、GS和GR分别代表球状胶束、棒状胶束、聚集中球状胶束和聚集中棒状胶束。从图 6和图 7中可以观察到直径约为5 nm的球状胶束,与DLS的结果一致;且小的球状胶束相互吸引,聚集成较大的球状胶束。从图 6(e)可以看出,随着浓度的增加,球状胶束的直径明显增大,然后一些球状胶束的亲水外壳层坍塌,疏水基构成的核心相互吸引形成棒状胶束。这在S-30的溶液中也可以看到,由于S-30表面活性剂分子的EO段较长,形成了较大的球状胶束和较粗的棒状胶束。这些胶束的形态与DPD模拟的结果一致。
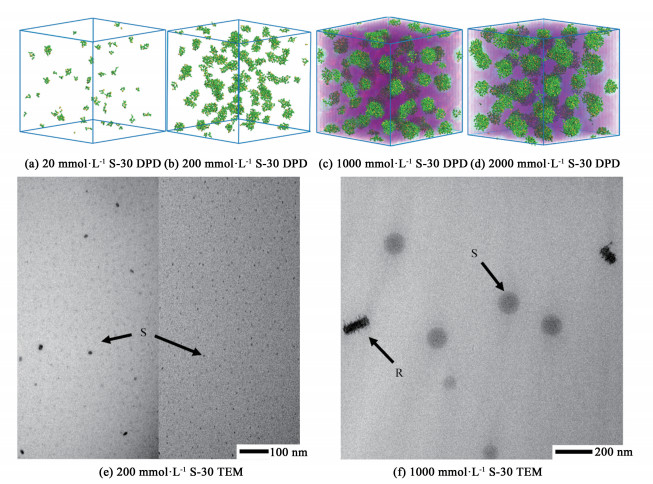
|
| 图 7 S-30溶液的胶束形貌 Fig.7 Micelle morphologies in S-30 solution |
| |
由于S-10的亲水性基团大小适中,所以S-10形成的胶束形状具有代表性,高浓度下的胶束形成过程可以帮助我们理解表面活性剂分子在溶液中的聚集行为,故以2 000 mmol·L-1的S-10溶液为例观察20 000步内的分子自组装过程。如图 8所示,当模拟步数在500步之后,截取X、Y和Z轴上的0.5~1.0部分以便于观察。图 8(a)在0步时,表面活性剂分子以单体的形式随机分布在溶液中,在与水分子的相互作用下开始自组装过程。图 8(b)在500步时,表面活性剂分子的疏水基在水珠子的排斥力和自身的相互吸引力下开始聚集成球状胶束。图 8(c)在2 000步时,表面活性剂分子聚集成球状胶束,但并不稳定。球状胶束核心外层的疏水基团相互吸引和融合,转变为棒状胶束。图 8(d)在20 000步时,棒状胶束的尺寸变得更大,更稳定存在。
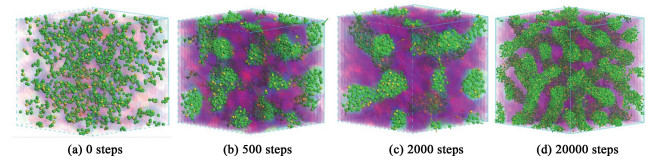
|
| 图 8 2 000 mmol·L-1的S-10溶液在不同时间的胶束形态 Fig.8 Micellar morphology in S-10 solution at 2 000 mmol·L-1 at different times |
| |
表面活性剂分子在水-气界面上的聚集行为与溶液内部有所不同,但它深刻地影响表面活性剂的表面活性,决定了表面活性剂的应用。表面张力的计算通常是通过对跨越2个分离部分的界面上正切应力和正切应力的差值进行积分,根据Groot等[28]和Irving等[29]的研究,通过公式(14)可以得到DPD模拟中的无量纲界面张力。
| $ {\gamma _{{\rm{DPD}}}} = \int {\left\{ {{{\bar p}_{xx}}(\bar x) - \frac{1}{2}\left[ {{{\bar p}_{yy}}(\bar x) + {{\bar p}_{zz}}(\bar x)} \right]} \right\}} {\rm{d}}\bar x $ | (14) |
式(14)中:pxx(x),pyy(x),pzz(x)是应力张量沿X轴的对角元,实际表面张力可按式(15)计算。
| $ \gamma = \frac{{{k_{\rm{B}}}T}}{{R_{\rm{c}}^2}}{\gamma _{{\rm{DPD}}}} $ | (15) |
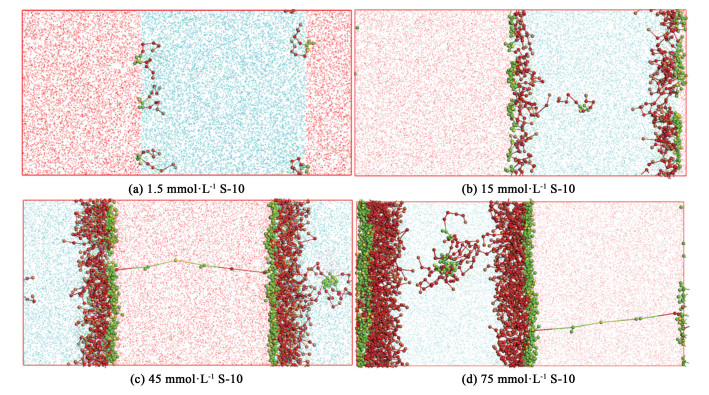
式(15)中:kB代表玻尔兹曼常数,T代表绝对温度,Rc是截止半径。根据式(14),首先需要得到应力张量沿X轴的对角元。模拟系统在1个40×20×20的模拟单元进行以确保水-气界面垂直于X轴,珠子总数为48 000个,保证W珠子与N珠子的数量比是1 ∶1,表面活性剂珠子数根据浓度设置。以15 mmol·L-1的S-10模拟系统为例,S-10分子与水分子的数量比为0.027 ∶100,由于1个S-10分子由2个EOH珠子、8个EO珠子、4个A珠子、1个S珠子共15个珠子组成,3个水分子组成1个1个W珠子,所以最后模拟系统的W珠子、N珠子、S-10的总珠子个数比为33.333 ∶33.333 ∶0.405。表面活性剂在水-气界面的分布如图 9所示,从图 9中可以看出疏水性基团插入到空气中,亲水性基团插入到水中。随着浓度的增加,表面活性剂在水气界面的吸附趋于饱和,如图 9(b)所示。过量的表面活性剂分子不易继续吸附在界面上,只能存在于水相中;随着浓度的进一步增加,单体聚集形成二聚体/三聚体甚至球状胶束。
|
| 图 9 不同浓度水-气界面S-10形貌 Fig.9 Morphology of S-10 in water-air interface at different concentrations |
| |
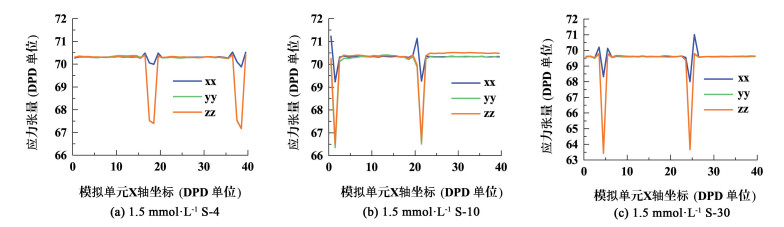
图 10(a)、图 10 (b)和图 10 (c)分别是溶液浓度为1.5 mmol·L-1的S-4、S-10、S-30溶液的应力张量图。由DPD模块模拟结果可以得到3者应力张量沿X轴方向的对角元原始数据,根据式(14)将其用Origin软件画图并积分可得DPD模拟中的无量纲界面张力γDPD,然后将计算得到的γDPD代入式(15),可以得到DPD模拟的表面张力,1.5 mmol·L-1浓度下的S-4、S-10、S-30用DPD模拟得到的表面张力分别为32.505、37.726和43.833 mN·m-1。根据此方法,将所有浓度下的S-4、S-10、S-30溶液进行DPD模拟,然后计算出DPD模拟表面张力,并与实验测量得到的表面张力作对比。DPD模拟表面张力和实验测量表面张力如表 2所示,其中Δγ是DPD表面张力和实验表面张力差值的绝对值。
|
| 图 10 1.5 mmol·L-1 S-4、S-10的应力张量 Fig.10 Stress tensor diagram of 1.5 mmol·L-1 S-4 and S-10 |
| |
| 浓度/(mmol·L-1) | S-4 | S-10 | S-30 | ||||||||
| γ | γexp | Δγ | γ | γexp | Δγ | γ | γexp | Δγ | |||
| 0 | 67.079 | 71.41 | 4.331 | ||||||||
| 0.75 | 48.659 | 38.52 | 10.139 | 52.993 | 38.84 | 14.153 | 56.244 | 43.07 | 13.174 | ||
| 1.50 | 32.505 | 32.71 | 0.205 | 37.726 | 35.74 | 1.986 | 43.833 | 40.71 | 3.123 | ||
| 3.00 | 32.308 | 30.31 | 1.998 | 27.679 | 32.88 | 5.201 | 41.764 | 36.55 | 5.214 | ||
| 15.00 | NA | NA | NA | 29.354 | 29.28 | 0.074 | 36.832 | 31.96 | 4.872 | ||
| 45.00 | NA | NA | NA | 37.627 | 29.67 | 7.957 | 22.359 | 32.03 | 9.671 | ||
当溶液浓度为0 mmol·L-1,即为水的表面张力,如表 2所示,DPD模拟得到的水-气界面处表面张力和实验测量值相差约4 mN·m-1,这是合理的,因为实际空气中除了78%的氮气外,还有其他气体存在。对比3种表面活性剂不同浓度下的模拟表面张力和实验表面张力,DPD模拟的结果与实验的结果基本一致,说明用DPD来预测此类表面活性剂的界面张力是可行的;但在S-10的DPD模拟结果中,45 mmol·L-1的溶液表面张力反而大于15 mmol·L-1的溶液表面张力,结合模拟结果和对角元数据来看得知这是由于模拟所用的单元体积有限,产生的胶束会对水-气界面处产生作用力,引起界面应力的变化;在浓度较低时(0.75 mmol·L-1)时DPD模拟表面张力与实验表面张力值相差较大。由此可知,使用DPD模拟可以对表面活性剂溶液在常温常压下的表面张力进行很好的预测,受限于计算机硬件水平不能使用更大的模拟单元而导致当溶液浓度增大到CMC之后的模拟结果不太准确,有所局限性,在浓度较低或较高时跟实际测量值还是有偏差。
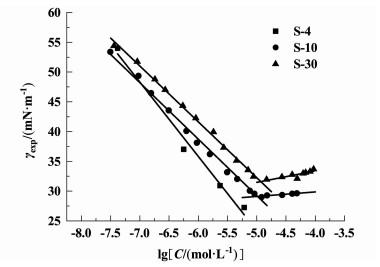
通过比较相同浓度下S-4、S-10、S-30的表面张力可知,随着亲水性基团的增加,表面活性剂的润湿性变差。使用Kruss的K100C表面张力仪测量并用Origin制作出γexp-lgC的曲线,如图 11所示。可以看出,S-4由于在水中的溶解度过低而没有达到CMC,S-10和S-30的CMC分别为10.56和11.9 mmol·L-1,与Musselman[24]测得的10.5和11.2 mmol·L-1基本一致,与本研究的DLS结果相吻合。对图 11 CMC前的数据进行拟合,得到拟合方程,斜率表示表面活性剂降低水表面张力的能力(dγ/d(lgC)),换算成公式(16)中dγ/d(lnC) 即可计算吸附容量Γ和表面活性剂分子在溶液表面积A;S-4、S-10、S-30的斜率分别为-12.475 76、-9.864 45、-9.227 35。吸附容量Γ和表面活性剂分子在溶液表面积A可以表示用方程式(16)和式(17)[30]计算得到,计算结果如表 3所示。
| $ \frac{{ - {\rm{d}}\gamma }}{{RT}} = \mathit{\Gamma }{\rm{d}}(\ln C) $ | (16) |
| $ A = \frac{1}{{\mathit{\Gamma }{N_{\rm{A}}}}} $ | (17) |
|
| 图 11 S-4、S-10和S-30的表面张力随浓度增加的曲线 Fig.11 The curves of surface tension of S-4, S-10 and S-30 with the increase of concentration |
| |
| 表面活性剂 | 10-6Γ/(mol·m-2) | A/nm2 |
| S-4 | 2.186 49 | 0.759 7 |
| S-10 | 1.733 78 | 0.958 1 |
| S-30 | 1.621 80 | 1.024 3 |
式(16)和(17)中:NA是阿伏伽德罗常数。可以看出,随着EO段的增加,S-4、S-10和S-30的分子在最大吸附时间时的表面积随之增大,也就意味着当界面吸附饱和时,界面可以吸附的表面活性剂分子数量更少,界面张力更高,润湿性更差。S表面活性剂具有相同的疏水基团,但聚环氧乙烷链长度不同,聚环氧乙烷链越长,表面吸附容量越小,分子表面积越大,这表明聚环氧乙烷链不是完全直的或完全卷曲的结构。可以确定S表面活性剂的EO段在水中呈无序、多向分布。DPD结果也证实了这一点。
3 结论本研究采用实验和DPD模拟相结合的方法,研究了非离子Gemini表面活性剂S-10和S-30在水溶液中的聚集行为。我们发现,在S-10和S-30水溶液中,低浓度的单体-二聚体/三聚体-团簇共存。随着浓度的增加,疏水基相互吸引,形成以疏水基为核,亲水基为壳的球状胶束,防止水分子进入核;随着浓度的增加,球状胶束的尺寸增大,当球状胶束增长到一定程度时,它们就变得不稳定,壳层就会崩溃。核中的疏水基团相互吸引,形成热力学上更稳定的棒状胶束,这一现象已被DLS和TEM直接证实。在水-气界面,DPD模拟的表面张力值与实验值一致。发现分子截面积随亲水性基团的增加而增大。这也证明了S表面活性剂的亲水基在水中并不是完全直线或完全卷曲的定向结构,而是一种无序、多样的定向分布。
| [1] |
NIEH M P, KUMAR S K, FERNANDO R H, et al. Effect of the hydrophilic size on the structural phases of aqueous nonionic Gemini surfactant solutions[J]. Langmuir: The ACS Journal of Surfaces and Colloids, 2004, 20(21): 9061-9068. DOI:10.1021/la0494831 |
| [2] |
SCHRAMM L L. Surfactants[M]. Cambridge: Cambridge University Press, 2000.
|
| [3] |
GODDARD E D. Polymer/surfactant interaction: Interfacial aspects[J]. Journal of Colloid and Interface Science, 2002, 256(1): 228-235. DOI:10.1006/jcis.2001.8066 |
| [4] |
YANG J. Viscoelastic wormlike micelles and their applications[J]. Current Opinion in Colloid & Interface Science, 2002, 7(5/6): 276-281. |
| [5] |
HOOGERBRUGGE P J, KOELMAN J M V A. Simulating microscopic hydrodynamic phenomena with dissipative particle dynamics[J]. Europhysics Letters (EPL), 1992, 19(3): 155-160. DOI:10.1209/0295-5075/19/3/001 |
| [6] |
GROOT R D, MADDEN T J. Dynamic simulation of diblock copolymer microphase separation[J]. The Journal of Chemical Physics, 1998, 108(20): 8713-8724. DOI:10.1063/1.476300 |
| [7] |
MA Y, WANG Y, DENG X, et al. Dissipative particle dynamics and molecular dynamics simulations on mesoscale structure and proton conduction in a SPEEK/PVDF-g-PSSA membrane[J]. RSC Advances, 2017, 7(63): 39676-39684. DOI:10.1039/C7RA07301A |
| [8] |
ZHEN L, LIU K, HUANG D, et al. Structure-property relationship of sulfosuccinic acid diester sodium salt micelles: 3D-QSAR model and DPD simulation[J]. Journal of Dispersion Science and Technology, 2016, 37(7): 941-948. DOI:10.1080/01932691.2015.1073601 |
| [9] |
BORNER A, PANERAI F, MANSOUR N N. High temperature permeability of fibrous materials using direct simulation Monte Carlo[J]. International Journal of Heat and Mass Transfer, 2017, 106: 1318-1326. DOI:10.1016/j.ijheatmasstransfer.2016.10.113 |
| [10] |
ARAI N, YASUOKA K, MASUBUCHI Y. Spontaneous self-assembly process for threadlike micelles[J]. The Journal of Chemical Physics, 2007. DOI:10.1063/1.2747240 |
| [11] |
KHEDR A, STRIOLO A. DPD parameters estimation for simultaneously simulating water-oil interfaces and aqueous nonionic surfactants[J]. Journal of Chemical Theory and Computation, 2018, 14(12): 6460-6471. DOI:10.1021/acs.jctc.8b00476 |
| [12] |
VISHNYAKOV A, LEE M T, NEIMARK A V. Prediction of the critical micelle concentration of nonionic surfactants by dissipative particle dynamics simulations[J]. The Journal of Physical Chemistry Letters, 2013, 4(5): 797-802. DOI:10.1021/jz400066k |
| [13] |
CAO X, XU G, LI Y, et al. Aggregation of poly(ethylene oxide)-poly(propylene oxide) block copolymers in aqueous solution: DPD simulation study[J]. The Journal of Physical Chemistry A, 2005, 109(45): 10418-10423. DOI:10.1021/jp053636r |
| [14] |
ZHOU G, GAO M, DENG X, et al. A mesoscopic DPD simulation study on long chain quaternary ammonium gemini surfactant solution[J]. Journal of Dispersion Science and Technology, 2020, 42(1): 58-66. DOI:10.1080/01932691.2019.1661852 |
| [15] |
TAN H, WANG Z, LI J, et al. An approach for the sphere-to-rod transition of multiblock copolymer micelles[J]. ACS Macro Letters, 2013, 2(2): 146-151. DOI:10.1021/mz3005583 |
| [16] |
SATO S, KISHIMOTO H. Thermodynamic and viscometric studies on the solution state of surfynol 465 in water[J]. Bulletin of the Chemical Society of Japan, 1985, 58(1): 282-287. DOI:10.1246/bcsj.58.282 |
| [17] |
SATO S, KISHIMOTO H. Osmotic and activity coefficients of a nonionic surfactant, surfynol 465, at its higher concentrations in water[J]. Journal of Colloid and Interface Science, 1988, 126(1): 108-113. DOI:10.1016/0021-9797(88)90105-1 |
| [18] |
SATO S, KISHIMOTO H. Enthalpic studies on the formation and interaction of micelles of a nonionic, surfynol 465[J]. Journal of Colloid and Interface Science, 1988, 123(1): 216-223. DOI:10.1016/0021-9797(88)90237-8 |
| [19] |
SATO S, KISHIMOTO H. Behavior of nonionic surfactant, surfynol 465, in aqueous media[M]. Boston, MA: Springer US, 1989: 341-357.
|
| [20] |
SATO S. Micellar behavior of a nonionic surfactant, surfynol 465, from carbon-13 NMR resonance frequencies in water-d2[J]. The Journal of Physical Chemistry, 1989, 93(12): 4829-4833. DOI:10.1021/j100349a030 |
| [21] |
SATO S, ASAI N, YONESE M. Formation of colloidal silver in the presence of a nonionic surfactant, Surfynol 465[J]. Colloid and Polymer Science, 1996, 274(9): 889-893. DOI:10.1007/BF00654748 |
| [22] |
SATO S, TODA K, ONIKI S. Kinetic study on the formation of colloidal gold in the presence of acetylenic glycol nonionic surfactant[J]. Journal of Colloid and Interface Science, 1999, 218(2): 504-510. DOI:10.1006/jcis.1999.6443 |
| [23] |
SATO S. Raman scatterings of colloidal silver and gold prepared in the presence of a nonionic surfactant, Surfynol 465[J]. Colloid and Polymer Science, 1996, 274(12): 1161-1169. DOI:10.1007/BF00655687 |
| [24] |
MUSSELMAN S W, CHANDER S. Wetting and adsorption of acetylenic diol based nonionic surfactants on heterogeneous surfaces[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2002, 206(1/2/3): 497-513. |
| [25] |
GROOT R D, WARREN P B. Dissipative particle dynamics: Bridging the gap between atomistic and mesoscopic simulation[J]. The Journal of Chemical Physics, 1997, 107(11): 4423-4435. DOI:10.1063/1.474784 |
| [26] |
GROOT R D. Mesoscopic simulation of polymer-surfactant aggregation[J]. Langmuir, 2000, 16(19): 7493-7502. DOI:10.1021/la000010d |
| [27] |
BLANCO M. Molecular silverware. I. General solutions to excluded volume constrained problems[J]. Journal of Computational Chemistry, 1991, 12(2): 237-247. DOI:10.1002/jcc.540120214 |
| [28] |
GROOT R D, RABONE K L. Mesoscopic simulation of cell membrane damage, morphology change and rupture by nonionic surfactants[J]. Biophysical Journal, 2001, 81(2): 725-736. DOI:10.1016/S0006-3495(01)75737-2 |
| [29] |
MAITI A, MCGROTHER S. Bead-bead interaction parameters in dissipative particle dynamics: Relation to bead-size, solubility parameter, and surface tension[J]. The Journal of Chemical Physics, 2004, 120(3): 1594-1601. DOI:10.1063/1.1630294 |
| [30] |
MITTAL K L, SHAH D O. Adsorption and aggregation of surfactants in solution[M]. Marcel Dekker, 2003. DOI:10.1201/9780203910573
|
 2022, Vol. 39
2022, Vol. 39





