慢性伤口因慢性疾病、营养不足、细菌感染等因素不遵循自然的愈合过程而延长了愈合时间[1]。因此,预防和治疗慢性伤口是当代医学最重要的挑战之一。在慢性伤口中,毛细管渗漏、患者淋巴系统衰竭或水肿会导致伤口渗出液过多。渗出液过多会导致伤口周围的健康皮肤组织浸软并抑制伤口愈合。此外,慢性伤口渗出液中组织破坏性蛋白酶水平相对较高,因此腐蚀性更高。渗出液引起的气味和污渍也会对患者的整体健康和生活质量产生负面影响[2-3]。因此,理想伤口敷料的一个关键特点是在保持伤口湿润的同时除去多余的渗出物。根据这一特点,人们开发了水胶体[4-6]、水凝胶[7-9]和泡沫[10-12]等亲水性聚合物敷料用以促进伤口愈合。亲水性聚氨酯泡沫(PUFs)因其具有高吸水性、稳定性、柔软性、柔韧性和低细胞毒性[11, 13-15]而在伤口处理方面备受关注。
尽管敷料在伤口与环境之间起到了物理屏障的作用,但是伤口还会受到致病菌的感染,如变形杆菌、大肠杆菌和金黄色葡萄球菌等,对伤口愈合过程不利,如处理不当甚至会引起细胞炎症和败血症等致命病症。为了达到良好的杀菌效果,和保持伤口长期无菌愈合环境,则要求敷料能够在初期突释抗菌药物,快速杀死病变伤口处的细菌,随后长期释放,维持有效抑菌水平[1]。然而,亲水性聚合物能够快速吸收伤口分泌物,导致抗生素的突释,随着抗生素在伤口处浓度减小,抑菌效果会降低,当药物浓度低于最小抑菌浓度时细菌便会出现抗药性[16]。因此,为了满足控制伤口感染的要求,人们试图通过将药物负载到聚合物微球,然后将其载入敷料基体中[17],或者将药物与聚合物骨架形成可水解的共价键以实现药物缓释的目的[18, 19]。然而,这些制备方法较为复杂,不利于投入生产。
因此,本研究制备一种负载亲水性药物硫酸庆大霉素和疏水性药物环丙沙星的亲水性聚氨酯泡沫敷料,以快速释放亲水性药物,长期释放疏水性药物,从而保持有效药物浓度。分别对材料的形貌、机械力学性能、理化性能进行表征。以大肠杆菌为代表的革兰氏阴性菌和以金黄色葡萄球菌为代表的革兰氏阳性菌为模型研究载药泡沫的抗菌性;采用CCK-8法研究泡沫材料对小鼠胚胎成纤维细胞(3T3)的细胞毒性。
1 实验部分 1.1 实验试剂聚乙二醇(PEG2000,Mn=2000)、甘油、甲苯二异氰酸酯(TDI80)、泊洛沙姆L45,上海阿拉丁生化科技股份有限公司;硅油L580,迈图高新材料有限公司;硫酸庆大霉素(GS)、环丙沙星(Cip),天津市江天化工技术股份有限公司。
1.2 合成方案合成方案如图 1所示。
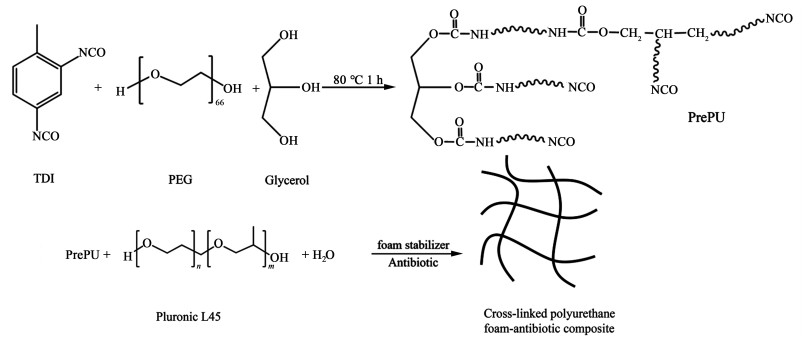
|
| 图 1 PUFs的合成方案 Fig.1 Synthetic scheme of PUFs |
| |
将已除水的PEG2000和甘油的混合物(物质的量之比为3 ∶4)加入装有机械搅拌的三口瓶中,在氮气保护下升温至80 ℃后加入TDI80,在搅拌下反应到—NCO含量达到理论值(质量分数为10%)时停止反应,得到亲水性聚氨酯预聚体(PrePU)。通过二正丁胺法来测定预聚物中—NCO含量。
1.2.2 载药亲水性聚氨酯泡沫的制备载药亲水性聚氨酯泡沫通过手工发泡小规模制备。将泊洛沙姆L45(质量分数为25%)、硅油L580(质量分数为10%)和抗生素(质量分数为5%)分散在蒸馏水中搅拌均匀制备出水相混合物;然后在室温下将PrePU加入水相混合物中(质量比为1 ∶1,下同)并剧烈搅拌约10 s。将发起的泡沫放入80 ℃烘箱中,烘干,分别得到含有Cip、GS和Cip/GS(1 ∶1)的聚氨酯泡沫敷料PUF-G、PUF-C和PUF-CG。PUFs为未载药和载药聚氨酯泡沫的统称。
1.3 性能表征 1.3.1 傅里叶变换红外光谱(FT-IR)采用Bio-Rad FT-IR 3000型傅里叶红外光谱仪测定泡沫和预聚体中的特征峰。测试条件为室温,测试波数范围为4 000~450 cm-1,扫描次数为32次。
1.3.2 场发射扫描电镜(SEM)泡沫的表面形貌通过场发射扫描电子显微镜(SEM,S4800)表征。每个样品喷金100 s,在15 kV的加速电压下进行扫描。使用ImageJ软件测量泡沫孔径分布。
1.3.3 液体吸收率泡沫液体吸收率根据YY/T 0471.1—2004中描述的进行测定。将干燥样品称质量W0,然后将样品浸入PBS(pH=7.4)中30 min,用镊子取出样品悬空静置30 s,称质量W1。液体吸收率(LA)计算公式如式(1)。
| $ {\rm{LA}} = ({W_1} - {W_0})/{W_0} $ | (1) |
泡沫的保水率评价方法是通过将吸收液体后的样品放置于多孔金属板上,对样品施加一定压缩强度(5.33 kPa)进行的[12]。施加压力使未结合的液体流出,保持20 s后重新称质量W2。保水率(LR)计算公式如式(2)。
| $ {\rm{LR}} = ({W_2} - {W_0})/{W_0} $ | (2) |
泡沫水蒸气透过率(MVTR)根据YY/T 0471.2—2004中描述的进行测定。将圆形样品覆盖在装有20 mL水的圆柱形实验容器(开孔面积为10 cm2)的凸缘上,夹紧样品并称质量W0。随后放入37 ℃的鼓风干燥箱中保温24 h,取出后重新称质量W1。水蒸气透过率(MVTR)计算公式如式(3)。
| $ {\rm{MVTR}} = ({W_0} - {W_1}) \times 1000 $ | (3) |
泡沫的拉伸性能是在25 ℃下通过电子万能试验机(WDW-05L)测定。拉伸强度测试速度为100 mm ·min-1。弹性模量由形变为5%时的应力应变曲线的斜率计算得出。
1.3.7 透射电子显微镜(TEM)采用透射电子显微镜(JEM-1400 Flash)观察水相中环丙沙星的形貌。制样方法:将含1.0 mg ·mL-1的环丙沙星水相混合物滴在铜网上,放置48 h除去水分。
1.3.8 体外药物释放将载药PUF浸泡在装有40 mL的PBS (pH值为7.4)的离心管中,置于37 ℃及100 r ·min-1的恒温震荡箱中;在一定的时间点取出4.0 mL的释放液,并用同体积的PBS代替。采用茚三酮显色反应测定释放液中GS浓度。采用紫外分光光度计在270 nm处测定Cip浓度。
1.3.9 体外抑菌性能用琼脂扩散法和摇瓶法研究载药泡沫对大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)的抗菌活性[13]。琼脂扩散法是将样品放置在涂有细菌悬浊液的营养琼脂板上,培养24 h后,测量每个样品周围的抑菌圈。因此,将泡沫切成直径为10 mm的圆柱体,放置在含有1×107 CFU大肠杆菌或黄色葡萄球菌的琼脂板上。在37 ℃培养24 h,拍照测量抑菌圈直径。
在摇瓶法中,样品的抗菌活性通过测定OD值来定量评价。将样品在37 ℃的PBS中分别浸泡1和3 d。将取出的样品放入含有5 mL营养液和1×107 CFU大肠杆菌或金黄色葡萄球菌的离心管中。将离心管放入37 ℃的培养箱中以100 r ·min-1的速度震荡培养24 h。然后取100 μL细菌溶液用酶标仪在600 nm吸光度下测量OD值。含有细菌但没有样品的为对照组。
1.3.10 溶血实验采用新西兰大耳白兔抗凝全血对PUFs进行溶血试验。将2 mL的抗凝全血与8 mL的无菌PBS混合,以250×g离心15 min后,弃去上层液体,将下层红细胞用无菌PBS洗涤至上层清液为无色。将1 mL红细胞与9 mL无菌PBS混合形成红细胞悬液。1 mg样品与1 mL红细胞悬液混合作为实验组,1 mL的红细胞悬液作为阴性对照组,0.1 mL红细胞和0.9 mL的无菌蒸馏水为阳性对照组。37 ℃孵育1 h后,将实验组与对照组2 000×g离心15 min,吸取上层清液于96孔板中,用酶标仪测量540 nm波长的吸光度,溶血率(Hemolysis ratio)计算公式如式(4):
| $ {\rm{Hemolysis}}\;{\rm{ratio}} = \frac{{{\rm{O}}{{\rm{D}}_{{\rm{sample}}}} - {\rm{O}}{{\rm{D}}_{{\rm{negative}}}}}}{{{\rm{O}}{{\rm{D}}_{{\rm{positive}}}} - {\rm{O}}{{\rm{D}}_{{\rm{negative}}}}}} \times 100\% $ | (4) |
式(4)中:ODsample、ODnegative和ODpositive分别为样品、阴性对照组和阳性对照组的OD值。
1.3.11 细胞毒性实验采用小鼠胚胎成纤维细胞(3T3)对PUFs进行细胞毒性试验[20]。将细胞培养悬浮于含有10%胎牛血清(FBS)、硫酸青霉素(100 units ·mL-1)和链霉素(100 μg ·mL-1)的Dulbecco改良的Eagle培养基(DMEM,GIBCO)中。将0.5 mL包含1×105细胞悬液接种到24孔板中,进一步在37 ℃、5%的潮湿CO2培养箱中培养24 h。随后向每个孔中加入2 mL新鲜培养液。将泡沫切成50 mg立方块,经紫外线灭菌后加入每个孔中。将培养板在37 ℃孵育24 h,然后将泡沫和培养基取出,并将含有50 μL CCK-8试剂的0.5 mL完全生长培养基添加到平板的每个孔中。进一步孵育4 h后,用多功能酶标仪(Varioskan Flash,Thermo Scientific)测定450 nm波长的吸光度。含PBS的细胞作为对照组,每组设置3个平行样品。细胞存活率(Cell viability)通过方程式(5)计算。
| $ {\rm{Cell}}\;{\rm{viability}} = {\rm{OD}}/{\rm{O}}{{\rm{D}}_0} $ | (5) |
式(5)中:OD是样品的吸光度值,OD0是空白对照的吸光度值。
2 结果与讨论 2.1 材料评估图 2为PrePU和PUFs的红外光谱图。
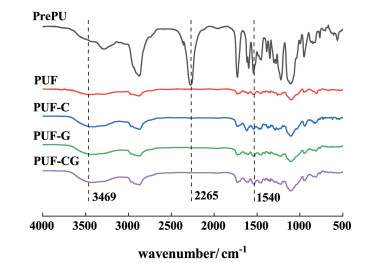
|
| 图 2 PrePU和PUFs的红外光谱图 Fig.2 FT-IR spectra of PrePU and PUFs |
| |
PrePU在2 265 cm-1处出现了—NCO的特征峰,PUFs在2 265 cm-1处没有—NCO的特征峰,这说明PrePU所含的—NCO反应完全,并可以预测材料没有细胞毒性。—NCO与水反应会生成脲基并产生CO2,因此在3 469和1 540 cm-1附近有—NH(氨基甲酸酯和脲基)的伸缩和弯曲振动峰。其中PUF-G和PUF-CG在1 540 cm-1处的峰相比于PUF略有增强,说明含有—NH2的GS有可能参与了反应。
图 3(a)~图 3(d)均显示了PUFs具有很好的开孔结构和聚氨酯软泡特征,孔径分布比较集中,其中未载药泡沫的平均孔径为286 μm,孔径在400~500 μm之间的大孔较多,而泡沫载药后,平均孔径均减小,且孔径在400~500 μm之间的大孔几乎消失。由于GS含有—NH2,而—NH2和—NCO的反应活性强于水和—NCO的反应活性,所以—NH2的存在减少了CO2的生成,从而降低了负载GS的PUFs的孔径;Cip含有的羧基会在一定程度上抑制—NCO与水的反应,降低了CO2生成速度,降低了体系内并泡现象的可能,从而降低了负载Cip的PUFs的孔径[21]。
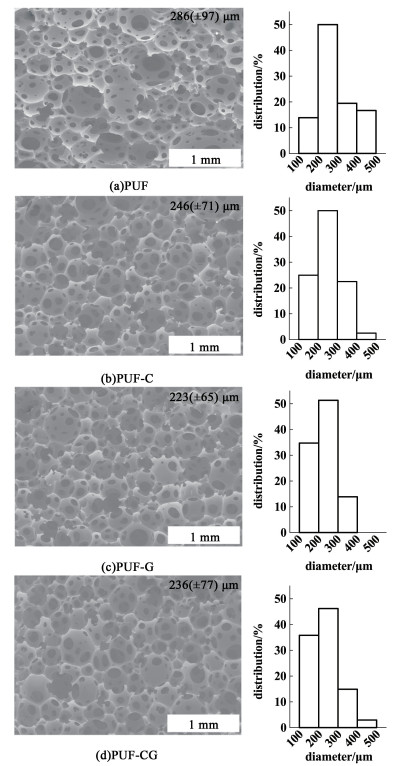
|
| 图 3 PUFs的SEM图、平均孔径和孔径分布图 Fig.3 SEM, average pore size and pore size distribution of PUFs |
| |
图 4显示了PUFs的吸液率、保水率和水蒸气透过率。
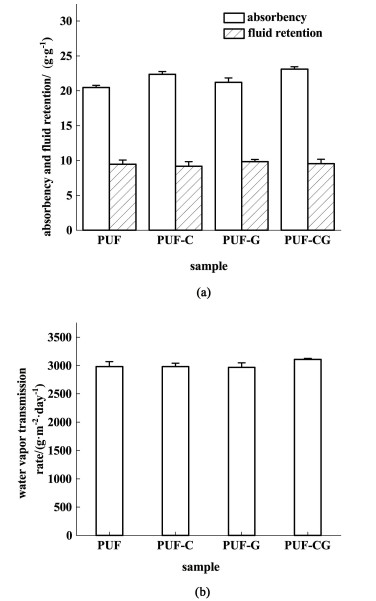
|
| 图 4 PUFs的(a)吸液率、保水率和(b)水蒸气透过率 Fig.4 (a) Absorbency, fluid retention and (b)water vapor transmission rate of PUFs |
| |
样品在PBS溶液中浸泡24 h后吸液倍率达到21 g ·g-1,保水率达到9 g ·g-1,WVTR为3 000 g ·m-2 ·d-1。泡沫的高吸液率和高保水率是由泡沫的化学和物理结构决定的。在化学组成上,泡沫的软段为聚乙二醇,有助于吸附水分子。在物理结构上,泡沫是由半封闭的泡孔组成的,在一定的外力作用下,部分水分子会被限制在泡孔中。载药泡沫的高吸收能力能够快速有效地吸收大量伤口渗出液,降低浸渍感染风险,高保水率能够保证在敷料吸收伤口渗出液后有效防止敷料中的液体因受到挤压而浸渍污染伤口周围皮肤。理想的伤口敷料的WVTR为2 000~2 500 g ·m-2 ·d-1,在这一标准下,载药敷料才既能够保持伤口湿润又可以有效防止伤口渗出液过量堆积在伤口处。如图 4(b)所示,PUFs的WVTR约为3 000 g ·m-2 ·d-1,比理想范围稍大。由此可以说明,载药聚氨酯泡沫将更适合应用于伤口渗出液较多的伤口。
图 5为PUFs的应力-应变曲线。用作伤口敷料的材料在使用过程中必须要表现出弹性、强度和韧性等机械性能。药物的载入对聚合物复合材料的力学性能产生了影响。
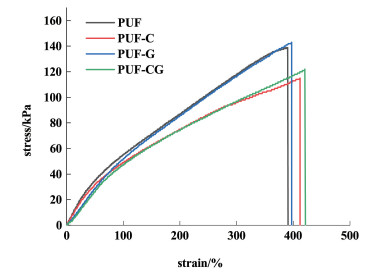
|
| 图 5 聚氨酯泡沫和载药聚氨酯泡沫的应力-应变曲线 Fig.5 Stress-strain curves of PUF and drug loaded PUFs |
| |
如图 5所示,未载药PUF的弹性模量为65 kPa,拉伸强度为140 kPa,断裂伸长率为390%(表 1)。对于负载疏水性药物的泡沫,其弹性模量和拉伸强度均有所下降,断裂伸长率提高,说明疏水性药物的加入在一定程度上降低聚氨酯泡沫的弹性和强度,提高了韧性。亲水性药物GS的载入同样降低了材料的弹性模量,但对材料的强度和韧性没有影响。
| 样品 | 弹性膜量/kPa | 拉伸强度/kPa | 断裂伸长率/% |
| PUF | 64.81(±6.03) | 136.41(±10.10) | 390.67(±33.32) |
| PUF-C | 58.30(±8.19) | 113.44(±6.78) | 442.31(±3.55) |
| PUF-G | 58.77(±1.86) | 133.41(±13.69) | 420.50(±36.52) |
| PUF-CG | 59.08(±6.44) | 125.08(±6.75) | 440.12(±32.90) |
图 6(a)为PUF-G和PUF-CG在PBS溶液(pH=7.4)中GS的释放行为曲线。图 6(b)为PUF-C和PUF-CG在PBS溶液(pH=7.4)中环丙沙星的释放行为曲线。
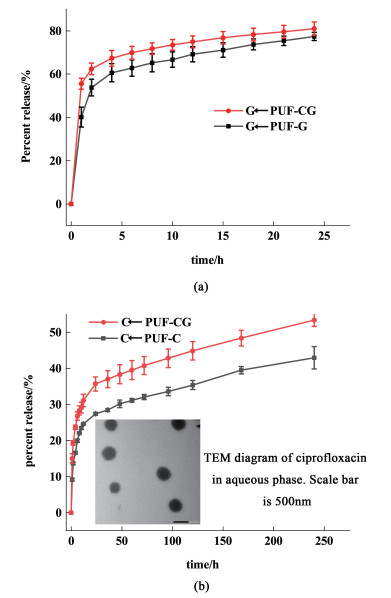
|
| 图 6 载药PUFs对(a) Cip和(b) GS的释放曲线 Fig.6 Release of (a) GS and (b) Cip from drug loaded PUFs |
| |
在前4 h,GS的释放量约为60%和65%,说明有突释现象发生;在1 d后,当GS的释放量超过75%后,继续延长时间,释放量几乎不再增加,这可能是因为在制备PUFs的过程中,小部分GS与预聚体发生了反应,导致药物不能够完全释放。
PUF-C和PUF-CG中的环丙沙星在第1 d里释放速度较快,分别释放了27.36%和35.68%。释放10 d后,约有42.8%和53.4%的环丙沙星分别从PUF-C和PUF-CG中释放出来,说明环丙沙星能够长期释放。因为在制备PUFs的过程中,疏水性环丙沙星在水相混合物中是被泊洛沙姆L45包裹着以微粒的形式存在[如图 6(b)],这将会延长环丙沙星的释放时间。GS和环丙沙星在PUF-CG中的释放速度均明显高于只载一种药物的泡沫,说明双负载药物下,一种药物的释放制造了释放通道,从而加速了另一种药物的扩散。
2.3 材料抗菌性能评估分别使用大肠杆菌和金黄色葡萄球菌作为革兰氏阴性菌和革兰氏阳性菌模型进行抗菌实验。采用琼脂扩散法检测载药聚氨酯泡沫对细菌生长的抑制作用。如图 7所示,未载药PUF对E. coli和S. auteus的生长没有抑制作用,而载药的PUFs周围有明显的抑菌圈。
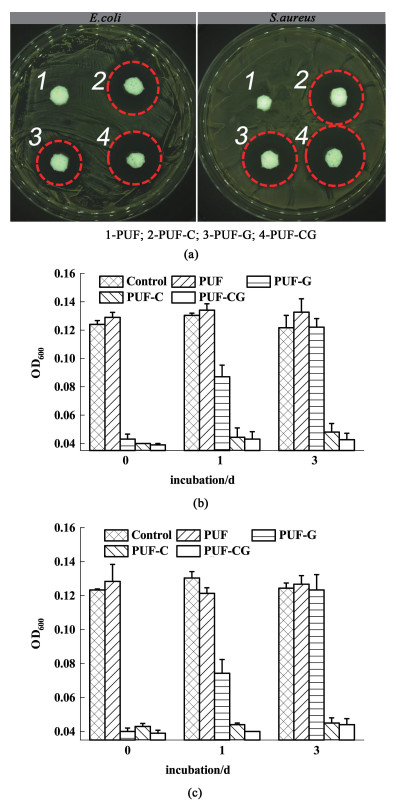
|
| 图 7 (a) 不同材料对大肠杆菌和金黄色葡萄球菌的抑菌圈实验;(b)在PBS中37 ℃释放0、1和3 d后的PUFs对大肠杆菌的抗菌性能;(c)在PBS中37 ℃释放0、1和3 d后的PUFs对金黄色葡萄球菌的抗菌性能 Fig.7 (a) Inhibition ring test against S. aureus and E. coli; (b) Antibacterial activity of PUFs against E. coli after being released in PBS at 37 ℃ for 0, 1 and 3 days; (c) Antibacterial activity of PUFs against S. aureus after being released in PBS at 37 ℃ for 0, 1 and 3 days |
| |
如表 2所示,PUF-CG对E. coli和S. aureus的抑菌圈直径都比负载单药的PUF大,这些结果说明负载双药的泡沫抗菌效果最好。这可能是因为在释放初期GS的释放速度很快,迅速形成的释放通道促进了Cip的释放,因而双负载抗生素的PUF的抑菌圈明显比另外2种负载单药的抑菌圈大。
| 样品 | E. coli | S. auteus |
| PUF | 0 | 0 |
| PUF-C | 23.80(±1.05) | 26.80(±0.62) |
| PUF-G | 22.00(±1.00) | 24.67(±1.56) |
| PUF-CG | 24.67(±1.52) | 28.17(±0.29) |
为了研究药物释放对细菌生长的抑制作用,在不同时间点从药物释放测试中回收的泡沫与细菌一起孵育后,检测细菌悬浊液的光密度。如图 7(b)所示,未载药的泡沫对细菌的生长没有抑制作用。未处理的载药PUF对2种菌种的生长有显著的抑制作用;释放1 d后,PUF-G抗菌效果明显降低,释放3 d后就不再有抑菌效果;PUF-C和PUF-CG在所有时间点均有显著的抑制细菌生长的效果。这些实验结果说明,亲水性药物在1 d内的累积释放量已经高达75%,环丙沙星能够持续释放。亲水性GS的突释可以在初期快速杀死病变伤口处的细菌,疏水性Cip的持续释放能够长期维持有效抑菌水平。
2.4 材料的生物安全性 2.4.1 材料的血液相容性溶血率是评价伤口敷料血液相容性的重要参数,材料的溶血率应低于5%。如图 8所示,PUF、PUF-C、PUF-G和PUF-CG的溶血率均远小于5%,符合伤口敷料的标准。因此,抗生素的加入并未影响材料的血液相容性。

|
| 图 8 PUFs的溶血率 Fig.8 Hemolysis ratio of PUFs |
| |
成纤维细胞在皮肤修复的炎症期起着至关重要的作用,它能够合成胶原并促进细胞外基质的形成。然而,在慢性伤口中,成纤维细胞的增殖期明显缩短。因此,需要生物相容性好的材料来减少对这些细胞的进一步损伤。以成纤维细胞(3T3)为细胞模型,对载药的聚氨酯泡沫的潜在细胞毒性进行了体外评价。如图 9所示,细胞的存活率均超过100%,说明材料没有毒性,并且有利于细胞生长。
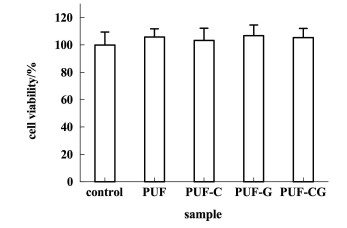
|
| 图 9 CCK-8法检测培养24 h后PUFs对3T3细胞的细胞毒性 Fig.9 Cell viability of 3T3 exposed to PUFs for 24 h by CCK-8 assay |
| |
一种有效的慢性伤口敷料需要在吸收过量渗出液的同时保持伤口湿润,减少细菌生长。在本研究中,我们成功制备了负载抗生素的PUFs,载药PUFs弹性韧性良好,呈开孔结构,泡沫孔径范围为200~400 μm,具有优异的吸液率和保水率以及适当的水蒸气透过率,能够及时吸收过量的渗出液,保持伤口湿润,防止浸渍影响伤口周围地正常皮肤组织;对于PUFs-CG,亲水性药物GS会在1 d内释放,疏水性药物环丙沙星会持续释放,使材料长期保持优异的抗菌能力。在抗菌能力很强的情况下,材料依旧能够保持良好的生物安全性。通过在PUF制备的过程中载入亲水和疏水性药物,可以构建出用于渗出液较多的伤口的具有可调节物理机械和功能特性的新型亲水性聚氨酯泡沫。
| [1] |
SKÓRKOWSKA-TELICHOWSKA K, CZEMPLIK M, KULMA A, et al. The local treatment and available dressings designed for chronic wounds[J]. Journal of the American Academy of Dermatology, 2013, 68(4): e117-e126. DOI:10.1016/j.jaad.2011.06.028 |
| [2] |
BOATENG J S, MATTHEWS K H, STEVENS H N E, et al. Wound healing dressings and drug delivery systems: A review[J]. Journal of Pharmaceutical Sciences, 2008, 97(8): 2892-2923. DOI:10.1002/jps.21210 |
| [3] |
EMING S A, MARTIN P, TOMIC-CANIC M. Wound repair and regeneration: Mechanisms, signaling, and translation[J]. Science Translational Medicine, 2014. DOI:10.1126/scitranslmed.3009337 |
| [4] |
TAKEUCHI T, ITO M, YAMAGUCHI S, et al. Hydrocolloid dressing improves wound healing by increasing M2 macrophage polarization in mice with diabetes[J]. Nagoya Journal of Medical Science, 2020, 82(3): 487-498. |
| [5] |
TAN W, ARULSELVAN P, NG S F, et al. Improvement of diabetic wound healing by topical application of Vicenin-2 hydrocolloid film on Sprague Dawley rats[J]. BMC Complementary and Alternative Medicine, 2019. DOI:10.1186/s12906-018-2427-y |
| [6] |
HIRANPATTANAKUL P, JONGJITPISSAMAI T, AUNGWEROJANAWIT S, et al. Fabrication of a chitin/chitosan hydrocolloid wound dressing and evaluation of its bioactive properties[J]. Research on Chemical Intermediates, 2018, 44(8): 4913-4928. DOI:10.1007/s11164-018-3344-x |
| [7] |
HAN L, WANG M, PRIETO-LÓPEZ L O, et al. Self-hydrophobization in a dynamic hydrogel for creating nonspecific repeatable underwater adhesion[J]. Advanced Functional Materials, 2020. DOI:10.1002/adfm.201907064 |
| [8] |
KAUR P, GONDIL V S, CHHIBBER S. A novel wound dressing consisting of PVA-SA hybrid hydrogel membrane for topical delivery of bacteriophages and antibiotics[J]. International Journal of Pharmaceutics, 2019. DOI:10.1016/j.ijpharm.2019.118779 |
| [9] |
PANG Q, ZHENG X, LUO Y, et al. A photo-cleavable polyprodrug-loaded wound dressing with UV-responsive antibacterial property[J]. Journal of Materials Chemistry B, 2017, 5(45): 8975-8982. DOI:10.1039/C7TB01696D |
| [10] |
王康, 郝艳丽. 海藻酸钙海绵及其载银后的性能研究[J]. 化学工业与工程, 2017, 34(3): 18-23. WANG Kang, HAO Yanli. Study on the capacity of calcium alginate sponge with or without silver nanoparticles[J]. Chemical Industry and Engineering, 2017, 34(3): 18-23. (in Chinese) |
| [11] |
ZHAO B, QIAN Y, QIAN X, et al. Fabrication and characterization of waterborne polyurethane/silver nanocomposite foams[J]. Polymer Composites, 2019, 40(4): 1492-1498. DOI:10.1002/pc.24888 |
| [12] |
PYUN D G, CHOI H J, YOON H S, et al. Polyurethane foam containing rhEGF as a dressing material for healing diabetic wounds: Synthesis, characterization, in vitro and in vivo studies[J]. Colloids and Surfaces B: Biointerfaces, 2015, 135: 699-706. DOI:10.1016/j.colsurfb.2015.08.029 |
| [13] |
MORENA A G, STEFANOV I, IVANOVA K, et al. Antibacterial polyurethane foams with incorporated lignin-capped silver nanoparticles for chronic wound treatment[J]. Industrial & Engineering Chemistry Research, 2020, 59(10): 4504-4514. |
| [14] |
LUNDIN J G, MCGANN C L, DANIELS G C, et al. Hemostatic Kaolin-polyurethane foam composites for multifunctional wound dressing applications[J]. Materials Science and Engineering: C, 2017, 79: 702-709. DOI:10.1016/j.msec.2017.05.084 |
| [15] |
BROEKEMA F I, OEVEREN W, SELTEN M H A, et al. In vivo hemostatic efficacy of polyurethane foam compared to collagen and gelatin[J]. Clinical Oral Investigations, 2013, 17(4): 1273-1278. DOI:10.1007/s00784-012-0809-y |
| [16] |
YANG S, LI X, LIU P, et al. Multifunctional chitosan/polycaprolactone nanofiber scaffolds with varied dual-drug release for wound-healing applications[J]. ACS Biomaterials Science & Engineering, 2020, 6(8): 4666-4676. |
| [17] |
ZHAO W, ZHANG X, ZHANG R, et al. Self-assembled herbal medicine encapsulated by an oxidation-sensitive supramolecular hydrogel for chronic wound treatment[J]. ACS Applied Materials & Interfaces, 2020, 12(51): 56898-56907. |
| [18] |
JALVANDI J, WHITE M, GAO Y, et al. Polyvinyl alcohol composite nanofibres containing conjugated levofloxacin-chitosan for controlled drug release[J]. Materials Science and Engineering: C, 2017, 73: 440-446. DOI:10.1016/j.msec.2016.12.112 |
| [19] |
JIANG H, FANG D, HSIAO B, et al. Preparation and characterization of ibuprofen-loaded poly(lactide-co-glycolide)/poly(ethylene glycol)-g-chitosan electrospun membranes[J]. Journal of Biomaterials Science, Polymer Edition, 2004, 15(3): 279-296. DOI:10.1163/156856204322977184 |
| [20] |
WEI S, LIU X, ZHOU J, et al. Dual-crosslinked nanocomposite hydrogels based on quaternized chitosan and clindamycin-loaded hyperbranched nanoparticles for potential antibacterial applications[J]. International Journal of Biological Macromolecules, 2020, 155: 153-162. DOI:10.1016/j.ijbiomac.2020.03.182 |
| [21] |
王德源, 冯权, 王玉晓, 等. 阳离子型聚氨酯泡沫载体的制备及对活性污泥的吸附性能[J]. 高分子学报, 2012(6): 679-684. WANG Deyuan, FENG Quan, WANG Yuxiao, et al. Preparation of cationic polyurethane foam carriers and their adsorption properties for activated sludge[J]. Acta Polymerica Sinica, 2012(6): 679-684. (in Chinese) |
 2022, Vol. 39
2022, Vol. 39





