2. 陕西科技大学环境科学与工程学院, 西安 710021
2. School of Environmental Science and Engineering, Shaanxi University of Science & Technology, Xi'an 710021, China
锂离子电池具有工作压力高、能量密度大、自放电率低、无记忆效应和环境友好等优点[1],自20世纪90年代被索尼公司成功商业化后[2],在全球便携式电子设备、新能源汽车、医疗器械和军事装备等领域广泛使用[3]。我国是锂离子电池生产制造大国,近年锂离子电池产量急剧增加,随之而来的是废旧电池的退役高峰期。锂离子电池主要由正极、负极、电解质、铝箔、铜箔和外壳等组成,其中正极材料成本占据40%,主要含锂、钴、镍和锰等有价金属。废旧锂电池中的有价金属含量远远超过对应矿物储量,如果未经处理直接丢弃,会导致严重的重金属污染和资源浪费[4];电解质、黏结剂和隔膜主要是一些有机成分,这些高危物质如果释放到环境中,会污染水环境、大气和土壤等,造成氟污染和有机物污染,最终威胁人类的健康生存。针对废旧锂电池的环境污染性和资源性双重特点,研究废旧锂离子电池资源化回收具有重要实际意义和应用前景。
目前废旧锂离子电池回收技术主要有机械化学法、火法、湿法回收以及耦合工艺。机械化学回收过程主要由机械力主导,粉末颗粒被强烈撞击破碎,内部结构坍塌,显著降低反应的活化能,机械化学法对环境污染小,但是产品提纯难度增大,反应时间较长,难以适应大规模的回收工艺。火法回收通常是将处理后的电池或者正极材料在500~1 000 ℃高温中焙烧,高价的过渡金属被还原为易于回收低价态形式,技术工序简单,处理量大,具有较高的经济可行性,对原料组分要求低,目前已经应用于大规模生产性处理回收正极材料,但是回收过程能耗巨大,对设备要求高,高温导致一些污染性气体释放,需要后续净化处理。湿法回收一般是利用一些合适的化学试剂选择性溶解废旧锂离子电池中的有价金属而进行回收分离的一种方法[5]。由于废旧锂离子电池正极材料多为高价态金属氧化物,可通过酸/碱和外加还原剂浸出,将有价金属以低价态离子形式溶解。湿法工艺具有金属回收率高、产品纯度大、能耗低等优点[6]。传统统湿法冶金工艺比较适合回收化学组成相对单一的废旧锂电池,也可耦合高温冶金,例如Umicore采用的Val’Eas工艺中,废旧锂电池不经破碎等预处理直接在炉中熔炼,其中石墨、塑料、有机溶剂充当燃料,获得Co-Ni-Cu-Fe合金,之后采用湿法冶金法从合金中回收Co、Ni和Cu[7],制得氢氧化钴/氯化钴等产品。
目前常用正极材料类型有钴酸锂(LiCoO2)、三元材料(LiNixCoyMn1-x-yO2)、锰酸锂(LiMn2O4)和磷酸铁锂(LiFePO4),废旧正极材料经湿化学浸出后,镍、钴、锰和锂等金属以离子态溶解在浸出液中,分离回收各种金属并制得高附加值产品是回收过程的主要目标,因此各种金属离子的分离尤为重要。本论文针对现有的锂离子电池回收过程中浸出液的有价金属离子分离技术进行总结,并对其未来发展进行展望。
1 有价金属分离技术研究进展浸出液中的有价金属离子主要包括Li+、Co2+、Ni2+和Mn2+等金属离子,分离过程是针对以上金属离子进行提取回收。目前从浸出液中分离提取不同金属的技术有化学沉淀法、溶剂萃取法、吸附法、膜分离法和电沉积法等。
1.1 化学沉淀法化学沉淀分离一般是向溶液中加入沉淀剂,使金属离子选择性转化为相应的难溶沉淀物,从液相转移至固相从而实现分离,原理是不同化合物在一定酸碱度下的溶解度不同。化学沉淀法简单、成本低,易于控制和适合工业应用。各种离子的沉淀剂和对应产物见表 1。
| 金属离子 | 沉淀剂 | 沉淀产物 | 参考文献 |
| Li+ | Na2CO3 | Li2CO3 | [8] |
| Na3PO4 | Li3PO4 | [9-10] | |
| NaF | LiF | [11] | |
| Co2+ | NaOH | Co(OH)2 | [12] |
| 草酸/草酸铵 | CoC2O4·2H2O | [13] | |
| NaCO3 | CoCO3 | [14] | |
| (NH4)2S | CoS | [15] | |
| Mn2+ | NaOH | Mn(OH)2 | [12] |
| NaCO3 | MnCO3 | [16] | |
| (NH4)2S2O8 | MnO2 | [17] | |
| KMnO4 | MnO2 | [12] | |
| Ni2+ | NaOH | Ni(OH)2 | [12] |
| NaCO3 | NiCO3 | [18] | |
| 丁二酮肟 | 镍与丁二酮肟络合物 | [9] | |
| Fe3+(来自LFP材料) | 磷酸根 | FePO4 | [19] |
| NaOH | Fe(OH)3 | [8, 10] | |
| Ca(OH)2 | Fe2O3 | [16] | |
| H2S | FeS2 | [16] |
Li+常用的沉淀剂有Na2CO3、Na3PO4和NaF,对应沉淀产物分别为Li2CO3、Li3PO4和LiF,反应为(1)~(3),其中回收的Na2CO3和Na3PO4可直接用作再合成的正极材料钴酸锂/三元和磷酸铁锂的锂源。Li2CO3的溶解度随温度升高而降低,在使用碳酸盐沉淀锂需要在高温溶液中进行,Li等[8]将富集Li+(5 g·L-1以上)溶液升温至95 ℃后再加入Na2CO3,回收最高89.95%的Li2CO3。当混有其他难溶物时,单独分离Li2CO3较困难,通过往溶液中注入CO2促进Li2CO3转化为可溶解的LiHCO3[如反应(4)]而过滤分离Li[20],再采用蒸发结晶获得高纯度Li2CO3产品[如反应(5)]。Na3PO4沉淀锂的沉淀率较高,但是需要严格控制溶液pH值,一般在碱性溶液中沉淀,根据不同的溶液体系沉淀最适宜pH值范围不同,Xiao等[21]通过热力学模拟和实验验证了Li+/Fe3+-PO43--H2O体系中pH值为11~13时可以沉淀99.7%的Li+。
| ${\rm{2L}}{{\rm{i}}^ + }{\rm{ + CO}}_3^{2 - }{\rm{ = L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{(s)}} $ | (1) |
| ${\rm{3L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + PO}}_4^{3 - }{\rm{ = L}}{{\rm{i}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}{\rm{(s)}} $ | (2) |
| ${\rm{L}}{{\rm{i}}^{\rm{ + }}}{\rm{ + }}{{\rm{F}}^ - }{\rm{ = LiF(s)}} $ | (3) |
| ${\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}\left( {\rm{s}} \right){\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ = 2LiHC}}{{\rm{O}}_{\rm{3}}}\left( {{\rm{aq}}} \right) $ | (4) |
| ${\rm{2LiHC}}{{\rm{O}}_{\rm{3}}}\left( {{\rm{aq}}} \right){\rm{ = L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}\left( {\rm{s}} \right){\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\left( {{\rm{aq}}} \right){\rm{ + C}}{{\rm{O}}_{\rm{2}}}{\rm{(g)}} $ | (5) |
化学沉淀法分离Co时,使用NaOH[12]、草酸铵[13]、NaCO3[14]和(NH4)2S[15]等沉淀剂,Co2+分别以Co(OH)2、CoC2O4·2H2O、CoCO3和CoS形式沉淀析出。Co(OH)2和CoC2O4·2H2O经500 ℃及以上热分解后转化为Co3O4[22-23][反应式(6)~(7)],可以作为再生钴酸锂的前驱体,因此氢氧化钠和草酸盐是废旧正极材料闭环回收技术中最常用的钴的沉淀剂。部分多元酸在湿法浸出废旧正极材料时可以同步沉淀Co。使用酒石酸[24]、草酸[25]、磷酸[26]浸出废旧钴酸锂时,过滤分离的沉淀分别为酒石酸钴(C4H4O6Co)、草酸钴(CoC2O4·2H2O)和磷酸钴(Co3(PO4)2)。Sun等[25]使用1.0 mol·L-1草酸为浸出剂和沉淀剂,15.%(体积分数)H2O2为还原剂,在80 ℃、固液比为50 g·L-1浸出废旧钴酸锂120 min,浸出同时钴的选择性沉淀为草酸钴,锂溶解富集在浸出液中,但是浸出剂过量时沉淀草酸钴再次溶解[反应式(8)~(9)]。同步浸出沉淀时需要严格控制反应条件,尤其是酸浓度,同时确保沉淀产物的效率和纯度,以实现目标金属高效分离。
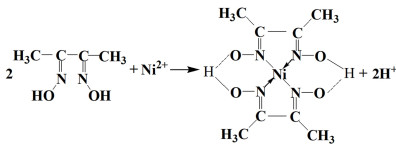
针对浸出液中Mn2+,目前使用的化学沉淀剂有NaOH、NaCO3[16]、(NH4)2S2O8[17]和KMnO4[12]等。NaOH和NaCO3沉淀过程是Mn2+与OH-或CO32-简单结合为难溶物Mn(OH)2和MnCO3,而(NH4)2S2O8和KMnO4是与Mn2+发生氧化还原反应,生成MnO2沉淀[反应式为(10)~(11)]。Ni2+的化学沉淀剂有NaOH、NaCO3、丁二酮肟(C4H8N2O2)等,分别生成Ni(OH)2、NiCO3、镍与丁二酮肟络合物。Chen等[9]使用丁二酮肟试剂从含Li+、Co2+、Ni2+、Mn2+的溶液中沉淀分离Ni2+时,控制溶液pH=6可以选择性沉淀98%的Ni2+,沉淀产物为红色络合物,如反应(12),使用盐酸溶解该沉淀,镍以NiCl2形式回收,同时再生丁二酮肟。铁主要存在于LiFePO4正极的浸出液中,浸出时加入氧化剂,如过硫酸钠[19],LiFePO4中的2价铁氧化为难溶物FePO4,而Li+溶解在浸出液中,实现同步浸出分离,由于磷酸铁锂材料湿化学浸出液组分简单,铁与锂较易分离,对该类正极材料的不同金属分离关注较少。
| ${\rm{6Co}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \buildrel \Delta \over = {\rm{2C}}{{\rm{o}}_{\rm{3}}}{{\rm{O}}_{\rm{4}}}{\rm{ + 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\;\left( {\rm{g}} \right) $ | (6) |
| $\begin{array}{c} {\rm{Co}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}} \cdot {\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\left( {\rm{s}} \right){\rm{ + 2}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \buildrel \Delta \over = \\ {\rm{C}}{{\rm{o}}_{\rm{3}}}{{\rm{O}}_{\rm{4}}}\left( {\rm{s}} \right){\rm{ + 6C}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\;\left( {\rm{g}} \right) \end{array} $ | (7) |
| $\begin{array}{c} {\rm{3}}{{\rm{H}}_{\rm{2}}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2LiCo}}{{\rm{O}}_{\rm{2}}}\left( {\rm{s}} \right){\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}{\rm{ = }}\\ {\rm{L}}{{\rm{i}}_{\rm{2}}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2Co}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}\left( {\rm{s}} \right){\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O + }}{{\rm{O}}_{\rm{2}}}{\rm{(g)}} \end{array} $ | (8) |
| $\begin{array}{c} {\rm{3}}{{\rm{H}}_{\rm{2}}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{ + LiCo}}{{\rm{O}}_{\rm{2}}}\left( {\rm{s}} \right){\rm{ + 1}}{\rm{.5}}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}{\rm{ = }}\\ {\rm{LiH}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}{\rm{ + Co}}{\left( {{\rm{H}}{{\rm{C}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O + }}{{\rm{O}}_{\rm{2}}}{\rm{(g)}} \end{array} $ | (9) |
| $\begin{array}{c} {\rm{M}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{ + }}{\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{{\rm{S}}_{\rm{2}}}{{\rm{O}}_{\rm{8}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O = }}\\ {\rm{Mn}}{{\rm{O}}_{\rm{2}}}\left( {\rm{s}} \right){\rm{ + }}{\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}} \end{array} $ | (10) |
| ${\rm{3M}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{ + 2MnO}}_4^ - {\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O = 5Mn}}{{\rm{O}}_{\rm{2}}}\left( {\rm{s}} \right){\rm{ + 4}}{{\rm{H}}^{\rm{ + }}} $ | (11) |
 |
(12) |
在处理含Li+、Co2+、Ni2+和Mn2+多种金属离子的浸出液时,Meshram等[18]使用草酸引入草酸根,在pH=1.5、50 ℃的酸性溶液中沉淀反应2 h,98%的Co2+以CoC2O4·2H2O形式沉淀分离;使用饱和碳酸钠溶液在pH值分别调至7.5、9、14状态下依次沉淀92%的Mn2+、89%的Ni2+和98%的Li+,获得MnCO3、NiCO3和Li2CO3沉淀产物。使用同一沉淀剂沉淀不同有价金属离子虽然流程简单,但是由于过渡金属化学性质高度相似,最适宜沉淀条件相差不大,极易导致共沉淀而不能有效分离。Cai等[27]在Li+、Co2+和Mn2+的浸出液中,加入Na2S,Co2+和Mn2+转化为CoS和MnS混合沉淀,滤液中剩余的Li+通过Na3PO4回收为Li3PO4,后续使用乙酸溶液能选择性溶解MnS,分离CoS。化学沉淀各种金属离子的沉淀产物中,硫化物较难应用于锂离子电池的闭环循环回收利用,使用硫化物作为沉淀剂较少。
化学沉淀分离各金属离子流程简单,浸出液中Li+、Co2+、Ni2+和Mn2+分离的同时能直接获得对应目标金属产物,但是Co2+、Ni2+和Mn2+同为过渡金属离子,化学性质相似,容易共沉淀,建议使用具有高选择性的沉淀剂,如图 1所示的回收流程中,使用丁二酮肟络合沉淀Ni2+,使用草酸或者草酸铵沉淀Ni2+为草酸钴,Mn2+经过硫酸盐或者高锰酸钾等氧化物氧化沉淀为MnO2,最终Li+以碳酸锂形式回收。沉淀条件需要严格控制,尤其是溶液pH值。此外化学沉淀过程需要消耗大量沉淀剂,甚至需要添加晶种或絮凝剂[10],导致沉淀产物含有其他金属杂质,可能需要进一步纯化。为了减少其他金属离子共沉淀,沉淀剂的选择、沉淀顺序、溶液pH值的控制、温度等条件是化学沉淀法的操作关键。
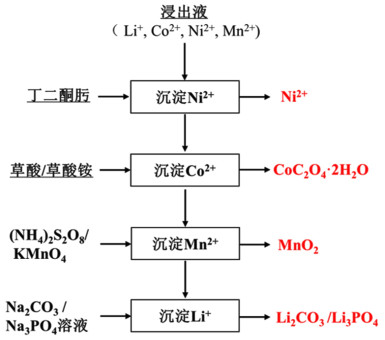
|
| 图 1 化学沉淀法从浸出液中回收各金属离子流程图 Fig.1 Flow chart of recycling metal ions from lixivium by chemical precipitation method |
| |
溶剂萃取是基于物质在不同相中溶解度不同而实现分离。当萃取系统达到平衡时,金属离子与萃取剂形成配体络合物而富集回收[28]。大多萃取剂可再生,重复使用。溶剂萃取的效果取决于萃取率和相分离能力,在萃取分离过程中,分配系数、分离系数、萃取率是非常重要的参数。萃取分离已被广泛应用于各种湿化学过程,对于废旧锂离子电池正极材料的浸出液中的Li+、Co2+、Ni2+和Mn2+等金属离子,常用萃取剂有:Cyanex 272(二(2, 4, 4-三甲基戊基)次膦酸)、PC-88A/P-507(2-乙基己基磷酸单2-乙基己基酯)、D2EHPA(二-(2-乙基己基)磷酸)、TOA(三辛胺)、DEHPA(二乙基己基酸)和P204(二(2-乙基己基)磷酸酯)等。萃取后需要洗涤和反萃,洗涤是去除共萃取的杂质,反萃是将萃取分离金属离子转移至水相,同时实现萃取剂的再生,通常使用酸溶液进行反萃,水相中的金属离子经处理得到最终金属盐类产物。
对含多种离子的浸出液体系提纯分离,目前使用萃取剂分离主要萃取Co2+、Ni2+和Mn2+,萃取后Li+存在萃余液中,经化学沉淀法回收。Cyanex-272和PC-88A一般用于萃取Co2+,尤其适用于Co2+和Ni2+分离[29],价格相对昂贵;PC-88A、P204、D2EHPA大多用于萃取分离Mn2+。在溶剂萃取中,选择合适的pH值对过程影响非常大[30],如图 2所示,大多萃取剂是在酸性条件下进行,Cyanex272从浸出液中分离和回收Co2+,室温下萃取平衡pH值范围为4.5~5.5。Cu2+的萃取一般使用螯合萃取剂Acorga M5640和LIX 84-IC,其中LIX 84-IC对Ni2+也有较好的萃取作用,为了尽量避免共萃,应根据溶液中离子种类将溶液调节至合适的pH值,并使用选择性较高的萃取剂。螯合萃取剂对外界条件(例如温度、pH值等)不敏感,操作条件宽泛,但是螯合萃取剂萃取后会加大反萃难度,使Cu2+难以从萃取有机相中剥离,因此萃取剂的选择需综合考虑萃取和反萃过程。
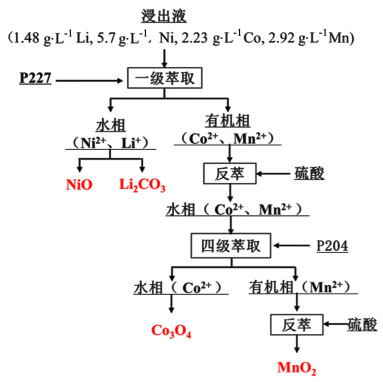
Liu等[31]在处理废旧三元材料的浸出液(1.48 g·L-1 Li, 5.71 g·L-1 Ni, 2.23 g·L-1 Co, 2.92 g·L-1 Mn)时,如图 3所示,使用0.8 mol·L-1 P227(二(2-乙基己基)次膦酸)一级萃取Co2+和Mn2+,水相中的Li+经化学沉淀为Li2CO3而实现与Ni2+的分离;使用稀硫酸溶液反萃有机相中的Co2+和Mn2+,再使用P204经四级萃取Mn2+实现Co2+/Mn2+的分离,整个流程Li、Ni、Co和Mn回收率分别为96.15%、91.54%、91.15%和91.56%,最终经化学沉淀、焙烧等处理获得产物MnO2、Li2CO3、NiO和Co3O4质量分数分别为100%、98%、93%和100%。Yang等[32]使用30%(体积分数) PC-88A在水油体积比(O/A)为2∶1、pH=5.9条件下,98%的Mn2+和90%的Co2+从浸出液中被共同萃取,近99%的Ni2+和100%的Li+仍留在萃余液中,使用30%(体积分数)新癸酸作为萃取剂,在pH=4, 水油体积比为1∶3下萃取近100%的Ni2+。Mn2+和Co2+反萃后选择沉淀法对共萃液中的钴、锰进行分离,在pH=0.5、0.076 mol·L-1 KMnO4、80 ℃、60 min条件下沉淀Mn2+,锰与钴的分离率达到90%以上。
萃取对各类金属选择性强、回收率高、产物纯度大,但是在最终产物形成中不可避免使用化学沉淀法制备,易导致回收流程长等问题。
部分萃取剂联合使用时有时可以获得更好的萃取效果[33]。Zhao等[34]发现2种商业萃取剂PC-88A和Cyanex-272协同萃取体系可以有效的从含Li+、Co2+和Mn2+的浸出液中萃取Co2+和Mn2+,富集在萃余相中的Li+以碳酸锂的形式回收;在剩余含Co2+和Mn2+的有机相中加入稀硫酸溶液和EDTA(乙二胺四乙酸)络合分离Co2+至水相;使用0.01 mol·L-1的稀硫酸溶液反萃有机相中Mn2+,再生的萃取剂用于循环萃取,整个萃取分离流程均利用了2种萃取剂的特性,有效使得多种金属离子分离,但是体系pH值要求严格,萃取率有待优化。Zhang等[35]开发了由苯甲酰三氟丙酮(HBTA)、三辛基氧化膦(TOPO)和煤油组成萃取体系,利用HBTA与TOPO在提取碱金属离子时具有较强的协同作用,在最适宜条件水油体积比为1∶1,pH=8.5时从浸出液(含Co2+、Ni2+和Li+等)经三级逆流萃取选择性萃取90%以上的锂。
离子液体由于具有一些独特的物理化学性质,如溶解金属配合物的能力较强、可忽略的蒸汽压、低挥发性和不可燃烧性,使其可以作为环境友好的溶剂应用于萃取分离。离子液体一般是由阴离子和阳离子组合而成的纯态液体,属于有机盐,可以通过选择不同阳离子和阴离子进行复配调节一些特性。Zante等[36]使用磷酸三丁酯(TBT)为配体的咪唑基离子液体萃取模拟浸出液(含Li+、Co2+和Ni2+),萃取过程中Li+与离子液体阳离子发生交换。由于咪唑阳离子高成本和低生物降解性,引入四苯基硼钠盐(NaTFPB)牺牲阳离子、使用更疏水的咪唑烷基离子液体(1-癸基3-甲基咪唑双(三氟甲基磺酰基)酰亚胺([C10mim] [NTf2]),在pH值为2时,从模拟的浸出液中选择性萃取Li+。Othman等[37]使用脂肪酸基离子液体油酸-四辛基鏻([P8888][oleate])从浸出液(含Li+、Co2+、Ni2+和Mn2+)萃取99%以上的钴和锰,该长链四烷基膦酸阳离子和疏水性油酸阴离子的结合一定程度上抑制离子液体在水相的溶解损失。萃取后水相中的镍和锂的使用化学沉淀法分离,使用氨水、碳酸铵和硫酸铵的复合溶液反萃分离萃取相中Mn2+与Co2+,Mn2+以碳酸锰的形式沉淀,Co2+保留在萃余液中,同时再生的离子液体可以在萃取循环中重复使用。离子液体萃取过程虽然萃取剂用量大,但是酸耗微弱,萃取效率高。
萃取法是分离提纯浸出液中有价金属离子的有效方法,处理量大容易工业化,选择性高,萃取剂大多能重复使用,但是一般萃取剂为有机溶剂,易挥发,对人体和环境有害;大多工艺一次萃取效率低,需要多级萃取,费时费力;萃取有价金属离子之后需要酸溶液洗脱,过程产生大量废水需要处理。目前离子液体是较为环保高效的萃取剂,但是价格昂贵,导致分离成本增大。不同萃取剂对Co2+、Ni2+和Mn2+的萃取pH值不同,完整的回收工艺需要对溶液pH值反复调节,消耗酸碱,此外共萃问题也需重视,选择性强的萃取剂成本较高。因此需要不断开发新的低成本、高选择性的萃取剂,根据不同溶液目标金属选用合适的萃取体系,在回收率与工艺成本之间寻求平衡。
1.3 吸附分离法吸附分离是一种固液萃取分离法,对目标金属进行选择性分离,利用具有较强吸附能力的吸附剂,选择性地对其中一个或者一类成分进行吸附使其在吸附剂上富集,从而达到从混合物中分离某一组分的目标,尤其是对于低浓度溶液,吸附分离是比较方便且低成本的方法。吸附剂来源众多,例如有矿物、有机物、沸石、工业副产品、农业废弃物、生物质和聚合材料等,主要分为物理吸附和化学吸附。
在废旧锂离子电池湿法浸出液中,锂是一种轻元素,与吸附剂表面之间的相互作用最弱,通常较难被物理吸附。Purnomo等[38]使用KOH化学活化法和高温物理活化法从椰壳炭中制备低成本活性炭,发现经800 ℃活化的活性炭,可获得的最大比表面积为365 m2·g-1,总孔体积为0.148 cm3·g-1,通过半连续柱吸附,从废旧正极材料浸出液(含Li+、Co2+、Ni2+和Mn2+)中高效吸附除Li+之外的其他金属离子,吸附处理后溶液为富含Li+的溶液,吸附过程最长滞后时间为97 min, 利于最大化吸附其他金属离子而不会过早脱附,该吸附剂对Co2+、Ni2+和Mn2+没有选择性,但吸附容量不同,利用离子之间吸收能力的差异可用于通过吸附柱在连续吸附系统中进行分离。吸附分离对Li+具有较高的选择性。通过改变吸附剂孔隙率、液体流速和的吸附剂粒度可以优化分离效果。Wang等[39]设计一种锰型锂离子筛为吸附剂,从含Co2+、Ni2+、Li+和NH4+的浸出液中有效分离Li+,该离子筛对Li+、N2+和Co2+的吸附亲和力分别为32.665、0.154和0.033,选择系数α(Li+/Ni2+)与α(Li+/Co2+)分别为212.11和983.89,吸附过程中由于Ni2+和Co2+离子半径较大,较难进入吸附位点,因此对Li+具有优异的吸附选择性,能有效地将99.9%以上的Li+离子从浸出液中分离出来,0.17%的Ni2+和1.79%的Co2+被吸附。
Co2+常用的物理吸附剂是商业活性炭,其他吸附剂还有杏核活性炭、坡缕石、榛子壳活性炭、膨润土、螺旋藻[40]、甲壳素和稻壳[41]等。Peres等[40]使用螺旋藻对浸出液(含Co2+和Li+)吸附处理研究回收Co2+,与商业活性炭吸附剂对比,发现吸附过程中Co2+与木炭发生物理吸附,而在螺旋藻表面发生表面络合;螺旋藻和活性炭两种吸附剂最大吸附量分别为82%和72%。Cunha等[41]以甲壳素和稻壳为吸附剂,从废旧正极材料浸出液(含Co2+和Li+)中回收Co2+,在pH值为6、318 K时,甲壳素和稻壳的最大吸附量分别为50.0和17.6 mg·g-1,Co2+回收率为95.0%。以上浸出液体系较为单一,没有深入研究吸附剂在其他过渡金属离子干扰下对Co2+的选择性。
化学吸附是通过吸附剂与离子发生络合或离子交换等化学反应进行选择性吸附。Long等[42]设计六氰合铁酸铜(CuHCF)纳米膜,纳米膜作为阳极,通过电化学从含Li+、Co2+、Cu2+和Al3+混合溶液分离Co2+,分离过程中主要是化学吸附,阳极电化学还原过程同时,带正电荷的Co2+吸附在CuHCF膜上。吸附反应为Cu3[FeⅢ(CN)6]2+2e-+Co2+ → CoCu3[FeⅡ(CN)6]2,后续通过转换电极再生纳米膜。
离子交换分离时,离子交换树脂中官能团选择性吸附液相中某些金属离子时,树脂同时释放出等价态离子到溶液中以维持溶液电中性,液相中离子和树脂离子发生可逆化学反应。分离效果较好的树脂需要对目标离子的选择性好,树脂上吸附位点的数量较多、容量大,粒度分布合适,具有高的主链强度,以减少回收过程中树脂的断裂和磨损程度。在相对复杂的溶液中,不同功能树脂可有效去除Al3+、Fe3+等杂质离子,选择性回收Cu2+、Co2+和Li+等有价金属,离子交换法适合较复杂的多金属浸出液体系。目前的研究主要集中在开发具有特定功能的树脂。Gomaa等[43]使用2种螯合剂固化附在γ-Al2O3分子筛制得一种对Co2+具有高度选择性吸附的固体离子交换树脂,在仅含Co2+模拟液中超过99%的Co2+被吸附,在真实浸出液(含Co2+、Li+、Ni2+、Mn2+、Cu2+和Al3+)中能选择性吸附87.5%以上的Co2+离子,0.2 mol·L-1 HCl溶液作为洗脱剂释放超过98%的被吸附Co2+,再生的离子交换树脂可以用于后续循环吸附,由于Co2+与离子交换树脂上螯合剂的活性基团的结合热力学稳定性高于与其他竞争离子的结合热力学稳定性,该化学吸附过程能从含多种相似性质金属离子的浸出液中选择性吸附分离Co2+。Guo等[44]使用3种萃取剂浸渍树脂(SIRs)从废LIBs的浸出液中选择性地分离回收Cu2+、Co2+和Li+,双(2-乙基己基)磷酸(D2EHPA) 浸渍的SIR对Fe3+和Al3+有较高的选择性,用于吸附分离杂质Fe3+和Al3+;之后溶液进入2-乙基己基膦酸单-2-乙基己基酯(PC-88A)浸渍的SIR的吸附柱中,Cu2+被树脂选择性分离;剩余溶液通过PC-88A和双(2,4,4-三甲基戊基)次膦酸(Cyanex 272) 浸渍的SIR的吸附柱,选择性吸附回收Co2+;最后,1-苯基-1,3-十四烷二酮(C11phβDK)和三正辛基氧化膦(TOPO)协同浸渍的SIR填充柱选择性回收Li+,流程示意图如图 4所示,吸附后通过盐酸溶液洗脱负载的金属离子和再生吸附柱。
吸附分离是一种低能耗的固液分离法,经洗脱后可以再生循环使用,过程不需要剧烈的相混合和大量的有机溶剂,从浸出液中分离提取不同金属的过程是基于吸附剂的良好的吸附能力和选择性实现的,吸附剂的选择是吸附过程的关键,但是Co2+、Ni2+和Mn2+可能存在一定量的共吸附,此外吸附之后的洗脱过程需要消耗酸/碱液,导致废水排放增加。通过开发功能化的吸附剂和新的吸附方法是目前吸附分离有价金属离子的主要研究方向,在吸附过程中应平衡目标金属离子的吸附容量和选择性,采用高选择性、高吸附容量、易获得和价格低廉的吸附剂。
1.4 膜分离膜分离通常是根据粒子不同的孔径大小,金属离子在功能膜中选择性地渗透或滞留而分离。膜分离推动力有浓度差、电场力、静压力差和蒸汽压差等,一般较好的功能膜需要具有较大的透过速度和较好的选择性、机械强度好、稳定性强、耐化学试剂和低成本等。开发功能膜使其包含特定金属载体对湿法冶金等领域中金属离子分离十分重要。
Sonoc等[45]采用基于阳离子交换膜的唐南(Donnan)透析法,从废LIBs的浸出溶液中分离回收Li、Ni、Co和Mn,94.1%的Li离子回收为高纯碳酸锂,99.4%的过渡金属离子(即Ni、Co和Mn)通过后续溶剂萃取工艺回收为硫酸盐,实验模拟表明在2 d内,利用5 000 dm2的CMS C-1805 Neosepta单价离子交换膜和2 000 dm2的CMX C-1586 Neosepta多价离子交换膜,能从1 000 L含285 mol锂、钴、镍和锰各95 mol的混合溶液选择回收锂。
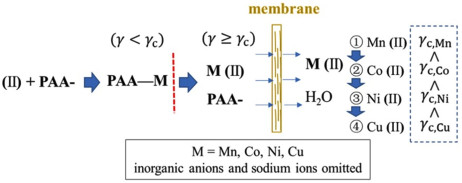
络合超滤已被广泛应用于分离和浓缩含可回收金属离子的废水,金属离子与络合剂络合形成大分子络合物无法通过膜,从而选择性地使未络合的离子通过膜。Gao等[46]在废旧锂离子电池正极浸出液中(含Al3+、Fe3+、Li+、Mn2+、Co2+、Ni2+和Cu2+),化学沉淀分离Al3+和Fe3+后,加入聚丙烯酸钠(PAAS)作为络合剂形成金属络合物,Li+几乎不与PAAS络合,而其它金属离子可以与PAAS络合形成剪切稳定性不同的PAA-M络合物(M=锰、钴、镍和铜)。因此,先使用络合超滤法分离锂。如图 5所示,根据不同金属络合物剪切稳定性的不同,利用旋转圆盘膜通过剪切诱导解离耦合超滤,按临界剪切速率从小到大的顺序,当剪切场的剪切速率超过聚合物与金属的络合物的临界剪切速率时,聚合物与金属离子的络合物解离,因此提高剪切速率依次分离锰、钴、镍和铜,实现金属离子的选择性分离。
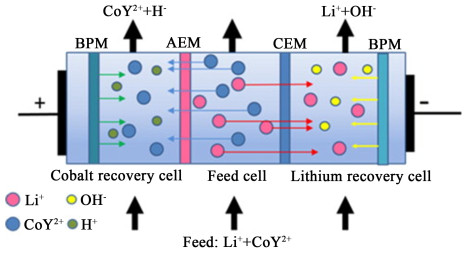
Iizuka等[47]基于金属离子螯合的双极膜电渗析分离方法,分离回收浸出液中Li+和Co2+,以乙二胺四乙酸(EDTA)为螯合剂,pH>4时几乎所有的Co离子都能与EDTA螯合,而锂离子很难螯合,利用不同金属离子螯合平衡常数差异通过双极膜电渗析系统处理浸出液,如图 6所示,该系统由2层离子交换膜和1层双极膜组成,Li+和Co2+通过不同极的膜进行富集分离。
膜分离技术是一种有效的从浸出液中有效回收有价金属的方法,过程不涉及相变,一般能耗较低,分离条件温和,操作方便,对环境友好,但是稳定性有限,膜较为昂贵,需定期清洗,后续还需对分离的金属离子进行洗脱、沉淀产物等操作,大多与别的分离技术耦合连用,具有一定的应用潜力。
1.5 电沉积分离近些年来,浸出工艺不断发展和创新,通过电化学途径回收正极有价金属逐渐引起人们关注。电沉积是通过在两个电极之间施加电压来诱导溶液中离子之间的氧化还原反应,依据不同金属的标准还原电位可以达到电沉积金属成分而实现分离。主要的影响参数有电流密度、电路电压、溶液pH值和电解时间等参数。
目前针对电化学分离的研究较少,大多与正极材料的浸出同步发生,浸出的高价金属离子通过电化学还原在阴极沉积为高纯度金属单质。Diaz等[48]在使用Fe2+作为还原剂电化学浸出还原回收正极材料LiNixCoyMnzO2时,Li+、Co2+、Ni2+和Mn2+富集在浸出液中同时回收阴极上沉积的铜。Prabaharan等[49]在2 mol·L-1硫酸溶液中电解浸出废旧正极材料,Cu在阴极沉积回收,浸出液除铝后为Co2+和Mn2+的富集液(Co 46 g·L-1、Mn 24 g·L-1),使用电沉积分离钴和锰,钴还原沉积在阴极,而锰在阳极被氧化形成MnO2,在最适宜分离条件200 A·m-2,pH值2.0~2.5,90 ℃下,整个流程回收钴、铜、锰的总回收率分别在96%、97%和99%。电沉积过程反应式如(13)~(16)[49]:
阴极:
| ${\rm{C}}{{\rm{o}}^{{\rm{2 + }}}}{\rm{ + 2}}{{\rm{e}}^ - } \to {\rm{Co}} $ | (13) |
| ${\rm{2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2}}{{\rm{e}}^ - } \to {{\rm{H}}_{\rm{2}}} $ | (14) |
阳极:
| ${\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 4}}{{\rm{e}}^ - } $ | (15) |
| ${\rm{M}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Mn}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2}}{{\rm{e}}^ - } $ | (16) |
电化学过程简单,通过电化学方法分离金属是一种可持续的清洁生产策略,可减少资源回收的环境负担,属于绿色化学回收,但是过程能耗高,需要严格控制条件,防止共沉积多种物质导致产物不纯。
1.6 其他分离法金玉健等[50]使用盐析法,向含有Li+和Co2+的浸出液中加入饱和(NH4)2SO4溶液和无水乙醇,降低溶液的介电常数和钴盐的溶解度,通过控制条件发生分段盐析,Co2+盐析生成(NH4)2Co(SO4)2沉淀从溶液中分离,当浸出液、硫酸铵溶液、无水乙醇的体积比为2∶1∶3时,Co2+的析出率达到92%以上。
Aktas等[51]使用乙醇可以达到分离浸出液中Co2+和Li+,硫酸加还原剂浸出溶解LiCoO2后,由于硫酸钴的溶解度比硫酸锂低得多,加入乙醇(乙醇/溶液体积比为3∶1)之后,92%的钴以硫酸钴沉淀形式被回收,随后调节pH值至10加入氢氧化锂,剩余的钴以沉淀Co(OH)2析出回收。乙醇的存在降低了水的热力学活性,促进了金属与硫酸盐的结合和随后的沉淀;继续加入溶液/乙醇体积比为3∶1的乙醇,绝大部分的Li以Li2SO4的形式沉淀回收。
2 结语废旧锂离子电池正极回收过程中,湿法工艺无论是全程使用,还是与其他技术耦合,单独回收各金属产物都必然需要对浸出液中的有价金属离子进行分离提纯。由于操作方便,沉淀剂成本低,现阶段的分离技术仍是以化学沉淀法为主;萃取分离、吸附分离已经取得重要进展,现集中于新型高效低成本萃取剂和吸附剂的开发。未来湿法浸出液中的离子分离技术研究可以参考以下内容:
1) 分离过程能高效获得高附加值的金属盐类产物,但是均存在一定弊端,包括化学沉淀法需要过量沉淀剂的消耗,溶剂萃取法、吸附分离和膜分离需要洗脱过程,导致大量废水待处理,因此应在开发新型分离技术时注重减少废水、废物的产生。
2) 对于获得高纯度产物目标的分离过程,应针对每种金属离子的特性安排流程,例如Li+较适合在分离Co2+、Ni2+和Mn2+等离子后使用化学沉淀法回收;对于Co2+、Ni2+和Mn2+相似性质分离较困难的金属离子,沉淀、萃取和吸附等方法需要严格控制操作条件,防止分离附带其他杂质;整个流程可以采用多种技术耦合分离工艺,实现高选择性、低成本和环境友好分离。对于提纯后的产物含少量杂质,应拓展低纯度产物的应用范围和研究,实现废旧锂离子电池的短流程资源化回收利用。
| [1] |
Wang Y, An N, Wen L, et al. Recent progress on the recycling technology of Li-ion batteries[J]. Journal of Energy Chemistry, 2021, 55: 391-419. DOI:10.1016/j.jechem.2020.05.008 |
| [2] |
张笑笑, 王鸯鸯, 刘媛, 等. 废旧锂离子电池回收处理技术与资源化再生技术进展[J]. 化工进展, 2016, 35(12): 4026-4032. Zhang Xiaoxiao, Wang Yangyang, Liu Yuan, et al. Recent progress in disposal and recycling of spent lithium-ion batteries[J]. Chemical Industry and Engineering Progress, 2016, 35(12): 4026-4032. (in Chinese) |
| [3] |
李丽, 葛静, 陈人杰, 等. 废旧锂离子电池回收制备钴酸锂的研究进展[J]. 化工进展, 2010, 29(4): 757-761. Li Li, Ge Jing, Chen Renjie, et al. Progress in LiCoO2 preparation from spent Li-ion batteries[J]. Chemical Industry and Engineering Progress, 2010, 29(4): 757-761. (in Chinese) |
| [4] |
张英杰, 宁培超, 杨轩, 等. 废旧三元锂离子电池回收技术研究新进展[J]. 化工进展, 2020, 39(7): 2828-2840. Zhang Yingjie, Ning Peichao, Yang Xuan, et al. Research progress on the recycling technology of spent ternary lithium ion battery[J]. Chemical Industry and Engineering Progress, 2020, 39(7): 2828-2840. (in Chinese) |
| [5] |
Chen X, Cao L, Kang D, et al. Hydrometallurgical processes for valuable metals recycling from spent lithium-ion batteries[M]//Recycling of Spent Lithium-Ion Batteries. Cham: Springer International Publishing, 2019: 93-139
|
| [6] |
张梦龙, 何几文, 田欢, 等. 废旧锂离子电池中有价金属的回收研究进展[J]. 化学工业与工程, 2019, 36(4): 23-30. Zhang Menglong, He Jiwen, Tian Huan, et al. Research progress on recovery of valuable metals from spent lithium ion batteries[J]. Chemical Industry and Engineering, 2019, 36(4): 23-30. (in Chinese) |
| [7] |
Yao Y, Zhu M, Zhao Z, et al. Hydrometallurgical processes for recycling spent lithium-ion batteries: A critical review[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 13611-13627. |
| [8] |
Li L, Bian Y, Zhang X, et al. A green and effective room-temperature recycling process of LiFePO4 cathode materials for lithium-ion batteries[J]. Waste Management, 2019, 85: 437-444. DOI:10.1016/j.wasman.2019.01.012 |
| [9] |
Chen X, Zhou T, Kong J, et al. Separation and recovery of metal values from leach liquor of waste lithium nickel cobalt manganese oxide based cathodes[J]. Separation and Purification Technology, 2015, 141: 76-83. DOI:10.1016/j.seppur.2014.11.039 |
| [10] |
Song Y, Zhao Z. Recovery of lithium from spent lithium-ion batteries using precipitation and electrodialysis techniques[J]. Separation and Purification Technology, 2018, 206: 335-342. DOI:10.1016/j.seppur.2018.06.022 |
| [11] |
Zheng Y, Song W, Mo W, et al. Lithium fluoride recovery from cathode material of spent lithium-ion battery[J]. RSC Advances, 2018, 8(16): 8990-8998. DOI:10.1039/C8RA00061A |
| [12] |
Wang R, Lin Y, Wu S. A novel recovery process of metal values from the cathode active materials of the lithium-ion secondary batteries[J]. Hydrometallurgy, 2009, 99(3/4): 194-201. |
| [13] |
Chen X, Chen Y, Zhou T, et al. Hydrometallurgical recovery of metal values from sulfuric acid leaching liquor of spent lithium-ion batteries[J]. Waste Management, 2015, 38: 349-356. DOI:10.1016/j.wasman.2014.12.023 |
| [14] |
Granata G, Moscardini E, Pagnanelli F, et al. Product recovery from Li-ion battery wastes coming from an industrial pre-treatment plant: Lab scale tests and process simulations[J]. Journal of Power Sources, 2012, 206: 393-401. DOI:10.1016/j.jpowsour.2012.01.115 |
| [15] |
Natarajan S, Boricha A B, Bajaj H C. Recovery of value-added products from cathode and anode material of spent lithium-ion batteries[J]. Waste Management, 2018, 77: 455-465. DOI:10.1016/j.wasman.2018.04.032 |
| [16] |
Pakarinen J, Paatero E. Recovery of manganese from iron containing sulfate solutions by precipitation[J]. Minerals Engineering, 2011, 24(13): 1421-1429. DOI:10.1016/j.mineng.2011.06.004 |
| [17] |
Dutta D, Kumari A, Panda R, et al. Close loop separation process for the recovery of Co, Cu, Mn, Fe and Li from spent lithium-ion batteries[J]. Separation and Purification Technology, 2018, 200: 327-334. DOI:10.1016/j.seppur.2018.02.022 |
| [18] |
Meshram P, Pandey B D, Mankhand T R. Hydrometallurgical processing of spent lithium ion batteries (LIBs) in the presence of a reducing agent with emphasis on kinetics of leaching[J]. Chemical Engineering Journal, 2015, 281: 418-427. DOI:10.1016/j.cej.2015.06.071 |
| [19] |
Zhang J, Hu J, Liu Y, et al. Sustainable and facile method for the selective recovery of lithium from cathode scrap of spent LiFePO4 batteries[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(6): 5626-5631. |
| [20] |
Hu J, Zhang J, Li H, et al. A promising approach for the recovery of high value-added metals from spent lithium-ion batteries[J]. Journal of Power Sources, 2017, 351: 192-199. DOI:10.1016/j.jpowsour.2017.03.093 |
| [21] |
Xiao C, Zeng L. Thermodynamic study on recovery of lithium using phosphate precipitation method[J]. Hydrometallurgy, 2018, 178: 283-286. DOI:10.1016/j.hydromet.2018.05.001 |
| [22] |
Zhao J, Qu X, Qu J, et al. Extraction of Co and Li2CO3 from cathode materials of spent lithium-ion batteries through a combined acid-leaching and electro-deoxidation approach[J]. Journal of Hazardous Materials, 2019. DOI:10.1016/j.jhazmat.2019.120817 |
| [23] |
孟奇, 张英杰, 董鹏, 等. 废旧锂离子电池中钴、锂的回收研究进展[J]. 化工进展, 2017, 36(9): 3485-3491. Meng Qi, Zhang Yingjie, Dong Peng, et al. Recovery of Co and Li from spent lithium ion batteries[J]. Chemical Industry and Engineering Progress, 2017, 36(9): 3485-3491. (in Chinese) |
| [24] |
Chen X, Kang D, Cao L, et al. Separation and recovery of valuable metals from spent lithium ion batteries: Simultaneous recovery of Li and Co in a single step[J]. Separation and Purification Technology, 2019, 210: 690-697. DOI:10.1016/j.seppur.2018.08.072 |
| [25] |
Sun L, Qiu K. Organic oxalate as leachant and precipitant for the recovery of valuable metals from spent lithium-ion batteries[J]. Waste Management, 2012, 32(8): 1575-1582. DOI:10.1016/j.wasman.2012.03.027 |
| [26] |
Chen X, Ma H, Luo C, et al. Recovery of valuable metals from waste cathode materials of spent lithium-ion batteries using mild phosphoric acid[J]. Journal of Hazardous Materials, 2017, 326: 77-86. DOI:10.1016/j.jhazmat.2016.12.021 |
| [27] |
Cai G, Fung K Y, Ng K M, et al. Process development for the recycle of spent lithium ion batteries by chemical precipitation[J]. Industrial & Engineering Chemistry Research, 2014, 53(47): 18245-18259. |
| [28] |
黎华玲, 陈永珍, 宋文吉, 等. 湿法回收退役三元锂离子电池有价金属的研究进展[J]. 化工进展, 2019, 38(2): 921-932. Li Hualing, Chen Yongzhen, Song Wenji, et al. Research progress on the recovery of valuable metals in retired LiNixCoyMnzO2 batteries by wet process[J]. Chemical Industry and Engineering Progress, 2019, 38(2): 921-932. (in Chinese) |
| [29] |
Hong H, Kim D, Choi H, et al. Solvent extraction of co, Ni and Mn from NCM sulfate leaching solution of Li(NCM)O2 secondary battery scraps[J]. Archives of Metallurgy and Materials, 2017, 62(2): 1011-1014. DOI:10.1515/amm-2017-0143 |
| [30] |
Lv W, Wang Z, Cao H, et al. A critical review and analysis on the recycling of spent lithium-ion batteries[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(2): 1504-1521. |
| [31] |
Liu T, Chen J, Li H, et al. An integrated process for the separation and recovery of valuable metals from the spent LiNi0.5Co0.2Mn0.3O2 cathode materials[J]. Separation and Purification Technology, 2020. DOI:10.1016/j.seppur.2020.116869 |
| [32] |
Yang Y, Lei S, Song S, et al. Stepwise recycling of valuable metals from Ni-rich cathode material of spent lithium-ion batteries[J]. Waste Management, 2020, 102: 131-138. DOI:10.1016/j.wasman.2019.09.044 |
| [33] |
Liu Y, Lee M, Senanayake G. Potential connections between the interaction and extraction performance of mixed extractant systems: A short review[J]. Journal of Molecular Liquids, 2018, 268: 667-676. DOI:10.1016/j.molliq.2018.07.097 |
| [34] |
Zhao J, Shen X, Deng F, et al. Synergistic extraction and separation of valuable metals from waste cathodic material of lithium ion batteries using Cyanex272 and PC-88A[J]. Separation and Purification Technology, 2011, 78(3): 345-351. DOI:10.1016/j.seppur.2010.12.024 |
| [35] |
Zhang L, Li L, Rui H, et al. Lithium recovery from effluent of spent lithium battery recycling process using solvent extraction[J]. Journal of Hazardous Materials, 2020. DOI:10.1016/j.jhazmat.2020.122840 |
| [36] |
Zante G, Masmoudi A, Barillon R, et al. Separation of lithium, cobalt and nickel from spent lithium-ion batteries using TBP and imidazolium-based ionic liquids[J]. Journal of Industrial and Engineering Chemistry, 2020, 82: 269-277. DOI:10.1016/j.jiec.2019.10.023 |
| [37] |
Othman E A, van Der Ham A G J, MiedemA H, et al. Recovery of metals from spent lithium-ion batteries using ionic liquid[P8888] [Oleate[J]. Separation and Purification Technology, 2020. DOI:10.1016/j.seppur.2020.117435 |
| [38] |
Purnomo C W, Kesuma E P, Perdana I, et al. Lithium recovery from spent Li-ion batteries using coconut shell activated carbon[J]. Waste Management, 2018, 79: 454-461. DOI:10.1016/j.wasman.2018.08.017 |
| [39] |
Wang H, Huang K, Zhang Y, et al. Recovery of lithium, nickel, and cobalt from spent lithium-ion battery powders by selective ammonia leaching and an adsorption separation system[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(12): 11489-11495. |
| [40] |
Peres E C, Cunha J M, Dortzbacher G F, et al. Treatment of leachates containing cobalt by adsorption on Spirulina sp. and activated charcoal[J]. Journal of Environmental Chemical Engineering, 2018, 6(1): 667-685. |
| [41] |
Da Cunha J M, Klein L, Bassaco M M, et al. Cobalt recovery from leached solutions of lithium-ion batteries using waste materials as adsorbents[J]. The Canadian Journal of Chemical Engineering, 2015, 93(12): 2198-2204. DOI:10.1002/cjce.22331 |
| [42] |
Long X, Chen R, Tan J, et al. Electrochemical recovery of cobalt using nanoparticles film of copper hexacyanoferrates from aqueous solution[J]. Journal of Hazardous Materials, 2020. DOI:10.1016/j.jhazmat.2019.121252 |
| [43] |
Gomaa H, Shenashen M A, Yamaguchi H, et al. Extraction and recovery of Co2+ions from spent lithium-ion batteries using hierarchical mesosponge γ-Al2O3 monolith extractors[J]. Green Chemistry, 2018, 20(8): 1841-1857. DOI:10.1039/C7GC03673F |
| [44] |
Guo F, Nishihama S, Yoshizuka K. Selective recovery of valuable metals from spent Li-ion batteries using solvent-impregnated resins[J]. Environmental Technology, 2013, 34(10): 1307-1317. DOI:10.1080/09593330.2012.746734 |
| [45] |
Sonoc A C, Jeswiet J, Murayama N, et al. A study of the application of Donnan dialysis to the recycling of lithium ion batteries[J]. Hydrometallurgy, 2018, 175: 133-143. DOI:10.1016/j.hydromet.2017.10.004 |
| [46] |
Gao J, Qiu Y, Li M, et al. Separation of valuable metals in spent LiNi0.46Co0.2Mn0.34O2 battery by shear induced dissociation coupling with ultrafiltration[J]. Hydrometallurgy, 2019. DOI:10.1016/j.hydromet.2019.105127 |
| [47] |
Iizuka A, Yamashita Y, Nagasawa H, et al. Separation of lithium and cobalt from waste lithium-ion batteries via bipolar membrane electrodialysis coupled with chelation[J]. Separation and Purification Technology, 2013, 113: 33-41. DOI:10.1016/j.seppur.2013.04.014 |
| [48] |
Diaz L A, Strauss M L, Adhikari B, et al. Electrochemical-assisted leaching of active materials from lithium ion batteries[J]. Resources, Conservation and Recycling, 2020. DOI:10.1016/j.resconrec.2020.104900 |
| [49] |
Prabaharan G, Barik S P, Kumar N, et al. Electrochemical process for electrode material of spent lithium ion batteries[J]. Waste Management, 2017, 68: 527-533. DOI:10.1016/j.wasman.2017.07.007 |
| [50] |
金玉健, 梅光军, 李树元. 盐析法从锂离子电池正极浸出液中回收钴盐的研究[J]. 环境科学学报, 2006, 26(7): 1122-1125. Jin Yujian, Mei Guangjun, Li Shuyuan. Study on cobaltous recovery from cathode leachate of lithium-ion battery by salting out[J]. Acta Scientiae Circumstantiae, 2006, 26(7): 1122-1125. DOI:10.3321/j.issn:0253-2468.2006.07.013 (in Chinese) |
| [51] |
Aktas S, Fray D J, Burheim O, et al. Recovery of metallic values from spent Li ion secondary batteries[J]. Mineral Processing and Extractive Metallurgy, 2006, 115(2): 95-100. DOI:10.1179/174328506X109040 |
 2021, Vol. 38
2021, Vol. 38