2. 天津大学合成生物学前沿科学中心和系统生物工程教育部重点实验室, 天津 300072
2. Frontier Science Center for Synthetic Biology, Key Laboratory of Systems Bioengineering (Ministry of Education), Tianjin 300072, China
近年来,化石能源的过度消耗以及温室气体的过量排放已对生态环境造成不可逆转的后果,并且在能源与环境方面威胁到人类社会的可持续发展。受温室气体过量排放的影响,十年间地球的平均表面温度上升约1.0 ℃,且正在加速上涨[1]。由全球变暖所带来的自然灾害已在全球造成上百亿美元的经济损失[2]。化石燃料燃烧所产生的温室气体中,CO2占到总排放量的68%[3]。为了保障能源与环境的可持续发展,回收人类生产活动所产生的碳足迹(Carbon Footprint)已在世界范围内达成共识。
CO2的回收转化不仅可以降低大气中CO2的浓度,而且能够在生产增值燃料和化学品的同时促进人工碳循环。CO2中的碳原子处于最高氧化态,在转化为含碳化合物时,最高价态向低价态还原的过程是非自发且缓慢的,因此需要大量的能量来驱动还原反应[4]。自然界中的植物和光合微生物通过光合作用将CO2转化为生物质,研究人员也设计出人工光合系统来驱动CO2还原。但是,光能供应的间歇性,使反应系统的连续性受到限制[5]。相比之下,电能驱动CO2还原受天气或地域的影响较小,在实现长效碳循环上具有更好的应用前景。此外,电能来源广泛,可以从太阳能、风能、潮汐能这些可再生的能源中产生。并且,电驱动CO2还原操作条件温和,常温常压下即可完成反应[6]。
CO2的电驱动还原以电能作为能量,在催化剂的协同下将CO2还原并转化为化学原料和生物燃料[7]。根据催化剂的差异,CO2的电驱动还原包括CO2的无机电催化(CO2 Electrocatalytic Reduction Reaction,CO2RR)和CO2的微生物电合成(Microbial Electrosynthesis, MES)。在无机电催化系统中,电催化剂主要决定了CO2还原的途径与产物;而在微生物电合成系统中,电极主要是传输电子或还原电子载体,辅助生物催化剂完成CO2的固定与转化。本篇综述主要介绍CO2电驱动还原中的CO2无机电催化和CO2微生物电合成,其中CO2无机电催化从金属基催化剂与非金属催化剂发展的方面进行介绍,CO2微生物电合成从直接和间接的电子传递方式进行介绍,最终总结并展望了CO2电驱动还原系统的发展(图 1)。
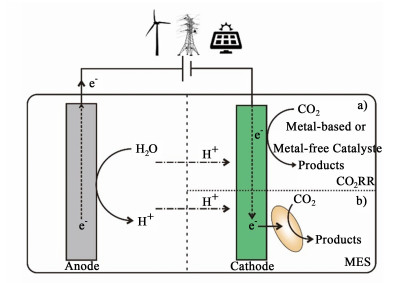
|
| 图 1 CO2电驱动还原示意图:a) CO2的无机电催化;b) CO2的微生物电合成 Fig.1 Schematic diagram of electricity-driven CO2 reduction: a) CO2 electrocatalytic reduction reaction (CO2RR); b) CO2 microbial electrosynthesis (MES) |
| |
CO2的无机电催化还原通过电催化剂进行多次电子转移来实现CO2还原。催化CO2还原的电催化剂种类多样,使CO2可通过多种途径转化为对应的还原产物[8];并且反应操作灵活,可以通过调节电压大小、溶液pH值、电解液的离子种类和浓度等来提高反应速率和转化率[6]。这些特性使其在碳回收与能量储存方面具有前景。CO2无机电催化的还原产物主要为一氧化碳(CO)、甲酸(HCOOH)、甲醇(CH3OH)和甲烷(CH4)等C1产物。此外,还能通过C—C键的偶联形成乙烯(C2H4)、乙醇(C2H5OH)等C2+产物[9]。催化过程中使用的电催化剂对CO2的还原效率和产物选择性非常重要。为了提高CO2无机电催化还原过程的法拉第效率、反应选择性和产物特异性,关键在于设计并合成高性能的电催化剂。目前,高性能电催化剂的开发主要聚焦于金属基催化剂和非金属催化剂,总结于表 1。
| 催化剂类型 | 催化剂 | 还原产物 | 法拉第效率 | 参考文献 | |
| 金属基催化剂 | 纯金属 | np-Ag | CO | 92% | [12] |
| Sn | Formate | 90% | [13] | ||
| Cu | C2H4 | 83% | [14] | ||
| 金属合金 | PdAg | Formate | 95% | [15] | |
| AuCu3@Au | CO | 97% | [16] | ||
| AgZn | CO | 91% | [17] | ||
| 无机金属 | N-ND/Cu | C2含氧化合物 | 63% | [18] | |
| Cu3N | C2H4 | 60% | [19] | ||
| OBC | C2H4 | 45% | [20] | ||
| 金属有机配合物 | MOF-1992 | CO | 80% | [21] | |
| Ir-GDE | Formate | [22] | |||
| Au25簇 | CO | 100% | [23] | ||
| 非金属催化剂 | 杂原子掺杂 | NCNT | CO | 80% | [27] |
| NPC | CO | 98% | [28] | ||
| NGQD | C2H4 | 31% | [29] | ||
| 无机化合物 | BP | HCHO | 92% | [30] | |
金属基电催化剂在CO2的电催化还原中应用广泛,并通过催化剂的粒度优化、表面改性、化学修饰和材料掺杂等手段改善了金属表面的活性位点密度,提升了催化性能。常见的金属基催化剂包括纯金属催化剂、金属合金催化剂、无机金属化合物催化剂和金属有机配合物催化剂[10]。
纯金属催化剂是最常见的金属类催化剂,通过对反应中间体的吸附与解吸强度来决定最终还原产物的种类。常见的纯金属电催化剂包括Au、Ag、Zn、Pb、Sn和Cu等[11]。通过提高金属表面的活性位点,能够提升对CO2的电催化活性。粒径优化是一种提高电催化活性的方法。Lu等[12]合成了纳米级别的多孔银电催化剂(np-Ag),能够以92%的法拉第效率将CO2还原为CO。Castillo等[13]使用粒径为150 nm的Sn电催化还原CO2,产物甲酸的生产速率达到3.2 mmol ·m-2 ·s-1。此外,表面改性也是一种有效的手段。Zhang等[14]尝试对铜纳米片的表面结构进行改造,以增强反应中间体和羟基离子在催化剂上的吸附,促进C—C键的偶联与产物C2H4的形成。合理的尺寸改造和表面修饰可以提高纯金属电催化剂的性能,但将活性位点过分暴露在复杂的电催化系统中可能会降低催化剂的寿命。在金属催化剂中引入第2组分进行改性并提高催化稳定性的策略得到了关注和研究。
金属合金催化剂通过掺入第2种金属来优化反应界面的性能,提高合金催化剂的稳定性和催化活性。合理引入第2金属组分在降低副产物对催化活性位点的竞争、促进相邻金属间的电子转移、提高稳定性方面效果明显。Zhou等[15]设计了一种PdAg合金纳米球,引入Ag减弱了反应副产物在Pb的表面吸附同时提高了反应稳定性和选择性。PdAg在-0.27 V(vs. RHE,可逆氢电极)外加电压下催化CO2还原为甲酸盐,法拉第效率达到95%。Ma等[16]合成了AuCu3@Au合金电催化剂,相邻金属原子间的电子转移增强使得CO2的催化反应保持97.27%的法拉第效率。Sarah等[17]报道了AgZn合金电极,该合金集成了Ag良好的纳米结构和Zn优异的催化活性,产物CO的法拉第效率达到91%。通过合理地引入第二组分,合金催化剂能够利用各金属组分间的电子和空间效应实现协同催化,降低反应过电势并提高催化剂的活性与稳定性。然而,合金催化剂的第二组分通常是贵金属,由于其稀缺性和昂贵给合金催化剂的大规模开发带来挑战。
与合金催化剂不同,无机金属催化剂是在金属基催化剂上引入了廉价的无机分子合成的。电负性较强的氮、氧和硫等能作为第2组分来改善金属电催化剂的性能。通过调整无机和金属组分来产生界面协同效应,在触发还原产物高效合成的同时提高催化界面的稳定性。常见的无机金属催化剂种类有金属氮化物和金属氧化物。Wang等[18]设计并组装了氮掺杂铜/金刚石纳米电催化剂(N-ND/Cu),为电催化CO2还原为C2含氧化合物构建了高选择性与稳定性的催化界面。相类似地,Sun的团队[19]报告了一种氮化铜(Cu3N)纳米立方体催化剂,在催化过程中显示出较好的C2H4产物选择性和稳定性。不止金属氮化物,某些金属变为氧化态后电催化性能也得到提升。Zhang等[20]制备的含氧铜(Oxygen-bearing Copper, OBC)电催化剂,在-0.95 V(vs. RHE)的外加电压下的电流密度达44.7 mA ·cm-2,是铜催化剂的26倍。无机金属催化剂的低成本、高电活性和出色的化学稳定性已经引起了研究人员的关注。但是,当前对无机金属催化剂的理性设计和反应机理研究还需要更加深入。
由金属与有机配体配位而成的金属有机配合物,被认为是电还原CO2的一种理想催化剂。金属单元与有机配体形成的三维网状结构具有高孔隙率和比表面积,使金属有机配合物具有较高的活性位点密度和传质速率,在低电势下显示出良好的电流密度。并且有机配体的种类丰富能够根据反应需求来调整金属有机配合物的性能。Yang和他的同事[21]制备了一种金属有机配合物(MOF-1992),与炭黑(CB)组装成电极用于电催化还原CO2,产物CO的法拉第效率为80%。有机金属电催化也可以固定在气体扩散电极上。Kang等[22]将二氢化铱钳负载到气体扩散电极上,反应8 h,还原产物甲酸盐的浓度达到11 mmol。配体保护的金属团簇同样具有良好的催化活性。配体保护的Au25簇还原CO2为CO,峰值产率为1.26 mmol ·cm-2 ·h-1,法拉第效率接近100%[23]。
1.2 非金属电催化剂在电催化还原CO2的研究中,金属基催化剂是广受关注和研究的一类电催化剂,但仍存在一些缺陷,如水溶液中稳定性差、金属离子浸出和潜在的环境毒性等。相比于金属基电催化剂,非金属催化剂具有化学稳定性高、成本低、环境友好等优点[24],正在发展成为金属基电催化剂的有效替代品。具有代表性的非金属电催化剂有杂原子掺杂碳基材料和无机化合物材料[25]。
碳基材料,如石墨棒、碳布等,已在电化学中显示出良好的稳定性。但是缺乏活性位点,使得碳基材料对CO2的电还原活性不明显。将杂原子掺杂到碳基材料中调节相邻碳的电子特性,能提高碳基材料的CO2催化活性。特别是氮掺杂的碳基材料,已被成功用作CO2电还原的非金属碳基催化剂[26]。Ajayan等[27]报告了使用氮掺杂的碳纳米管(NCNT)电催化还原CO2的研究,-0.78 V(vs. RHE)的外加电压下运行10 h,还原产物CO的法拉第效率达到80%。多孔结构的引入促进了CO2分子的扩散并扩展了催化活性区域。Huang团队[28]合成了高表面积、电导率和催化活性的氮掺杂多孔碳(NPC)电催化剂,可以选择性地将CO2转化为CO,法拉第效率达98.4%。将催化剂的结构尺寸缩小至纳米级别有可能显著提高催化活性,将非催化活性材料转变为高活性催化剂。Wu等[29]将石墨烯材料的尺寸调整到纳米级并掺杂氮原子,制备了氮掺杂石墨烯量子点(NGQD),能够催化CO2还原为C2H4和C2H5OH。
此外,硼、氮和磷等掺杂原子在碳基材料中展现出了CO2的电催化活性,使一些研究人员开始尝试利用高电负性原子合成无机化合物电催化剂。这些尝试有利于开发新型的电催化材料,并扩充了电还原CO2的理论基础。Mou等[30]发现磷化硼(BP)纳米粒子在电催化CO2还原为甲醇(CH3OH)方面具有较高的催化活性和反应选择性。在-0.5 V(vs. RHE)的外加电压下,反应可以达到92.0%的法拉第效率以及127.5 μg ·h-1 ·mg-1的产量。
CO2的无机电催化以金属或无机非金属材料作为催化剂,具有反应周期短、操作条件温和等特点。金属基催化剂因其高电活性、稳定性和具有丰富的催化活性位点等特点,在电催化反应中具有较高的法拉第效率。其中,金属合金催化剂的催化性能优越,得益于不同金属间相互协同所产生的界面效应,金属合金催化剂表现出高催化活性和产物选择性。以产物CO为例,法拉第效率接近100%[31]。并且在生产C2+化合物上也展现出良好的催化性能[32],法拉第效率>60%。而非金属催化剂成分复杂,包括杂原子掺杂碳基材料(氮掺杂的碳纳米管、氮掺杂多孔碳、碳量子点等)和无机化合物材料(磷化硼等),使其法拉第效率差距很大。如碳基材料氮掺杂多孔碳(NPC),能达到金属基催化剂的水平。而现阶段所研究的大部分无机电催化剂的法拉第效率为60%~90%之间[33-34],仍需进一步性能优化。
因此,开发高性能、高法拉第效率的催化剂是持续的探索方向。一方面通过复合催化剂协同,晶体缺陷工程和表面改性等手段,开发出高比表面积、高催化性能和高稳定性的催化剂。另一方面,需要建立更精确的理论模型来揭示电催化过程反应机理,指导和优化无机电催化系统的构建。
2 CO2的微生物电合成CO2的微生物电合成(MES)于2010年首次提出[35],指微生物利用阴极传递的电子作为还原力,将CO2通过生物固碳途径转化为多碳化合物的过程[36]。MES相较于CO2的无机电催化在合成长碳链化合物方面具有独特优势。MES借助微生物自身灵活多样的代谢途径和日益成熟的代谢工程技术,能够生产如醇类、萜烯、生物聚酯等长碳链化合物[37-39]。此外,MES具有很高的能量转化效率,电能转化为化学能的效率超过80%[40]。因此,MES不仅是一种碳转化技术,更是利用可再生电能生产生物燃料的储能技术,应用前景十分广阔。
MES中的微生物能够通过直接或间接的方式摄取阴极上的电子,作为CO2固定与转化的还原力。目前阴极电子向微生物胞内传递的详细机制尚未阐明,但大部分学者按照电子在电极与微生物之间的传递方式,将MES分为2类(图 2)[41-42]。一类是直接电子传递,即亲电微生物附着在导电固体表面(阴极或铁矿物质)上直接吸收电子,如产乙酸菌卵形链球菌(Sporomusa ovata),杨氏梭菌(Clostridium ljungdahlii),热醋穆尔氏菌(Moorella thermoacetica),类球鼠孢菌(Sporomusa sphaeroides),醋酸梭菌(Clostridium aceticum)[43],以及产甲烷菌甲烷杆菌目(Methanobacteriales)和甲烷八叠球菌目(Methanosarcinales)等[44]。另一类是间接电子传递,即通过电子载体(如H2、HCOOH、Fe2+和NH3等)介导实现非亲电微生物与电极之间的电子转移,如罗尔斯通氏菌(Ralstonia eutropha)和氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)等[41-42](表 2)。
| 类型 | 生物催化剂 | 阴极材料 | 产物 | 产率 | 参考文献 |
| 直接电子传递 | S.ovata | 粗糙石墨棒 | 乙酸 | 0.15 mmol·d-1 | [35] |
| M. palustre | 碳布 | 甲烷 | 200 mmol·m-2·d-1 | [45] | |
| M. thermoautotrophica | CNP包裹碳布电极 | 乙酸 | 58.2 mmol·m-2·d-1 | [46] | |
| Acetoanaerobium | EPD-3D | 乙酸 | 1 330 g·m-2·d-1 | [47] | |
| Mixed methanogens | 三维石墨化颗粒活性炭 | 甲烷 | 15.12 m3·m-3·d-1 | [48] | |
| M. thermoautotrophica | 碳布电极 | 乙酸 | 11.6 mmol·L-1·d-1 | [50] | |
| Homoacetogenic consortia | 不锈钢网 | 乙酸 | 24.53 mg·L-1·d-1 | [51] | |
| H2介导 | R. eutropha | NiMoZn合金 | 异丙醇 | 43.2 mg·L-1·d-1 | [56] |
| R. eutropha | Co-P合金 | 异丙醇 | 97.3 mg·L-1·d-1 | [57] | |
| 异丁醇和3-甲基-1-丁醇 | 38.5 mg·L-1·d-1 | ||||
| PHB | 116.8 mg·L-1·d-1 | ||||
| S. ovata | Co-P合金 | 乙酸 | 26.7 mmol·L-1·d-1 | [58] | |
| R. eutropha | 不锈钢电极 | 萜烯 | 17 mg CDW-1·d-1 | [39] | |
| M. maripaludi | NiMo | 甲烷 | 1.4L·d-1 | [73] | |
| 甲酸介导 | R. eutropha | 铟箔电极 | 异丙醇 | ~24 mg·L-1·d-1 | [37] |
| 3-甲基-1-丁醇 | ~12 mg·L-1·d-1 | ||||
| R. eutropha | 气体扩散电极 | PHB | 56 mg·L-1·d-1 | [60] | |
| 甲酸+NR | R. eutropha | 碳布电极 | PHB | 91.6 mg·L-1·d-1 | [38] |
| MV | M. thermoacetica | 玻碳电极 | 甲酸 | 21 mmol·L-1·d-1 | [65] |
| C. formicoaceticum | 甲酸 | 60 mmol·L-1·d-1 | |||
| NR | M. extorquens | 碳毡电极 | 甲酸 | 93.7 μmol·L-1·d-1 | [66] |
2009年,Cheng等[45]首次报道产甲烷菌Methanobacterium palustre能够直接从阴极电极表面摄取电子并将CO2为还原甲烷。2010年,Lovley团队[35]首次发现了产乙酸微生物S. ovata可以直接利用石墨电极上的电子将CO2还原为乙酸盐,并提出了微生物电合成的概念。之后该团队陆续发现S. sphaeroides,C. ljungdahlii,C. aceticum和M. thermoacetica都能直接利用电极上的电子驱动CO2还原,这一发现扩大了微生物电合成的应用范围[43]。微生物与电极间的相互作用是影响电子传递效率的主要因素。目前研究者们通过开发和改造阴极材料、优化操作条件等不断强化微生物与电极之间的相互作用,进一步提升MES系统的性能。
阴极材料影响着电极界面与微生物之间电子传递和生物膜的形成。研究者通过阴极材料的开发与表面修饰,扩大比表面积使能负载更多的微生物,促进微生物与电极之间的相互作用和生物膜的形成,从而提高MES的效率。在开发和改造MES的阴极时,主要考虑生物相容性、比表面积以及化学稳定性等。Yu等[46]用碳纳米颗粒将M. thermoautotrophica固定到阴极碳布电极上,改善了细胞与电极的物理接触并提升了电极和生物膜之间的电子转移速率。在-0.4 V(vs. SHE,SHE标准氢电极)的外加电压下,产物乙酸的电合成速率达到58.2 mmol ·m-2 ·d-1[图 3a)]。Victoria和Ludovic合成了一系列具有三维分层多孔结构的高导电阴极材料(EPD-3D)[47],这类电极的高表面积增加了微生物的负载,强化了细菌与电极之间的相互作用。系统中的电流密度高达200 A ·m-2,乙酸盐的产率为1 330 g ·m-2 ·d-1。Cheng等[48]利用三维石墨化颗粒活性炭作为阴极,成功地加速了产甲烷菌的生物膜富集,提高了甲烷的产率,达到15.12 m3 ·m-3 ·d-1。此外,向MES系统中加入生物相容性高的导电聚合物(PPy)能够降低环境电阻,涂覆PPy的阴极显示出更低的电荷转移电阻和更高的电流密度[49]。
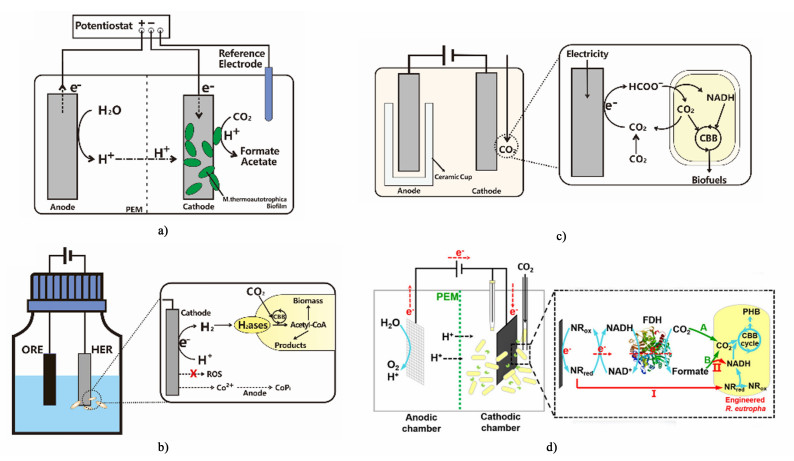
|
| 图 3 a) 直接接触的CNP包裹碳布电极- M. thermoautotrophica的MES概念图[40];b) H2介导的CoPi-R. eutropha的MES概念图[48];c) 甲酸介导铟箔- R. eutropha的MES概念图[33];d)双电子载体(甲酸与NR)介导的R. eutropha的MES概念图[34] Fig.3 a) Schematic diagram of direct contact CNP coated carbon cloth electrode-M. thermoautotrophica. redrawn from Ref.[40]; b) schematic diagram of H2-mediated CoPi-R. eutropha schematic diagram. redrawn from Ref. [48]; c) schematic diagram of formic acid mediated indium foil-R. eutropha. redrawn from Ref. [33]; d) schematic diagram of R. eutropha mediated by two-electron carrier (formic acid and NR) reproduced with permission of Ref.[34] |
| |
阴极电势、温度和无机碳源(HCO3-)的浓度等系统条件均是影响MES性能和产物产量的重要因素。如阴极电势越低时,电流密度越大,电合成效率越高,但电势过低会造成电能的损失。因此探索合适的系统条件是很重要的。研究者们通过研究和优化系统的条件,不断改善MES系统的性能。Faraghiparapari等[50]利用M. thermoautotrophica研究了温度对微生物电合成系统的影响。通过调节MES系统的操作温度至微生物生长的最适宜温度60 ℃时,乙酸盐产率最高达11.6 mmol ·m-2 ·d-1。Pant的团队[51]研究了在产乙酸菌混菌体系下不同浓度的HCO3-对MES系统性能的影响,在一定范围内提高HCO3-的浓度能够提高乙酸盐的产量,最高可达24.53 mg ·L-1 ·d-1。
2.2 间接电子传递的微生物电合成直接电子传递的微生物主要包括产乙酸菌和产甲烷菌,它们的操作条件是厌氧环境并且基因工具箱的开发不充分,这些都限制了MES的应用范围。而电子载体的引入使更多的非亲电型自养微生物能够实现CO2的微生物电合成,扩大了MES的范围,丰富了产物多样性。根据电子载体的不同,间接传递型MES系统包括H2介导、甲酸介导和其他电子载体介导[41]。
2.2.1 H2介导H2是化能无机自养型微生物常用的还原力供体。H2还原电位(Eo≈-0.41 V)较低[52],可被自养型微生物胞内的氢化酶氧化,并转化为还原力被细胞所利用。产甲烷菌、产乙酸菌不仅可以直接从阴极表面获得电子,还能利用H2进行CO2的还原[53-54]。这可以通过改变微生物电合成运行参数,如阴极电势和电极材料等来实现。Li等[55]研究发现当阴极电势为-0.7和-0.8 V(vs. Ag/AgCl)时,产甲烷菌与阴极主要通过直接电子传递;而当阴极电势达到-0.9~-1.1 V(vs. Ag/AgCl)时,产甲烷菌与阴极主要是由H2介导的间接电子传递。Geppert等[54]认为阴极电位越低,微生物通过直接电子传递产甲烷比例越小,通过H2介导传递途径产甲烷比例越高。
H2可通过电催化裂解水生产,高效的析氢催化剂的开发是H2可持续利用的关键[52]。目前常用的析氢活性较高的催化剂主要为过渡金属(Ni、Co和Mn等)及其衍生物。催化剂表面浸出的金属离子往往不利于细菌的生长代谢,而且还可能出现金属腐蚀等问题。研究者们致力于开发和构建安全有效的析氢催化剂,不断提升微生物电合成的CO2还原效率。Silver团队[56]报道了一种微生物电合成系统,选用镍锰锌合金(NiMoZn)作为析氢催化剂,工程改造的R. eutropha作为生物催化剂,实现将CO2转化为异丙醇,产量达到216 mg ·L-1。但在运行过程发现阴极NiMoZn合金会浸出镍,并且阳极会产生活性氧,这2种物质对细菌均有毒性。针对这一问题,Silver团队[57]继续开发新的析氢催化剂磷化钴(CoPi)[图 3b)],检测发现整个系统H2O2基本无积累,同时阴极浸出的Co2+又不断地附着在阳极钴磷合金(Co-P)上,这样的自愈过程使溶液保持了极低浓度的Co2+。最终构建水分解-生物合成系统CO2还原效率约为10%,超过了自然光合系统的效率。
H2在水中溶解度较低[58],限制了H2的传质效率,从而影响还原力的供给和微生物固碳效率。针对这一问题,Rodrigues等[58]引入具有生物相容性的全氟化碳纳米乳液(PFCs)作为H2载体。H2在PFCs包裹后的溶解度比在水中高出一个数量级,同时传质速率提升3倍,CO2还原成乙酸的产量提高190%。另一方面,随着合成生物学的迅速发展及多模块组合适配等工程化策略的引入,使微生物电合成系统能够生产更多高附加值的产物。Krieg等[39]首次利用MES实现从CO2到α-萜烯的生产。该研究通过异源引入甲羟戊酸途径和α-萜烯合成酶实现了R. eutropha工程改造,并利用H2实现CO2的还原和萜烯的生产。每消耗1 kW的电能,能够生产17 mg ·CDW-1的α-萜烯。
2.2.2 甲酸介导相比于H2,甲酸具有溶解度高、安全性好和易于运输的优势。并且甲酸电化学合成简单,还原电位低(Eo≈-0.42 V)[59],在胞内易被转化为CO2和还原力为微生物提供碳源和能量。这些优势使甲酸正在成为研究者们优选的还原力载体。Li等[37]首次利用甲酸作为电子载体,将可再生电能装置与固碳微生物集成,实现CO2到高级醇的转化。这项研究以R. eutropha LH74 D作为工程菌株,以电能和CO2作为唯一的能源和碳源,反应100 h,高级醇总产量超过140 mg ·L-1[图 3c)]。考虑到MES在工业放大过程中,原位处理中间载体甲酸和终产物会增加下游分离处理的难度和成本。Stöckl等[60]通过空间分离电催化CO2产甲酸和生物转化CO2产化合物2个过程,建立了从CO2到聚羟基丁酸酯(polyhydroxybutyrate, PHB)的可扩展耦合。在该耦合系统中,CO2先被气体扩散电极电化学还原为甲酸,而后电解液中的甲酸被R. eutropha生物转化为PHB,最终产量达56 mg ·L-1。另一方面,开发模式微生物-大肠杆菌(Escherichia coli)的MES技术有助于拓展MES的微生物种类,使MES技术趋向成熟。Tashiro等[61]开发了甲酸介导E. coli的MES系统,首先,工程改造异养微生物E. coli,异源引入还原性甘氨酸途径用于CO2固定。其次,使用电催化剂还原CO2生成甲酸盐,甲酸盐生成速率为450 mg ·L-1 ·d-1。最终工程改造E. coli能够在CO2和电能下生长。
2.2.3 其他电子载体介导氧化还原型电子载体的开发补充了电子载体的类型,扩大了还原力间接传递的途径,同时拓宽了电极材料的选择范围。氧化还原电子载体包括天然的和人工的电子载体[42]。发挥作用的机制是氧化态载体直接从电极上获得电子转化为还原态,将电子传递给细胞,反应后的氧化态载体继续从电极上获得电子转化为还原态,实现循环利用(图 2)。
天然的电子载体(NH3、Fe2+)往往应用于特定的化能自养型微生物,如嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)和欧洲亚硝化毛杆菌(Nitrosomonas europaea)等。A. ferrooxidans以Fe2+作为电子载体,用于还原CO2[62]。相似地,NO3-可以被电化学还原成NH3,N. europaea以NH3作为电子载体用于CO2还原,从而用于生成生物量[63]。Fe2+和NH3作为电子供体的主要限制是还原电位过高,需要消耗大量电子载体才能为细胞提供能量,从而降低了生物质和还原产物的合成[52]。
研究者们正在不断探索和开发人工的电子载体,如有机小分子甲基紫腈(Methyl Viologen, MV)、中性红(Neutral Red, NR)和蒽醌-2, 6-二磺酸盐(Anthraquinone-2, 6-disulfonate, AQDS)等。这些人工电子载体的优势是还原电势低,具有良好的氧化还原活性[38, 64]。Steinbusch等[64]评价了不同电子载体MV、NR和AQDS在MES中的效果。添加MV的实验组与对照相比,乙醇的生产效率提升6倍,最终浓度提升2倍,达到13.5 mmol。Song等[65]研究显示,在M. thermoacetica和Clostridium formicoaceticum的微生物电合成系统,加入MV有助于高效转化CO2为甲酸。此外,将中性红聚集到碳毡电极的表面,有助于提升甲酸产量和系统电子回收效率[66]。
在MES反应的后期,许多人工的电子载体会表现出细胞毒性,不利于长时间反应。针对这一问题,研究者们人工合成了生物相容性高的大分子共聚物。Hashimoto团队[67]人工合成了一种氧化还原活性聚合物(PMF),将PMF添加到E.coli和植物乳杆菌(lactobacillus plantarum)中,催化电流分别达52 mA和16 mA,表明PMF可促进跨细胞电子转移。然而,由于其高氧化还原电位(Eo≈500 mV),该共聚物无法为活细胞提供电子,需要进一步优化。Hashimoto团队[68]在PMF基础上合成了新的电子载体(pMBVi)。在-0.40 V(vs. SHE)的外加电压下,电流密度为7.8 μA ·cm-2,表明该共聚物能够将电子直接转移到E.coli。然而,人工的大分子共聚物氧化还原电位较高,合成方法复杂,还需要深入研究才能应用于MES系统中。
双电子载体的应用有助于构建高效的CO2的微生物电合成系统,极大增强了从阴极到微生物的电子传递,从而增强了产物合成。本课题组[38]开发出一种新型酶辅助微生物电合成系统,实现从CO2到生物聚酯的合成。一方面,甲酸脱氢酶催化生产的甲酸与中性红双管齐下,极大地增强了从阴极到R. eutropha的电子传递,整个系统只需要提供-0.6 V(vs. Ag/AgCl)的恒电位,节省了电能。另一方面,通过异源表达固碳关键酶增强了R. eutropha固碳能力。最终工程菌株积累了485 mg ·L-1的PHB,与对照组相比产量提升了3倍[图 3d)]。
CO2的微生物电合成具有还原产物多样,附加值高的特点。电极与微生物界面间的电子转移直接影响微生物电合成的能量转化效率。直接电子传递的微生物电合成的主要优势是能量转化效率高,可达到90%[40, 69]。产甲烷菌、产乙酸菌是常见的亲电型微生物,通过高效低耗的Wood-Ljungdahl途径将电子转移到目标产物,产物中电能转化效率高达90%以上[70]。Jourdin团队[47]研发的三维多孔的高导电阴极材料促进了产乙酸菌的生物膜的形成,该系统的电子和CO2流向乙酸盐中的回收率接近100%。而间接电子传递中,以具有代表性的H2为例,目前电解水产H2的能量转化效率为70%~80%[71],H2被微生物进一步利用生产产物。并且间接电子传递需要的电势往往更低,从而需要更多的电能输入,使能量转化效率降低[72]。
3 结语CO2的电驱动还原是一种绿色、清洁的碳转化工艺,为环境与能源的可持续发展提供了一种优选策略。综述回顾了以无机电催化和微生物电合成系统为代表的CO2电驱动还原的发展,并从催化剂的种类和能量转化方式的角度介绍了CO2的电驱动还原的特点。无机电催化CO2系统的反应周期短、操作灵活,通过控制电极电势及反应温度易于调节反应速率[6]。反应系统具有结构紧凑和随需应变的特点,在规模化应用上具有前景。但同时无机电催化CO2还原的发展仍面临挑战,产物多为C1化合物,C2+产物合成困难[7]。与之相比,微生物电合成系统借助微生物自身灵活多样的代谢途径和日益成熟的代谢工程技术,可生产如高级醇、丁酸、生物聚酯等长碳链化合物[37-39]。MES系统具有运行稳定和能耗较低的特点。但目前微生物电合成效率还处于较低水平,阴极与微生物界面间的电子转移机制尚未完全阐明。
CO2的电驱动还原在实现可再生电能向化学能转化、无机碳向化学产品或生物燃料转化方面具有核心优势。然而能量利用率、产物特异性和反应规模等问题阻碍了它迈向成熟化和实际应用的进程。为此,未来的CO2电驱动还原系统的发展可以聚焦于以下方面:1)通过调整电极材料、合理配制电解液或优选电子载体,降低反应体系中的内阻,减少电能传递过程中的损耗,提高能量利用效率;2)依据反应机理或利用合成生物学手段设计并开发高性能的无机或微生物催化剂,提高催化活性和产物特异性,使CO2和能量集中流向目标产物;3)理性设计和扩大反应器的规模,探索并优化系统的反应参数,确保扩大反应规模后不影响CO2转化效果。
| [1] |
Hoegh-Guldberg O, Jacob D, Taylor M, et al. The human imperative of stabilizing global climate change at 1.5℃[J]. Science, 2019. DOI:10.1126/science.aaw6974 |
| [2] |
Xu Y, Ramanathan V, Victor D G. Global warming will happen faster than we think[J]. Nature, 2018, 564(7734): 30-32. DOI:10.1038/d41586-018-07586-5 |
| [3] |
Adams S, Nsiah C. Reducing carbon dioxide emissions; Does renewable energy matter?[J]. Science of the Total Environment, 2019. DOI:10.1016/j.scitotenv.2019.07.094 |
| [4] |
Mikkelsen M, Jørgensen M, Krebs F C. The teraton challenge. A review of fixation and transformation of carbon dioxide[J]. Energy Environ Sci, 2010, 3(1): 43-81. DOI:10.1039/B912904A |
| [5] |
Bajracharya S, Aryal N, de Wever H, et al. Bioelectrochemical syntheses[M]. Cham: Springer International Publishing, 2019.
|
| [6] |
Song R, Zhu W, Fu J, et al. Electrode materials engineering in electrocatalytic CO2 reduction: Energy input and conversion efficiency[J]. Advanced Materials, 2020. DOI:10.1002/adma.201903796 |
| [7] |
Chen Z, Wang X, Liu L. Electrochemical reduction of carbon dioxide to value-added products: The electrocatalyst and microbial electrosynthesis[J]. The Chemical Record, 2019, 19(7): 1272-1282. DOI:10.1002/tcr.201800100 |
| [8] |
Qiao J, Liu Y, Hong F, et al. A review of catalysts for the electroreduction of carbon dioxide to produce low-carbon fuels[J]. Chemical Society Reviews, 2014, 43(2): 631-675. DOI:10.1039/C3CS60323G |
| [9] |
Jiang X, Nie X, Guo X, et al. Recent advances in carbon dioxide hydrogenation to methanol via heterogeneous catalysis[J]. Chemical Reviews, 2020, 120(15): 7984-8034. DOI:10.1021/acs.chemrev.9b00723 |
| [10] |
Gao D, Arán-Ais R M, Jeon H S, et al. Rational catalyst and electrolyte design for CO2 electroreduction towards multicarbon products[J]. Nature Catalysis, 2019, 2(3): 198-210. DOI:10.1038/s41929-019-0235-5 |
| [11] |
Rosen B A, Hod I. Tunable molecular-scale materials for catalyzing the low-overpotential electrochemical conversion of CO2[J]. Advanced Materials, 2018, 30(41): 1706238. DOI:10.1002/adma.201706238 |
| [12] |
Lu Q, Rosen J, Zhou Y, et al. A selective and efficient electrocatalyst for carbon dioxide reduction[J]. Nature Communications, 2014. DOI:10.1038/ncomms4242 |
| [13] |
Del Castillo A, Alvarez-Guerra M, Solla-Gullón J, et al. Electrocatalytic reduction of CO2 to formate using particulate Sn electrodes: Effect of metal loading and particle size[J]. Applied Energy, 2015, 157: 165-173. DOI:10.1016/j.apenergy.2015.08.012 |
| [14] |
Zhang B, Zhang J, Hua M, et al. Highly electrocatalytic ethylene production from CO2 on nanodefective Cu nanosheets[J]. Journal of the American Chemical Society, 2020, 142(31): 13606-13613. DOI:10.1021/jacs.0c06420 |
| [15] |
Zhou Y, Zhou R, Zhu X, et al. Mesoporous PdAg nanospheres for stable electrochemical CO2 reduction to formate[J]. Advanced Materials, 2020. DOI:10.1002/adma.202000992 |
| [16] |
Ma X, Shen Y, Yao S, et al. Core-shell nanoporous AuCu3@Au monolithic electrode for efficient electrochemical CO2 reduction[J]. Journal of Materials Chemistry A, 2020, 8(6): 3344-3350. DOI:10.1039/C9TA09471G |
| [17] |
Lamaison S, Wakerley D, Blanchard J, et al. High-current-density CO2-to-CO electroreduction on Ag-alloyed Zn dendrites at elevated pressure[J]. Joule, 2020, 4(2): 395-406. DOI:10.1016/j.joule.2019.11.014 |
| [18] |
Wang H, Tzeng Y K, Ji Y, et al. Synergistic enhancement of electrocatalytic CO2 reduction to C2 oxygenates at nitrogen-doped nanodiamonds/Cu interface[J]. Nature Nanotechnology, 2020, 15(2): 131-137. DOI:10.1038/s41565-019-0603-y |
| [19] |
Yin Z, Yu C, Zhao Z, et al. Cu3N nanocubes for selective electrochemical reduction of CO2 to ethylene[J]. Nano Letters, 2019, 19(12): 8658-8663. DOI:10.1021/acs.nanolett.9b03324 |
| [20] |
Zhang W, Huang C, Xiao Q, et al. Atypical oxygen-bearing copper boosts ethylene selectivity toward electrocatalytic CO2 reduction[J]. Journal of the American Chemical Society, 2020, 142(26): 11417-11427. DOI:10.1021/jacs.0c01562 |
| [21] |
Matheu R, Gutierrez-Puebla E, Monge M Á, et al. Three-dimensional phthalocyanine metal-catecholates for high electrochemical carbon dioxide reduction[J]. Journal of the American Chemical Society, 2019, 141(43): 17081-17085. DOI:10.1021/jacs.9b09298 |
| [22] |
Kang P, Zhang S, Meyer T J, et al. Rapid selective electrocatalytic reduction of carbon dioxide to formate by an iridium pincer catalyst immobilized on carbon nanotube electrodes[J]. Angewandte Chemie International Edition, 2014, 53(33): 8709-8713. DOI:10.1002/anie.201310722 |
| [23] |
Kauffman D R, Alfonso D, Matranga C, et al. Experimental and computational investigation of Au25 clusters and CO2: A unique interaction and enhanced electrocatalytic activity[J]. Journal of the American Chemical Society, 2012, 134(24): 10237-10243. DOI:10.1021/ja303259q |
| [24] |
Wang W, Shang L, Chang G, et al. Intrinsic carbon-defect-driven electrocatalytic reduction of carbon dioxide[J]. Advanced Materials, 2019, 31(19): 1808276. DOI:10.1002/adma.201808276 |
| [25] |
Talapaneni S N, Singh G, Kim I Y, et al. Nanostructured carbon nitrides for CO2 capture and conversion[J]. Advanced Materials, 2020. DOI:10.1002/adma.201904635 |
| [26] |
Chakraborty P, Ma T F, Zahiri A H, et al. Carbon-based materials for thermoelectrics[J]. Advances in Condensed Matter Physics, 2018, 2018: 1-29. |
| [27] |
Wu J, Yadav R M, Liu M, et al. Achieving highly efficient, selective, and stable CO2 reduction on nitrogen-doped carbon nanotubes[J]. ACS Nano, 2015, 9(5): 5364-5371. DOI:10.1021/acsnano.5b01079 |
| [28] |
Ye L, Ying Y, Sun D, et al. Highly efficient porous carbon electrocatalyst with controllable N-species content for selective CO2 reduction[J]. Angewandte Chemie International Edition, 2020, 59(8): 3244-3251. DOI:10.1002/anie.201912751 |
| [29] |
Wu J, Ma S, Sun J, et al. A metal-free electrocatalyst for carbon dioxide reduction to multi-carbon hydrocarbons and oxygenates[J]. Nature Communications, 2016. DOI:10.1638/ncomms13869 |
| [30] |
Mou S, Wu T, Xie J, et al. Boron phosphide nanoparticles: A nonmetal catalyst for high-selectivity electrochemical reduction of CO2 to CH3OH[J]. Advanced Materials, 2019. DOI:10.1002/adma.201903499 |
| [31] |
Yuan X, Zhang L, Li L, et al. Ultrathin Pd-Au shells with controllable alloying degree on Pd nanocubes toward carbon dioxide reduction[J]. Journal of the American Chemical Society, 2019, 141(12): 4791-4794. DOI:10.1021/jacs.8b11771 |
| [32] |
Ma S, Sadakiyo M, Heima M, et al. Electroreduction of carbon dioxide to hydrocarbons using bimetallic Cu-Pd catalysts with different mixing patterns[J]. Journal of the American Chemical Society, 2017, 139(1): 47-50. DOI:10.1021/jacs.6b10740 |
| [33] |
Zhang W, Hu Y, Ma L, et al. Progress and perspective of electrocatalytic CO2 reduction for renewable carbonaceous fuels and chemicals[J]. Advanced Science, 2018. DOI:10.1002/advs.201700275 |
| [34] |
Yang C, Li S, Zhang Z, et al. Organic-inorganic hybrid nanomaterials for electrocatalytic CO2 reduction[J]. Small, 2020. DOI:10.1002/smll.202001847 |
| [35] |
Nevin K P, Woodard T L, Franks A E, et al. Microbial electrosynthesis: Feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds[J]. mBio, 2010, 1(2): e00103-e00110. |
| [36] |
Rabaey K, Rozendal R A. Microbial electrosynthesis-revisiting the electrical route for microbial production[J]. Nature Reviews Microbiology, 2010, 8(10): 706-716. DOI:10.1038/nrmicro2422 |
| [37] |
Li H, Opgenorth P H, Wernick D G, et al. Integrated electromicrobial conversion of CO2 to higher alcohols[J]. Science, 2012. DOI:10.1126/science.1217643 |
| [38] |
Chen X, Cao Y, Li F, et al. Enzyme-assisted microbial electrosynthesis of poly(3-hydroxybutyrate) via CO2 bioreduction by engineered ralstonia eutropha[J]. ACS Catalysis, 2018, 8(5): 4429-4437. DOI:10.1021/acscatal.8b00226 |
| [39] |
Krieg T, Sydow A, Faust S, et al. CO2 to terpenes: Autotrophic and electroautotrophic α-humulene production with cupriavidus necator[J]. Angewandte Chemie, 2018, 130(7): 1897-1900. DOI:10.1002/ange.201711302 |
| [40] |
Tremblay P L, Zhang T. Electrifying microbes for the production of chemicals[J]. Frontiers in Microbiology, 2015. DOI:10.3389/fmicb.2015.00201 |
| [41] |
Tremblay P L, Angenent L T, Zhang T. Extracellular electron uptake: Among autotrophs and mediated by surfaces[J]. Trends in Biotechnology, 2017, 35(4): 360-371. DOI:10.1016/j.tibtech.2016.10.004 |
| [42] |
Lee S Y, Oh Y K, Lee S, et al. Recent developments and key barriers to microbial CO2 electrobiorefinery[J]. Bioresource Technology, 2021. DOI:10.1016/j.biortech.2020.124350 |
| [43] |
Nevin K P, Hensley S A, Franks A E, et al. Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms[J]. Applied and Environmental Microbiology, 2011, 77(9): 2882-2886. DOI:10.1128/AEM.02642-10 |
| [44] |
Walker D J F, Martz E, Holmes D E, et al. The Archaellum of methanospirillum hungatei is electrically conductive[J]. bioRxiv, 2018. DOI:10.1101/458356 |
| [45] |
Cheng S, Xing D, Call D, et al. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology, 2009, 43(10): 3953-3958. |
| [46] |
Yu L, Yuan Y, Tang J, et al. Thermophilic Moorella thermoautotrophica-immobilized cathode enhanced microbial electrosynthesis of acetate and formate from CO2[J]. Bioelectrochemistry, 2017, 117: 23-28. DOI:10.1016/j.bioelechem.2017.05.001 |
| [47] |
Flexer V, Jourdin L. Purposely designed hierarchical porous electrodes for high rate microbial electrosynthesis of acetate from carbon dioxide[J]. Accounts of Chemical Research, 2020, 53(2): 311-321. DOI:10.1021/acs.accounts.9b00523 |
| [48] |
Cheng S, Mao Z, Sun Y, et al. A novel electrochemical oxidation-methanogenesis system for simultaneously degrading antibiotics and reducing CO2 to CH4 with low energy costs[J]. Science of the Total Environment, 2021. DOI:10.1016/j.scitotenv.2020.141732 |
| [49] |
Luo H, Qi J, Zhou M, et al. Enhanced electron transfer on microbial electrosynthesis biocathode by polypyrrole-coated acetogens[J]. Bioresource Technology, 2020. DOI:10.1016/j.biortech.2020.123322 |
| [50] |
Faraghiparapari N, Zengler K. Production of organics from CO2 by microbial electrosynthesis (MES) at high temperature[J]. Journal of Chemical Technology & Biotechnology, 2017, 92(2): 375-381. |
| [51] |
Mohanakrishna G, Abu Reesh I M, Vanbroekhoven K, et al. Microbial electrosynthesis feasibility evaluation at high bicarbonate concentrations with enriched homoacetogenic biocathode[J]. Science of the Total Environment, 2020. DOI:10.1016/j.scitotenv.2020.137003 |
| [52] |
Claassens N J, Sánchez-Andrea I, Sousa D Z, et al. Towards sustainable feedstocks: A guide to electron donors for microbial carbon fixation[J]. Current Opinion in Biotechnology, 2018, 50: 195-205. DOI:10.1016/j.copbio.2018.01.019 |
| [53] |
Jourdin L, Freguia S, Flexer V, et al. Bringing high-rate, CO2-based microbial electrosynthesis closer to practical implementation through improved electrode design and operating conditions[J]. Environmental Science & Technology, 2016, 50(4): 1982-1989. |
| [54] |
Geppert F, Liu D, van Eerten-Jansen M, et al. Bioelectrochemical power-to-gas: State of the art and future perspectives[J]. Trends in Biotechnology, 2016, 34(11): 879-894. DOI:10.1016/j.tibtech.2016.08.010 |
| [55] |
Li J, Li Z, Xiao S, et al. Startup cathode potentials determine electron transfer behaviours of biocathodes catalysing CO2 reduction to CH4 in microbial electrosynthesis[J]. Journal of CO2 Utilization, 2020, 35: 169-175. DOI:10.1016/j.jcou.2019.09.013 |
| [56] |
Torella J P, Gagliardi C J, Chen J S, et al. Efficient solar-to-fuels production from a hybrid microbial-water-splitting catalyst system[J]. PNAS, 2015, 112(8): 2337-2342. DOI:10.1073/pnas.1424872112 |
| [57] |
Liu C, Colón B C, Ziesack M, et al. Water splitting-biosynthetic system with CO2 reduction efficiencies exceeding photosynthesis[J]. Science, 2016, 352(6290): 1210-1213. DOI:10.1126/science.aaf5039 |
| [58] |
Rodrigues R M, Guan X, Iñiguez J A, et al. Perfluorocarbon nanoemulsion promotes the delivery of reducing equivalents for electricity-driven microbial CO2 reduction[J]. Nature Catalysis, 2019, 2(5): 407-414. DOI:10.1038/s41929-019-0264-0 |
| [59] |
Abel A J, Clark D S. A comprehensive modeling analysis of formate-mediated microbial electrosynthesis[J]. ChemSusChem, 2021, 14(1): 344-355. DOI:10.1002/cssc.202002079 |
| [60] |
Stöckl M, Harms S, Dinges I, et al. From CO2 to bioplastic-coupling the electrochemical CO2 reduction with a microbial product generation by drop-in electrolysis[J]. ChemSusChem, 2020, 13(16): 4086-4093. DOI:10.1002/cssc.202001235 |
| [61] |
Tashiro Y, Hirano S, Matson M M, et al. Electrical-biological hybrid system for CO2 reduction[J]. Metabolic Engineering, 2018, 47: 211-218. DOI:10.1016/j.ymben.2018.03.015 |
| [62] |
Guan J, Berlinger S A, Li X, et al. Development of reactor configurations for an electrofuels platform utilizing genetically modified iron oxidizing bacteria for the reduction of CO2 to biochemicals[J]. Journal of Biotechnology, 2017, 245: 21-27. DOI:10.1016/j.jbiotec.2017.02.004 |
| [63] |
Khunjar W O, Sahin A, West A C, et al. Biomass production from electricity using ammonia as an electron carrier in a reverse microbial fuel cell[J]. PLoS One, 2012. DOI:10.1371/journal.pone.0044846 |
| [64] |
Steinbusch K J, Hamelers H V, Schaap J D, et al. Bioelectrochemical ethanol production through mediated acetate reduction by mixed cultures[J]. Environmental Science & Technology, 2010, 44(1): 513-517. |
| [65] |
Song J, Kim Y, Lim M, et al. Microbes as electrochemical CO2 conversion catalysts[J]. ChemSusChem, 2011, 4(5): 587-590. DOI:10.1002/cssc.201100107 |
| [66] |
Seelajaroen H, Haberbauer M, Hemmelmair C, et al. Enhanced bio-electrochemical reduction of carbon dioxide by using neutral red as a redox mediator[J]. ChemBioChem, 2019, 20(9): 1196-1205. DOI:10.1002/cbic.201800784 |
| [67] |
Nishio K, Nakamura R, Lin X, et al. Extracellular electron transfer across bacterial cell membranes via a cytocompatible redox-active polymer[J]. ChemPhysChem, 2013, 14(10): 2159-2163. DOI:10.1002/cphc.201300117 |
| [68] |
Kaneko M, Ishikawa M, Song J, et al. Cathodic supply of electrons to living microbial cells via cytocompatible redox-active polymers[J]. Electrochemistry Communications, 2017, 75: 17-20. DOI:10.1016/j.elecom.2016.12.002 |
| [69] |
Claassens N J, Cotton C A R, Kopljar D, et al. Making quantitative sense of electromicrobial production[J]. Nature Catalysis, 2019, 2(5): 437-447. DOI:10.1038/s41929-019-0272-0 |
| [70] |
Lovley D R, Nevin K P. Electrobiocommodities: Powering microbial production of fuels and commodity chemicals from carbon dioxide with electricity[J]. Current Opinion in Biotechnology, 2013, 24(3): 385-390. DOI:10.1016/j.copbio.2013.02.012 |
| [71] |
Haas T, Krause R, Weber R, et al. Technical photosynthesis involving CO2 electrolysis and fermentation[J]. Nature Catalysis, 2018, 1(1): 32-39. DOI:10.1038/s41929-017-0005-1 |
| [72] |
Karthikeyan R, Singh R, Bose A. Microbial electron uptake in microbial electrosynthesis: A mini-review[J]. Journal of Industrial Microbiology & Biotechnology, 2019, 46(9/10): 1419-1426. |
| [73] |
Kracke F, Deutzmann J S, Gu W, et al. In situ electrochemical H2 production for efficient and stable power-to-gas electromethanogenesis[J]. Green Chemistry, 2020, 22(18): 6194-6203. DOI:10.1039/D0GC01894E |
 2021, Vol. 38
2021, Vol. 38






