阿特拉津(ATZ)是一种应用广泛的除草剂,但由于其毒性和生物难降解性,对动植物和环境产生了较大影响,所以,对ATZ的降解已引起了人们越来越多的关注[1-2]。为了有效降解ATZ,基于生物、物理和化学的多种处理技术已经被广泛研究[3-4]。其中,高级氧化技术(AOPs)具有降解效率高和环境友好等特点,被认为是一种具有良好应用前景的技术。
近年来,AOPs中基于活化过一硫酸盐(PMS)产生硫酸自由基(SO4·-)降解有机污染物的方法已经成为废水处理研究的热点[5-6]。PMS的活化方法主要有碱活化[7]、超声活化[8]、过渡金属活化[9]等。过渡金属中的钴基催化剂,因对PMS具有良好的催化性能[10],而被用于活化PMS降解有机污染物。其中,钴基-普鲁士蓝类似物Co3[Co(CN)6]2(CoCo-PBA)是一种典型的金属有机框架材料,具有比表面积大,结构可控以及金属位点排列有序等特点[11-12],作为活化PMS的催化剂时表现出了优良的性能[13-14]。但是由于CoCo-PBA在水溶液中的回收性较差[15-17],这一定程度上限制了它的应用,因此,开发一种负载CoCo-PBA的催化剂是非常有必要的。
层状双金属氢氧化物(LDH)因其层间阴离子的可交换性和空间的可调控性[18],被认为是一种理想的催化剂载体,所以,可考虑将CoCo-PBA负载于LDH层上制得相对易于回收的非均相催化剂。由于Cu2+能有效活化PMS[19],并且Fe与其他过渡金属相比具有成本方面的优势,因此,LDH可选择由Cu2+和Fe3+构成的CuFe-LDH。
本研究采用共沉淀法将CoCo-PBA负载于LDH上制得相对易于回收的CoCo-PBA@CuFe-LDH复合材料。通过ATZ的降解研究CoCo-PBA@CuFe-LDH活化PMS的催化性能,重点考察催化剂用量、PMS用量、初始pH值、温度以及共存离子等对ATZ降解率的影响和催化剂的重复使用性,在此基础上通过电子顺磁光谱和淬灭实验,确定CoCo-PBA@CuFe-LDH/PMS体系中的活性物质。
1 实验部分 1.1 实验药品阿特拉津(C8H14ClN5, ATZ)购买于南京都莱生物技术有限公司;硝酸铁(Fe(NO3)3·9H2O)、过一硫酸盐(2KHSO5·KHSO4·K2SO4, PMS)、硝酸铜[Cu(NO3)2·3H2O]、醋酸钴[Co(CH3COO)2·4H2O]、柠檬酸钠(C6H5Na3O7·2H2O)、和乙二醇(C2H6O2)均由阿拉丁生化科技股份有限公司提供;钴氰化钾[K3Co(CN)6]和乙醇(C2H6O)在北京伊诺凯科技有限公司购买; 硫酸(H2SO4)和氢氧化钠(NaOH)从天津元立化工有限公司购买;正丙醇(C3H7OH)、叔丁醇(C4H10O)、甲醇(CH3OH,色谱级)和乙腈(C2H3N,色谱级)均由科密欧化学试剂有限公司提供。所有的药品无特别说明均为分析纯,使用时未进一步提纯。实验室用水为超纯水。
1.2 CoCo-PBA@CuFe-LDH复合材料的制备 1.2.1 CuFe-LDH的制备采用共沉淀法制备CuFe-LDH。首先,将12 mmol Cu(NO3)2·3H2O和6 mmol Fe(NO3)3·9H2O完全溶解于175 mL由超纯水、正丙醇和乙二醇按体积比3∶3∶1构成的混合溶剂中,然后,在氮气氛围和充分的磁力搅拌下,向混合溶液中逐滴添加0.2 mol/L NaOH,直至pH=9,将得到的固体悬浮物在室温下老化24 h。最后,离心分离收集沉淀物,并用超纯水反复清洗数次,70 ℃下真空干燥,得到CuFe-LDH,研磨成粉备用。
1.2.2 CoCo-PBA@CuFe-LDH的制备采用共沉淀法制备复合材料CoCo-PBA@CuFe-LDH。首先,将0.5 g制得的CuFe-LDH分散到50 mL 0.2 mol·L-1的K3[Co(CN)6]溶液中,磁力搅拌使[Co(CN)6]3-离子充分替换CuFe-LDH层间的NO3-,6 h后离心收集中间产物,并用超纯水反复清洗数次。然后,将中间产物加入到100 mL含有3 mmol (CH3COO)2Co·4H2O和4.5 mmol C6H5Na3O7·2H2O的溶液中,室温下磁力搅拌20 h,最后,离心分离收集沉淀物,并用超纯水反复清洗数次,70 ℃下真空干燥,得到复合材料CoCo-PBA@CuFe-LDH,研磨成粉备用。
1.3 降解实验首先,将一定量制得的催化剂加入到200 mL ATZ溶液中,298 K水浴加热,磁力搅拌30 min,使催化剂与ATZ达到充分的吸附/解吸平衡。然后,加入一定量的PMS引发降解反应,并在一定时间间隔内取样3 mL加入盛有1 mL甲醇的离心管中进行淬灭,使用0.2 μm注射器式过滤器进行快速过滤。最后,用HPLC分析ATZ的浓度。每次实验结束后,离心收集催化剂并用超纯水清洗数次,烘干备用。在考察体系初始pH值对ATZ降解效果的影响时,使用1 mol·L-1的NaOH溶液和1 mol·L-1的H2SO4溶液调节ATZ溶液的初始pH值。
1.4 表征与分析对制备得到的CoCo-PBA@CuFe-LDH复合材料分别采用X射线衍射仪(XRD, D8-Focus, 德国布鲁克公司)、电感耦合等离子体发射光谱(ICP-OES,Varian-VISTA-MPX,美国瓦里安公司)、发射扫描电子显微镜(FE-SEM, S4800, 日本日立公司)以及X射线能谱仪(EDS)测定样品的晶体结构、金属元素组成、形貌以及元素分布等信息。利用电子顺磁共振波谱仪(EPR,A300,德国布鲁克公司)检测CoCo-PBA@CuFe-LDH/PMS体系生成的活性物质。
采用高效液相色谱仪(HPLC,LC-2030,日本岛津公司)检测ATZ的浓度。检测条件为:色谱柱: WondaSilⓇ C18 Superb 5 μm column (4.6 mm×250 mm);进样量:20 μL;柱温:30 ℃;UV检测波长:222 nm;流动相:乙腈和超纯水(体积比为70∶30);流速:1 mL·min-1。
2 结果与讨论 2.1 复合材料的的表征 2.1.1 XRD和ICP-OES分析将制得的CuFe-LDH和复合材料CoCo-PBA@CuFe-LDH进行XRD测试,结果如图 1所示。

|
| 图 1 合成样品的XRD图谱 Fig.1 XRD patterns of prepared samples |
| |
由图 1可知,CuFe-LDH在2θ=12.9°、25.8°、33.6°、36.6°、38.7°、58.3°和60.9°处的衍射峰,分别对应(003)、(006)、(009)、(012)、(015)、(110)和(113)晶面,与Kamellia Nejati等的研究结果相似[20],说明已成功合成了Cu2+与Fe3+物质的量之比为2.00/1.00的CuFe-LDH。对于CoCo-PBA@CuFe-LDH复合材料的XRD衍射峰,通过与CoCo-PBA的标准PDF卡片(JCPDS 77-1161)进行比对,匹配情况良好[21],这说明制得的复合材料中含有CoCo-PBA,但是未观察到明显的CuFe-LDH衍射峰。为了揭示未发现CuFe-LDH衍射峰的原因,使用ICP-OES进一步测定了2种样品中的金属元素组成,结果如表 1所示。结果发现,合成的CuFe-LDH中Cu与Fe的物质的量之比为2.01∶1.00,而CoCo-PBA@CuFe-LDH复合材料中Cu与Fe的物质的量之比为1.18∶1.00,这可能是由于CoCo-PBA在CuFe-LDH上生长过程中,破坏了CuFe-LDH原有的层板结构,导致了元素比例发生了变化。另外,根据Ma等[22]的研究结果CuFe-LDH中Cu2+与Fe3+物质的量之比的降低会引起XRD衍射峰强度逐渐变弱,所以在复合材料CoCo-PBA@CuFe-LDH的衍射峰中没发现明显的CuFe-LDH衍射峰。
| Sample | The molar ratio of Fe, Cu and Co |
| CuFe-LDH | 1.00∶2.01∶0 |
| CoCo-PBA@CuFe-LDH | 1.00∶1.18∶2.48 |
图 2显示了制得的CuFe-LDH和复合材料CoCo-PBA@CuFe-LDH的形貌。

|
| 图 2 CuFe-LDH的SEM图a)和CoCo-PBA@CuFe-LDH的SEM图b) 与EDS元素映射图c)~h) Fig.2 SEM image of CuFe-LDHand b) SEM image and c)—h)EDS elemental mappings of CoCo-PBA@CuFe-LDH |
| |
从图 2a)中可以观察到明显的层状结构,说明成功制备了层状双金属氢氧化物CuFe-LDH。从图 2b)中也可以能观察到轻微的层状结构。但由于CoCo-PBA的负载,CuFe-LDH中Cu2+/Fe3+的物质的量之比由负载前的2.01变成了负载后的1.18,Cu2+与Fe3+的物质的量之比的改变会影响到LDH层板的原子排布,进而导致LDH的形貌也会发生一些改变[23],观察到的层状结构不明显,有团聚的颗粒。另外,EDS分析的结果显示出Co、Cu和Fe等元素在复合材料中均匀分布,结果如图 2c)~图 2h)所示。
根据上述几个表征分析结果,可以推断出CoCo-PBA已经成功地负载在CuFe-LDH上,制备得到了复合材料CoCo-PBA@CuFe-LDH。
2.2 不同活化条件对ATZ降解效果的影响PMS降解有机污染物ATZ首先要通过催化剂CoCo-PBA@CuFe-LDH活化产生大量的活性自由基,进而实现有机污染物的降解。催化剂的用量、PMS的用量、反应温度、初始pH值以及体系中的杂质离子都会对降解效果产生一定的影响。
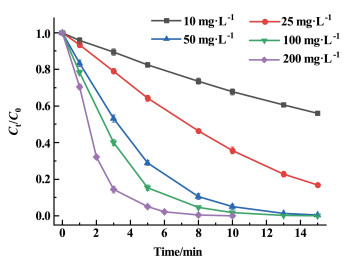
2.2.1 CoCo-PBA@CuFe-LDH用量的影响在保持ATZ浓度为15 mg·L-1,PMS用量为300 mg·L-1,初始pH值为6.3的条件下,考察催化剂CoCo-PBA@CuFe-LDH用量的改变对ATZ降解的影响,结果如图 3所示。
|
| 图 3 CoCo-PBA@CuFe-LDH用量对ATZ降解的影响 Fig.3 Effect of CoCo-PBA@CuFe-LDH dosage on ATZ degradation |
| |
由图 3可知,当催化剂的用量从10 mg·L-1提升至50 mg·L-1,反应进行10 min时,ATZ降解率从30.6% 提升到了95.3%。但CoCo-PBA@CuFe-LDH的剂量从50 mg·L-1进一步提升至200 mg·L-1时,反应进行10 min时,对应的ATZ降解率从95.3%提升到了99.9%。这是因为催化剂用量较低时,提升催化剂量可以提供更多活性位点,降解效率提升非常显著,催化剂的用量是影响降解反应的关键因素。当催化剂量达到一定水平后,活性位点数量趋于饱和,进一步提高催化剂量对于降解效果提升并不明显,所以降解实验中催化剂的用量选择为50 mg·L-1。
2.2.2 PMS用量的影响在保持ATZ浓度为15 mg·L-1,初始pH值为6.3,CoCo-PBA@CuFe-LDH用量为50 mg·L-1的条件下,考察改变PMS用量对ATZ降解的影响,结果如图 4所示。当PMS的用量在50~300 mg·L-1范围时,随着PMS用量的提升,ATZ的降解效率显著提升。当PMS用量进一步提升至350 mg·L-1时,ATZ的降解效率略微有下降。这主要是因为在PMS用量较低时,CoCo-PBA@CuFe-LDH表面提供的活性位点较多,没有被完全利用,ATZ的降解效率随着PMS用量的提升而增加。但当PMS剂量过多时,由于过量的HSO5-会淬灭部分生成的活性物质,生成低反应活性的SO5·-[24-25],导致活性物质的减少,使得ATZ的降解效率稍有下降。因此,降解实验中PMS的用量选择为300 mg·L-1。

|
| 图 4 PMS用量对ATZ降解的影响 Fig.4 Effect of PMS dosage on ATZ degradation |
| |
在保持ATZ浓度为15 mg·L-1,PMS用量为300 mg·L-1,CoCo-PBA@CuFe-LDH用量为50 mg·L-1的条件下,考察改变初始pH值对ATZ降解的影响,结果如图 5所示。

|
| 图 5 初始pH值对ATZ降解的影响 Fig.5 Effect of initial pH value on ATZ degradation |
| |
由图 5可知,ATZ溶液的初始pH值为6.3,当反应初始pH值由6.3降低至3.0时,ATZ的降解率由99.5%降低到49.4%。当初始pH值进一步增加至11.0时,ATZ的降解效率显著下降,这主要是是因为在酸性条件下,随着初始酸度的增强,反应体系H+浓度增加,会消耗部分产生活性物质如SO4·-和·OH[24, 26],也可能会破坏催化剂的结构,从而导致反应效率降低。当在碱性条件时,由于H2SO5的pKa2为9.4,HSO5-易转化为非自由基SO52-,另外,淬灭实验的结果显示SO4·-是ATZ降解过程中起主要作用的自由基,OH-可能与SO4·-发生反应可生成·OH[10, 27],导致ATZ降解效率略有下降,因此选择在初始pH值为6.3的环境下进行降解实验
2.2.4 温度的影响在保持ATZ浓度为15 mg·L-1,CoCo-PBA@CuFe-LDH用量为50 mg·L-1,PMS用量为300 mg·L-1,初始pH值为6.3的条件下,考察了不同反应温度时ATZ的降解率,结果如图 6所示。

|
| 图 6 温度对ATZ降解的影响;b) ATZ降解的Arrhenius曲线 Fig.6 Effect of temperature on ATZ degradation; b) The Arrhenius curves of ATZ degradation |
| |
由图 6可知,当反应温度为293、298、303和308 K时,反应5 min后ATZ的降解率分别为48.0%、71.2%、89.0%和98.6%,表明温度的升高可以提高ATZ的降解率。对该反应过程,采用拟一级动力学模型ln(Ct/C0)=-kobs t进行描述,计算得到不同温度下反应动力学常数kobs值,结果如表 2所示。
| T/K | kobs/min-1 | R2 of kobs |
| 293 | 0.173 | 0.993 |
| 298 | 0.326 | 0.989 |
| 303 | 0.532 | 0.987 |
| 308 | 0.729 | 0.994 |
根据Arrhenius方程,通过绘制lnkobs与1/T的关系图,计算得到了CoCo-PBA@CuFe-LDH/PMS体系ATZ降解反应的活化能Ea为72.2 kJ·mol-1,说明温度对ATZ的降解速率影响较大,综合考虑选择在室温298 K下进行降解实验。
| $ {\rm{ln}}{k_{obs}} = {\rm{ln}}A - {E_a}/RT $ | (1) |
式(1)中:kobs为表观速率常数,min-1;Ea为表观活化能,kJ·mol-1;R为摩尔气体常数,8.314 J·mol-1·K-1;A为指前因子,min-1。
2.2.5 共存离子(HCO3-, H2PO4-和Cl-)的影响在废水中通常会含有一些其它的无机离子,这些离子的存在往往会对目标物的降解产生一定的影响。对于CoCo-PBA@CuFe-LDH/PMS降解ATZ体系来说,阴离子的影响往往大于阳离子的影响,所以论文对于HCO3-,H2PO4-,和Cl-等3种常见的阴离子对对该体系的影响进行了研究,结果如图 7所示。

|
| 图 7 a) HCO3-; b) H2PO4-和c) Cl-对ATZ降解的影响 Fig.7 Effect of a) HCO3-; b) H2PO4- and c) Cl- on ATZ degradation |
| |
由图 7可知,在CoCo-PBA@CuFe-LDH/PMS降解ATZ体系中,3种离子均表现出对ATZ降解的抑制作用。对于HCO3-和H2PO4-来说,随着浓度的增加其抑制作用也逐渐增加,这是因为HCO3-和H2PO4-均能快速与SO4·-和·OH反应并生成无反应活性的HCO3·-和H2PO4·-等[28-29],进而影响了ATZ的降解率。但对于Cl-来说,当Cl-浓度从2 mmol·L-1提升至10 mmol·L-1时,表现出对ATZ降解的抑制作用随着浓度的增加而逐渐增强,但当浓度进一步提升至50 mmol·L-1时,其抑制作用与10 mmol·L-1时的相比并没有明显提升。这主要由Cl-所参与的反应不同所造成。虽然Cl-可以消耗一部分SO4·-和·OH,会造成ATZ降解效率的下降,但是同时也能直接与HSO5-反应[30-32],所以在Cl-浓度较高时并没有表现出更为严重的抑制作用。
2.3 CoCo-PBA@CuFe-LDH活化PMS降解ATZ的性能通过对比不同体系(仅PMS、仅CoCo-PBA@CuFe-LDH、Co-PBA@CuFe-LDH/PMS)下ATZ的降解情况,来分析CoCo-PBA@CuFe-LDH催化剂活化PMS的活化性能,结果如图 8所示。

|
| 图 8 不同体系下ATZ降解情况 Fig.8 Degradation of ATZ in different systems |
| |
通过上述各种影响因素的考察,得到了较适宜的降解条件,ATZ浓度为15 mg·L-1,催化剂用量为50 mg·L-1,PMS用量为300 mg·L-1,初始pH值为6.3,反应温度为298 K。在此反应条件下,通过活化PMS降解ATZ(CoCo-PBA@CuFe-LDH/PMS),反应15 min后ATZ降解率可以达到99.5%。对比无活化的PMS自氧化降解ATZ的过程,降解率小于3%。同样,对比只有CoCo-PBA@CuFe-LDH而无PMS参与的降解过程,ATZ的降解率也很低,不到3%,说明CoCo-PBA@CuFe-LDH对于PMS具有优异的活化性能,使该体系发挥出了较高的氧化作用。
2.4 CoCo-PBA@CuFe-LDH的稳定性催化剂的重复使用性和稳定性是影响催化剂实际应用价值的重要因素。在保持ATZ浓度为15 mg·L-1,催化剂用量为50 mg·L-1,PMS用量为300 mg·L-1,初始pH值为6.3,温度为298 K的条件下,将制得的催化剂CoCo-PBA@CuFe-LDH循环反应4次,以考察其使用稳定性,结果如图 9所示。

|
| 图 9 a) CoCo-PBA@CuFe-LDH重复使用对ATZ降解的效果; b) CoCo-PBA@CuFe-LDH的XRD图谱 Fig.9 a)Effect of reuse of CoCo-PBA@CuFe-LDH on ATZ degradation; b) XRD patterns of CoCo-PBA@CuFe-LDH |
| |
在4次实验中反应时间为15 min时,ATZ的降解率分别为99.5%, 95.1%, 89.6%和83.4%,说明经过4次运行后CoCo-PBA@CuFe-LDH仍能保持较高的活化性能,具有较好的重复使用性。为了进一步考察催化剂的稳定性,使用ICP-OES检测CoCo-PBA@CuFe-LDH的金属离子的浸出量,测得铜、钴、铁的浸出量分别为1.35、0.48和0.09 mg·L-1,造成每1次ATZ降解效率的降低。但是与文献[33]报道的一些催化剂相比,CoCo-PBA@CuFe-LDH中浸出的金属离子相对较少,说明CoCo-PBA@CuFe-LDH具有较好的稳定性。此外,对比4次反应前后CoCo-PBA@CuFe-LDH的XRD图谱,发现反应前后的衍射峰并未发生明显改变,说明所制得的复合材料的晶体结构没有明显改变,具有很好的稳定性。
2.5 氧化活性物质的识别根据文献[5]报道,过渡金属活化PMS降解污染物的过程中可能会同时存在SO4·-和·OH 2种活性物质。为证实CoCo-PBA@CuFe-LDH/PMS体系中SO4·-和·OH自由基的存在与否,以DMPO为自由基捕捉剂,进行EPR实验,测定了该反应体系在不同反应时间时的电子顺磁共振波谱,结果如图 10a)所示。

|
| 图 10 a) CoCo-PBA@CuFe-LDH/PMS体系的EPR光谱;b) 淬灭剂对CoCo-PBA@CuFe-LDH/PMS体系中CBZ降解的影响 Fig.10 a) EPR spectra of CoCo-PBA@CuFe-LDH/PMS system; b) effect of quenching agents on ATZ degradation in CoCo-PBA@CuFe-LDH/PMS system |
| |
由图 10a)可观察到DMPO-HO·和DMPO-SO4·-的特征信号峰,说明CoCo-PBA@CuFe-LDH/PMS体系中同时存在SO4·-和·OH 2种自由基。另外,随着反应的进行,DMPO-SO4·-的信号峰仅有轻微的变化,而DMPO-HO·的信号峰却逐渐增强,这可能是由于在反应过程中,HSO5-不断生成SO4·-,而SO4·-又被消耗生成了更多的·OH[34]。
为了进一步确认CoCo-PBA@CuFe-LDH/PMS体系中存在的氧化活性物质以及它们对ATZ降解的贡献度,论文进行了淬灭实验研究。由于乙醇(EtOH)与SO4·-和·OH均发生反应,且具有非常高的反应速率[k(·OH+EtOH)=1.9×109L·mol-1·s-1, k(SO4·-+EtOH)=1.6×107 L·mol-1·s-1][35],而叔丁醇(TBA)与SO4·-和·OH也发生反应,但TBA与·OH的反应速率[k(·OH+TBA)=(3.8-7.6)×108 L·mol-1·s-1]是与SO4·-的反应速率[k(SO4·-+TBA)=(4.0-9.1)×105 L·mol-1·s-1]的1 000倍左右[24],因此,利用2者与SO4·-和·OH的反应速率的不同,分别将EtOH和TBA作自由基淬灭剂进行ATZ的降解反应,结果如图 10b)所示。由图 10可知,当EtOH的浓度为100 mmol·L-1时,ATZ降解反应几乎停止,说明活性物质已经全部被EtOH消耗掉;但当TBA浓度为100 mmol·L-1时,ATZ的降解率仍达到76%,表明SO4·-对ATZ的降解起到了关键的作用。
3 结论1) 采用共沉淀法将CoCo-PBA负载于层状双金属氢氧化物CuFe-LDH上,制得易于回收的CoCo-PBA@CuFe-LDH复合材料,用于活化PMS降解ATZ。
2) 通过考察降解过程中的主要影响因素发现,提高催化剂CoCo-PBA@CuFe-LDH用量和反应温度都有利于ATZ的降解;PMS用量过多会对ATZ的降解产生轻微的抑制作用;过酸和过碱的环境都对ATZ降解产生不利影响;系统中存在的HCO3-, H2PO4-和Cl-等离子对ATZ的降解均表现出了一定的抑制作用。
3) 研究得到了CoCo-PBA@CuFe-LDH活化PMS降解ATZ的较适宜的反应条件,ATZ浓度为15 mg·L-1,催化剂用量为50 mg·L-1,PMS用量为300 mg·L-1,初始pH值为6.3,反应温度为298 K。在此条件下,反应15 min后ATZ的降解率可以达到99.5%。经过循环使用4次后,ATZ的降解率仍然能达到83.4%,表明CoCo-PBA@CuFe-LDH具有较好的催化活性和重复使用性。
4) 利用EPR波谱和淬灭实验,发现CoCo-PBA@CuFe-LDH/PMS体系中可以同时产生SO4·-和·OH 2种自由基,其中SO4·-对ATZ的降解起到了更为关键的作用。
| [1] |
Bo L, Kiriarachchi H D, Bobb J A, et al. Preparation, activity, and mechanism of ZnIn2S4-based catalysts for photocatalytic degradation of atrazine in aqueous solution[J]. Journal of Water Process Engineering, 2020. DOI:10.1016/j.jwpe.2020.101334 |
| [2] |
de Albuquerque F P, de Oliveira J L, Moschini-Carlos V, et al. An overview of the potential impacts of atrazine in aquatic environments: Perspectives for tailored solutions based on nanotechnology[J]. Science of the Total Environment, 2020. DOI:10.1016/j.scitotenv.2019.13486 |
| [3] |
He H, Liu Y, You S, et al. A review on recent treatment technology for herbicide atrazine in contaminated environment[J]. International Journal of Environmental Research and Public Health, 2019. DOI:10.3390/ijerph16245129 |
| [4] |
Marican A, Durán-Lara E F. A review on pesticide removal through different processes[J]. Environmental Science and Pollution Research, 2018, 25(3): 2051-2064. DOI:10.1007/s11356-017-0796-2 |
| [5] |
Ghanbari F, Moradi M. Application of peroxymonosulfate and its activation methods for degradation of environmental organic pollutants: Review[J]. Chemical Engineering Journal, 2017, 310: 41-62. DOI:10.1016/j.cej.2016.10.064 |
| [6] |
Xiao R, Luo Z, Wei Z, et al. Activation of peroxymonosulfate/persulfate by nanomaterials for sulfate radical-based advanced oxidation technologies[J]. Current Opinion in Chemical Engineering, 2018, 19: 51-58. DOI:10.1016/j.coche.2017.12.005 |
| [7] |
Qi C, Liu X, Ma J, et al. Activation of peroxymonosulfate by base: Implications for the degradation of organic pollutants[J]. Chemosphere, 2016, 151: 280-288. DOI:10.1016/j.chemosphere.2016.02.089 |
| [8] |
Xu L, Wang X, Sun Y, et al. Mechanistic study on the combination of ultrasound and peroxymonosulfate for the decomposition of endocrine disrupting compounds[J]. Ultrasonics Sonochemistry, 2020. DOI:10.1016/j.ultsonch.2019.104749 |
| [9] |
Oh W, Dong Z, Lim T. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal: Current development, challenges and prospects[J]. Applied Catalysis B: Environmental, 2016, 194: 169-201. DOI:10.1016/j.apcatb.2016.04.003 |
| [10] |
Hu P, Long M. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Applied Catalysis B: Environmental, 2016, 181: 103-117. DOI:10.1016/j.apcatb.2015.07.024 |
| [11] |
Cao M, Wu X, He X, et al. Shape-controlled synthesis of Prussian blue analogue Co3[Co(CN)6]2 nanocrystals[J]. Chemical Communications, 2005(17): 2241-2243. DOI:10.1039/b500153f |
| [12] |
Deng L, Yang Z, Tan L, et al. Investigation of the Prussian blue analog Co3[Co(CN)6]2 as an anode material for nonaqueous potassium-ion batteries[J]. Advanced Materials, 2018. DOI:10.1002/adma.201802510 |
| [13] |
Lin K, Chen B, Chen C. Evaluating Prussian blue analogues MII3[MIII(CN)6]2 (MII=Co, Cu, Fe, Mn, Ni; MIII=Co, Fe) as activators for peroxymonosulfate in water[J]. RSC Advances, 2016, 6(95): 92923-92933. DOI:10.1039/C6RA16011E |
| [14] |
Zhao C, Liu B, Li X, et al. A Co-Fe Prussian blue analogue for efficient Fenton-like catalysis: The effect of high-spin cobalt[J]. Chemical Communications, 2019, 55(50): 7151-7154. DOI:10.1039/C9CC01872G |
| [15] |
Ai S, Guo X, Zhao L, et al. Zeolitic imidazolate framework-supported Prussian blue analogues as an efficient Fenton-like catalyst for activation of peroxymonosulfate[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019. DOI:10.1016/j.colsurfa.2019.123796 |
| [16] |
Wu C, Chiu Y, Lin K. Macrosphere-supported nanoscale Prussian blue analogues prepared via self-assembly as multi-functional heterogeneous catalysts for aqueous oxidative and reductive reactions[J]. Separation and Purification Technology, 2018, 199: 222-232. DOI:10.1016/j.seppur.2017.12.049 |
| [17] |
Vipin A K, Fugetsu B, Sakata I, et al. Cellulose nanofiber backboned Prussian blue nanoparticles as powerful adsorbents for the selective elimination of radioactive cesium[J]. Scientific Reports, 2016. DOI:10.1038/srep37009 |
| [18] |
Feng J, He Y, Liu Y, et al. Supported catalysts based on layered double hydroxides for catalytic oxidation and hydrogenation: General functionality and promising application prospects[J]. Chemical Society Reviews, 2015, 44(15): 5291-5319. DOI:10.1039/C5CS00268K |
| [19] |
Nfodzo P, Choi H. Triclosan decomposition by sulfate radicals: Effects of oxidant and metal doses[J]. Chemical Engineering Journal, 2011, 174(2/3): 629-634. |
| [20] |
Nejati K, Davary S, Saati M. Study of 2, 4-dichlorophenoxyacetic acid (2, 4-D) removal by Cu-Fe-layered double hydroxide from aqueous solution[J]. Applied Surface Science, 2013, 280: 67-73. DOI:10.1016/j.apsusc.2013.04.086 |
| [21] |
Zhang H, Li C, Chen D, et al. Facile preparation of Prussian blue analogue Co3[Co(CN)6]2 with fine-tuning color transition temperature as thermochromic material[J]. CrystEngComm, 2017, 19(15): 2057-2064. DOI:10.1039/C7CE00384F |
| [22] |
Ma Y, Chen F, Yang Q, et al. Sulfate radical induced degradation of methyl violet azo dye with CuFe layered doubled hydroxide as heterogeneous photoactivator of persulfate[J]. Journal of Environmental Management, 2018, 227: 406-414. |
| [23] |
Fan G, Li F, Evans D G, et al. Catalytic applications of layered double hydroxides: Recent advances and perspectives[J]. Chemical Society Reviews, 2014, 43(20): 7040-706. DOI:10.1039/C4CS00160E |
| [24] |
Hou L, Li X, Yang Q, et al. Heterogeneous activation of peroxymonosulfate using Mn-Fe layered double hydroxide: Performance and mechanism for organic pollutant degradation[J]. Science of The Total Environment, 2019, 663: 453-464. DOI:10.1016/j.scitotenv.2019.01.190 |
| [25] |
Ahmadi M, Ghanbari F. Combination of UVC-LEDs and ultrasound for peroxymonosulfate activation to degrade synthetic dye: Influence of promotional and inhibitory agents and application for real wastewater[J]. Environmental Science and Pollution Research, 2018, 25(6): 6003-6014. DOI:10.1007/s11356-017-0936-8 |
| [26] |
Zhang H, Wang J, Zhang X, et al. Enhanced removal of lomefloxacin based on peroxymonosulfate activation by Co3O4/δ-FeOOH composite[J]. Chemical Engineering Journal, 2019, 369: 834-844. DOI:10.1016/j.cej.2019.03.132 |
| [27] |
Wang J, Wang S. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517. DOI:10.1016/j.cej.2017.11.059 |
| [28] |
Zheng H, Bao J, Huang Y, et al. Efficient degradation of atrazine with porous sulfurized Fe2O3 as catalyst for peroxymonosulfate activation[J]. Applied Catalysis B: Environmental, 2019. DOI:10.1016/j.apcatb.2019.118056 |
| [29] |
Hong Y, Peng J, Zhao X, et al. Efficient degradation of atrazine by CoMgAl layered double oxides catalyzed peroxymonosulfate: Optimization, degradation pathways and mechanism[J]. Chemical Engineering Journal, 2019, 370: 354-363. DOI:10.1016/j.cej.2019.03.127 |
| [30] |
Anipsitakis G P, Dionysiou D D, Gonzalez M A. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds[J]. Environmental Science & Technology, 2006, 40(3): 1000-1007. |
| [31] |
Zhang H, Liu X, Lin C, et al. Peroxymonosulfate activation by hydroxylamine-drinking water treatment residuals for the degradation of atrazine[J]. Chemosphere, 2019, 224: 689-697. DOI:10.1016/j.chemosphere.2019.02.186 |
| [32] |
Ji Y, Dong C, Kong D, et al. New insights into atrazine degradation by cobalt catalyzed peroxymonosulfate oxidation: Kinetics, reaction products and transformation mechanisms[J]. Journal of Hazardous Materials, 2015, 285: 491-500. DOI:10.1016/j.jhazmat.2014.12.026 |
| [33] |
Wang G, Cheng C, Zhu J, et al. Enhanced degradation of atrazine by nanoscale LaFe1-xCuxO3-δ perovskite activated peroxymonosulfate: Performance and mechanism[J]. Science of The Total Environment, 2019, 673: 565-575. DOI:10.1016/j.scitotenv.2019.04.098 |
| [34] |
Gong C, Chen F, Yang Q, et al. Heterogeneous activation of peroxymonosulfate by Fe-Co layered doubled hydroxide for efficient catalytic degradation of Rhoadmine B[J]. Chemical Engineering Journal, 2017, 321: 222-232. DOI:10.1016/j.cej.2017.03.117 |
| [35] |
Zhang L, Zhao X, Niu C, et al. Enhanced activation of peroxymonosulfate by magnetic Co3MnFeO6 nanoparticles for removal of carbamazepine: Efficiency, synergetic mechanism and stability[J]. Chemical Engineering Journal, 2019, 362: 851-864. DOI:10.1016/j.cej.2019.01.078 |
 2021, Vol. 38
2021, Vol. 38





