2. 天津大学化工学院, 天津 300350
2. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300350, China
静电纺丝是一种制备微纳米纤维的常用方法。静电纺纳米纤维膜具有很高的比表面积,可调节孔隙度和孔径等优点,被广泛应用于伤口敷料、组织工程、药物递送等生物医用领域[1-4]。聚己内酯、聚乳酸、纤维素、透明质酸等生物材料都可以通过静电纺丝技术制备纳米纤维膜。透明质酸(HA)是由D-葡萄糖醛酸和N-乙酰-D-葡糖胺二糖单元组成的天然线性多糖,是细胞质基质的重要组成部分[5]。由于HA具有优异的生物相容性、可降解性,被广泛应用于生物医学领域,但是HA易溶于水、降解速度较快且黏弹性很高,可纺性较差,所以很多研究中通过对其改性或与其他物质混合来提高可纺性和耐水溶性。Takahashi等[6]分别用叠氮基和环辛基修饰HA,使其在PBS中降解时间超过14 d,提高了HA的耐水溶性;Ma等[7]将HA与壳聚糖混纺制备具有核壳结构的纤维,HA为核,提高了HA的可纺性和耐水溶性。
聚乙烯醇-苯乙烯吡啶(PVA-SBQ)是一种新型光敏高分子材料,在紫外光辐照下会发生交联形成具有网络结构的聚合物。由于PVA-SBQ具有良好的生物相容性、储存性能和光敏性,被广泛的用作光交联材料[8]。Tao等[9]利用PVA-SBQ与透明质酸成膜来提高透明质酸膜的耐水溶性,Liu等[10]对PVA-SBQ与PVA的电转移进行了研究,并应用于药物递送。
5-氟尿嘧啶(5-FU)是一种抗癌药物,对实体肿瘤具有广泛的活性,可用于乳腺癌、结直肠癌等恶性肿瘤的治疗[11-14]。但是5-FU在体内裸释速度较快且副作用严重,因此研究合适的给药载体,降低5-FU的释放速度具有重要的意义。
本研究利用甲基丙烯酸缩水甘油酯对透明质酸进行改性得到带双键的GMHA,GMHA和PVA-SBQ均可在紫外光下发生交联,形成复合纤维网络。采用静电纺丝技术制备了PVA-SBQ/GMHA纤维膜,并通过紫外光交联形成复合纤维膜,对辐照交联的最适宜时间以及交联前后纤维膜的耐水溶性、不同环境下的溶胀性能和药物释放进行了研究,表明交联后的纤维膜的耐水溶性和药物缓释性能都有明显的改善。
1 实验部分 1.1 主要原料甲基丙烯酸缩水甘油酯(GMA),分析纯,上海阿拉丁生化科技股份有限公司;透明质酸(HA),分析纯,上海阿拉丁生化科技股份有限公司;聚乙烯醇-苯乙烯吡啶盐(PVA-SBQ),168-H型,上海光毅印刷器材科技有限公司;2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮(I2959),分析纯,上海阿拉丁生化科技股份有限公司;5-氟尿嘧啶(5-FU),分析纯,上海晶纯生化科技股份有限公司;盐酸(37%水溶液),天津光复科技发展有限公司。
1.2 主要设备及仪器电导率仪,METTLER TOLED FE38,梅特勒-托利多国际贸易(上海)有限公司;傅里叶红外光谱仪(FT-IR),Nicolet iS50,赛默飞世尔科技公司;冷场发射扫描电子显微镜(SEM),Hitachi S-4800,日本HITACHI公司;透射电子显微镜(TEM),Hitachi H7650,日本HITACHI公司;紫外分光光度计,Lambda35,PerkinElmer公司。
1.3 样品制备 1.3.1 GMHA的合成取1 g HA溶于100 mL蒸馏水中,加入2.2 mL三乙胺、2.2 mL GMA、2.2 g四丁基溴化铵,反应24 h,将产物在蒸馏水中透析48 h,冷冻干燥得到GMHA样品[15]。
1.3.2 PVA-SBQ/GMHA纤维膜的制备将一定质量的PVA-SBQ在90 ℃下完全溶解于水配制5 mL浓度为40%的溶液,加入0.01 g GMHA,制备PVA-SBQ/GMHA的纺丝液。在电压20 kV、接收距离20 cm、给料速率1.0 mL/h的条件下静电纺得到PVA-SBQ/GMHA纤维膜。在PVA-SBQ/GMHA纺丝液中加入1.0%(质量分数,下同)的5-氟尿嘧啶,在相同的纺丝条件下制备载药PVA-SBQ/GMHA纤维膜。
1.4 结构表征与性能测试 1.4.1 FT-IR分析将研磨后的GMHA、HA样品和溴化钾混合、压片,用傅里叶红外光谱仪测试。
1.4.2 SEM分析将溶胀前后的纤维膜干燥,喷金,在冷场发射扫描电子显微镜下观察形貌,采用X特征射线能谱仪测定纤维膜表面F元素的含量,利用软件Nano Measurer测量纤维直径并求其平均值。
1.4.3 纺丝液电导率测试用电导率仪测试纺丝液的电导率,每种溶液重复测量3次,取平均值。
1.4.4 纤维膜溶胀比与溶失率的测定将PVA-SBQ、未光照的以及紫外光照不同时间的PVA-SBQ/GMHA纤维膜原样的质量记为w0,将纤维膜原样分别放入等体积的缓冲溶液中,每间隔2 h取出纤维膜,除去表面水分,3次称量其质量取平均值记为wh,将浸水后的样品烘干至恒质量后再次称取其质量记为w1,利用公式(1)求其溶胀比q1,利用公式(2)求其溶失率q2;同样将PVA-SBQ/GMHA纤维膜分别放置于不同pH值、温度的缓冲溶液中,按照上述方法求其溶胀比q1。
| $ {q_1} = {w_{\rm{h}}}/{w_0} $ | (1) |
| $ {q_2}{\rm{ = }}\left( {{w_0} - {w_1}} \right)/{w_0} \times 100{\rm{\% }} $ | (2) |
式(1)和式(2)中:w0为膜原样的质量,wh为浸水不同时间后吸水膜的质量,w1为浸水不同时间后干燥膜的质量。
1.4.5 纤维膜载药释放测试取一定质量的PVA-SBQ/GMHA载药纤维膜分别放置于相同体积的缓冲溶液中进行药物释放测试,在不同的时间间隔内量取5 mL的药物释放溶液于比色皿中,在波长为267 nm处测量溶液的吸光度,然后将溶液倒回。根据所测量的吸光度和5-FU的标准释放曲线,计算不同时间药物的累积释放量,结合纤维膜中药物的理论含量求出药物的累积释放百分比[16]。
样品纤维膜的理论载药量:
| $ m = {m_1}a/\left( {a + b + c} \right) $ | (3) |
式(3)中:m为纤维膜中药物的理论含量;m1为样品纤维膜的质量;a为纺丝液中药物的质量;b为纺丝液中GMHA的质量;c为纺丝液中PVA-SBQ的质量。
释放药物累积百分比:
| $ p = {m_{\rm{t}}}/m \times 100\% $ | (4) |
式(4)中:p为药物累积释放百分比;mt为药物累积释放量;m为载药纤维膜样品的理论载药量。
2 结果与讨论 2.1 透明质酸的修饰图 1为HA与GMHA的红外谱图。

|
| 图 1 HA与GMHA的红外光谱 Fig.1 FTIR spectra of HA and GMHA powders |
| |
从图 1中可以看出改性后的GMHA在1 732 cm-1处出现酯羰基的峰,说明用甲基丙烯酸酐改性成功;在1 638 cm-1处出现的C=C键的特征峰与透明质酸酰胺键的峰位置相近,以致改性后峰形变宽;并且位于809 cm-1处的环氧基的特征峰消失,以上均表明GMA已成功接枝到HA上[17]。
2.2 形貌分析图 2是未载药及载药1.0%和2.5%的PVA-SBQ/GMHA纤维膜的扫描电镜、纤维直径分布及EDX元素分析图。随着药物含量增加,PVA-SBQ/GMHA纤维平均直径有所减小,原因是在纺丝溶液中加入药物后电导率增加(如表 1所示),导致纺丝过程中流体受到的电场力增大,纤维直径减小[18-20]。载药1.0%的PVA-SBQ/GMHA纤维膜表面出现少量药物聚集,而加入2.5%药后,有很多纺锤状PVA-SBQ/GMHA纤维出现,并且纤维膜表面出现了药物颗粒,其主要原因是5-FU在溶剂中的溶解度的限制,当载药量为1.0%时药物可以完全溶解,由于纺丝过程中溶剂挥发,部分5-FU裸露在纤维表面,当载药量增加到2.5%时,部分5-FU以颗粒的状态存在于纺丝溶液中,影响纺丝并在纺丝过程中直接附着在纤维表面[21-22]。EDX能谱测试结果也证明了这一点,载药前的纤维膜表面有微量的F元素存在,1.0%的载药纤维膜表面有少量的F元素存在,而2.5%的载药纤维膜表面有较多的F元素存在。
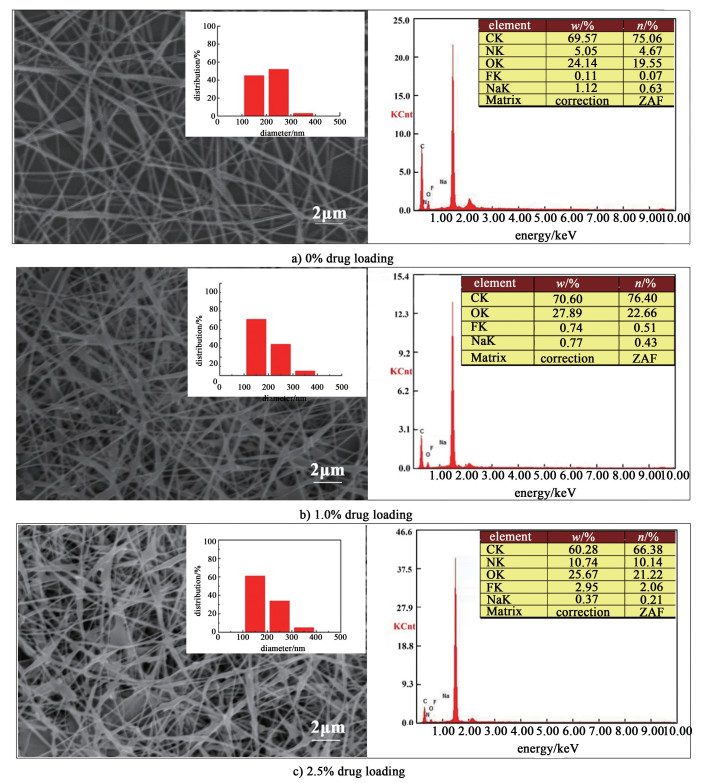
|
| 图 2 PVA-SBQ/GMHA纤维膜扫描电镜及纤维直径分布图 Fig.2 EDX and SEM of PVA-SBQ/GMHA fiber membrane |
| |
| 纺丝液 | 电导率/(μS·cm-1) |
| PVA-SBQ/GMHA | 1 175 |
| PVA-SBQ/GMHA+1% 5-FU | 1 297 |
| PVA-SBQ/GMHA+2% 5-FU | 1 409 |
图 3是不同光照时间下的PVA-SBQ/GMHA纤维膜在水中溶胀后的扫描电镜图。
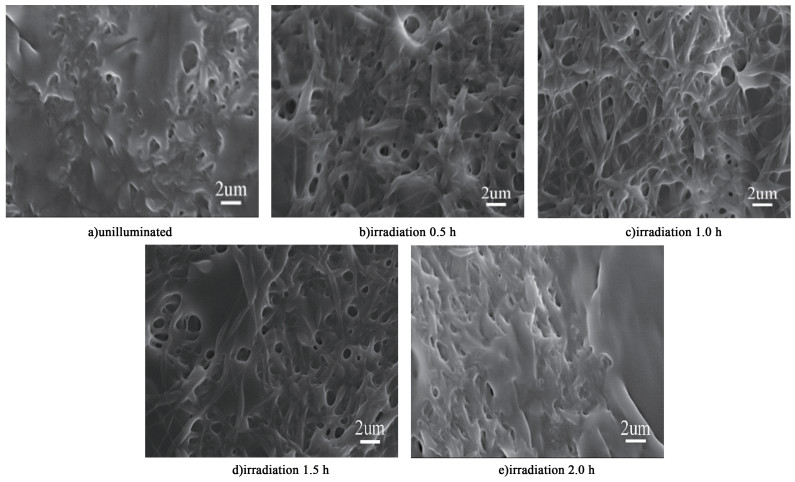
|
| 图 3 不同光照时间下的纤维膜浸水后的SEM图 Fig.3 SEM image of fiber membrane immersed in water for half an hour under different illumination time |
| |
由图 3中可以看出未光照的纤维膜在浸水的瞬间发生溶解,纤维形貌消失;而经过紫外光辐射之后,浸水的纤维发生溶胀,仍能保留纤维的形貌,并且随光照时间的增长,浸水后纤维的形貌越明显,这是由于在光照条件下水溶性的PVA-SBQ/GMHA纤维发生交联,且随时间的增长交联程度增加,溶解度降低[23-24];然而当光照时间达2.0 h时,浸水后的纤维膜纤维形貌消失,这是因为光照时间较长时透明质酸发生降解,交联网络破坏,纤维膜的耐水性变差[25-28],纤维形貌破坏。对比发现当紫外光照射时长为1.0 h时,溶胀后的PVA-SBQ/GMHA纤维膜形貌最好。
2.3 溶胀比分析图 4是PVA-SBQ、PVA-SBQ/GMHA纤维膜溶胀曲线。

|
| 图 4 PVA-SBQ和PVA-SBQ/GMHA纤维膜溶胀曲线 Fig.4 Swelling curve of PVA-SBQ and PVA-SBQ/GMHA |
| |
由图 4中可以看出,加入GMHA之后纤维膜的溶胀比有所增加,这是由于GMHA分子链中含有大量的亲水基团,如—COOH和—OH等,可以与水分子以氢键的形式结合,提高了纤维膜的溶胀比,然而纤维膜中GMHA的含量较少,所以溶胀比变化较小。
图 5是紫外光照不同时间下的PVA-SBQ/GMHA纤维膜的溶胀曲线。
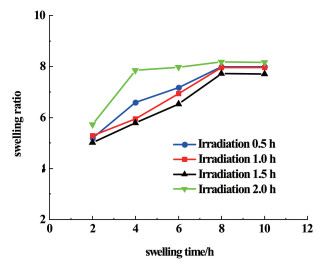
|
| 图 5 紫外光照不同时间下的PVA-SBQ/GMHA纤维膜的溶胀曲线 Fig.5 Swelling curve of PVA-SBQ/GMHA fiber membrane under different illumination time |
| |
与图 4中PVA-SBQ/GMHA纤维膜溶胀曲线对比,发现浸水4.0 h时紫外光照时间为0.5 h时纤维膜的溶胀比略高于未光照的纤维膜,这是因为未光照时纤维内的GMHA分子溶于水,纤维膜的吸水能力下降,紫外光照射0.5 h时,纤维内的PVA-SBQ、GMHA发生交联,纤维膜的溶解度下降;当紫外光照时间继续增加,纤维膜的溶胀比随光照时间的增长而降低,因为紫外光照时间越长,交联程度越高,水分子进入膜内部的难度增加;然而光交联的时间超过2.0 h后,纤维膜的溶胀比增加,这是因为紫外光照时间过长,透明质酸降解[25-28],交联网络破裂,水分子易与纤维膜中亲水基团结合。图 6是紫外光照不同时间下的PVA-SBQ/GMHA纤维膜的溶失率曲线。
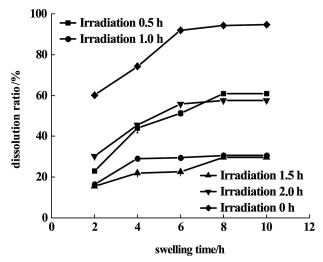
|
| 图 6 紫外光照不同时间下的PVA-SBQ/GMHA纤维膜的溶失率 Fig.6 Dissolution ratio of PVA-SBQ/GMHA fiber membrane under different illumination time |
| |
图 6中曲线显示,纤维膜的溶失率随着紫外光照时间的增长而降低,当光照时长超过2.0 h时,溶失率上升,此规律与扫描电镜的结果一致。
图 7a)是不同温度下的PVA-SBQ/GMHA溶胀曲线,温度越高纤维膜的溶胀比越低。当温度较低时透明质酸峰分子链呈伸展结构,链上的亲水基团与水分子形成氢键,溶胀度较高;当温度升高时分子的布朗运动加快,氢键断裂,溶胀度降低。图 7b)是不同pH值下的PVA-SBQ/GMHA纤维膜的溶胀曲线,当pH值为2.2时纤维膜的溶胀度比7.2时略小,当pH值较低时,溶液中的—NH2和—OH基团易发生质子化带正电荷,被溶液中的H+和Cl-屏蔽,使纤维膜的溶胀度减小;当pH值为7.2时,溶液中Cl-的含量减少,屏蔽作用减弱,溶胀度增加[29]。
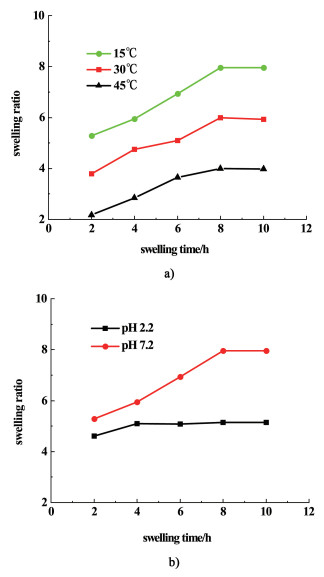
|
| 图 7 a) 不同温度下和b)不同pH值下的PVA-SBQ/GMHA溶胀曲线 Fig.7 Swelling curves of PVA-SBQ under a)different temperatures and b)different pHs |
| |
图 8是5-FU裸释、载药1.0%的PVA-SBQ/GMHA纤维膜光交联前后载药释放曲线。
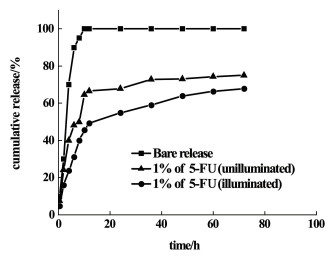
|
| 图 8 5-FU裸释和光交联前后PVA-SBQ/GMHA纤维膜载药释放曲线 Fig.8 Drug release curves of 5-furacil bare release, unilluminated and illuminated PVA-SBQ/GMHA fiber membrane |
| |
当5-FU药物裸释时,药物的累积释放量在10 h内就超过了90%,药物的释放速率较快,易造成浪费,且对人体伤害较大;而未光交联的1.0%载药PVA-SBQ/GMHA纤维膜,在10 h内的累积释放率在64%,之后释放速率减缓,持续释放至36 h,累积释放量为72%;光交联的1.0%载药PVA-SBQ/GMHA纤维膜,在10 h内的累积释放率在46%,缓慢释放至72 h,累积释放量为68%,由于纤维表面药物的残留和部分纤维的溶解与溶胀导致前10 h的释放速度较快,之后药物的释放以纤维膜降解为主[28]。对比3条曲线,PVA-SBQ/GMHA纤维膜载药释放速率相较于裸释有所减缓,而光交联之后的纤维膜缓释效果更为明显。
图 9a)是PVA-SBQ/GMHA纤维膜在不同温度下的药物释放曲线,随着环境温度的升高药物的释放速度与累积释放率均有所下降。药物的释放过程受纤维溶胀和溶解的影响,图 9b)是PVA-SBQ/GMHA纤维膜在不同pH值下的药物累积释放曲线。

|
| 图 9 a) PVA-SBQ/GMHA纤维膜在不同温度、b)不同pH值下的药物释放曲线 Fig.9 Drug release curve of PVA-SBQ/GMHA fiber membrane under different a) temperatures and b) pH |
| |
由图 9a)可知,纤维膜的溶胀比随温度的升高而降低,因此药物的释放速度与累积释放率降低。由图 9b)可知,在pH值为2.2时药物的释放速度与累积释放率比pH值为7.2时略低,这是因为纤维膜在pH值为2.2时的溶胀比小于在pH值为7.2时的溶胀比[30]。
3 结论采用静电纺制备了PVA-SBQ/GMHA复合纳米纤维,在紫外光照射下得到光交联复合纳米纤维膜。通过SEM研究了紫外光照不同时间下复合纳米纤维溶胀前后的形貌,光照1.0 h效果最佳。PVA-SBQ/GMHA纤维膜的溶胀比随着温度增加而降低,pH值为2.2时溶胀度比pH值为7.2时小。相对于药物裸释和未交联纤维膜,光交联的载药PVA-SBQ/GMHA纤维膜药物释放相对平缓,在10 h内的累积释放率大约40%。累积释放率随着温度升高而降低,pH值为2.2时小于pH值为7.2时的累积释放率,这和PVA-SBQ/GMHA纤维膜溶胀比的变化规律相一致。
| [1] |
Zhu L, Liu X, Du L, et al. Preparation of asiaticoside-loaded coaxially electrospinning nanofibers and their effect on deep partial-thickness burn injury[J]. Biomedicine & Pharmacotherapy, 2016, 83: 33-40. |
| [2] |
Cao W, Hong Z, Yuan X. Ultrafine fibrous membranes by coaxial electrospinning for artificial blood vessel[J]. Chemical Journal of Chinese Universities, 2011, 32(6): 1396-1400. |
| [3] |
邱玉宇, 蔡维维, 邱丽颖, 等. 负载王不留行黄酮苷纳米纤维作为创伤敷料的研究[J]. 生物医学工程学杂志, 2017, 34(3): 394-400. Qiu Yuyu, Cai Weiwei, Qiu Liying, et al. Preparation and study of vaccarin-loaded nanofibers used as wound healing material[J]. Journal of Biomedical Engineering, 2017, 34(3): 394-400. (in Chinese) |
| [4] |
Monteiro N, Martins M, Martins A, et al. Antibacterial activity of chitosan nanofiber meshes with liposomes immobilized releasing gentamicin[J]. Acta Biomaterialia, 2015, 18: 196-205. DOI:10.1016/j.actbio.2015.02.018 |
| [5] |
Luo Y, Kirker K R, Prestwich G D. Cross-Linked hyaluronic acid hydrogel films:New biomaterials for drug delivery[J]. Journal of Controlled Release, 2000, 69(1): 169-184. DOI:10.1016/S0168-3659(00)00300-X |
| [6] |
Takahashi A, Suzuki Y, Suhara T, et al. In situ cross-linkable hydrogel of hyaluronan produced via copper-free click chemistry[J]. Biomacromolecules, 2013, 14(10): 3581-3588. DOI:10.1021/bm4009606 |
| [7] |
Ma G, Liu Y, Fang D, et al. Hyaluronic acid/chitosan polyelectrolyte complexes nanofibers prepared by electrospinning[J]. Materials Letters, 2012, 74: 78-80. DOI:10.1016/j.matlet.2012.01.012 |
| [8] |
Zhou J, Wang Q, Lu H, et al. Preparation and characterization of electrospun polyvinyl alcoholstyrylpyridinium/β-cyclodextrin composite nanofibers:Release behavior and potential use for wound dressing[J]. Fibers and Polymers, 2016, 17(11): 1835-1841. DOI:10.1007/s12221-016-6716-0 |
| [9] |
Tao Y, Ai L, Bai H, et al. Synthesis of pH-responsive photocrosslinked hyaluronic acid-based hydrogels for drug delivery[J]. Journal of Polymer Science Part A, 2012, 50(17): 3507-3516. DOI:10.1002/pola.26159 |
| [10] |
Liu Y, Bolger B, Cahill P A, et al. Water resistance of photocrosslinked polyvinyl alcohol based fibers[J]. Materials Letters, 2009, 63(3/4): 419-421. |
| [11] |
Bleiberg H, Conroy T, Paillot B, et al. Randomised phase Ⅱ study of cisplatin and 5-fluorouracil (5-FU) versus cisplatin alone in advanced squamous cell oesophageal cancer[J]. European Journal of Cancer, 1997, 33(8): 1216-1220. DOI:10.1016/S0959-8049(97)00088-9 |
| [12] |
Safwat M A, Soliman G M, Sayed D, et al. Gold nanoparticles enhance 5-fluorouracil anticancer efficacy against colorectal cancer cells[J]. International Journal of Pharmaceutics, 2016, 513(1/2): 648-658. |
| [13] |
Ghiringhelli F, Apetoh L. Enhancing the anticancer effects of 5-fluorouracil:Current challenges and future perspectives[J]. Biomedical journal, 2015. DOI:10.4103/2319-4170.130923 |
| [14] |
Morán M C, Carazo J, Busquets M A. Dual responsive gelatin-based nanoparticles for enhanced 5-fluorouracil efficiency[J]. Colloids and Surfaces B:Biointerfaces, 2018, 172: 646-654. DOI:10.1016/j.colsurfb.2018.09.027 |
| [15] |
Bencherif S A, Srinivasan A, Horkay F, et al. Influence of the degree of methacrylation on hyaluronic acid hydrogels properties[J]. Biomaterials, 2008, 29(12): 1739-1749. DOI:10.1016/j.biomaterials.2007.11.047 |
| [16] |
Leach J B, Bivens K A, Patrick C W, et al. Photocrosslinked hyaluronic acid hydrogels:Natural, biodegradable tissue engineering scaffolds[J]. Biotechnology and Bioengineering, 2003, 82(5): 578-589. DOI:10.1002/bit.10605 |
| [17] |
艾玲.氨基多糖光敏改性研究[D].江苏无锡: 江南大学, 2011 Ai Ling. Amino polysaccharide photosensitive modification[D]. Jiangsu Wuxi: Jiangnan University, 2011(in Chinese) |
| [18] |
Segura T, Anderson B C, Chung P H, et al. Crosslinked hyaluronic acid hydrogels:A strategy to functionalize and pattern[J]. Biomaterials, 2005, 26(4): 359-371. DOI:10.1016/j.biomaterials.2004.02.067 |
| [19] |
Wang X, Huang Y, Bu N, et al. Morphology characterization and influential mechanism analysis of electrospun micro/nano-fiber[J]. Science Bulletin, 2012, 57(10): 860-866. |
| [20] |
(新加坡)拉马克瑞斯纳·西拉姆, 著.莫秀梅, 何创龙, 王红声, 译.静电纺丝与纳米纤维导论[M].上海: 东华大学出版社, 2012
|
| [21] |
Zeng J, Xu X, Chen X, et al. Biodegradable electrospun fibers for drug delivery[J]. Journal of Controlled Release, 2003, 92(3): 227-231. DOI:10.1016/S0168-3659(03)00372-9 |
| [22] |
Shanmuga S S, Sangeetha D. Fabrication and evaluation of electrospun collagen/poly(N-isopropyl acrylamide)/chitosan mat as blood-contacting biomaterials for drug delivery[J]. Journal of Materials Science:Materials in Medicine, 2012, 23(6): 1421-1430. DOI:10.1007/s10856-012-4610-x |
| [23] |
Cui J, Qiu L, Qiu Y, et al. Co-Electrospun nanofibers of PVA-SbQ and Zein for wound healing[J]. Journal of Applied Polymer Science, 2015. DOI:10.1002/app.42565 |
| [24] |
Hamilton R, Fox E M, Acharya R A, et al. Water insoluble derivatives of hyaluronic acid: US, 4937270[P]. 1990-06-26
|
| [25] |
Bai H, Sun Y, Xu J, et al. Rheological and structural characterization of HA/PVA-SbQ composites film-forming solutions and resulting films as affected by UV irradiation time[J]. Carbohydrate Polymers, 2015, 115: 422-431. DOI:10.1016/j.carbpol.2014.08.103 |
| [26] |
Xu J, Bai H, Yi C, et al. Self-Assembly behavior between native hyaluronan and styrylpyridinium in aqueous solution[J]. Carbohydrate Polymers, 2011, 86(2): 678-683. DOI:10.1016/j.carbpol.2011.05.006 |
| [27] |
凌沛学. 透明质酸[M]. 北京: 中国轻工业出版社, 2000.
|
| [28] |
Tao Y, Ai L, Bai H, et al. Synthesis of pH-responsive photocrosslinked hyaluronic acid-based hydrogels for drug delivery[J]. Journal of Polymer Science Part A, 2012, 50(17): 3507-3516. DOI:10.1002/pola.26159 |
| [29] |
胡咏梅.生物可降解聚氨酯/5-氟尿嘧啶控释载药体系研究[D].河北秦皇岛: 燕山大学, 2014 Hu Yongmei. Study on synthesis and applications of biodegradable polyurethane as a drug sustained-release material loaded with 5-fluorouracil[D]. Hebei Qinhuangdao: Yanshan University, 2014(in Chinese) |
| [30] |
Anirudhan T S, Manasa M A. Novel pH switchable gelatin based hydrogel for the controlled delivery of the anti cancer drug 5-fluorouracil[J]. RSC Advances, 2014, 4(24): 12109-12118. DOI:10.1039/c3ra47991a |
 2021, Vol. 38
2021, Vol. 38





