2. 天津化学化工协同创新中心, 天津 300072;
3. 天津市功能精细化学品技术工程中心, 天津 300350
2. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China;
3. Tianjin Engineering Research Center of Functional Fine Chemicals, Tianjin 300350, China
肺癌是恶性肿瘤中致死率最高的肿瘤[1],已经严重影响了人类的健康,其中非小细胞肺癌(NSCLC)的比例高达85%~90%。传统的手术治疗和化疗对非小细胞肺癌的成功率较低,5 a生存率仅为15%左右。目前分子靶向治疗由于其特异性高,毒性低,耐受性良好等因素在癌症治疗中发挥着重要作用,成为非小细胞肺癌的首选治疗方案[2]。间变性淋巴瘤激酶(ALK),是受体酪氨酸激酶(RTKs)的一种,它的激活可促进肿瘤细胞的增殖、分化并促使肿瘤细胞耐药性的产生,在结构上属于胰岛素受体的超家族。棘皮动物微管相关蛋白4(EML-4)于2007年首次在日本被发现。值得注意的是,大约5%NSCLC患者都含有EML4-ALK基因重排[3]。针对ALK融合基因靶点的小分子抑制剂的研究受到药物化学工作者的高度重视。当前在研或已上市的ALK激酶抑制剂,主要有Crizotinib[4]、Ceritinib[5]、Alectinib[6]、Brigatinib[7]、CEP-37440[8]、PF-06463922[9]、ASP3026[10]、X-396[11]和RXDX-101[12](图 1)。
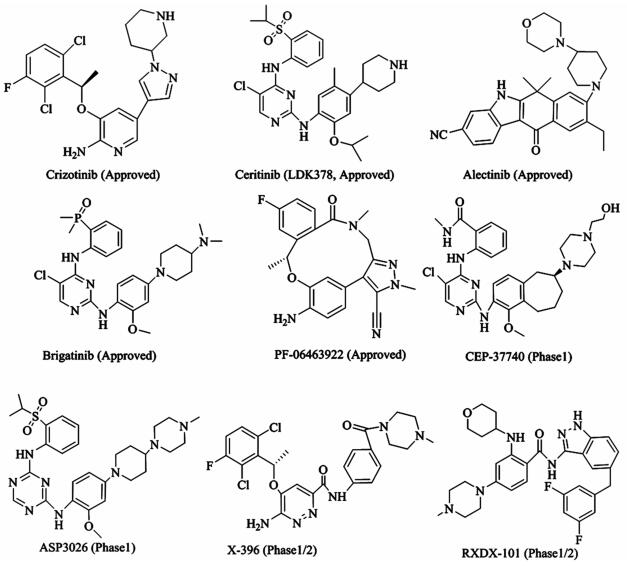
|
| 图 1 ALK激酶抑制剂 Fig.1 ALK kinase inhibitors |
| |
目前已上市的ALK靶向药物面临着耐药性突变,肿瘤脑部转移以及副作用等巨大挑战。例如,在接受Crizotinib治疗后1~2 a,绝大多数病人都会产生耐药以及肿瘤脑部转移问题[4],Ceritinib[5]能有效对抗80%克唑替尼耐药突变,但对G1202R和F1174C的抗性突变无效。Alectinib[6]克服了许多已知的ALK耐药突变,包括最常见的Leu1196Met和Gly1269Ala,但对Gly1202Arg和Ile1171突变无活性。此外,它常伴有一些临床不良反应,如便秘、疲劳、肌痛和外周水肿。因此,新型ALK激酶抑制剂,特别是那些具有ALK抑制活性,过血脑屏障能力和副作用小的ALK靶向制剂是目前开发的热点。
研究发现,用于治疗NSCLC患者的小分子抑制剂大多数是嘧啶化合物,尤其是ALK激酶抑制剂,例如Ceritinib、CEP-33740和Brigatinib,这些药物通过引入氮杂环结构对母体嘧啶环进行修饰,增加了药物活性。NVP-TAE684[13]是由Novartis公司于2007年通过生物筛选得到的,能够阻断ALCL衍生细胞系和ALK依赖性细胞系的生长,IC50值为2~10 nM,由于其毒性原因未能进入临床研究,但针对NVP-TAE684的结构改造与优化一直在进行。例如Ceritinib,AP26113和CEP-28122[14]均是直接从NVP-TAE684衍生过来的,值得注意的是,Ceritinib在2014年4月获得FDA批准上市。
吡嗪嵌段常见于许多具有强抗肿瘤活性的化合物中,如咪唑并[1, 2-a]吡嗪[15],2-芳基氨基-3-(芳基磺酰基)喹喔啉[16]和咪唑并[1, 5-a]吡嗪[17]。本文中,我们对ALK抑制剂NVP-TAE684进行结构改造,引入吡嗪氮杂环修饰基团,设计2个新型嘧啶衍生物[图 2a)]。目标化合物7的合成路线见图 2b)。基于早期钯催化Buchwald-Hartwig C-N交叉偶联反应的经验[18-19],以4-氨基哌啶-1-羧酸叔丁酯(1a)和4-(4-氨基-5-异丙氧基-2-甲基苯基)哌啶-1-羧酸叔丁酯(1b)为原料,与2-氯-5-异丙基吡嗪经过Buchwald-Harting C-N交叉偶联反应胺化得到新化合物2(2a, 2b);化合物2通过脱Boc保护,得到重要中间体3 (3a, 3b);化合物4通过还原反应得到化合物5;化合物5再通过亲核取代反应与2,4,5-三氯嘧啶发生作用,得到化合物6;目标化合物7 (7a, 7b)通过Pd催化的Buchwald-Hartwig C-N胺化化合物3与化合物6实现。采用MTT法对目标化合物进行初步的体外抗肿瘤活性研究,这里所选择的细胞系为人大细胞肺癌(NCI-H460)和人鳞肺癌细胞(NCI-H520)。
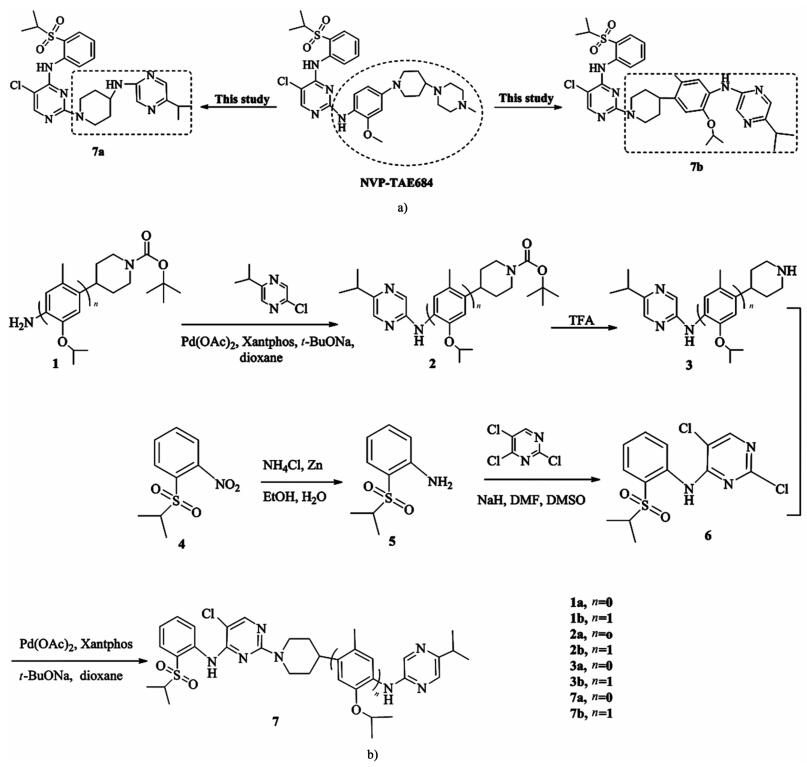
|
| 图 2 新型嘧啶衍生物及其合成路线 Fig.2 Novel pyrimidine derivatives and its synthesis route scheme |
| |
INOVA-500 MHz型核磁共振波谱仪(CDCl3或DMSO-d6为溶剂,TMS为内标)(美国Varian公司);20 L旋转蒸发仪(巩义市华仪器有限责任公司);LCQ advantage MAX型液相色谱-ESI质谱联用仪(美国Thermo fisher公司)。
所用化学试剂来自成上海毕得医药科技有限公司和天津希恩思生化科技有限公司;溶剂均为分析纯, 来自天津江天化工有限公司,均经过干燥及重蒸后使用;柱色谱所用硅胶(300~400目),烟台新诺化工有限公司;抗肿瘤活性实验所用的人大细胞肺癌细胞株NCI-H460以及人肺鳞癌细胞株NCI-H520来自中科院上海细胞库。
1.2 合成 1.2.1 2a,2b的合成(以2a为例)将2-二氯-5-异丙基吡嗪150 μL(0.75 mmol),叔丁基4-氨基哌啶-1-羧酸酯(1a)150 mg(0.75 mmol),醋酸钯(5%,摩尔分数),4, 5-双二苯基膦-9, 9-二甲基氧杂蒽(10%,摩尔分数),叔丁醇钠(3.0当量),8~10 mL无水二氧六环依次加入到100 mL的Schlenk瓶中,氮气置换10 min后升温至120 ℃搅拌10 h。通过TLC跟踪反应。反应结束冷却后,加入水(20 mL)和乙酸乙酯(20 mL)分离各相,水相用更多的乙酸乙酯(3×50 mL)萃取,合并有机相,无水硫酸镁干燥,过滤并真空浓缩。将粗物质通过硅胶色谱法,使用溶剂梯度[V(石油醚):V(乙酸乙酯)=20:1、10:1和5:1]进行纯化,得到浅黄色固体2a, 收率70%; 1H NMR (CDCl3, 500 MHz) δ: 7.85 (d, J=2.7 Hz, 1H), 7.77 (d, J=2.7 Hz, 1H), 4.30 (d, J=7.1 Hz, 1H), 4.09 (s, 3H), 2.95 (s, 2H), 2.84 (dt, J=13.4 Hz, 6.7 Hz, 1H), 2.07 (d, J=9.9 Hz, 2H), 1.46 (s, 9H), 1.42~1.34 (m, 2H), 1.27 (d, J=6.7 Hz, 6H); 13C NMR (CDCl3, 126 MHz) δ: 154.97, 150.98, 147.61, 139.21, 131.86, 79.81, 48.02, 32.53, 29.93, 28.68, 20.59; HR-MS(ESI) m/z: Calcd for C17H29N4O2 {[M+H]+}321.228 5, found: 321.227 9。
2b:加入叔丁基4-(4-氨基-5-异丙氧基-2-甲基苯基)哌啶-1-羧酸酯(1b)220 mg(0.60 mmol)和2-氯-5-异丙基吡嗪110 μL(0.60 mmol),将粗物质通过硅胶色谱法,使用溶剂梯度[V(石油醚):V(乙酸乙酯)=20:1、15:1、10:1和8:1]进行纯化,得到浅黄色固体2b, 收率65%; 1H NMR (CDCl3, 500 MHz) δ: 8.27 (s, 1H), 8.00 (d, J=2.7 Hz, 1H), 7.91 (d, J=2.7 Hz, 1H), 7.31 (s, 1H), 6.73 (s, 1H), 4.59 (dt, J=12.1 Hz, 6.1 Hz, 1H), 4.26 (s, 2H), 3.09 (dt, J=13.5 Hz, 6.8 Hz, 1H), 2.83 (s, 3H), 2.33 (s, 3H), 1.75 (d, J =12.8 Hz, 2H), 1.57 (s, 2H), 1.49 (s, 9H), 1.39 (d, J=4.8 Hz, 6H), 1.38 (d, J=4.1 Hz, 6H); 13C NMR (CDCl3, 126 MHz) δ: 155.14, 149.40, 148.88, 144.96, 139.03, 137.03, 133.21, 128.65, 127.59, 120.65, 110.68, 79.70, 71.61, 38.46, 32.91, 30.66, 29.95, 28.76, 22.62, 20.52, 19.32; HR-MS(ESI) m/z: Calcd for C27H41N4O3{[M+H]+}469.317 3, found: 469.317 2。
1.2.2 3a,3b的合成(以3a为例)化合物(2a):DCM:TFA=(1 mmol:2 mL:1 mL),将2a溶于DCM中,缓慢滴加TFA,室温搅拌2 h后,旋干溶剂,将剩余物质用少量乙酸乙酯溶解,用5% Na2CO3溶液调pH值约为7。用乙酸乙酯萃取并合有机相,无水硫酸镁干燥,过滤并真空浓缩。所得产物用[V(石油醚):V(二氯甲烷)=1:1]重结晶。得到乳白色固体3a, 收率98%; 1H NMR (DMSO-d6, 500 MHz) δ: 7.80 (d, J=2.5 Hz, 1H), 7.66 (d, J=2.5 Hz, 1H), 6.44 (d, J=7.0 Hz, 1H), 4.08 (s, 1H), 3.32 (d, J=12.7 Hz, 2H), 3.31~3.17 (m, 2H), 2.99 (t, J=11.4 Hz, 2H), 2.00 (d, J=11.7 Hz, 2H), 1.75 (q, J=13.5 Hz, 2H), 1.11 (d, J=6.6 Hz, 6H); 13C NMR (DMSO-d6, 126 MHz) δ:151.44, 148.54, 139.21, 131.12, 45.90, 43.10, 28.88, 28.82, 21.33; HR-MS(ESI) m/z: Calcd for C12H21N4{[M+H]+}221.176 1, found: 221.176 1。
3b:得到浅黄色固体3b, 收率96%; 1H NMR (DMSO-d6, 400 MHz) δ: 8.59 (s, 1H), 7.96 (d, J=2.7 Hz, 1H), 7.89 (d, J =2.7 Hz, 1H), 7.88 (s, 1H), 7.52 (s, 1H), 6.80 (s, 1H), 4.56 (dt, J=12.1 Hz, 6.0 Hz, 1H), 3.39 (s, 2H), 3.21 (dt, J=13.4 Hz, 6.7 Hz, 1H), 3.03 (s, 3H), 2.26 (s, 3H), 1.84 (s, 4H), 1.28 (d, J=6.7 Hz, 6H), 1.25 (d, J=6.0 Hz, 6H); 13C NMR (DMSO-d6, 101 MHz) δ: 149.71, 148.65, 146.60, 139.12, 137.60, 133.24, 128.77, 127.18, 123.29, 111.61, 71.30, 44.51, 35.52, 29.97, 29.73, 22.39, 20.78, 18.99; HR-MS(ESI) m/z: Calcd for C22H33N4O{[M+H]+}369.264 9, found: 369.265 1。
1.2.3 化合物5的合成在250 mL三口瓶中加入市售的1-(异丙基磺酰基)-2-硝基苯(4)10.0 g(43.60 mmol),无水乙醇(128 mL)和水(32 mL),机械搅拌,使反应物在溶剂中充分溶解,再加入氯化铵7.0 g(130.8 mmol),锌粉22.8 g(348.80 mmol)。同时保持温度低于60 ℃。加完后,缓慢升高温度至85 ℃,再回流2 h。通过TLC跟踪反应,反应结束后立即过滤,浓缩除去乙醇,加入水(100 mL),用乙酸乙酯萃取3次,合并有机相,用无水MgSO4干燥,过滤并真空浓缩。使用柱色谱过柱分离产物,洗脱剂[V(石油醚):V(乙酸乙酯)=3.0:1.0],纯化得到棕黄色固体,产率89%; 1H NMR(CDCl3, 500 MHz) δ: 7.65~7.63(dd,J=1.5 Hz, 8.0 Hz, 1H), 7.33(m, 1H), 6.79(t, 1H), 6.72(d, J=8.5 Hz, 1H), 5.08(s, 2H), 3.35~3.32(m, 1H), 1.31(d, J=6.5 Hz, 6H); HR-MS(ESI) m/z: Calcd for C9H13NO2SNa {[M+Na]+}222.0, found: 222.0。
1.2.4 化合物6的合成在冰浴环境中,于100 mL三口瓶中依次加入2-(异丙基磺酰基)苯胺(5)2.0 g(10.09 mmol),DMF(20 mL),DMSO(2 mL),磁力搅拌至原料完全溶解在溶剂中。缓慢加入NaH 726.4 mg(30.27 mmol),搅拌30 min后,缓慢滴加用[V (DMF)/V (DMSO)=10.0:1.0]稀释的2,4,5-三氯嘧啶3.7 g(20.18 mmol)溶液,移去冰水浴装置,混合物于25 ℃条件下搅拌24 h后停止反应。加入10%NaCl(50 mL)水溶液和乙酸乙酯(100 mL)进行萃取,水相用更多的乙酸乙酯(3×100 mL)萃取,合并有机相,无水硫酸镁干燥,过滤并真空浓缩。粗产物在冷乙醇中直接结晶析出,得到白色固体,收率75%; 1H NMR(DMSO-d6, 500 MHz) δ: 9.81(s, 1H), 8.56(s, 1H), 8.31(d, J=8.5 Hz, 1H), 7.90(d, J=8.0 Hz, 1H), 7.87(t, 1H), 7.48(t, 1H), 3.54(m, 1H), 1.15(d, J=6.5 Hz, 6H). 13C NMR(DMSO-d6, 125 MHz) δ:157.2, 135.7, 131.6, 126.8, 125.6, 124.9, 115.3, 55.1, 15.3; HR-MS(ESI) m/z: Calcd for C13H13Cl2N3O2SNa{[M+Na]+} 367.999 6, found: 368.000 3。
1.2.5 7a和7b的合成方法同化合物3的合成步骤,其中醋酸钯,4, 5-双二苯基膦-9, 9-二甲基氧杂蒽以及叔丁醇钠的用量增加为原比例的1.5倍。
7a:加入5-异丙基-N-(哌啶-4-基)吡嗪-2-胺(3a)130 mg(0.60 mmol)和2, 5-二氯-N-(2-(异丙基磺酰基)苯基)嘧啶-4-胺(6)204 mg(0.60 mmol),将粗物质通过硅胶色谱法,使用溶剂梯度[V(石油醚):V(乙酸乙酯)=20:1、10:1、5:1和2:1]进行纯化,得到白色固体7a,收率32%; 1H NMR (CDCl3, 400 MHz) δ: 9.48 (s, 1H), 8.54 (d, J=8.3 Hz, 1H), 8.03 (s, 1H), 7.85 (dd, J=5.2 Hz, 2.2 Hz, 2H), 7.76 (d, J=2.8 Hz, 1H), 7.57 (t, J=7.9 Hz, 1H), 7.16 (t, J=7.6 Hz, 1H), 4.55 (d, J=13.5 Hz, 2H), 4.37 (d, J=7.3 Hz, 1H), 4.21 (s, 1H), 3.20 (ddd, J=29.5 Hz, 18.2 Hz, 9.1 Hz, 3H), 2.91~2.73 (m, 1H), 2.15 (d, J=12.3 Hz, 2H), 1.46 (dd, J=23.4 Hz, 11.8 Hz, 2H), 1.27 (d, J =6.9 Hz, 6H), 1.24 (d, J=6.7 Hz, 6H); 13C NMR (CDCl3, 126 MHz) δ: 159.53, 155.37, 155.19, 151.05, 147.70, 139.24, 139.05, 134.59, 131.87, 131.45, 124.34, 122.87, 104.06, 55.65, 48.27, 43.70, 32.38, 30.01, 20.48, 15.60; HR-MS(ESI) m/z: Calcd for C25H33ClN7O2S {[M+H]+}530.209 9, found: 530.209 9; HPLC purity: 99.03%, retention time=3.78 min。
7b:加入N-(2-异丙氧基-5-甲基-4-(哌啶-4-基)苯基)-5-异丙基吡嗪-2-胺(3b)120 mg(0.33 mmol)和2, 5-二氯-N-(2-(异丙基磺酰基)苯基)嘧啶-4-胺(6)113 mg(0.33 mmol),将粗物质通过硅胶色谱法,使用溶剂梯度[V(石油醚):V(乙酸乙酯)=20:1、10:1和8:1]进行纯化,得到白色固体7b,收率26%; 1H NMR (CDCl3, 500 MHz) δ: 9.53 (s, 1H), 8.61 (d, J=8.3 Hz, 1H), 8.29 (s, 1H), 8.09 (s, 1H), 8.00 (d, J=2.1 Hz, 1H), 7.92 (d, J=2.2 Hz, 1H), 7.90 (d, J=7.8 Hz, 1H), 7.62 (t, J=7.7 Hz, 1H), 7.31 (s, 1H), 7.20 (t, J=7.3 Hz, 1H), 6.72 (s, 1H), 4.83 (d, J=12.8 Hz, 2H), 4.56 (dt, J=11.6 Hz, 5.8 Hz, 1H), 3.26 (dt, J=13.4 Hz, 6.8 Hz, 1H), 3.08 (dt, J=13.2 Hz, 6.7 Hz, 1H), 2.98 (d, J=11.1 Hz, 3H), 2.38 (s, 3H), 1.88 (d, J=12.4 Hz, 2H), 1.64 (d, J=12.6 Hz, 2H), 1.38 (d, J=6.7 Hz, 6H), 1.35 (d, J=6.0 Hz, 6H), 1.32 (d, J=6.8 Hz, 6H); 13C NMR (CDCl3, 126 MHz) δ: 159.54, 155.37, 155.25, 149.37, 148.95, 144.96, 139.15, 138.98, 136.94, 134.62, 133.37, 131.48, 128.78, 127.69, 124.39, 122.91, 122.85, 110.73, 103.86, 71.65, 55.66, 45.50, 38.77, 32.88, 30.66, 22.61, 20.53, 19.38, 15.62; HR-MS(ESI) m/z: Calcd for C35H45ClN7O3S{[M+H]+}678.298 8, found: 678.299 1; HPLC purity: 99.05%, retention time=12.41 min。
1.3 化合物的体外抗肿瘤活性测试选用人大细胞肺癌细胞株NCI-H460以及人肺鳞癌细胞株NCI-H520(购于中科院上海细胞库),于37 ℃、5%CO2、饱和湿度的条件下,用含10%胎牛血清(FBS)、青霉素(100 μg/mL)及链霉素(0.100 g/L)的Iscove’s Modified Dulbecco’s Medium (IMDM)培养液常规无菌培养。我们小组合成的目标化合物7a,7b (质量分数>99%),在使用前,首先溶解在二甲基亚砜(DMSO)中以制备10 g/L储存溶液,然后用新鲜的IMDM培养液稀释。
用四甲基偶氮唑蓝比色法即MTT法检测NCI-H460和NCI-H520细胞的增殖活性,将约1 000个细胞接种到96孔组织培养板的各个孔中并孵育12 h,然后用不同浓度的药物处理细胞36 h和48 h。向每个孔中加入20 μL MTT,并将板再孵育4 h。4 h后终止培养,吸去上层培养液,留下蓝紫色甲臜结晶,每孔各加入150 μL二甲基亚砜(DMSO),振荡器上振荡10 min,待结晶溶解后,立即使用ELISA读数器在620 nm处检测吸光度。对于每种测试的化合物,选择至少5种浓度,得到抑制率和浓度曲线,并在每种细胞系中测试3次。IC50(抑制浓度50%)至少是3次测定的平均值并采用Graph-Pad Prism软件进行计算。
2 结果与讨论 2.1 合成使用钯催化Buchwald-Hartwig C-N交叉偶联反应对化合物2(2a, 2b)及目标化合物7(7a, 7b)合成时,分别对其进行催化剂及用量、配体种类及用量、碱的种类及用量、溶剂、反应温度及时间等实验因素进行了考察,最终优化出最适宜的实验条件:Pd(OAc)2作为催化剂及用量为5%(摩尔分数),Xantphos作为配体及用量为10%(摩尔分数),叔丁醇钠作为碱及用量为3当量,无水二氧六环作为溶剂,于120 ℃下反应10 h。值得注意的是,在相同的钯催化条件下,化合物2(2a, 70%; 2b,65%)的收率远高于目标化合物7(7a, 20%; 7b, 16%)。这应该与亲电试剂的亲电能力紧密相关,2-氯-5-异丙基吡嗪的反应活性高于化合物6。此外,胺的空间位阻对收率也有一定的影响,胺上的取代基越大,位阻越大,反应越难进行。通过实验发现,增加催化剂和配体的量[Pd(OAc)2:7.5%; Xantphos:15%,均为摩尔百分数]会使目标化合物的产率增加(7a, 32%; 7b, 26%)。
2.2 体外抗肿瘤活性为了评估体外细胞活力,用MTT比色法进行测定以确定化合物7(7a, 7b)对NCI-H460和NCI-H520细胞的活力抑制作用。以细胞活力(%)、药物浓度以及时间作曲线图(图 3),不同剂量(0.010~0.125 μmol/L)的7a处理细胞株36和48 h后,对NSCLC细胞NCI-H460和NCI-H520细胞活力的影响如图 3a)和图 3b)所示。用低浓度的(0~0.01 μmol/L)的7a处理NCI-H460和NCI-H520细胞后,其细胞活力均保持90%以上;提高浓度的(0.020~0.125 μmol/L)的7a会导致NCI-H460和NCI-H520细胞活力明显下降,且随着药物浓度的增加,时间的延长,抑制作用增强,当7a的剂量为0.125 μmol/L时,NCI-H460和NCI-H520细胞活力均降到20%左右。可得出7a对NCI-H460和NCI-H520细胞的增殖抑制作用呈剂量、时间依赖性。正如预期的那样,不同剂量(0.020~0.240 μmol/L)的7b对NCI-H460和NCI-H520细胞的增殖抑制作用也是呈剂量依赖性和时间依赖性的[图 3c)和图 3d)]。
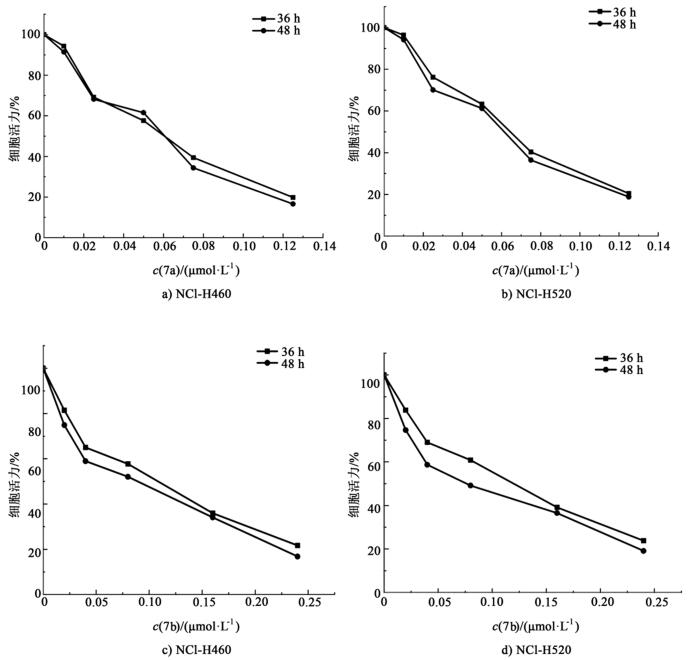
|
| 图 3 通过MTT测定法测定7a和7b处理后NCI-H460和NCI-H520细胞的活力 Fig.3 Viability of NCI-H460 and NCI-H520 cells after 7a and 7b treatment were determined by MTT assay |
| |
表 1为目标化合物7a和7b的体外抗肿瘤活性。由表 1可见,7a和7b对2株细胞均表现出一定的抗肿瘤活性,并且7a对NCI-H460和NCI-H520细胞的抑制活性较好些,特别是对NCI-H460细胞的IC50值为52.10(±0.10) nM。
| Comp | IC50 /nM | |||
| NCI-H460 (36 h) | NCI-H460 (48 h) | NCI-H520 (36 h) | NCI-H520 (48 h) | |
| 7a | 52.10(±0.10) | 53.96(±0.11) | 58.36(±0.12) | 53.34(±0.10) |
| 7b | 82.80(±0.16) | 66.64(±0.13) | 96.31(±0.19) | 64.61(±0.12) |
| 注:NCI-H460表示人大细胞肺癌、NCI-H520表示人鳞肺癌细胞;IC50值为3次独立的平均实验值。 | ||||
通过Pd催化的Buchwald-Hartwig C-N偶联反应胺化2, 5-二氯-N-(2-(异丙基磺酰基)苯基)嘧啶-4-胺与杂芳基胺,成功合成了2种新的嘧啶衍生物。制备的二(杂)芳基胺被评估为非小细胞肺癌中的抗肿瘤药,并且可以建立一些结构-活性关系。在本报告中,我们使用MTT比色法进行体外抗肿瘤活性研究,结果表明目标化合物7a和7b对NCI-H460和NCI-H520细胞有明显的增殖抑制和诱导凋亡的作用,且呈剂量依赖性和时间依赖性,具有潜在的抗肿瘤活性。这2种化合物在我们课题组所有研究的化合物中是最有希望的,将对这些化合物进一步研究以确定它们的作用机制。
| [1] |
Dai L, Smith C D, Foroozesh M, et al. The sphingosine kinase 2 inhibitor ABC294640 displays anti-non-small cell lung cancer activities in vitro and in vivo[J]. International Journal of Cancer, 2018, 142(10): 2153-2162. DOI:10.1002/ijc.31234 |
| [2] |
郭子寒, 杜琼, 戴贤春, 等. 肿瘤分子靶向治疗药物的发展概况[J]. 上海医药, 2018, 39(5): 5-9. Guo Zihan, Du Qiong, Dai Xianchun, et al. The development of targeted anti-cancer therapy[J]. Shanghai Medical & Pharmaceutical Journal, 2018, 39(5): 5-9. DOI:10.3969/j.issn.1006-1533.2018.05.003 (in Chinese) |
| [3] |
Choi Y L, Soda M, Yamashita Y, et al. EML4-ALK mutations in lung cancer that confer resistance to ALK inhibitors[J]. New England Journal of Medicine, 2010, 363(18): 1734-1739. DOI:10.1056/NEJMoa1007478 |
| [4] |
Cui J J, Tran-Dube' M, Shen H, et al. Structure based drug design of crizotinib (PF-02341066), a potent and selective dual inhibitor of mesenchymal-epithelial transition factor (c-MET) kinase and anaplastic lymphoma kinase (ALK)[J]. Journal of Medicinal Chemistry, 2011, 54(18): 6342-6363. DOI:10.1021/jm2007613 |
| [5] |
Shaw A T, Kim D W, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer[J]. New England Journal of Medicine, 2014, 370(13): 1189-1197. DOI:10.1056/NEJMoa1311107 |
| [6] |
Ou S H I, Ahn J S, de Petris L, et al. Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer:A phase II global study[J]. Journal of Clinical Oncology, 2016, 34(7): 661-668. DOI:10.1200/JCO.2015.63.9443 |
| [7] |
Kim D W, Tiseo M, Ahn M J, et al. Brigatinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small-cell lung cancer:a randomized, multicenter phase II trial[J]. Journal of Clinical Oncology, 2017, 35(22): 2490-2498. DOI:10.1200/JCO.2016.71.5904 |
| [8] |
Ott G R, Cheng M, Learn K S, et al. Discovery of clinical candidate CEP-37440, A selective inhibitor of focal adhesion kinase (FAK) and anaplastic lymphoma kinase (ALK)[J]. Journal of Medicinal Chemistry, 2016, 59(16): 7478-7496. DOI:10.1021/acs.jmedchem.6b00487 |
| [9] |
Zou H, Friboulet L, Kodack D P, et al. PF-06463922, an ALK/ROS1 inhibitor, overcomes resistance to first and second generation ALK inhibitors in preclinical models[J]. Cancer Cell, 2015, 28(1): 70-81. |
| [10] |
Iikubo K, Kondoh Y, Shimada I, et al. Discovery of N-{2-methoxy-4-[4-(4-methylpiperazin-1-yl)piperidin-1-yl]phenyl}-N'-[2-(propane-2-sulfonyl)phenyl]-1, 3, 5-triazine-2, 4-diamine (ASP3026), a potent and selective anaplastic lymphoma kinase (ALK) inhibitor[J]. Chemical and Pharmaceutical Bulletin, 2018, 66(3): 251-262. DOI:10.1248/cpb.c17-00784 |
| [11] |
Horn L, Wakelee H, Reckamp K, et al. P3.02a-001 response and plasma genotyping from phase I/II trial of ensartinib (X-396) in patients (pts) with ALK+NSCLC topic:ALK[J]. Journal of Thoracic Oncology, 2017. DOI:10.1016/j.jtho.2016.11.1631 |
| [12] |
Farago A F, Le L, Zheng Z, et al. Durable clinical response to entrectinib in NTRK1-rearranged non-small cell lung cancer[J]. Journal of Thoracic Oncology, 2015, 10(12): 1670-1674. DOI:10.1097/01.JTO.0000473485.38553.f0 |
| [13] |
Galkin A V, Melnick J S, Kim S, et al. Identification of NVP-TAE684, a potent, selective, and efficacious inhibitor of NPM-ALK[J]. Proceedings of the National Academy of Sciences, 2007, 104(1): 270-275. DOI:10.1073/pnas.0609412103 |
| [14] |
Cheng M, Quail M R, Gingrich D E, et al. CEP-28122, a highly potent and selective orally active inhibitor of anaplastic lymphoma kinase with antitumor activity in experimental models of human cancers[J]. Molecular Cancer Therapeutics, 2012, 11(3): 670-679. DOI:10.1158/1535-7163.MCT-11-0776 |
| [15] |
Goel R, Luxami V, Paul K. Recent advances in development of imidazo[1, 2-a]pyrazines:Synthesis, reactivity and their biological applications[J]. Organic & Biomolecular Chemistry, 2015, 13(12): 3525-3555. |
| [16] |
Wu P, Su Y, Liu X, et al. Synthesis and biological evaluation of novel 2-arylamino-3-(arylsulfonyl)quinoxalines as PI3Kα inhibitors[J]. European Journal of Medicinal Chemistry, 2011, 46(11): 5540-5548. DOI:10.1016/j.ejmech.2011.09.015 |
| [17] |
Kamal A, Ramakrishna G, Raju P, et al. Synthesis and anticancer activity of oxindole derived imidazo[J]. European Journal of Medicinal Chemistry, 2011, 46(6): 2427-2435. DOI:10.1016/j.ejmech.2011.03.027 |
| [18] |
Inoue F, Kashihara M, Yadav M R, et al. Buchwald-hartwig amination of nitroarenes[J]. Angewandte Chemie International Edition, 2017, 56(43): 13307-13309. DOI:10.1002/anie.201706982 |
| [19] |
Ruiz-Castillo P, Buchwald S L. Applications of palladium-catalyzed C-N cross-coupling reactions[J]. Chemical Reviews, 2016, 116(19): 12564-12649. DOI:10.1021/acs.chemrev.6b00512 |
 2020, Vol. 37
2020, Vol. 37





