2. 天津市化学科学与工程协同创新中心, 天津 300072
2. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China
目前,绿色可持续发展理念已深入现代化工领域[1]。其中一个关键原则是在化工生产过程中使用高效的催化剂来提高转化率和选择性,从而减少废弃物的排放。由于大多数催化剂回收困难,会对环境造成很大污染,因此在化工生产中迫切需要环境友好、易回收、可循环使用的催化剂。在酸催化工艺中,与Lewis酸(LA)催化剂相比,Brnsted酸(BA)催化剂具有反应简单、安全、绿色、成本低等优点。然而,小分子BA催化剂通常难以再循环并且可能导致环境污染。因此,开发可回收的酸催化剂[2]已成为现代绿色化学研究的热点。到目前为止,各种载体材料,如硅胶[3]、石墨烯、磁性Fe3O4[4]、无机复合材料[5]和金属有机骨架(MOFs)[6]等已被用于负载型酸性催化剂的合成,并取得了良好的催化效果。然而,这些载体材料也存在着一些不足,如成本高、制备工艺复杂、热稳定性差、循环性差等问题。
吡喃类杂环化合物被广泛应用于颜料、医药[7]、化妆品等行业,还被用作农用化学品[8]。因此,此类化合物的合成与制备在化工领域具有重要的研究价值。合成此类化合物的催化剂主要有过渡金属[9]、钨酸[10]、固体酸[11]等,但此类催化剂大多数回收困难,会对环境造成污染,因此在化工生产中迫切需要绿色友好、可循环使用的催化剂。
聚丙烯纤维、聚丙烯腈纤维和尼龙纤维等纺织纤维,具有低廉易得、易于修饰、耐腐蚀等优势而备受关注[12]。其中,表面含有大量氰基的聚丙烯腈纤维(PANF),可以很容易进行表面改性,构建可调控柔性微环境,具有独特的催化反应特点。本研究通过2步简单的修饰反应,通过共价键将磷酸基固定在PANF表面,制备了磷酸功能化纤维(PANEAPF)(图示1),研究了PANEAPF催化剂对芳香醛、丙二腈和α-萘酚的三组分反应以及4-羟基香豆素和芳香醛的Friedel-Crafts反应的催化性能。
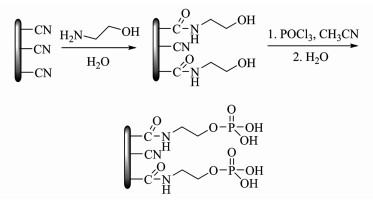
|
| 图 1 PANEAPF的制备 Fig.1 Preparation of PANEAPF |
| |
傅里叶变换红外光谱仪(Model Nicolet IS 10),扫描电子显微镜(Model Nova 450),高效液相色谱仪(安捷伦1200), 液体核磁共振谱仪(BrukerBiospin AVANCEIII 400 MHz)。电子单纤维强力机(Model YG(B)001A,温州电子仪器公司)。使用电子单纤维强力机表征纤维的机械性能。具体操作步骤:取7~10 cm长的单根纤维,将其放置到检测机器上夹紧两端,控制纤维的伸长速度为20 mm/min。由机器记录断裂强度。
腈纶纤维,中国抚顺石化公司;乙醇胺,三氯氧磷(POCl3),芳香醛,丙二腈,α-萘酚,香豆素,萘及其他有机试剂。所有试剂均为分析纯或化学纯。水为去离子水。
1.2 实验方法 1.2.1 磷酸纤维催化剂的制备根据之前报道的方法[13],将PANF(3 g),水(45 mL)和乙醇胺(30 mL)置于100 mL圆底烧瓶中,并回流3.5 h。冷却后取出纤维,用60~65 ℃的热水洗涤至洗液呈中性,然后烘干纤维并称质量,得到乙醇胺改性的纤维PANEAF。通过公式(1)和公式(2)计算增质量和官能度:
| $ W = \left( {{W_1} - {W_0}} \right)/{W_0} \times 100\% $ | (1) |
| $ F = \left( {{W_1} - {W_0}} \right)/\left( {{W_1}M} \right) \times 1000 $ | (2) |
式(1)和(2)中:W0和W1分别为PANF和改性纤维的质量;M为增加的相对分子质量。
将PANEAF纤维(1 g)、除水乙腈(20 mL)和POCl3(2 mL)置于50 mL圆底烧瓶中并加热回流。反应结束后将溶液冷却至室温,并将纤维放入冷水中搅拌2 h。随后用60~65 ℃的热水洗涤至洗液呈中性,然后烘干纤维并称质量,得到一系列不同增重的磷酸功能化纤维PANEAPF。
1.2.2 化合物4的合成在反应瓶中加入芳香醛1.0 mmol、丙二腈0.079 2 g(1.2 mmol),α-萘酚0.158 4 g(1.1 mmol),水(10 mL),并在油浴100 ℃下反应。反应结束后用乙酸乙酯萃取,收集有机相,旋转蒸发除去溶剂,通过柱色谱纯化,得到产物。
4a: 1H NMR (400 MHz, DMSO-d6) δ 8.29 (d, J=8.2 Hz, 1H), 7.94 (d, J=8.0 Hz, 1H), 7.72~7.58 (m, 3H), 7.43 (d, J=8.0 Hz, 2H), 7.33 (d, J=8.1 Hz, 2H), 7.28 (s, 2H), 7.14 (d, J=8.5 Hz, 1H), 5.00 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.63, 145.15, 143.22, 133.22, 132.02, 130.05, 129.17, 128.18, 127.35, 127.21, 126.55, 124.49, 123.20, 121.18, 120.86, 117.87, 56.29, 40.64。
4b: 1H NMR (400 MHz, DMSO-d6) δ 8.30 (d, J=7.6 Hz, 1H), 7.95 (d, J=7.4 Hz, 1H), 7.78~7.57 (m, 3H), 7.49 (d, J=10.1 Hz, 2H), 7.42~7.22 (m, 4H), 7.18 (d, J=8.0 Hz, 1H), 5.02 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.76, 148.88, 143.27, 133.27, 131.52, 130.73, 130.39, 128.19, 127.40, 127.25, 126.50, 124.58, 123.21, 122.43, 121.23, 120.78, 117.68, 56.14, 40.87。
4c: 1H NMR (400 MHz, DMSO-d6) δ 8.28 (d, J=8.2 Hz, 1H), 7.99~7.81 (m, 2H), 7.76~7.55 (m, 4H), 7.50 (t, J=7.6 Hz, 1H), 7.37 (d, J=7.7 Hz, 1H), 7.31 (s, 2H), 7.07 (d, J=8.5 Hz, 1H), 5.47 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.71, 149.31, 143.60, 139.18, 134.10, 133.42, 132.33, 128.98, 128.19, 127.57, 127.33, 126.04, 124.75, 124.35, 123.17, 121.29, 120.38, 116.60, 55.74, 36.56。
4d: 1H NMR (400 MHz, DMSO-d6) δ 8.31 (d, J=8.1 Hz, 1H), 8.17 (d, J=11.2 Hz, 2H), 7.95 (d, J=7.9 Hz, 1H), 7.77 (t, J=12.7 Hz, 1H), 7.75~7.56 (m, 4H), 7.38 (s, 2H), 7.20 (d, J=8.4 Hz, 1H), 5.25 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.89, 148.46, 148.33, 143.38, 135.08, 133.35, 130.97, 128.21, 127.52, 127.33, 126.43, 124.72, 123.21, 122.63, 122.51, 121.24, 117.28, 55.81, 40.72。
4e: 1H NMR (400 MHz, DMSO-d6) δ 8.26 (t, J=8.9 Hz, 1H), 8.20 (d, J=7.9 Hz, 2H), 7.91 (d, J=7.9 Hz, 1H), 7.58~7.68 (m, 3H), 7.55 (d, J=7.9 Hz, 2H), 7.34 (s, 2H), 7.11 (d, J=8.3 Hz, 1H), 5.16(s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.81, 153.45, 146.97, 143.41, 133.38, 129.51, 128.21, 127.52, 127.32, 126.40, 124.69, 124.55, 123.22, 121.23, 120.65, 117.09, 55.67, 40.99。
4f: 1H NMR (400 MHz, DMSO-d6) δ 8.32 (d, J=8.2 Hz, 1H), 7.95 (d, J=7.9 Hz, 1H), 7.83~7.54 (m, 7H), 7.33 (s, 2H), 7.18 (d, J=8.4 Hz, 1H), 5.17 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.81, 147.51, 143.34, 133.29, 132.52, 130.51, 129.61, 128.20, 127.45, 127.28, 126.44, 124.64, 124.38, 123.21, 121.25, 120.70, 117.55, 56.03, 40.90。
4g: 1H NMR (400 MHz, DMSO-d6) δ 8.28 (t, J=13.9 Hz, 1H), 7.89 (d, J=7.9 Hz, 1H), 7.52~7.71 (m, 3H), 7.40~7.20 (m, 5H), 7.17 (s, 2H), 7.12 (d, J=8.2 Hz, 1H), 4.90 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.64, 146.17, 143.21, 133.16, 129.18, 128.14, 127.40, 127.24, 127.15, 126.70, 124.37, 123.23, 121.17, 120.99, 118.42, 56.75, 41.39。
4h: 1H NMR (400 MHz, DMSO-d6) δ 8.29 (d, J=8.0 Hz, 1H), 7.93 (d, J=7.6 Hz, 1H), 7.83~7.47 (m, 3H), 7.29~6.93 (m, 7H), 4.90 (s, 1H), 2.30 (s, 3H)。13C NMR (101 MHz, DMSO-d6) δ 160.54, 143.26, 143.13, 136.51, 133.13, 129.72, 128.14, 128.06, 127.20, 127.12, 126.73, 124.29, 123.23, 121.17, 121.00, 118.54, 56.86, 41.00, 21.07。
4i: 1H NMR (400 MHz, DMSO-d6) δ 8.29 (d, J=8.0 Hz, 1H), 7.91 (d, J=7.7 Hz, 1H), 7.75~7.50 (m, 3H), 7.23~7.33 (m, 1H), 7.19~7.09 (m, 3H), 7.08 (t, J=8.0 Hz, 2H), 6.93 (t, J=6.8 Hz, 1H), 5.31 (s, 1H), 3.85 (s, 3H)。13C NMR (101 MHz, DMSO-d6) δ 161.29, 156.86, 143.49, 133.86, 133.10, 129.50, 128.71, 128.09, 127.05, 126.29, 124.27, 123.20, 121.35, 121.10, 118.62, 112.09, 56.51, 56.21, 55.81, 34.89, 19.03。
4j: 1H NMR (400 MHz, DMSO-d6) δ 8.29 (d, J=8.2 Hz, 1H), 7.93 (d, J=7.9 Hz, 1H), 7.52~7.76 (m, 3H), 7.37~7.19 (m, 3H), 7.14 (d, J=7.8 Hz, 1H), 6.88 (s, 1H), 6.84 (d, J=7.7 Hz, 2H), 4.91 (s, 1H), 3.75 (s, 3H)。13C NMR (101 MHz, DMSO-d6) δ 160.70, 159.89, 147.74, 143.16, 133.18, 130.34, 128.15, 127.24, 127.13, 126.65, 124.34, 123.22, 121.18, 120.97, 120.36, 118.31, 114.25, 112.27, 56.58, 55.47, 41.32。
4k: 1H NMR (400 MHz, DMSO-d6) δ 9.35 (s, 1H), 8.24 (d, J=8.0 Hz, 1H), 7.88 (d, J=7.7 Hz, 1H), 7.72~7.48 (m, 3H), 7.08 (d, J=7.1 Hz, 3H), 7.05 (d, J=7.5 Hz, 2H), 6.71 (d, J=7.4 Hz, 2H), 4.78 (s, 1H)。3C NMR (101 MHz, DMSO-d6) δ 160.44, 156.76, 143.03, 136.66, 133.07, 129.16, 128.13, 127.10, 126.82, 124.22, 123.24, 121.14, 118.94, 115.84, 57.23。
4l: 1H NMR (400 MHz, DMSO-d6) δ 8.28 (d, J=8.1 Hz, 1H), 7.95 (d, J=7.8 Hz, 1H), 7.77~7.55 (m, 3H), 7.42 (s, 1H), 7.32 (d, J=10.6 Hz, 3H), 7.14 (s, 1H), 7.00 (s, 1H), 5.32 (s, 1H)。13C NMR (101 MHz, DMSO-d6) δ 160.72, 151.20, 142.89, 133.30, 128.18, 127.35, 127.21, 126.53, 125.98, 125.02, 124.44, 123.19, 121.20, 120.81, 118.18, 56.95, 36.63。
1.2.3 化合物5的合成4-羟基香豆素(2.2 mmol),芳香醛(1.0 mmol),水(10 mL)置于反应瓶中,并在60 ℃(油浴)下反应。反应结束后用乙酸乙酯萃取,收集有机相,旋转蒸发除去溶剂,柱色谱纯化,得到产物。
5a: 1H NMR (400 MHz, DMSO-d6) δ 10.63 (s, 2H), 7.87 (d, J=7.6 Hz, 2H), 7.59 (t, J=7.3 Hz, 2H), 7.27 (m, 8H), 6.31 (s, 1H)。
5b: 1H NMR (400 MHz, DMSO-d6) δ 8.10 (d, J=8.0 Hz, 2H), 7.84 (d, J=7.1 Hz, 2H), 7.66~7.15 (m, 8H), 6.37 (s, 1H)。
5c: 1H NMR (400 MHz, DMSO-d6) δ 11.63 (s, 2H), 7.87 (d, J=7.7 Hz, 2H), 7.66 (d, J=7.8 Hz, 1H), 7.56 (q, J=8.0 Hz, 3H), 7.43~7.39 (m, 2H), 7.35~7.26 (m, 4H), 6.54 (s, 1H)。
5d: 1H NMR (400 MHz, DMSO-d6) δ 10.93 (s, 2H), 7.88 (d, J=7.8 Hz, 2H), 7.60 (t, J=7.7 Hz, 2H), 7.47~7.25 (m, 6H), 7.11 (d, J=8.5 Hz, 2H), 6.29 (s, 1H)。
5e: 1H NMR (400 MHz, DMSO-d6) δ 7.88 (d, J=7.7 Hz, 2H), 7.61 (t, J=7.6 Hz, 2H), 7.40~7.27 (m, 4H), 7.26~7.21 (m, 2H), 7.16 (d, J=7.2 Hz, 3H), 6.39 (s, 1H)。
5f: 1H NMR (400 MHz, DMSO-d6) δ 10.70 (s, 2H), 7.90 (d, J=7.7 Hz, 2H), 7.62 (t, J=7.2 Hz, 2H), 7.43~7.27 (m, 4H), 7.07 (s, 4H), 6.34 (s, 1H), 2.29 (s, 3H)。
5g: 1H NMR (400 MHz, DMSO-d6) δ 7.89 (d, J=7.8 Hz, 2H), 7.58 (t, J=7.6 Hz, 2H), 7.37~7.26 (m, 4H), 7.14 (t, J=7.9 Hz, 1H), 6.77~6.60 (m, 3H), 6.31 (s, 1H), 3.65 (s, 3H)。
5h: 1H NMR (400 MHz, DMSO-d6) δ 9.97 (s, 2H), 7.92 (d, J=7.5 Hz, 2H), 7.61 (t, J=7.7 Hz, 2H), 7.40~7.28 (m, 4H), 7.25~7.12 (m, 2H), 6.94 (d, J=8.0 Hz, 1H), 6.88 (t, J=7.5 Hz, 1H), 6.29 (s, 1H), 3.58 (s, 3H)。
2 结果与讨论 2.1 红外表征通过红外谱图对纤维的结构及特征官能团进行表征。如图 2所示,在2 243 cm-1处的吸收峰对应于PANF上的—C≡N的伸缩振动峰。在1 727 cm-1处出现的强吸收峰归因于腈纶纤维中C=O的伸缩振动峰[图 2(a)][14]。纤维改性后,在3 200~3 600 cm-1处出现的宽吸收峰,对应于O—H的伸缩振动,这表明乙醇胺被成功负载到PANF上[图 2(b)]。在PANEAPF的红外光谱[图 2(c)]中,975 cm-1处的新吸收峰是属于P—OH伸缩振动,而1 170和1 070 cm-1处出现的2个吸收峰归因于O=P—O的伸缩振动,这进一步证明了磷酸被成功地修饰到纤维上[15]。
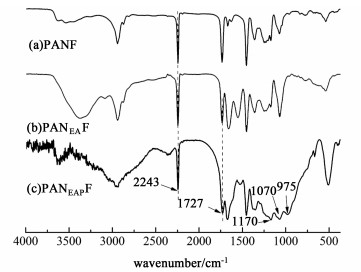
|
| 图 2 PANF,PANEAF和PANEAPF的红外光谱 Fig.2 FTIR spectra of PANF, PANEAF and PANEAPF |
| |
通过SEM表征纤维的表面形态。如图 3所示,原纤维改性后,可以清楚地观察到在放大后,PANEAF和PANEAPF的表面比PANF的更为粗糙[图 3a)~图 3c)],但依然保持良好的结构完整性。此外,PANEAPF循环10次后在高倍放大图像中表面变得略微粗糙[图 3d)],但是纤维的整体性仍然保持良好,这表明磷酸催化剂具有良好的稳定性。

|
| 图 3 a) PANF,b)PANEAF, c)PANEAPF和d)PANEAPF-10(循环10次后的磷酸纤维)的扫描电镜图像 Fig.3 SEM images of fibers of a) PANF, b) PANEAF, c) PANEAPF and d) PANEAPF-10 (phosphoric acid fibers after ten cycles) |
| |
探究了溶剂对纤维催化对氯苯甲醛、丙二腈和α-萘酚的三组分反应的影响,结果如表 1所示。当没有催化剂或加入PANF时(表 1,条目1~2),反应基本不能发生。在水中能获得相当高的转化率(表 1,条目3)。在常见有机溶剂中(表 1,条目4~13),除了在乙醇、甲醇和乙腈中获得少量的产物,其他溶剂中均没有获得最终产物。因此在这些溶剂中,水是最适宜的选择。
| 序号 | 催化剂 | 催化剂用量 | 溶剂 | 转化率/% |
| 1 | 水 | 5 | ||
| 2 | PANF | 50 mg | 水 | 8 |
| 3 | PANEAPF | 5% | 水 | 58 |
| 4 | PANEAPF | 5% | 乙醇 | 2 |
| 5 | PANEAPF | 5% | 甲醇 | 4 |
| 6 | PANEAPF | 5% | 乙酸乙酯 | 0 |
| 7 | PANEAPF | 5% | 乙腈 | 6 |
| 8 | PANEAPF | 5% | 二氯甲烷 | 0 |
| 9 | PANEAPF | 5% | 1, 4-二氧六环 | 0 |
| 10 | PANEAPF | 5% | DMF | 0 |
| 11 | PANEAPF | 5% | 甲苯 | 0 |
| 12 | PANEAPF | 5% | 环己烷 | 0 |
| 13 | PANEAPF | 5% | THF | 0 |
| 注:1.一般条件:对氯苯甲醛(1 mmol),丙二腈(1.2 mmol),α-萘酚(1.1 mmol),溶剂(10 mL),在65 ℃下反应4 h;2.萘作为内标物, 通过液相色谱仪得到转化率。3.反应在耐压瓶中进行。4.催化剂用量为摩尔分数。 | ||||
探究了PANEAPF官能度对三组分反应的影响。如图 4所示,随着PANEAPF官能度的增加,反应转化率随之增加。然而,随着PANEAPF官能度的增加,纤维的机械强度显著降低。因此,考虑到催化活性和循环性能,选择PANEAPF-1.23作为最适宜的催化剂。

|
| 图 4 PANEAPF官能度的影响 Fig.4 Effect of PANEAPF functionality |
| |
研究了反应温度和时间对反应的影响。当温度从80 ℃升至100 ℃时,反应转化率从30%增加至67%(表 2,条目1~2)。当延长反应时间至3h时,反应转化率增加至96%(表 2,条目3)。此外,还探讨了催化剂用量的影响。当催化剂用量(摩尔分数,下同)从2%增加到5%时,转化率显著增加,然而,催化剂用量增加到8%,转化率微弱地降低到95%(表 2,条目4~5)。因此,最适宜反应条件是在油浴100 ℃下催化剂用量为5%,反应时间为3 h。
| 序号 | 用量/% | 时间/h | 温度/℃ | 转化率/% |
| 1 | 5 | 2 | 80 | 30 |
| 2 | 5 | 2 | 100 | 67 |
| 3 | 5 | 3 | 100 | 96 |
| 4 | 2 | 3 | 100 | 58 |
| 5 | 8 | 3 | 100 | 95 |
| 注:1.萘作为内标物,通过高效液相色谱仪得到反应的转化率。2.反应在耐压瓶中进行,温度为油浴温度。 | ||||
在上述条件下,对底物的范围进行了扩展,结果列在图 5中,一般条件:芳香醛(1 mmol)、丙二腈(1.2 mmol)、α-萘酚(1.1 mmol)、催化剂(5%)、水(10 mL)并在油浴100 ℃下反应,均为分离产率。PANEAPF作为催化剂,产率为84%~97%,这与反应物中取代基的电子效应有关。吸电子基团的芳香醛(4a~4f)和苯甲醛的产率显著高于给电子基团取代的芳香醛(4h~4k)的产率。该催化剂也适用于杂芳醛(如噻吩甲醛),收率可达88%(4l)。
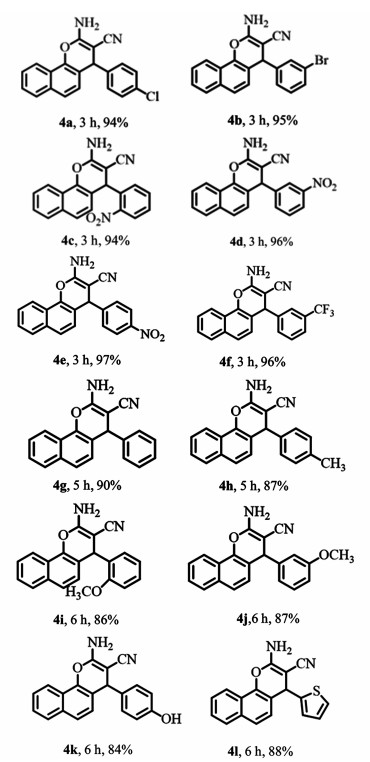
|
| 图 5 PANEAPF催化水中不同芳香醛、丙二腈和α-萘酚的三组分反应 Fig.5 hree-Component reaction of different aromatic aldehydes with malononitrile and α-naphthol in water catalyzed by PANEAPF |
| |
通过使用PANEAPF在温和条件下催化水相Friedel-Crafts反应合成了3, 3′-芳亚甲基双(4-羟基香豆素)类化合物。如图 6所示,一般条件:4-羟基香豆素(2.2 mmol),芳香醛(1 mmol),催化剂(20 mol%),水(10 mL),60 ℃(油浴)。无论取代基R是吸电子还是供电子基团,产率都可达90%以上(5a~5h)。与2-硝基苯甲醛相比,4-硝基苯甲醛具有更高的活性,这与空间位阻(5b,5c)有关。类似地,当取代基在苯环的间位而不是邻位(5g,5h)时,具有给电子取代基的芳香醛具有更高的反应活性。

|
| 图 6 PANEAPF催化4-羟基香豆素与芳香醛反应合成3, 3′-芳亚甲基双(4-羟基香豆素) Fig.6 Synthesis of 3, 3′-arylidene bis(4-hydroxycoumarins) from 4-hydroxycoumarin with aromatic aldehydes catalyzed by PANEAPF |
| |
催化剂的可循环性是绿色化学的重要理念,因此我们考察了PANEAPF催化剂在三组分反应中的循环使用情况。反应结束后,将纤维取出并用少量乙酸乙酯和乙醇洗涤,然后应用于下一循环。如图 7所示,经过10次循环后,磷酸固载化纤维的催化活性依然保持良好。与其他催化剂(见表 3)相比,PANEAPF易回收且具有良好的循环能力。这些结果表明磷酸功能化纤维是一种回收方便、循环使用性良好的催化剂。
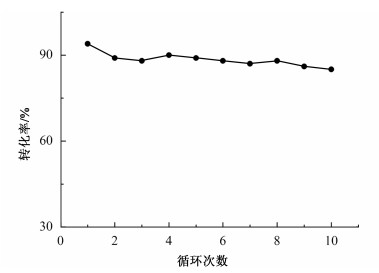
|
| 图 7 磷酸纤维PANEAPF的循环性能测试 Fig.7 The reusability test of the PANEAPF |
| |
成功合成了磷酸负载型纤维催化剂PANEAPF,并在水中实现了对芳香醛、丙二腈和α-萘酚的三组分反应以及4-羟基香豆素和芳香醛的Friedel-Crafts反应的高效催化。该催化剂显示出良好的催化性能和广泛的底物范围。此外与其他催化剂相比,PANEAPF具有良好的循环性能和稳定性,具有潜在的实际应用价值。
| [1] |
刘国辉, 章文. 绿色化工发展综述[J]. 中国环保产业, 2009(12): 19-25. Liu Guohui, Zhang Wen. Development summary on green chemical industry[J]. China Environmental Protection Industry, 2009(12): 19-25. (in Chinese) |
| [2] |
(a) Rafiee E, Eavani S. H3PW12O40 supported on silica-encapsulated γ-Fe2O3 nanoparticles: A novel magnetically-recoverable catalyst for three-component Mannich-type reactions in water[J]. Green Chem, 2011, 13(8): 2116-2122; (b) Alsalme A M, Wiper P V, Khimyak Y Z, et al. Solid acid catalysts based on H3PW12O40 heteropoly acid: Acid and catalytic properties at a gas-solid interface[J]. J Catal, 2010, 276(1): 181-189
|
| [3] |
Veisi H. Silica sulfuric acid (SSA) as a solid acid heterogeneous catalyst for one-pot synthesis of substituted pyrroles under solvent-free conditions at room temperature[J]. Tetrahedron Lett, 2010, 51(16): 2109-2114. DOI:10.1016/j.tetlet.2010.02.052 |
| [4] |
Rajkumari K, Kalita J, Das D, et al. Magnetic Fe3O4@silica sulfuric acid nanoparticles promoted regioselective protection/deprotection of alcohols with dihydropyran under solvent-free conditions[J]. RSC Adv, 2017, 7(89): 56559-56565. DOI:10.1039/C7RA12458A |
| [5] |
Dutta M M, Rajbongshi K K, Phukan P. CoFe2O4-SiO2-SO3H nanocomposite as a magnetically recoverable catalyst for oxidative bromination of alkynes[J]. Synth Commun, 2017, 47(24): 2330-2341. DOI:10.1080/00397911.2017.1376333 |
| [6] |
Dou Y, Zhang H, Zhou A, et al. Highly efficient catalytic esterification in an-SO3H-functionalized Cr(Ⅲ)-MOF[J]. Ind Eng Chem Res, 2018, 57(25): 8388-8395. DOI:10.1021/acs.iecr.8b01239 |
| [7] |
Rawat M, Prutyanov V, Wulff W D. Chromene chromium carbene complexes in the syntheses of naphthopyran and naphthopyrandione units present in photochromic materials and biologically active natural products[J]. J Am Chem Soc, 2006, 128(34): 11044-11053. DOI:10.1021/ja0568852 |
| [8] |
Jung E J, Park B H, Lee Y R. Chem Inform abstract: Environmentally benign, one-pot synthesis of pyrans by domino Knoevenagel/6π-electrocyclization in water and application to natural products[J]. Green Chem, 2010, 12(11): 2003-2011. DOI:10.1039/c0gc00265h |
| [9] |
Kadnikov D V, Larock R C. Synthesis of coumarins via palladium-catalyzed carbonylative annulation of internal alkynes byo-iodophenols[J]. Org Lett, 2000, 2(23): 3643-3646. DOI:10.1021/ol0065569 |
| [10] |
Kundu S K, Mondal J, Bhaumik A. Tungstic acid functionalized mesoporous SBA-15: A novel heterogeneous catalyst for facile one-pot synthesis of 2-amino-4H-chromenes in aqueous medium[J]. Dalton Trans, 2013, 42: 10515-10524. DOI:10.1039/c3dt50947h |
| [11] |
Reddy B M, Reddy V R, Giridhar D. Synthesis of coumarins catalyzed by eco-friendly W/ZrO2 solid acid catalyst[J]. Synth Commun, 2001, 31(23): 3603-3607. DOI:10.1081/SCC-100107007 |
| [12] |
(a) Mayer-Gall T, Lee J W, Opwis K, et al Textile catalysts-an unconventional approach towards heterogeneous catalysis[J]. ChemCatChem, 2016, 8(8): 1428-1436; (b) Lee J W, Mayer-Gall T, Opwis K, et al [J]., 2013, 341 (6151), 1225-1229; (c) Du J, Tao M, Zhang W. Fiber-Supported acid-base bifunctional catalysts for efficient nucleophilic addition in water[J]. ACS Sustainable Chem Eng, 2016, 4(8): 4296-4304; (d)Li P, Liu Y, Zhang W, et al Tuning the catalyticactivity of tertiary-amine functionalized polyacrylonitrile fibers by adjusting the surface microenvironment[J]. ChemCatChem, 2017, 9(19): 3725-3732
|
| [13] |
Xu G, Cao J, Zhao Y, et al. Phosphorylated polyacrylonitrile fibers as an efficient and greener acetalization catalyst[J]. Chem Asian J, 2017, 12(19): 2565-2575. DOI:10.1002/asia.201700846 |
| [14] |
Zhang L, Zhang X, Li P, et al. Effective Cd2+ chelating fiber based on polyacrylonitrile[J]. React Funct Polym, 2009, 69(1): 48-54. DOI:10.1016/j.reactfunctpolym.2008.10.008 |
| [15] |
Ma T, Qiao S. Acid-Base bifunctional periodic mesoporous metal phosphonates for synergistically and heterogeneously catalyzing CO2 conversion[J]. ACS Catal, 2014, 4(11): 3847-3855. DOI:10.1021/cs501124d |
| [16] |
Heidarizadeh F, Taheri N. Polystyrene-Supported basic dicationic ionic liquid as a novel, reusable, and efficient heterogeneous catalyst for the one-pot synthesis of chromene derivatives in water[J]. Res Chem Intermed, 2016, 42: 3829-3846. DOI:10.1007/s11164-015-2247-3 |
| [17] |
Wang Y, Luo J, Xing T, et al. Synthesis of a novel piperidine-functionalized poly(ethylene glycol) bridged dicationic ionic liquid and its application in one-pot synthesis of substituted 2-amino-2-chromenes and 3, 4-dihydropyrano[J]. Monatsh Chem, 2013, 144(12): 1871-1876. DOI:10.1007/s00706-013-1066-8 |
| [18] |
Heravi M M, Bakhtiari K, Zadsirjan V, et al. Aqua mediated synthesis of substituted 2-amino-4H-chromenes catalyzed by green and reusable Preyssler heteropolyacid[J]. Bioorg Med Chem Lett, 2007, 17(15): 4262-4265. DOI:10.1016/j.bmcl.2007.05.023 |
 2020, Vol. 37
2020, Vol. 37





