2. 清华大学材料学院, 北京 100084
2. Department of Materials Science and Engineering, Tsinghua University, Beijing 100084, China
Li+二次电池(LIBs)自1991年成功实现商业化以来,已经广泛被应用于便携式电子设备、电动汽车、规模储能等领域[1]。Li+电池由于其能量密度高、放电电压高等优点在便携式电子设备领域占据了绝对的市场优势[2]。目前商用Li+电池大多采用碳酸酯类电解液,这类电解液耐氧化能力差、易燃易渗漏,与锂金属负极、硅碳负极和高镍三元正极等电极材料存在高反应活性,使Li+电池存在泄露、起火和爆炸等严重的安全问题,严重阻碍了Li+电池的进一步大规模应用[3-4]。经过多年的发展,Li+电池的能量密度有了较大的提高,但是目前液态Li+电池的能量密度已经接近瓶颈[5],难以满足人们对电池能量密度越来越高的需求,采用含锂的高能量密度负极[6]和高压正极成为提高能量密度的关键,对电解质体系也提出了更高的要求[7]。固态电解质具有机械强度高、电化学稳定性高、热稳定性高等优点,可以匹配锂金属负极、高压正极,克服液态电解液带来的各种安全问题[8]。另外固态聚合物电解质还具有价格便宜、环境友好、易封装和不泄露等特点[9],为实现兼具高能量密度和高安全性的下一代Li+电池提供了可能。
固态电解质可按照组成分为无机固态电解质、聚合物固态电解质和复合固态电解质3大类。无机固态电解质具有室温离子电导率高、机械强度高、电化学稳定性高等优点,但是高阻抗的电极/电解质界面问题难以解决[10]。聚合物固态电解质更容易与电极形成低阻抗的界面,但是聚合物固态电解质的使用受制于其低室温离子电导率(10-8~10-6 S·cm-1)。聚合物固态电解质的概念始于1973年,Fenton[11]发现了PEO-LiX体系具有碱金属离子导电性,随后在1979年,Armand等[12]将PEO-LiX体系作为全固态电池的电解质,离子电导率达到了~10-4 S·cm-1(40~60 ℃),表现出了广阔的应用前景,从此聚合物电解质引起了广大研究者的兴趣。聚合物基电解质一般可以分为3大类:凝胶聚合物电解质(gel polymer electrolyte, GPE)、全固态聚合物电解质(all-solid-state polymer electrolytes, SPE)和聚合物基复合电解质(composite polymer electrolytes, CPE)。目前聚合物固态电解质基体主要包括:聚氧化乙烯(PEO)[13]、聚偏氟乙烯(PVDF)[14]、聚丙烯腈(PAN)[15]、聚甲基丙烯酸甲酯(PMMA)[16]和聚偏氟乙烯-六氟丙烯共聚物(PVDF-HFP)[17]等,其中对PEO及其衍生物的研究最为广泛。本论文主要从凝胶聚合物电解质、全固态聚合物电解质和聚合物基复合固态电解质3大类入手,立足于固态聚合物电解质在Li+电池中的电化学性能,系统总结了不同体系的固态聚合物电解质的离子传输机制、阐述了提高聚合物电解质离子电导率和电化学窗口等性能的主要改性方法和思路,同时展望了固态聚合物电解质面临的主要挑战和未来的发展方向。
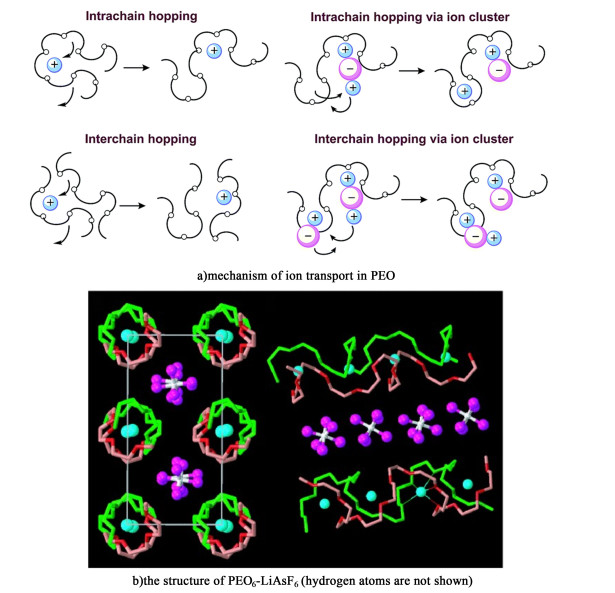
1 离子传输机制及关键参数 1.1 离子传输机制自1973年固态聚合物电解质出现以来,固态聚合物电解质中的离子传输机制就引起了广大研究者的关注。如同在传统液态电解液中一样,对锂盐的解离能力是实现离子输运的前提,聚合物中—O—、C=O、—S—和C≡N等极性基团是解离锂盐的关键[18]。聚合物的介电常数是评估聚合物对锂盐解离能力的重要参数,介电常数越高,则解离锂盐的能力越强[19]。在全固态聚合物电解质中,Li+的传输主要依赖于聚合物无定形区的链段运动,这就要求电池的工作温度高于聚合物电解质的玻璃化转变温度(Tg)。Li+在聚合物电解质中的传导机制如图 1a)所示,Li+与聚合物链段上的极性基团发生配位,在电场的驱动下,Li+随着聚合物链段的运动从1个配位点传输到下1个配位点,从而实现Li+的输运。然而离子也有可能通过聚合物电解质中的特殊晶体结构进行传导,图 1b)为PEO6-LiAsF6的晶体结构示意图,成对的PEO链折叠在一起,形成圆柱形隧道,Li+与醚氧键配合,沿着圆柱形隧道传输[20]。
聚合物电解质的离子电导率与温度之间的关系主要服从两种传导模型:Vogel-Tamman-Fulcher (VTF)模型和Arrhenius模型。Vogel-Tamman-Fulcher (VTF)模型可以用式(1)表述:
| $ \sigma ={{\sigma }_{0}}{{T}^{-\frac{1}{2}}}\exp \left( -\frac{{{E}_{a}}}{T-{{T}_{0}}} \right) $ | (1) |
式(1)中:σ0是频率因子,与载流子的数量有关;Ea为离子传导的活化能;T为工作温度;T0为平衡玻璃转移温度(T0=Tg-50,K);Tg为玻璃化转变温度。VTF公式被最早提出来用于解释玻璃状和无序材料中的扩散过程,可以由自由体积理论和配位熵等准热力学理论推导得出[21]。VTF行为通常与离子运动以及聚合物分支和溶剂分子的长程运动有关,目前VTF公式经常被用来描述玻璃化转变温度以上的聚合物固态电解质、凝胶聚合物电解质、有机液态电解质和离子液体中的离子传输行为[22]。
Arrhenius模型可以用式(2)表述。
| $ \sigma ={{\sigma }_{0}}{{T}^{-\frac{1}{2}}}\exp \left( -\frac{{{E}_{\text{a}}}}{kT} \right) $ | (2) |
式(2)中:k为玻尔兹曼常数,其他参数都如式(1)所述。Arrhenius行为通常与基体长程运动中伴随的离子跳跃运动相关,通常用来描述无机固态电解质、玻璃化转变温度以下的非晶聚合物电解质中的离子传输行为[22]。
1.2 关键参数 1.2.1 离子电导率离子电导率可用式(3)表示:
| $ \sigma (T)=\sum{{{n}_{i}}}{{q}_{i}}{{\mu }_{i}} $ | (3) |
式(3)中:σ(T)为某温度下的离子电导率;ni为载流子数目;qi为载流子带的电荷数;μi为载流子的传输速率。由式(3)可知,若要提高聚合物电解质的离子电导率,就要提高锂盐的解离能力来增大载流子的数目,并降低结晶度来提高载流子的传输速率。离子电导率是电解质体系离子传导性的衡量标准,是决定Li+电池电化学性能的关键因素之一。碳酸酯类有机电解液的离子电导率大约可以达到10-3~10-2 S·cm-1。一般来说,要求聚合物固态电解质的离子电导率接近或者高于10-4 S·cm-1,才能保证电池具有正常的充放电行为。
1.2.2 Li+迁移数Li+迁移数被定义为Li+迁移率占电解质中所有离子迁移率的比例,即:
| $ {{t}^{+}}=\frac{{{\mu }^{+}}}{{{\mu }^{+}}+{{\mu }^{-}}} $ | (4) |
t+为Li+迁移数,其中μ+和μ-分别为Li+的迁移率和其他阴离子的迁移率。由式(4)可以看出,Li+对电解质离子导电率的贡献率越高,Li+迁移数越接近于1。Li+迁移数的增大有利于减少电池充放电过程中的浓差极化,降低电极过电势,提高电池的能量密度[24]。目前研究者们主要通过减少阴离子的迁移来提高Li+迁移数,主要有2种方法:一是将阴离子枝接在聚合物电解质的骨架上[25],这是目前制备单离子导体最普遍的一种方法;二是在聚合物电解质中加入阴离子受体,选择性地与阴离子络合,限制阴离子的运动。
1.2.3 电化学稳定性一般使用电化学窗口来衡量固态电解质的电化学稳定性,电化学窗口是指电解质氧化电位与还原电位之间的电压差[9]。要实现电池正常的充放电就要求聚合物固态电解质具有足够宽的电化学窗口(4~5 V vs. Li/Li+),即氧化电位高于正极脱嵌Li+的氧化还原电位[18]。由于高压正极的使用是提高Li+电池能量密度的重要途径,所以探索具有宽电化学窗口的聚合物固态电解质十分关键。
1.2.4 机械强度理想的固态聚合物电解质应该具有高机械强度和一定的柔性,一方面可以有效地抑制锂金属枝晶的生长;另一方面也可以缓冲电极的体积膨胀,以保证充放电过程中始终保持电极和电解质的良好接触[26]。
1.2.5 与电极的兼容性固态电解质与电极之间保持稳定是对电解质的基本要求之一,但是目前一些固态电解质存在与电极不稳定的问题,如PAN、Li1+xAlxTi2-x(PO4)3(LATP)等与锂金属发生化学反应[27],损耗电极活性材料和电解质,从而影响电池的正常运行。另外,与电极相容性好有利于降低电极/电解质的界面阻抗,实现界面处Li+的快速传输。
1.2.6 热稳定性固态聚合物电解质具有高热稳定性一方面能够保证电池在高温下运行,另一方面能够保证电池在短路、过充等问题发生时不至于出现严重的热失控等安全问题。
2 凝胶聚合物电解质GPE作为固态电解质和液态电解液之间的一种中间形态,一般由聚合物基体(如PVDF、PAN、PMMA、PEO等)与电解液有机增塑剂[如碳酸乙烯酯(EC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)等]及锂盐[如LiN(SO2F)2(LiFSI)、LiClO4、C2F6LiNO4S2(LiTFSI)]组成,聚合物基体可以吸附大量的增塑剂,减少液相的泄露同时可以保持一定的机械强度[28]。所以,GPE兼具固态电解质和液态电解质的优点,既可以抑制锂枝晶的生长、提高电池的安全性,又可以保证与液态电解液相近的室温离子电导率和界面阻抗[29]。虽然聚合物基体吸收了大量的液相增塑剂,大大降低了聚合物的结晶度、提高了无定形区的比例,并且加速了无定形区链段的运动,但是聚合物基体与Li+的相互作用比较有限,对离子电导的贡献很小,GPE中的离子传输主要依赖于液相增塑剂部分[30]。在凝胶聚合物电解质中探索具有高热稳定性、自愈性、高柔性等特点的功能性GPE也是GPE的一项重要用途。GPE的制备主要有浇注成膜法、原位合成法、相转移法等制备方法。
GPE聚合物基体中通常具有很多极性基团,可以有效缓解锂硫电池中活性硫溶解和多硫化物穿梭的问题[31]。如Agostini等[32]通过将PVDF薄膜浸泡在1 mol/L LiTFSI DOL/DME(含LiNO3)中制备了一种新型凝胶聚合物电解质用于锂硫电池,离子电导率高达3×10-3 S·cm-1 (65 ℃)和7×10-4 S·cm-1(20 ℃),研究发现这种凝胶聚合物电解质对活性硫的溶解和多硫化物在负极侧的沉积具有明显的抑制作用。原位合成技术不仅对电极/电解质界面的形成十分有利,也可以简化Li+电池的组装流程。Kang等[33]首次采用原位合成的方法制备了四丙烯酸季戊四醇酯(PETEA)凝胶聚合物电解质用于锂硫电池,该电解质具有极高的离子电导率(1.13×10-2 S·cm-1),而且原位生成了良好的电极/电解质界面,同时在电极的表面原位形成了一层致密的钝化层,可以有效地保护电极、抑制多硫化物的穿梭效应。利用GPE也是提高电解质Li+迁移数的重要途径[图 2a)],Zhou等[34]通过原位光聚合的方法制备了多层次多功能的近似单离子凝胶聚合物电解质[图 2b)],Li+迁移数高达0.75,同时离子电导率也高达2.24×10-3 S·cm-1,用于锂金属电池表现出了优良的电化学性能。将凝胶聚合物电解质用于锂金属电池是解决锂金属负极枝晶生长问题的重要方法。如Lu等[35]采用无引发剂的开环聚合法制备了一种新型凝胶聚合物电解质用于锂金属电池,该聚合物电解质具有良好的机械强度和柔性,对抑制锂金属负极的枝晶生长表现出了明显的抑制作用(对称电池可以稳定工作900 h以上)[图 2c)和图 2d)]。

|
| 图 2 a) PETEA单体的聚合机理[33];b)多层多功能聚合物电解质的制备原理图[34];c)凝胶聚合物电解质的合成原理图[35];d)分别使用凝胶聚合物电解质和液态电解液的Li|Li对称电池在0.5和2.5 mA·cm-2的电流密度下锂沉积/脱除时的电压-时间曲线[35] Fig.2 a)Polymerization mechanism of the PETEA monomers[33] b)Schematic illustration of the preparation of hierarchical multifuntional polymer electrolyte[34]; c)Schematic of the synthesis of the GPE membrane[35]; d)The lithium deposition/stripping of Li/3D-GPE/Li and Li/separator-liquid-electrolyte/Li symmetrical cells at current densities of 0.5 and 2.5 mA·cm-2[35] |
| |
如上所述,凝胶聚合物电解质相比传统的电解液体系在抑制锂硫电池中的穿梭效应、抑制锂枝晶、改善电极/电解质界面方面具有明显优势,但是GPE仍然包含有部分液相成分,无法完全解决液态电解液带来的问题。在可规模化的全固态电解质被开发出来以前,GPE仍然是提高固态电解质离子电导率和改善界面相容性的重要途径,继续探索多功能的聚合物基体和原位聚合技术具有十分重要的意义。
3 全固态聚合物电解质固态聚合物电解质离子电导率过低的问题是目前研究者普遍关注的问题,降低聚合物电解质的玻璃化转变温度(Tg),加速Li+在聚合物自由链段的传递是最常用的策略之一。提高聚合物分子骨架的侧链长度、加入无机陶瓷填料等都是提高聚合物阵列中无定形区比例的有效方式。但是这种方式并没有改变聚合物电解质传输离子的本征机制,Li+在聚合物的电解质中的传递还受到锂盐的解离程度和Li+配位环境的影响[26]。提高聚合物的介电常数可以有效地提高锂盐的解离程度,但是Li+与路易斯酸基团的结合力强,导致Li+运动困难、Li+迁移数较低,进一步导致浓差极化,使电池电化学性能恶化。单离子导体的合成是提高Li+迁移数的重要方法,但是单离子导体中阴离子对Li+的强吸引力往往导致电解质表现出较低的离子电导率。综上,实现具有优异电化学性能的全固态聚合物锂电池必须寻找1)锂盐解离能力;2)Li+迁移数;3)聚合物结晶度;4)机械强度的平衡点,这几个因素具有相互制约的关系。下面从不同的聚合物电解质体系入手详细介绍近年来全固态聚合物电解质的发展情况。
3.1 PEO基固态电解质PEO基固态电解质是研究最多的一类聚合物电解质,这类材料具有解离锂盐能力强、与锂金属相容性好、电化学稳定性好、价格低廉等优点,但是其在室温下过低的离子电导率限制了PEO电解质的应用[23]。只有将温度提高到60 ℃以上,PEO的离子电导率才能够满足电池运行的要求,但是PEO在60 ℃接近熔融状态,机械强度较差。为了使PEO在室温下兼具高的离子电导率和高机械强度,研究者们采用了PEO枝接、共聚共混、添加增塑剂、添加无机填料等策略对其进行改性。
Bouchet等[36]报道了一种基于阴离子嵌段共聚物[P(STFSILi)-b-PEO-b-P(STFSILi)]的多功能单离子聚合物电解质,同时提高了离子电导率(1.3×10-5 S·cm-1)和机械强度(10 MPa,40 ℃),实现了高Li+迁移数(>0.85),但是受制于聚阴离子基团对Li+的束缚作用,使得离子电导率无法达到理想状况(>10-4 S·cm-1)[图 3a)]。

|
| 图 3 a) 单离子导体三嵌段共聚物P(STFSILi)-b-PEO-b-P(STFSILi)的化学结构[36];b)一体化全固态LiFePO4/复合电解质/Li电池的示意图[40];c)复合电解质/电极的截面扫描电子显微镜图像[40];d)原位水解过程中,PEO链和MUSiO2相互作用机制示意图[41];e)TEGDME与TEGDMA和PEO的交联示意图[37] Fig.3 a)Chemical structure of the single-ion conductor triblock copolymer P(STFSILi)-b-PEO-b-P(STFSILi) proposed as an electrolyte for lithium-metal-based batteries[36]; b)Schematic illustration of an integrated all-solid-state LiFePO4/PLLN/Li battery[40]; c)cross-sectional images of cathode and PLLN electrolyte before and after 60 ℃, the corresponding EDS mapping of Fe, and the cathode and PLLN fuse together at 60 ℃ to from an integrated all-solid-state battery[40]; d)Schematic figures showing the procedure of in situ hydrolysis and interaction mechanisms among PEO chains and MUSiO2[41]; e)Diagram of inter-crosslinking structure of PTT-SPE[37] |
| |
通过多种聚合物分子链与PEO分子链的相互作用来打乱PEO分子链的规律分布,是降低PEO的结晶度来提高固态电解质的离子电导率和改善聚合物电解质的机械强度的有效策略。Zhang等[37]使用原位光聚合双反应制备了柔性的PEO基聚合物电解质,引入四乙二醇二甲醚(TEGDME)和四甘醇二甲基丙烯酸酯(TEGDMA)与PEO链段形成交联无序结构,有效降低了PEO的结晶度,离子电导率高达2.7×10-4 S·cm-1(24 ℃),实现了PEO基固态电池的常温稳定运行[图 3e)]。
添加塑化剂是一种降低PEO-LiX体系结晶度,提高其无定形区比例的传统方法,加入液态的极性有机溶剂和小相对分子质量的PEG是研究者们普遍采用的策略[38]。但是液体塑化剂的加入使聚合物电解质的机械强度降低,无法有效地抑制锂枝晶的生长。O′Reilly等[39]将小相对分子质量的PEG作为增塑剂添加到PEO聚合物电解质中,PEG的加入提高了聚合物电解质的介电常数,降低离子团聚,有效地提高了离子电导率,同时研究者探索了不同的PEG加入量对PEO电解质离子电导率的影响。
大量的研究证明,在PEO基体中添加无机陶瓷填料可以提高固态电解质的离子电导率,一方面无机填料的加入有利于降低PEO的结晶度,增加无定形区的比例,提高离子电导率,另一方面根据路易斯酸理论,离子与无机填料表面的基团之间存在交互作用,有利于提高离子电导率。如Lin等[41]在PEO/LiClO4体系中原位合成单分散的粒径为12 nm的二氧化硅纳米粒子作为无机填料,通过二氧化硅粒子与PEO之间化学键合作用和机械包覆作用,实现了聚合物阵列与无机填料之间更好的相互作用。这种原位合成方法可以有效控制二氧化硅粒子的尺寸,实现二氧化硅粒子在PEO中的高度单分散,大幅度降低了PEO的结晶度,有利于LiClO4在聚合物中的解离。这种方法提高了离子电导率(1.2×10-3 S·cm-1,60 ℃),同时将PEO基电解质的电化学稳定窗口扩宽到了5.5 V,以LiFePO4为正极的全固态聚合物电池具有良好的电化学性能,在1 C倍率下可逆容量保持在100 mAh·g-1(60 ℃)和120 mAh·g-1(90 ℃)[图 3d)]。另外,很多研究者尝试将无机快离子导体作为PEO基电解质的填料,Wan[40]等报道了一种Li7La3Zr2O12纳米线作为PEO/LiTFSI的填料,提高了离子电导率(25 ℃下2.39×10-4 S·cm-1)和机械强度。他们同时将PEO/LiTFSI作为LiFePO4正极的黏结剂构建了一体化正极,提高了正极内部的离子输运能力,有效地降低了固态电解质与正极之间的界面阻抗[图 3b)和图 3c)]。
3.2 聚碳酸酯基固态电解质PEO由于介电常数较低,导致锂盐不能充分解离,从而造成固态电解质中离子的团聚和离子电导率的降低。脂肪族类或者环状碳酸酯类[—O—(C=O)—O—]具有较高的介电常数,可以保证锂盐的充分解离,常被用做液态电解液中的溶剂或者添加剂[42]。研究证明,在酯类聚合物骨架或者功能性侧链上引入此类结构可以提高其离子电导率和电化学稳定性[43]。聚碳酸乙烯酯(PEC)、聚碳酸环丙烷(PTMC)、聚碳酸丙烯酯(PPC)、聚碳酸亚乙烯酯(PVCA)等是非常有潜力的聚碳酸酯基聚合物固态电解质。
Kimura等[44]报道了一种聚碳酸乙烯酯(PEC)基固态电解质,组装了以PI为支撑体的PEC-LiFSI复合固态电解质,常温下离子电导率为1.6×10-5 S·cm-1,Li+迁移数高达0.5。Chai等[45]通过巧妙的原位热引发碳酸亚乙烯酯(VC)聚合的方法成功制备了与锂金属负极和高电压钴酸锂正极都具有良好界面兼容性的固态聚合物电解质(PVCA-SPE),具有宽电化学窗口(4.5 V)和高离子电导率(2.23×10-5 S·cm-1,25 ℃),使用这种固态聚合物电解质有望实现匹配高电压正极的高能量密度(260 Wh·kg-1)全固态锂金属电池[图 4a)和图 4b)]。2015年,Zhang等[46]报道了一种纤维素作为支撑体的PPC聚合物固态电解质(CPPC-SPE),实现了高机械强度(25 MPa)、高电化学稳定性(4.6 V)、高离子电导率(3 ×10-4 S·cm-1,20 ℃)和良好的锂金属负极兼容性。这种高离子电导率可能归因于C=O与Li+之间的相互作用及PPC低的结晶度,因为前者有利于更快速地传导Li+而后者有利于其链段的运动。其组装的LiFePO4/CPPC-SPE/Li电池具有1 000圈以上的循环寿命、高倍率性能和安全性能,是一种非常有潜力的全固态电解质[图 4c)和图 4d)]。2017年,Zhang等[47]又进一步将Li6.5La3Zr2.5Ti0.5O12(LLZTO)作为无机填料来进一步优化PPC电解质的性能,对离子电导率、机械强度、Li+迁移数等都具有不同程度的提高,实现了耐高压常温运行的全固态电池[图 4e)和图 4f)]。将常用的电解液溶剂和电解液添加剂的固态聚合物用于固态电解质是一个非常好的想法,因为这些聚合物具有高介电常数、高常温离子电导率、与正负极都具有良好的界面相容性等优点,但是其用于全固态电解质的加工工艺等方面还需要进一步的探索。

|
| 图 4 a) VC单体聚合的光学照片;b)固态聚合物电解质(PVCA-SPE)的实物光学照片[45];c)使用CPPC复合电解质的LiFePO4/Li电池的交流阻抗图谱(循环1圈后和循环1000圈后);d)使用CPPC复合电解质的LiFePO4/Li电池在0.5 C倍率下的循环稳定性[46];e)柔性LiFePO4/Li4Ti5O12软包全电池的组装示意图;f)柔性LiFePO4/Li4Ti5O12软包全电池的循环性能图,插图为LiFePO4/Li4Ti5O12软包全电池的交流阻抗图谱(循环1圈后和循环800圈后)[47] Fig.4 a)The typical image of in situ polymerization of VC into PVCA after heating at 60 ℃ for 24 h; b)the digital images of cellulose/PVCA-LiDFOB composite solid polymer electrolyte[45]; c)Nyquist plots for LiFePO4/Li cells using CPPC-SPE after the first cycle and after 1000 cycles; d)Cycling stability of LiFePO4/Li cell using CPPC-SPE at 0.5 C. Temperature: 20 ℃. The inset is SEM image of the lithium anode after 1000 cycles[46]; e)Schematic of flexible solid state LiFePO4/Li4Ti5O12 lithium ion full cell; f)cycle performance of solid state LiFePO4/Li4Ti5O12 lithium ion full cell. The inset is the impedance spectrum for the cell using PPCL-SPE after the first cycle and 800 cycles[47] |
| |
塑晶是一类由于分子或离子的旋转运动而在一定温度范围内具有位置有序但方向无序的材料,腈类材料在-40~60 ℃温度范围内都表现出具有高扩散性的塑晶行为。近年来,腈类材料由于具有高热稳定性和耐氧化能力被广泛用作固态电解质。2004年,Alarco等[48]首次报道了多种盐可以溶解于丁二腈的塑晶相,丁二腈的塑晶相作为固态电解质时常温离子电导率高达3 mS·cm-1。塑晶相的高极性使得其具有解离多种类型锂盐的能力,其无序性的结构使得塑晶相比常见的刚性晶体塑性和扩散性更好。但是锂盐的加入会降低塑晶的熔点,使得其在常温下表现出类似液态的行为,机械强度较低,无法形成自支撑的固态电解质层。因此丁二腈多被作为功能型添加剂加入到机械增强体中制备兼具高离子电导率和高机械强度的复合型固态电解质[49]。
为了进一步提高塑晶基固态电解质的机械强度,Zhou等[50]通过在丁二腈固态电解质中原位聚合PVA-CN形成交联网络,并且以电纺得到的PAN薄膜为支撑骨架,原位制备了多层次的全固态塑晶基固态电解质,该固态电解质具有高室温离子电导率(3.02×10-3 S·cm-1)、高Li+迁移数(0.57)和机械强度(15.31 MPa),能够有效地抑制锂枝晶的生长,但是腈类物质与锂金属的界面不相容性仍然没有得到很好的解决(图 5)。

|
| 图 5 多层次塑晶基聚合物电解质的原位合成路线 Fig.5 Schematic illustration for the in-situ synthesis route of SEN |
| |
聚硅氧烷又称硅酮和无机梳状聚合物,具有骨架柔性、化学稳定性、热稳定性、低毒等特点,可在硅与氧原子交替的骨架中与硅结合形成多种多样的副取代体[51]。聚硅氧烷因为其低玻璃化转变温度(Tg)、高常温离子电导率、高热稳定性和高化学稳定性等特点被广泛认为是一种非常有潜力的固态电解质,但是聚硅氧烷的低机械强度阻碍了其作为实用化固态电解质。于是近年来兼具高离子电导率和高机械强度的聚硅烷基固态电解质被广泛研究。Zhang等[52]使用低聚乙二醇取代聚硅氧烷作为导离子载体,他们设计了一种以低聚乙二醇基团作为内部塑化链段的新型交联聚硅氧烷基固态电解质,室温离子电导率高达1.33×10-4 S·cm-1,这是由于柔韧的硅氧烷骨架和短链PEO无定形区的快速摆动为Li+提供了快速传输的通道。随后,他们[53]继续探索了包括低聚乙二醇、(OCH2CH2)n等作为内部自由链段的一系列聚硅氧烷基交联网络聚合物电解质,采用LiN(CF3SO2)2为锂盐实现的最高离子电导率为1.62×10-4 S·cm-1。研究发现,离子电导率的高低取决于交联密度、低聚乙二醇链段的重复数、交联骨架的长度等因素。这种交联骨架与自由链段相结合的方式为提高聚合物电解质的离子电导率和机械强度提供了一种重要的思路。
3.5 其他体系固态聚合物电解质除了上述研究者们广泛关注的聚合物电解质体系外,还有一些其他的固态聚合物体系具有优异的电化学性能。如Zhao等[54]采用低浓度的可溶Al(OTf)3原位引发常用的电解液溶剂DOL聚合,制备出了常温离子电导率可以达到~10-3 S·cm-1的固态电解质,这种简单的原位聚合方式克服了固态电解质与电极之间界面阻抗过大的问题,满足了Li+在固态电解质体相和界面处都能够快速传输的需求[图 6a)和图 6b)]。另外,他们还研究了采用不同正极材料组装的全电池,都表现出了良好的电化学性能。Zhang等[55]研究了多种锂盐(LiFSI、LiTFSI、LiClO4)与PVDF电解质的兼容性,发现PVDF-LiFSI体系可以在电解质/锂金属界面处形成最稳定的界面层,有效抑制锂枝晶的生长,而且这种稳定的界面层在高电流密度下使电池断路,避免短路的发生[图 6c)]。Mackanic等[56]成功制备了具有交联结构的聚四氢呋喃(xPTHF)作为固态电解质,xPHHF中较低的氧浓度使得O—Li+结合力更弱,更有利于Li+的快速迁移,使聚合物固态电池具有更好的循环稳定性和倍率性能。开发新型的高性能聚合物电解质体系可以为新型全固态聚合物电池的研发提供更多的选择。

|
| 图 6 a) 原位和非原位聚合物电解质的合成示意图;b)(AlOTf)3引发DOL聚合的反应机理[54];c)Li/PVDF-LiX/Li对称电池在不同电流密度下的恒电流循环电压-时间曲线[55] Fig.6 a)Schematic illustrating ex-situ and in-situ synthesis of SPEs; b)Reaction mechanism illustrating how Al(OTf)3 initiates polymerization of DOL. Inset: digital photograph depicting the liquid DOL electrolyte (2 m LiTFSI/DOL, left) and solid-state poly-DOL electrolyte formed spontaneously in an electrolyte containing 0.5 mmol/L Al(OTf)3 salt (right)[54]; c)Galvanostatic cycling profiles of the Li‖PVDF-LiX‖Li cells at current density of 0.05, 0.1, and 0.2 mA·cm-2[55] |
| |
聚合物基复合电解质是指将全固态聚合物电解质与无机材料(SiO2、Al2O3和LLZO、LATP)或者其他类型的有机材料(纤维素等)复合得到的电解质。复合电解质可以结合多组分材料的优势,使聚合物电解质的机械强度和离子电导率都得到很好的提升,通过结构设计构筑多层多功能电解质还有望改善电极/电解质的界面相容性,实现全固态电池的综合电化学性能提升[57]。根据复合组分的不同,可以将复合固态电解质分为有机-无机复合电解质和有机-有机复合电解质2大类。在有机聚合物基体中加入无机陶瓷填料不仅能通过聚合物的结晶度从而提高离子电导率,也能保证复合电解质的机械强度和提高聚合物电解质的电化学稳定性。根据无机填料是否具有导离子的能力,可将其分为活性填料(LLZO和LATP)和惰性填料(SiO2、Al2O3和ZrO2)。关于无机填料的加入能够提高离子电导率的机制目前没有统一的定论,有几种主要的机制被研究者们所接受。1)无机填料加入到聚合物阵列中可以作为交联中心,阻止分子链的结晶,降低聚合物基体的结晶度,从而提高离子电导率[58],如Ma等[59]在聚乙二醇甲醚甲基丙烯酸酯(PEGMEM)基聚合物电解质中原位生成了单分散的TiO2纳米颗粒,有效地降低了EO链段的结晶度,提高了离子电导率(1.1×10-4 S·cm-1, 30 ℃);2)无机填料表面基团与离子和聚合物之间的交互作用提高了离子电导率[60],如Liu等[61]采用了Y2O3掺杂的ZrO2纳米线与PAN复合的复合电解质,由于Y2O3掺杂的ZrO2纳米线表面具有丰富的氧空位,这些氧空位可以与阴离子连接,从而释放更多的Li+,显著提高了离子电导率(1.07×10-5 S·cm-1)[图 7a)]。
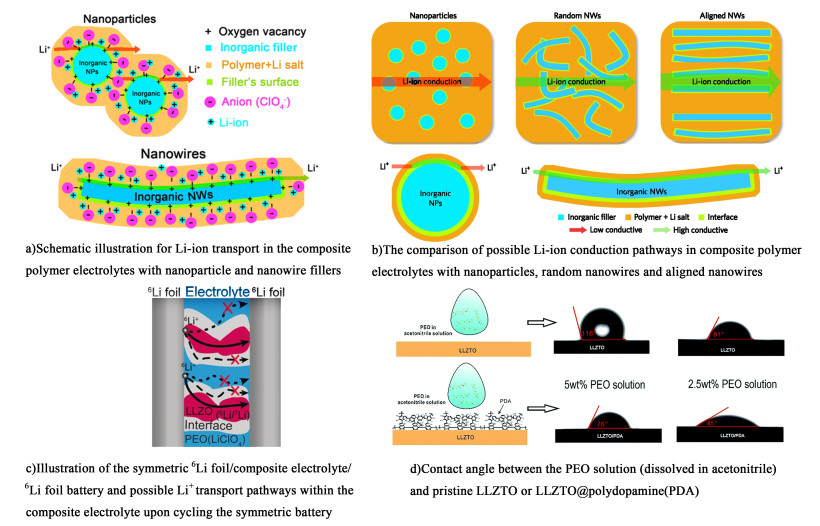
|
| 图 7 a) Li+在纳米粒子和纳米线填充的聚合物电解质中的传输示意图[61]; b)Li+在不同取向无机填料填充聚合物电解质中可能的传输路径[65]; c)Li+在LLZO/PEO复合聚合物电解质中的可能传输路径示意图[62];d)PEO溶液(溶于乙腈)与原始LLZTO和LLZTO@聚多巴胺之间的接触角对比图[66] Fig.7 a)Schematic illustration for Li-ion transport in the composite polymer electrolytes with nanoparticle and nanowire fillers[61]; b)The comparison of possible Li-ion conduction pathways in composite polymer electrolytes with nanoparticles, random nanowires and aligned nanowires[65]; c)Illustration of the symmetric 6Li foil/composite electrolyte/6Li foil battery and possible Li+ transport pathways within the composite electrolyte upon cycling the symmetric battery[62]; d)Contact angle between the PEO solution (dissolved in acetonitrile) and pristine LLZTO or LLZTO@polydopamine(PDA)[66] |
| |
Li+在有机-无机复合电解质中的传输路径引起了广大研究者的兴趣,如Zheng等[62]通过固态核磁实验验证了当LLZO作为PEO的无机填料时,Li+更倾向于通过LLZO内部进行传递,这为之前关于Li+在有机-无机复合电解质中传输机理的模拟计算[63]提供了实验依据[图 7c)]。所以快离子导体作为无机填料在提高聚合物电解质离子电导率上可能相比于惰性填料更有优势。Liu等[64]通过将静电纺丝得到的LLTO纳米线与PAN复合得到的复合电解质表现出了较高的室温离子电导率(2.4×10-4 S·cm-1),并且探索了LLTO的最适宜添加量(15%,质量分数),研究发现LLTO纳米线加入之后,PAN的结晶度并没有明显的改变,离子电导率的提高可能得益于LLZO纳米线构筑的3D网络提供了更多的空位作为Li+迁移的位点。后来Liu等[65]报道了一种电纺得到的定向排列的LLTO纳米线可以提高复合电解质的离子电导率(30 ℃,6.05×10-5 S·cm-1),其效果优于混乱排列的LLTO纳米线(30 ℃,5.40×10-6 S·cm-1),这说明物体填料在聚合物基体中的取向也对离子电导率起到了重要影响[图 7b)];研究者还通过计算模拟了定向排列的LLTO与PAN之间的理论界面离子电导率,其值高达1.26×10-2 S·cm-1(30 ℃),与液态电解液体系的离子电导率接近,证明无机填料与聚合物界面是非常好的Li+传输通道。改善填料与聚合物基体之间的界面也能够进一步提高离子电导率,如Huang等[66]使用多巴胺来修饰LLZTO与PEO的界面,使LLZTO与PEO具有更好的润湿性,成功提高了复合电解质的离子电导率和电化学性能[图 7d)]。所以对无机填料形貌、取向、界面的进一步精确调控是有机-无机复合电解质的未来发展方向,同时更有利于人们理解有机-无机复合电解质中的离子传输机制。另外,对聚合物电解质进行多层化设计也是一种重要思路,如Liang等[67]通过构建三明治结构的复合固态电解质,在锂金属与LATP之间构筑了1层PEO薄膜用来抑制LATP与锂金属之间的反应,在三元正极与LATP之间构筑了PAN层来改善界面接触,实现了良好的电极/电化学相容性。
聚合物电解质的高离子电导率和高机械强度往往难以兼得,通过将机械强度高的有机材料与离子电导率高的聚合物电解质结合起来,制备同时具有二者优点的有机-有机复合电解质也是一种重要的解决思路。如Wan等[68]设计了一种以超薄的柔性的多孔PI膜作为支撑体(8.6 μm)、PEO/LiTFSI作为导离子填料的有机-有机复合电解质薄膜,PEO/LiTFSI分子链在PI膜中实现垂直排列,成功地将30 ℃下的离子电导率提高到2.3×10-4 S·cm-1。这种超薄的(10 μm)电解质薄膜可以将固态电池的能量密度提高到246 Wh·kg-1,同时有效地抑制锂枝晶的生长,其Li/PEO/LiTFSI/PI/LiFePO4软包电池也具有非常好的安全性。这种以具有高机械强度的多孔有机薄膜作为支撑体,以导离子聚合物作为填料的设计策略为实现高能量密度的固态电池的实用化提供了一种十分可行的思路。
5 总结与展望开发兼具高离子电导率和高机械强度的固态电解质是突破兼具高安全性和高能量密度Li+电池的关键,而聚合物固态电解质具有成膜性好、与电极兼容性好等优点,与目前Li+电池的生产过程更加相近,是实现可商业化的全固态电池的重要固态电解质体系。综上所述,理想的聚合物固态电解质需要满足以下几点:1)在工作温度下应该具有足够高的离子电导率(>10-4 S·cm-1)和Li+迁移数;2)具有良好的电极/电解质相容性和足够低的界面阻抗;3)具有足够宽的电化学窗口和热稳定性;4)具有一定的机械强度和柔性。然而同时平衡上述性能是一个巨大的挑战,在综合性能优良的全固态聚合物电解质被开发出来之前,使用少量液态塑化剂或电解液的凝胶聚合物电解质在抑制锂枝晶生长、提高电池安全性方面具有广阔的应用前景。要实现高性能的全固态聚合物电池,在提高电解质本征属性的同时,对电极和电解质进行整体的结构设计、构建低阻抗界面和构建高效的导离子通路是也是关键环节。复合固态电解质是改性聚合物电解质的重要思路,如何更好地理解复合电解质中的离子传输机制和精确地调控无机填料与聚合物基体的结合方式是下一步研究工作的重点。原位合成技术能够有效地降低电极/电解质的界面阻抗,大大地简化电池组装工艺,为固态电池的商业化生产带来了更多可能。实现高能量密度和高安全性的固态电池来代替传统的Li+电池是未来高安全性电池的主要研究方向。
| [1] |
Armand M, Tarascon J M. Building better batteries[J]. Nature, 2008, 451(7179): 652-657. DOI:10.1038/451652a |
| [2] |
Armand M B, Chabagno J M, Duclot M J. Polyethers as solid electrolyte[C]//in Fast ion transport in solids, electrodes and Electrolytes, Lake Geneva: 1979
|
| [3] |
Palacín M R. Recent advances in rechargeable battery materials:A chemist's perspective[J]. Chemical Society Reviews, 2009, 38(9): 2565-2575. DOI:10.1039/b820555h |
| [4] |
Tarascon J M, Armand M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359-367. DOI:10.1038/35104644 |
| [5] |
Xu K. Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J]. Chemical Reviews, 2004, 104(10): 4303-4418. DOI:10.1021/cr030203g |
| [6] |
Goodenough J B, Kim Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587-603. DOI:10.1021/cm901452z |
| [7] |
Xu W, Wang J, Ding F, et al. Lithium metal anodes for rechargeable batteries[J]. Energy Environ Sci, 2014, 7(2): 513-537. DOI:10.1039/C3EE40795K |
| [8] |
Larcher D, Tarascon J M. Towards greener and more sustainable batteries for electrical energy storage[J]. Nature Chemistry, 2015, 7(1): 19-29. |
| [9] |
Xia S, Wu X, Zhang Z, et al. Practical challenges and future perspectives of all-solid-state lithium-metal batteries[J]. Chem, 2019, 5(4): 753-785. DOI:10.1016/j.chempr.2018.11.013 |
| [10] |
Yue L, Ma J, Zhang J, et al. All solid-state polymer electrolytes for high-performance lithium ion batteries[J]. Energy Storage Materials, 2016, 5: 139-164. DOI:10.1016/j.ensm.2016.07.003 |
| [11] |
Luntz A C, Voss J, Reuter K. Interfacial challenges in solid-state Li ion batteries[J]. The Journal of Physical Chemistry Letters, 2015, 6(22): 4599-4604. DOI:10.1021/acs.jpclett.5b02352 |
| [12] |
Fenton D E, Parker J M, Wright P V. Complexes of alkali metal ions with poly(ethylene oxide)[J]. Polymer, 1973. DOI:10.1016/0032-3861(73)90146-8 |
| [13] |
Gorecki W, Jeannin M, Belorizky E, et al. Physical properties of solid polymer electrolyte PEO(LiTFSI) complexes[J]. Journal of Physics:Condensed Matter, 1995, 7(34): 6823-6832. DOI:10.1088/0953-8984/7/34/007 |
| [14] |
Saito Y, Takeda S, Yamagami S, et al. Effect of the morphological features of the poly(vinylidene difluoride)-based gel electrolytes on the ionic mobility for lithium secondary batteries[J]. Macromolecules, 2019, 52(5): 2112-2119. DOI:10.1021/acs.macromol.8b02503 |
| [15] |
Peramunage D. Preparation of micron-sized Li4Ti5O12 and its electrochemistry in polyacrylonitrile electrolyte-based lithium cells[J]. Journal of the Electrochemical Society, 1998, 145(8): 2609-2615. DOI:10.1149/1.1838689 |
| [16] |
Xiao Q, Wang X, Li W, et al. Macroporous polymer electrolytes based on PVDF/PEO-b-PMMA block copolymer blends for rechargeable lithium ion battery[J]. Journal of Membrane Science, 2009, 334(1/2): 117-122. |
| [17] |
Wang W, Yuan Y, Wang J, et al. Enhanced electrochemical and safety performance of lithium metal batteries enabled by the atom layer deposition on PVDF-HFP separator[J]. ACS Applied Energy Materials, 2019, 2(6): 4167-4174. DOI:10.1021/acsaem.9b00383 |
| [18] |
Manthiram A, Yu X, Wang S. Lithium battery chemistries enabled by solid-state electrolytes[J]. Nature Reviews Materials, 2017, 2(4): 1-16. |
| [19] |
Christie A M, Lilley S J, Staunton E, et al. Increasing the conductivity of crystalline polymer electrolytes[J]. Nature, 2005, 433(7021): 50-53. DOI:10.1038/nature03186 |
| [20] |
MacGlashan G S, Andreev Y G, Bruce P G. Structure of the polymer electrolyte poly(ethylene oxide)6:LiAsF6[J]. Nature, 1999, 398(6730): 792-794. DOI:10.1038/19730 |
| [21] |
Aziz S B, Woo T J, Kadir M F Z, et al. A conceptual review on polymer electrolytes and ion transport models[J]. Journal of Science:Advanced Materials and Devices, 2018, 3(1): 1-17. DOI:10.1016/j.jsamd.2018.01.002 |
| [22] |
Quartarone E, Mustarelli P. Electrolytes for solid-state lithium rechargeable batteries:Recent advances and perspectives[J]. Chemical Society Reviews, 2011, 40(5): 2525-2540. DOI:10.1039/c0cs00081g |
| [23] |
Xue Z, He D, Xie X. Poly(ethylene oxide)-based electrolytes for lithium-ion batteries[J]. Journal of Materials Chemistry A, 2015, 3(38): 19218-19253. DOI:10.1039/C5TA03471J |
| [24] |
Diederichsen K M, McShane E J, McCloskey B D. Promising routes to a high Li+ transference number electrolyte for lithium ion batteries[J]. ACS Energy Letters, 2017, 2(11): 2563-2575. DOI:10.1021/acsenergylett.7b00792 |
| [25] |
Li S, Mohamed A I, Pande V, et al. Single-Ion homopolymer electrolytes with high transference number prepared by click chemistry and photoinduced metal-free atom-transfer radical polymerization[J]. ACS Energy Letters, 2018, 3(1): 20-27. DOI:10.1021/acsenergylett.7b00999 |
| [26] |
Lopez J, MacKanic D G, Cui Y, et al. Designing polymers for advanced battery chemistries[J]. Nature Reviews Materials, 2019, 4(5): 312-330. DOI:10.1038/s41578-019-0103-6 |
| [27] |
Hao X, Zhao Q, Su S, et al. Constructing multifunctional interphase between Li1.4Al0.4Ti1.6(PO4)3 and Li metal by magnetron sputtering for highly stable solid-state lithium metal batteries[J]. Advanced Energy Materials, 2019. DOI:10.1002/aenm.201901604 |
| [28] |
Cheng X, Pan J, Zhao Y, et al. Gel polymer electrolytes for electrochemical energy storage[J]. Advanced Energy Materials, 2018, 8(7): 1-16. DOI:10.1002/aenm.201702184 |
| [29] |
Song J, Wang Y, Wan C. Review of gel-type polymer electrolytes for lithium-ion batteries[J]. Journal of Power Sources, 1999, 77(2): 183-197. DOI:10.1016/S0378-7753(98)00193-1 |
| [30] |
Cho Y G, Hwang C, Cheong D S, et al. Gel polymer electrolytes:Gel/Solid polymer electrolytes characterized by in situ gelation or polymerization for electrochemical energy systems[J]. Advanced Materials, 2019. DOI:10.1002/adma.201970144 |
| [31] |
Judez X, Martinez-Ibañez M, Santiago A, et al. Quasi-Solid-State electrolytes for lithium sulfur batteries:Advances and perspectives[J]. Journal of Power Sources, 2019, 438: 226985. DOI:10.1016/j.jpowsour.2019.226985 |
| [32] |
Agostini M, Lim D H, Sadd M, et al. Stabilizing the performance of high-capacity sulfur composite electrodes by a new gel polymer electrolyte configuration[J]. ChemSusChem, 2017, 10(17): 3490-3496. DOI:10.1002/cssc.201700977 |
| [33] |
Liu M, Zhou D, He Y, et al. Novel gel polymer electrolyte for high-performance lithium-sulfur batteries[J]. Nano Energy, 2016, 22: 278-289. DOI:10.1016/j.nanoen.2016.02.008 |
| [34] |
Zhou D, Tkacheva A, Tang X, et al. Stable conversion chemistry-based lithium metal batteries enabled by hierarchical multifunctional polymer electrolytes with near-single ion conduction[J]. Angewandte Chemie International Edition, 2019, 58(18): 6001-6006. DOI:10.1002/anie.201901582 |
| [35] |
Lu Q, He Y, Yu Q, et al. Dendrite-Free, high-rate, long-life lithium metal batteries with a 3D cross-linked network polymer electrolyte[J]. Advanced Materials, 2017. DOI:10.1002/adma.201604460 |
| [36] |
Bouchet R, Maria S, Meziane R, et al. Single-Ion BAB triblock copolymers as highly efficient electrolytes for lithium-metal batteries[J]. Nature Materials, 2013, 12(5): 452-457. DOI:10.1038/nmat3602 |
| [37] |
Zhang Y, Lu W, Cong L, et al. Cross-Linking network based on poly(ethylene oxide):Solid polymer electrolyte for room temperature lithium battery[J]. Journal of Power Sources, 2019, 420: 63-72. DOI:10.1016/j.jpowsour.2019.02.090 |
| [38] |
Kelly I, Owen J R, Steele B C H. Mixed polyether lithium-ion conductors[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1984, 168(1/2): 467-478. |
| [39] |
O'Reilly M V, Masser H, King D R, et al. Ionic aggregate dissolution and conduction in a plasticized single-ion polymer conductor[J]. Polymer, 2015, 59: 133-143. DOI:10.1016/j.polymer.2014.12.002 |
| [40] |
Wan Z, Lei D, Yang W, et al. All-Solid-State batteries:Low resistance-integrated all-solid-state battery achieved by Li7La3Zr2O12 nanowire upgrading polyethylene oxide (PEO) composite electrolyte and PEO cathode binder[J]. Advanced Functional Materials, 2019, 29(1): 1970006. DOI:10.1002/adfm.201970006 |
| [41] |
Lin D, Liu W, Liu Y, et al. High ionic conductivity of composite solid polymer electrolyte via in situ synthesis of monodispersed SiO2 nanospheres in poly(ethylene oxide)[J]. Nano Letters, 2016, 16(1): 459-465. DOI:10.1021/acs.nanolett.5b04117 |
| [42] |
Zhang J, Yang J, Dong T, et al. Aliphatic polycarbonate-based solid-state polymer electrolytes for advanced lithium batteries:Advances and perspective[J]. Small, 2018, 14(36): 1-16. DOI:10.1002/smll.201800821 |
| [43] |
Zhou D, Shanmukaraj D, Tkacheva A, et al. Polymer electrolytes for lithium-based batteries:Advances and prospects[J]. Chem, 2019, 5(9): 2326-2352. DOI:10.1016/j.chempr.2019.05.009 |
| [44] |
Kimura K, Yajima M, Tominaga Y. A highly-concentrated poly(ethylene carbonate)-based electrolyte for all-solid-state Li battery working at room temperature[J]. Electrochemistry Communications, 2016, 66: 46-48. DOI:10.1016/j.elecom.2016.02.022 |
| [45] |
Chai J, Liu Z, Ma J, et al. In situ generation of poly(vinylene carbonate) based solid electrolyte with interfacial stability for LiCoO2 lithium batteries[J]. Advanced Science, 2017, 4(2): 1-9. |
| [46] |
Zhang J, Zhao J, Yue L, et al. Safety-Reinforced poly(propylene carbonate)-based all-solid-state polymer electrolyte for ambient-temperature solid polymer lithium batteries[J]. Advanced Energy Materials, 2015. DOI:10.1002/aenm.201501082 |
| [47] |
Zhang J, Zang X, Wen H, et al. High-Voltage and free-standing poly(propylene carbonate)/Li6.75La3Zr1.75Ta0.25O12 composite solid electrolyte for wide temperature range and flexible solid lithium ion battery[J]. Journal of Materials Chemistry A, 2017, 5(10): 4940-4948. DOI:10.1039/C6TA10066J |
| [48] |
Alarco P J, Abu-Lebdeh Y, Abouimrane A, et al. The plastic-crystalline phase of succinonitrile as a universal matrix for solid-state ionic conductors[J]. Nature Materials, 2004, 3(7): 476-481. DOI:10.1038/nmat1158 |
| [49] |
Fan L, Maier J. Composite effects in poly(ethylene oxide)-succinonitrile based all-solid electrolytes[J]. Electrochemistry Communications, 2006, 8(11): 1753-1756. DOI:10.1016/j.elecom.2006.08.017 |
| [50] |
Zhou D, He Y, Liu R, et al. In situ synthesis of a hierarchical all-solid-state electrolyte based on nitrile materials for high-performance lithium-ion batteries[J]. Advanced Energy Materials, 2015. DOI:10.1002/aenm.201500353 |
| [51] |
Kang Y, Lee J, Suh D H, et al. A new polysiloxane based cross-linker for solid polymer electrolyte[J]. Journal of Power Sources, 2005, 146(1/2): 391-396. |
| [52] |
Zhang Z, Sherlock D, West R, et al. Cross-Linked network polymer electrolytes based on a polysiloxane backbone with oligo(oxyethylene) side chains:Synthesis and conductivity[J]. Macromolecules, 2003, 36(24): 9176-9180. DOI:10.1021/ma0349276 |
| [53] |
Zhang Z, Jin J, Bautista F, et al. Ion conductive characteristics of cross-linked network polysiloxane-based solid polymer electrolytes[J]. Solid State Ionics, 2004, 170(3/4): 233-238. |
| [54] |
Zhao Q, Liu X, Stalin S, et al. Solid-State polymer electrolytes with in-built fast interfacial transport for secondary lithium batteries[J]. Nature Energy, 2019, 4(5): 365-373. DOI:10.1038/s41560-019-0349-7 |
| [55] |
Zhang X, Wang S, Xue C, et al. Self-Suppression of lithium dendrite in all-solid-state lithium metal batteries with poly(vinylidene difluoride)-based solid electrolytes[J]. Advanced Materials, 2019, 31(11): 1-9. DOI:10.1002/adma.201806082 |
| [56] |
MacKanic D G, Michaels W, Lee M, et al. Crosslinked poly(tetrahydrofuran) as a loosely coordinating polymer electrolyte[J]. Advanced Energy Materials, 2018, 8(25): 1-11. |
| [57] |
Xin S, You Y, Wang S, et al. Solid-State lithium metal batteries promoted by nanotechnology:progress and prospects[J]. ACS Energy Letters, 2017, 2(6): 1385-1394. DOI:10.1021/acsenergylett.7b00175 |
| [58] |
Appetecchi G, Croce F, Persi L, et al. Transport and interfacial properties of composite polymer electrolytes[J]. Electrochimica Acta, 2000, 45(8/9): 1481-1490. |
| [59] |
Ma C, Zhang J, Xu M, et al. Cross-Linked branching nanohybrid polymer electrolyte with monodispersed TiO2 nanoparticles for high performance lithium-ion batteries[J]. Journal of Power Sources, 2016, 317: 103-111. DOI:10.1016/j.jpowsour.2016.03.097 |
| [60] |
Croce F, Persi L, Scrosati B, et al. Role of the ceramic fillers in enhancing the transport properties of composite polymer electrolytes[J]. Electrochimica Acta, 2001, 46(16): 2457-2461. DOI:10.1016/S0013-4686(01)00458-3 |
| [61] |
Liu W, Lin D, Sun J, et al. Improved lithium ionic conductivity in composite polymer electrolytes with oxide-ion conducting nanowires[J]. ACS Nano, 2016, 10(12): 11407-11413. DOI:10.1021/acsnano.6b06797 |
| [62] |
Zheng J, Tang M, Hu Y. Lithium ion pathway within Li7La3Zr2O12-polyethylene oxide composite electrolytes[J]. Angewandte Chemie International Edition, 2016, 55(40): 12538-12542. DOI:10.1002/anie.201607539 |
| [63] |
Lee S S, Lim Y J, Kim H W, et al. Electrochemical properties of a ceramic-polymer-composite-solid electrolyte for Li-ion batteries[J]. Solid State Ionics, 2016, 284: 20-24. DOI:10.1016/j.ssi.2015.11.020 |
| [64] |
Liu W, Liu N, Sun J, et al. Ionic conductivity enhancement of polymer electrolytes with ceramic nanowire fillers[J]. Nano Letters, 2015, 15(4): 2740-2745. DOI:10.1021/acs.nanolett.5b00600 |
| [65] |
Liu W, Lee S W, Lin D, et al. Enhancing ionic conductivity in composite polymer electrolytes with well-aligned ceramic nanowires[J]. Nature Energy, 2017, 2(5): 1-7. |
| [66] |
Huang Z, Pang W, Liang P, et al. . A dopamine modified Li6.4La3Zr1.4Ta0.6O12/PEO solid-state electrolyte:enhanced thermal and electrochemical properties[J]. Journal of Materials Chemistry A, 2019, 7(27): 16425-16436. DOI:10.1039/C9TA03395E |
| [67] |
Liang J, Zeng X, Zhang X, et al. Engineering Janus interfaces of ceramic electrolyte via distinct functional polymers for stable high-voltage Li-metal batteries[J]. Journal of the American Chemical Society, 2019, 141(23): 9165-9169. DOI:10.1021/jacs.9b03517 |
| [68] |
Wan J, Xie J, Kong X, et al. Ultrathin, flexible, solid polymer composite electrolyte enabled with aligned nanoporous host for lithium batteries[J]. Nature Nanotechnology, 2019, 14(7): 705-711. DOI:10.1038/s41565-019-0465-3 |
 2020, Vol. 37
2020, Vol. 37