2. 中国科学院过程工程研究所生化工程国家重点实验室, 北京 100190
2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
现代生物技术飞速发展,越来越多的生物制品涌现并造福人类。为了制备高纯度、高活性的生物制品,往往需要从复杂体系中分离提纯目标产物,因此选择高效的分离方法至关重要。在众多分离纯化方法中,层析技术具有分离度高、易于保持生物活性、过程易于放大及自动化程度高等特点,在生物工程下游分离纯化领域得到广泛应用[1-2]。
层析介质是整个层析技术的核心组成,其性能直接关系分离效果的优劣。其中,传质能力是介质的主要性能之一,影响纯化处理量和分离效率[3-4]。与一般小分子化合物相比,蛋白质相对分子质量普遍较大,有的甚至达到几千万道尔顿,尺寸达数百纳米甚至数微米,层析过程中传质效率很低[5]。如何提升生物大分子特别是超大生物分子在层析介质内的传质能力一直是研究者们致力努力的方向。扩张床色谱、整体柱和超大孔介质等在提升超大生物分子分离效率方面具有较好的效果[6-9]。
琼脂糖是一种天然多糖,系以海洋红藻提取的琼脂为原料精制加工而成。琼脂糖层析介质是迄今为止应用最为广泛的层析介质之一,具有良好的孔道结构和亲水性、高稳定性、低非特异性吸附和易于衍生等优点。基于琼脂糖层析介质的凝胶过滤层析、离子交换层析、疏水层析和亲和层析等分离技术在蛋白、病毒、核酸和多肽等纯化领域均有很好的效果[10-12]。为了加强琼脂糖层析介质的传质效果,人们从促进颗粒内扩散作用入手,制备大孔琼脂糖介质,并应用于超大生物分子质粒DNA纯化等领域[13-15]。其中,采用复乳法制备得到的大孔琼脂糖介质,除了含有最常见的扩散孔(平均孔径30 nm)外,还含有一种大孔(也称对流孔,平均孔径2~30 μm)。这种大孔结构大大提升了大分子蛋白在介质颗粒内的扩散效率[16-17]。研究制备方法对大孔琼脂糖介质成孔性的影响,并进一步对其进行调控,对不断提高超大生物分子分离效率,具有十分重要的意义。天津大学孙彦等在大孔琼脂糖微球制备领域也做出了大量工作,他们采用无机盐复合制孔技术制备了具有微米级的超大孔琼脂糖微球[18-19]。
为了深入探究大孔琼脂糖微球的成孔性,本研究采用复乳法制备大孔琼脂糖微球,采用光学显微镜和激光粒度分析仪表征微球形貌和粒径分布,采用场发射扫描电子显微镜(scanning electron microscope, SEM)表征微球孔结构,探究制备条件对微球形貌、粒径与分布、孔结构的影响。通过激光共聚焦显微镜(confocal laser scanning microscope, CLSM)观察乙肝表面抗原(HBsAg)在微球上的吸附情况。研究为大孔琼脂糖微球在超大分子蛋白分离纯化的进一步应用打下基础。
1 实验 1.1 材料与试剂琼脂糖购自美国Promega公司。DEAE Sepharose FF购自美国GE Healthcare公司。异硫氰酸荧光素(FITC)购自美国Sigma公司。环氧氯丙烷、1, 4-丁二醇双缩水甘油醚、环己烷、Span 85、Tween 80和二乙胺基乙基盐酸盐(DEAE·HCl)等购自国药集团化学试剂有限公司,均为分析纯。
1.2 实验设备与分析仪器数显机械搅拌器和数显恒温装置(德国IKA公司)、EVOS XL光学显微镜(美国AMG公司)、Mastersizer 2000激光粒度仪(英国Malvern公司)、K850超临界点干燥仪(英国Emitech公司)、JSM-6700F冷场发射扫描电子显微镜(日本JEOL公司)和TCS SP5激光共聚焦显微镜(德国Leica公司)。
1.3 实验方法 1.3.1 大孔琼脂糖微球的制备与衍生大孔琼脂糖微球的制备过程包括制球、交联和衍生3部分。
1.3.1.1 制球将琼脂糖粉末溶于水,在沸水浴中搅拌加热一段时间直到透明,以此作为水相,缓慢降温至60 ℃。加入预热到60 ℃的含有Tween 80和环己烷的内油相,经过高速搅拌形成乳液。将乳液加入预热到60 ℃的含有Span 85和环己烷的外油相,搅拌成球后,将水浴锅温度降为25 ℃。依次采用乙醇、50%乙醇水混合物和水洗涤微球。
1.3.1.2 交联准确称取15 g洗净、抽干的大孔琼脂糖微球置于三口瓶内,依次向其中加入丙酮(15 mL)和环氧氯丙烷(3 mL),以及0.5 mL质量分数为40%的NaOH溶液(含质量分数为0.5%的NaBH4)。该体系于室温下搅拌12 h后,继续补加相同体积的环氧氯丙烷和浓NaOH溶液,过夜反应。反应结束后用大量去离子水将微球洗至中性。
1.3.1.3 DEAE衍生准确称取5 g洗净、抽干的交联大孔琼脂糖微球置于三口瓶内,加入10 mL 1 mol/L DEAE·HCl,混合0.5 h。向其中加入10 mL 5 mol/L NaOH溶液,60 ℃搅拌反应3 h。反应结束后用大量水洗涤。得到DEAE-大孔琼脂糖微球。
1.3.2 大孔琼脂糖微球的形貌观察采用光学显微镜观察大孔琼脂糖微球。将微球与去离子水形成的混合物滴加到载玻片上,盖上盖玻片后,在显微镜下调整焦距,记录微球外观。
1.3.3 大孔琼脂糖微球的粒径与分布测定采用激光粒度仪测定大孔琼脂糖微球的粒径及分布。将微球与去离子水的混悬液,滴加至样品池,当激光粒度仪视窗吸光度在7%~10%范围内时开始测量,记录测量结果。
1.3.4 大孔琼脂糖微球的扫描电镜分析大孔琼脂糖微球经超临界干燥后,采用冷场发射扫描电子显微镜观察干态微球的表面形貌。将样品经双面导电胶固定在样品台上,经喷金处理后放入电镜样品室内进行观察。
1.3.5 激光共聚焦显微镜实验采用激光共聚焦显微镜观察疫苗在介质上的结合情况。向5 mL HBsAg样品(蛋白浓度2 g/L)中加入适量的FITC后,在垂直混悬仪上混匀过夜。将染色后样品置于10 kDa的超滤管,加入20 mmol的PB缓冲液(pH值为7.0)清洗以除去未结合的FITC染料,洗至浓缩底液无明显颜色即可,离心机转速设置为4 000 r/min,温度为4 ℃。最终将HBsAg样品定容至10 mL,置于4 ℃冰箱保存,注意全程避光。将FITC-HBsAg样品与经20 mmol/L PB缓冲液(pH值为7.0)平衡后的DEAE-大孔琼脂糖微球混合,在垂直混悬仪上振荡一段时间后取样,用平衡缓冲液冲洗微球若干次,除去其表面未结合的蛋白。
2 结果与讨论 2.1 制备工艺对大孔琼脂糖微球性能的影响复乳法的主要原理为:首先将油相分散在琼脂糖溶液中,即将内油相导入琼脂糖液滴内,形成O/W初乳,然后将初乳继续分散在外油相中制备成O/W/O复乳,在此过程中内油相溢出水相,从而在琼脂糖液滴内形成通道,最终通过降温固化成球,连续的油相在琼脂糖微球中形成大孔结构,继续洗去油相,最终获得超大孔微球(图 1)。本研究主要从琼脂糖水溶液浓度、内油相与水相的体积比例(RIO:W)、外油相与水相的体积比例(ROO:W)、初乳转速与成球转速等方面,考察其对大孔琼脂糖微球性能的影响。
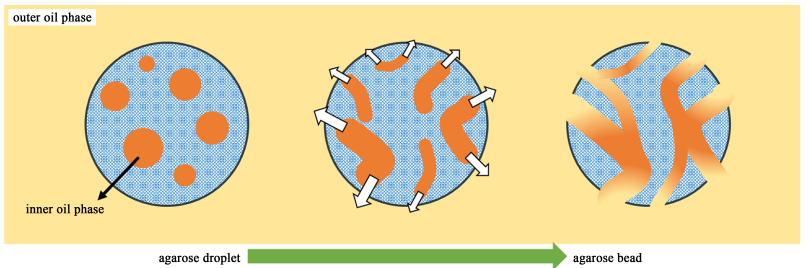
|
| 图 1 琼脂糖微球中复乳法致孔示意图 Fig.1 Schematic diagram of double emulsion method in agarose microspheres |
| |
由图 2和图 3可见,琼脂糖水溶液为6%(质量分数,下同)时表面出现典型的圆形巨大孔洞,直径可达10 μm以上。当质量分数降为4%时,超过数微米的超大孔则变得很少见,而整个球表面都出现了网状结构。质量分数继续下降至2%时,球表面出现了撕裂状的大孔(不同于质量分数为6%的圆形大孔)。推测低浓度的琼脂糖液滴由于其较低的表面张力,内油相以较为分散的形式溢出,而导致了该结构的产生。粒径分析表明,琼脂糖水溶液浓度越高,粒径分布越宽,这是体系黏度增加所致(图 4)。
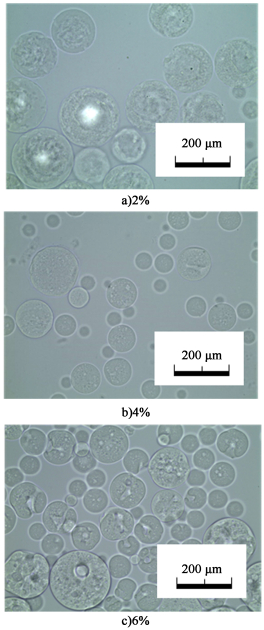
|
| 图 2 不同琼脂糖水溶液浓度制备大孔琼脂糖微球的 Fig.2 Optical micrographs of macroporous agarose microspheres prepared with different agarose aqueous solution concentration |
| |

|
| 图 3 不同琼脂糖水溶液浓度制备大孔琼脂糖微球的SEM图(50 000倍) Fig.3 SEM image of macroporous agarose microspheres prepared by different agarose aqueous solution concentration (50 000 times) |
| |

|
| 图 4 不同琼脂糖水溶液浓度制备大孔琼脂糖微球的粒径分布图 Fig.4 Particle size distribution of macroporous agarose microspheres prepared with different agarose aqueous solution concentration |
| |
由图 5和图 6可见,逐步增大内油相与水相的比例(RIO:W)时,大孔数量减少,表面大孔逐渐减少至消失,表面形貌变得相对更加均匀与疏松,由图 7可见,此时粒径明显下降。可能是内油相过多导致其从微球内部溢出时,原来的球体受到巨大的破坏力,其结构被打破,使其分裂成多个小球[15]。也就是说,内油相加入量过大时,其向外部的驱动力过大,不利于体系的稳定。对形成一定粒径要求的微球来说,需要进一步调控制备条件。

|
| 图 5 不同RIO:W制备大孔琼脂糖微球的光镜照 Fig.5 Photomicrograph of macroporous agarose microspheres prepared with different RIO:W (20 magnification) |
| |

|
| 图 6 不同RIO:W制备大孔琼脂糖微球的SEM图(50 000倍) Fig.6 SEM image of macroporous agarose microspheres prepared by different RIO:W (50 000 magnification) |
| |
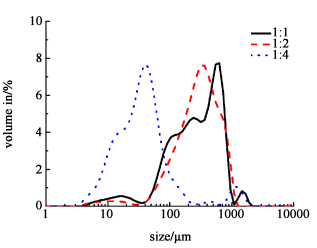
|
| 图 7 不同RIO:W制备大孔琼脂糖微球的粒径分布图 Fig.7 Particle size distribution of macroporous agarose microspheres prepared with different RIO:W |
| |
由图 8和图 9可见,增大外油相与水相的比例(ROO:W)时,大孔数量减少,但单个孔径变大,甚至能穿透整个球体,且表面形貌更加疏松。推测其原因可能是,增加外油相用量,形成O/W/O复乳时,外油相对内油相的结合力更大,即内油相受到更大的突破力,相互容易聚集形成更大孔道[17]。由图 10可见,外油相与水相比例对微球平均粒径基本无影响,ROO:W增大时,粒径分布稍有变宽趋势。

|
| 图 8 不同ROO:W制备大孔琼脂糖微球的光镜照片 Fig.8 Optical micrographs of macroporous agarose microspheres prepared with different ROO:W |
| |

|
| 图 9 不同ROO:W制备大孔琼脂糖微球的SEM图(50 000倍) Fig.9 SEM image of macroporous agarose microspheres prepared by different ROO:W (50 000 magnification) |
| |

|
| 图 10 不同ROO:W制备大孔琼脂糖微球的粒径分布图 Fig.10 Particle size distribution of macroporous agarose microspheres prepared with different ROO:W |
| |
初乳转速即为将内油相与水相混匀形成初乳液时所用的搅拌转速。由图 11和图 12可见,增大初乳转速时,表面大孔数量减少,孔道形状趋于规则,表面形貌变得更加平整。这可能是因为在更高的成乳转速下,内油相被分散为更细小的单个液滴,故在溢出到外油相中时受到的阻力更小,突破内水相时更加均一,有利于形成更加细小规则的孔道[16]。由图 13可见,初乳转速对微球粒径基本无影响。

|
| 图 11 不同初乳转速制备大孔琼脂糖微球的光镜照片 Fig.11 Optical micrographs of macroporous agarose microspheres prepared with different speed of emulsion forming |
| |

|
| 图 12 不同初乳转速制备大孔琼脂糖微球的SEM图(50 000倍) Fig.12 SEM image of macroporous agarose microspheres prepared by different speed of emulsion forming (50 000 magnification) |
| |

|
| 图 13 不同初乳转速制备大孔琼脂糖微球的粒径分布图 Fig.13 Particle size distribution of macroporous agarose microspheres prepared with different speed of emulsion forming |
| |
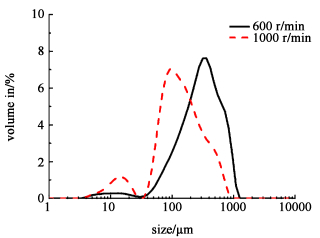
成球转速即为内油相与水相的混合乳液在外油相中成球时所用的搅拌转速。由图 14和图 15可见,增大成球转速时,大孔数量减少,孔的形状变得更圆,且球体表面变得更平坦均匀,表面大孔数量明显减少。推测在较高成球转速下,搅拌桨所提供的高剪切力使生成的乳液粒径更小[20],内油相突破水相受到的阻力更小,其以更均匀的方式溢出水相,从而形成的孔道更加细致。由图 16可见,成球转速越高,微球粒径越小,这符合剪切力对微球粒径的一般影响规律。
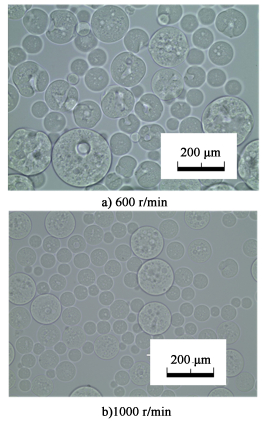
|
| 图 14 不同成球转速制备大孔琼脂糖微球的光镜照片 Fig.14 Optical micrograph of macroporous agarose microspheres prepared with different speed of beads forming |
| |

|
| 图 15 不同成球转速制备大孔琼脂糖微球的SEM图(50 000倍) Fig.15 SEM image of macroporous agarose microspheres prepared by different speed of beads forming (50 000 magnification) |
| |
|
| 图 16 不同成球转速制备大孔琼脂糖微球的粒径分布图 Fig.16 Particle size distribution of macroporous agarose microspheres prepared with different speed of beads forming |
| |
激光共聚焦显微镜可以在保持样品完整性的前提下,通过沿Z轴方向逐渐改变焦平面,来完成对样品不同层面的扫描,这对于表征大孔琼脂糖微球的内部孔道结构尤为重要。为了进一步探究超大分子蛋白在大孔琼脂糖微球与普通微球的分布差异,采用激光共聚焦显微镜考察被FITC荧光染色的乙肝表面抗原在微球中的结合分布情况。
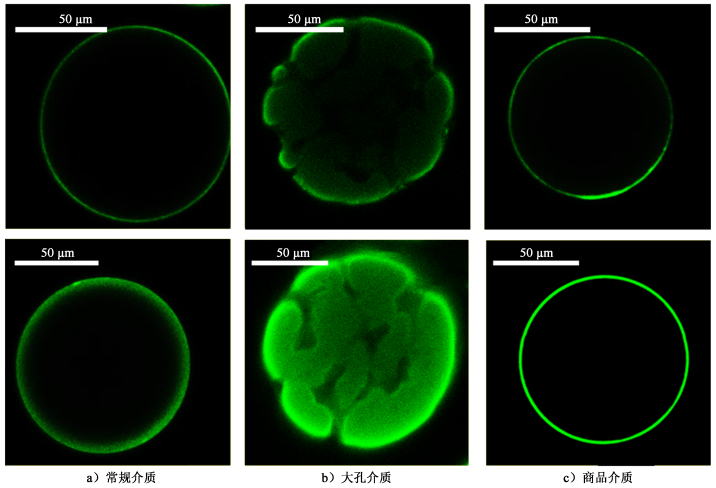
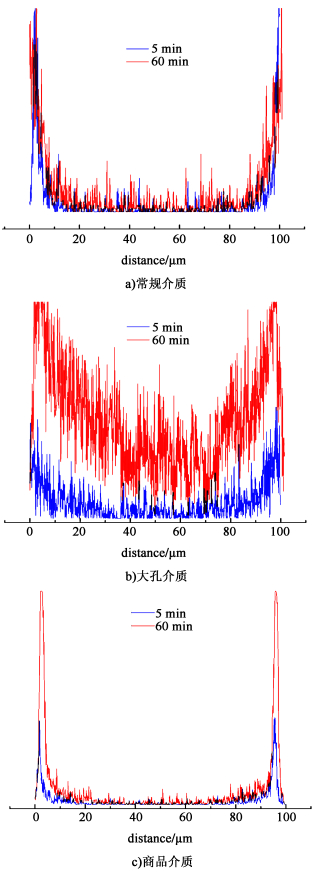
以同种琼脂糖为原料,采用常规制球方法,并进行衍生,制备出常规DEAE介质,考察制备方法对介质结合疫苗性能的影响,同时与市售DEAE介质比较,研究大孔介质在疫苗结合方面的效果。FITC-HBsAg与常规DEAE介质、DEAE-大孔琼脂糖微球和商品DEAE介质分别结合后,由图 17可见,浸泡5 min后,疫苗在这3种微球上的分布主要都集中在外表面,说明此时疫苗主要与外部偶联的DEAE基团结合,尚未进入介质内部。继续浸泡至60 min后,疫苗基本已完全渗入大孔琼脂糖微球内部,而在其他2种微球上仍然只在表面分布。对于常规琼脂糖介质来说,受传质阻力影响,大分子疫苗只能分布在介质外表面,无法进入其内部[21]。经计算,60 min后,大孔琼脂糖介质内部疫苗进入量高出市售介质近10倍,结合效率显著提升(图 18)。说明疫苗能够更快速、更充分地进入大孔琼脂糖微球内部,这是因为大孔琼脂糖微球拥有比普通介质更大的孔道,疫苗等超大生物分子进入其内部受到的扩散阻力更小,从而有助于目标蛋白的快速高效结合。
|
| 图 17 与HBsAg作用时间分别为5(上)和60 min(下)的琼脂糖微球CLSM图 Fig.17 The agarose microsphere CLSM pattern with 5 (top) and 60 min (bottom) interaction time with HBsAg |
| |
|
| 图 18 与HBsAg作用时间分别为5和60 min的琼脂糖微球CLSM荧光强度曲线 Fig.18 The agarose microsphere CLSM fluorescence intensity curve with 5 and 60 min interaction time with HBsAg |
| |
通过复乳法制备大孔琼脂糖微球,考察琼脂糖水溶液浓度、内油相与水相的比例、外油相与水相的比例、初乳转速和成球转速对微球形貌、粒径和成孔性等的影响,并对其结果进行表征。综合实验结果,当琼脂糖质量分数为6%、RIO:W=1:2、ROO:W=3:1、成乳转速为1 600 r/min以及成球转速为600 r/min时,能获得孔道分布均匀且大小适中的微球。激光共聚焦显微镜实验结果表明,经衍生后的大孔琼脂糖微球对乙肝疫苗有良好的结合能力,与传统琼脂糖介质相比,疫苗进入介质内部速度更快且更充分,60 min即可整个进入介质内部,在超大分子分离纯化领域极具应用潜力。
| [1] |
Zhang H, Fan D, Deng J, et al. Review separation and purification of proteins with chromatography applications[J]. Journal of Pure and Applied Microbiology, 2013, 7: 7-12. |
| [2] |
Nováková L, Vl AčG ková H. A review of current trends and advances in modern bio-analytical methods:Chromatography and sample preparation[J]. Analytica Chimica Acta, 2009, 656(1/2): 8-35. |
| [3] |
Gritti F, Horvath K, Guiochon G. How changing the particle structure can speed up protein mass transfer kinetics in liquid chromatography[J]. Journal of Chromatography A, 2012, 1263: 84-98. DOI:10.1016/j.chroma.2012.09.030 |
| [4] |
Kiss I, Bacskay I, Kilár F, et al. Comparison of the mass transfer in totally porous and superficially porous stationary phases in liquid chromatography[J]. Analytical and Bioanalytical Chemistry, 2010, 397(3): 1307-1314. DOI:10.1007/s00216-010-3627-6 |
| [5] |
Arrua R D, Talebi M, Causon T J, et al. Review of recent advances in the preparation of organic polymer monoliths for liquid chromatography of large molecules[J]. Analytica Chimica Acta, 2012, 738: 1-12. DOI:10.1016/j.aca.2012.05.052 |
| [6] |
Deshmukh N R, Lali A M. Adsorptive purification of pDNA on superporous rigid cross-linked cellulose matrix[J]. Journal of Chromatography B, 2005, 818(1): 5-10. DOI:10.1016/j.jchromb.2004.08.025 |
| [7] |
Tiainen P, Rokebul Anower M, Larsson P O. High-Capacity composite adsorbents for nucleic acids[J]. Journal of Chromatography A, 2011, 1218(31): 5235-5240. DOI:10.1016/j.chroma.2011.06.001 |
| [8] |
Jungbauer A, Hahn R. Monoliths for fast bioseparation and bioconversion and their applications in biotechnology[J]. Journal of Separation Science, 2004, 27(10/11): 767-778. |
| [9] |
Omidian H, Rocca J G, Park K. Elastic, superporous hydrogel hybrids of polyacrylamide and sodium alginate[J]. Macromolecular Bioscience, 2006, 6(9): 703-710. DOI:10.1002/(ISSN)1616-5195 |
| [10] |
Abdulrahman A, Ghanem A. Recent advances in chromatographic purification of plasmid DNA for gene therapy and DNA vaccines:A review[J]. Analytica Chimica Acta, 2018, 1025: 41-57. DOI:10.1016/j.aca.2018.04.001 |
| [11] |
Sun Y, Liu F, Shi Q. Approaches to high-performance preparative chromatography of proteins[J]. Biotechnology in China I:From bioreaction to bioseparation and bioremediation, 2009, 113: 217-254. |
| [12] |
Zhao L, Zhu K, Huang Y, et al. Enhanced binding by dextran-grafting to protein A affinity chromatographic media[J]. Journal of Separation Science, 2017, 40(7): 1493-1499. DOI:10.1002/jssc.v40.7 |
| [13] |
Gustavsson P E, Mosbach K, Nilsson K, et al. Superporous agarose as an affinity chromatography support[J]. Journal of Chromatography A, 1997, 776(2): 197-203. |
| [14] |
Gustavsson P E, Axelsson A, Larsson P O. Superporous agarose beads as a hydrophobic interaction chromatography support[J]. Journal of Chromatography A, 1999, 830(2): 275-284. DOI:10.1016/S0021-9673(98)00899-1 |
| [15] |
Gustavsson P E, Larsson P O. Superporous agarose, a new material for chromatography[J]. Journal of Chromatography A, 1996, 734(2): 231-240. |
| [16] |
Tiainen P, Gustavsson P E, Ljunglöf A, et al. Superporous agarose anion exchangers for plasmid isolation[J]. Journal of Chromatography A, 2007, 1138(1/2): 84-94. |
| [17] |
Gustavsson P E, Larsson P O. Continuous superporous agarose beds for chromatography and electrophoresis[J]. Journal of Chromatography A, 1999, 832(1/2): 29-39. |
| [18] |
孙彦, 周鑫, 史清洪.高容量大孔琼脂糖凝胶介质的制备方法: 中国, CN1472002[P].2004-02-04
|
| [19] |
周鑫.新型蛋白质色谱介质的研究[D].天津: 天津大学, 2003
|
| [20] |
Mu Y, Lyddiatt A, Pacek A W. Manufacture by water/oil emulsification of porous agarose beads:Effect of processing conditions on mean particle size, size distribution and mechanical properties[J]. Chemical Engineering and Processing:Process Intensification, 2005, 44(10): 1157-1166. DOI:10.1016/j.cep.2005.03.005 |
| [21] |
Zhao L, Liu Y, Huang Y, et al. Deliberate manipulation of the surface hydrophobicity of an adsorbent for an efficient purification of a giant molecule with multiple subunits[J]. Journal of Separation Science, 2011, 34(22): 3186-3193. DOI:10.1002/jssc.v34.22 |
 2019, Vol. 36
2019, Vol. 36





