20世纪60年代初,美国Ventron公司最先实现了硼氢化钠的工业化生产。目前,硼氢化钠的工业化生产主要采用2种工艺:一种是以无水硼砂、石英砂、金属钠和氢气为原料的Bayer法(干法);另一种则是以硼酸三甲酯和氢化钠为原料的Schlesinger法(湿法)。Schlesinger法[1]有着反应温度低、工艺可连续化等优点,适于大规模生产。
由Schlesinger法制备的硼氢化钠最初是以碱溶液形式存在的,固体硼氢化钠的生产还需要经过有机胺液液萃取[2]将硼氢化钠从氢氧化钠溶液中分离出来,再经萃取剂蒸发、冷却结晶和干燥等工艺。0 ℃的结晶母液中仍含有25%的硼氢化钠,硼氢化钠在没有碱的保护下稳定性很差[3-4],其与水反应生成偏硼酸钠和氢气,温度和碱度对于其在液相中的水解速率都有着很大影响[5]。为了减轻副产物偏硼酸钠对硼氢化钠最终质量的影响,工业生产中常将结晶母液送回萃取工段。这不仅增大了萃取、蒸发设备的操作费用,也引起了一定程度硼氢化钠的水解损失。
与硼氢化钠相比,硼氢化钾的溶解度小,水解反应温和。其在常压下空气中不吸潮,稳定性好。基于硼氢化钾和硼氢化钠性质差异,利用NaBH4(aq)+KOH(aq)→KBH4(s)+NaOH(aq),将硼氢化钠结晶母液直接与氢氧化钾反应制备固体硼氢化钾,可以有效地降低硼氢化钠母液循环量,减少其水解损失。
1 实验部分 1.1 实验药品和仪器实验仪器:电子天平,AL204型,Mettler Toledo;程序控温低温恒温槽,CKDC-3010型,南京凡帝朗信息科技有限公司;X射线衍射仪(Co_Kα靶,扫描范围10°~90°,λ=0.179 nm,扫描步长0.02°),X’Pert Pro型,荷兰Panalytical公司;蠕动泵,BT00-100 M,保定兰格恒流泵有限公司;光学显微镜,BK-300型,重庆奥特光学仪器有限公司;马尔文粒度分析仪,Mastersizer 3000型,英国马尔文仪器有限公司;数字三维视频显微镜,KH-7700型,日本浩视HIROX公司;旋转蒸发仪,RE-52A,上海亚荣生化仪器厂;循环水式多用真空泵,SHB-ⅢA型,上海翔雅仪器设备有限公司。
| 试剂名称 | 规格 | 生产厂家或经销商 |
| 硼氢化钠 | 质量分数96% | 华昌化工股份有限公司 |
| 氢氧化钾 | AR | 光复科技发展有限公司 |
| 氢氧化钠 | AR | 光复科技发展有限公司 |
| 硫代硫酸钠 | AR | 江天化工技术有限公司 |
| 重铬酸钾 | AR | 天津大学科威公司 |
| 碘酸钾 | AR | 天津市天大化工实验厂 |
| 碘化钾 | AR | 江天化工技术有限公司 |
| 硫酸钠 | AR | 光复科技发展有限公司 |
| 硫酸 | AR | 北京化工厂 |
| 无水甲醇 | AR | 光复科技发展有限公司 |
| 无水乙醇 | AR | 光复科技发展有限公司 |
依照当前工业生产中硼氢化钠0 ℃下结晶母液的组成(25%NaBH4,5%NaOH,70%H2O,均为质量分数)配置硼氢化钠结晶母液。称取5.0 g氢氧化钠,精确至0.01 g。置于300 mL夹套式三口结晶器中,加入70.0 g的蒸馏水进行溶解,并冷却至20 ℃,得到澄清的氢氧化钠溶液。一边搅拌,一边将事先称好的25.0 g硼氢化钠缓慢、多次、分批加入,尽可能确保多次加入的硼氢化钠完全溶解之后,再继续添加。硼氢化钠添加完成后,将溶液静置至澄清,备用。
1.3 反应结晶过程制备固体硼氢化钾根据实验所需的氢氧化钾和硼氢化钠反应物质的量之比,称取固体氢氧化钾,置于100 mL烧杯中,加70.0 g的蒸馏水,溶解。待溶液冷却,至完全澄清,移入锥形瓶中,备用。
将装有预先配制的硼氢化钠母液的夹套式结晶器连接程序控温低温恒温槽,在缓慢搅拌的条件下,加热至反应所需混溶温度。待母液达到预设温度后,将搅拌转速调高到预设值。根据微观混合理论[6],碱液在桨区流加进入结晶器的操作方式,可以较好地实现快速分散,这对于过饱和度的迅速分散是有利的。通过蠕动泵的软管,将锥形瓶内已冷却至澄清的沉淀相氢氧化钾溶液,以一定速度加入到液面下反应结晶器中搅拌桨叶尖端附近处,以利于过饱和度的迅速分散。进料结束后,开始降温,并控制降温速度。达到预设养晶温度后,停止搅拌,并恒温,静置。上述过程制备的硼氢化钾粗产品含有一定含量的碱性物质,主要是氢氧化钠和氢氧化钾。之后,用适量的甲醇洗涤硼氢化钾粗产品。过滤反应所得混合物后得到固体硼氢化钾湿产品。在680 mmHg(1 mmHg=133.3 Pa)、100 ℃条件下真空干燥10 h。通过旋转蒸发仪干燥除去甲醇和水分,得到精制的硼氢化钾最终产品。
1.4 硼氢化钾最终产品的分析硼氢化物的质量分数分析存在多种方法[7],包括电化学法[8]、碘量法[9]、释氢法[10-12]等。其中操作便捷且准确度高的方法是碘量法,包括3个步骤:第1步,在碱性条件下,碱金属硼氢化物与定量加入的过量碘酸钾标准液反应:
| $ \frac{1}{8}{\rm{MeB}}{{\rm{H}}_4} + \frac{1}{6}{\rm{KI}}{{\rm{O}}_3} \to \frac{1}{8}{\rm{MeB}}{{\rm{O}}_2} + \frac{1}{6}{\rm{KI}} + \frac{1}{4}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (1) |
第2步,在酸性条件下,过量的碘酸钾与碘化钾反应析出碘单质:
| $ \frac{1}{6}{\rm{KI}}{{\rm{O}}_3} + \frac{5}{6}{\rm{KI + }}\frac{1}{2}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4} \to \frac{1}{2}{{\rm{I}}_2} + \frac{1}{2}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_4} + \frac{1}{2}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (2) |
第3步,用硫代硫酸钠标准溶液滴定析出的碘单质,由此间接得到硼氢化物的质量分数:
| $ \frac{1}{2}{{\rm{I}}_2} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{{\rm{S}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}} \to {\rm{NaI}} + \frac{1}{2}{\rm{N}}{{\rm{a}}_{\rm{2}}}{{\rm{S}}_{\rm{4}}}{{\rm{O}}_{\rm{6}}} $ | (3) |
化工行标HG/T 3584—2011《硼氢化钾》[13]和HG/T 3585—2009《工业硼氢化钠》[14](适用于以硼酸三甲酯和氢化钠为物料生产硼氢化钠)硼氢化物质量分数测定步骤相同,但是取样量有差异,且后一方法试剂消耗量较大。为了使得实验过程中测定便捷化并节省试剂,本研究对产品硼氢化物的测定步骤进行了改进[15-16],对改进分析条件后的测定结果进行检验,确定所测得数据误差均可控制在0.3%之内。
2 结果与讨论 2.1 产物硼氢化钾的鉴定硼氢化钾与硼氢化钠的性质有一些差异,本研究利用BK-300型光学显微镜(放大倍数×100)观察了未经洗涤硼氢化钾含湿产品和原料硼氢化钠固体的形貌,得到光学显微镜下的照片,如图 1a)和图 1b)所示。图 1c)是KH-7700型数字三维视频显微镜(放大倍数×1 400)下观察的单个硼氢化钾颗粒。

|
| 图 1 自然环境条件下光学显微照片 Figure 1 OM images of wet product |
| |
在空气中,硼氢化钾稳定性较好,在观察条件下,不易发生释氢和吸湿,仍可以基本保持立方体的形貌,如图 1a)所示,可以看出,本研究所制取的硼氢化钾产品晶体,其晶体粒度是不均匀的,颗粒的粒度范围在200~250 μm范围内。图 1b)的一些类圆形状部分是释氢所引发的气泡,这是由于在空气中,硼氢化钠的吸湿性很强,可与空气中的水蒸气发生水解反应,释放氢气;受制于BK-300型光学显微镜成像能力和景深效果等限制,图 1a)中的颗粒成像略显模糊,本研究又利用了KH-7700型数字三维视频显微镜(放大倍数×1 400)观察了单个硼氢化钾颗粒,可以很清晰看出此晶体的棱角符合硼氢化钾立方晶系特性,颗粒的二维尺寸大约是210 μm×160 μm。
图 2a)是本研究所制备的产品硼氢化钾的X射线粉末衍射图,而图 2b)和图 2c)分别是粉末衍射联合标准委员会(Joint Committee on Powder Diffraction Standards)中固体硼氢化钾和硼氢化钠的衍射谱图(PDF#10-0112和PDF#9-0386)。

|
| 图 2 X射线粉末衍射谱图 Figure 2 XRD peaks |
| |
图 2a)是晶体典型的粉末衍射图谱,说明本研究所得到的晶体是晶态物质。通过比较图 2a)、2b)和2c)的相对衍射强度及衍射峰所在位置,不难看出,2a)的衍射图谱和2b)完全一致,而和2c)的衍射图谱不相符。结合反应前后体系中存在的成分(KBH4、KOH、NaBH4、NaOH以及少量偏硼酸盐)和X射线粉末衍射图谱特征性,可以定性地确定本研究所得到的固体就是硼氢化钾。
2.2 反应物物质的量之比的影响沉淀剂氢氧化钾以近饱和溶液状态进料,与硼氢化钠的碱性母液反应,制备硼氢化钾。根据化学平衡原理,氢氧化钾过量,可以保证其与硼氢化钠之间的反应发生更加充分,得到更多的硼氢化钾。
选择反应温度50 ℃,搅拌速度180 r/min,蠕动泵进料速度0.7 mL·min-1,养晶温度0 ℃,养晶1 h:分别按照不同反应物物质的量之比[n(KOH): n(NaBH4)],配置沉淀剂溶液,在不同降温速度下进行实验,考察反应物物质的量之比对产品的质量分数和收率影响,结果如图 3所示。

|
| 图 3 不同反应物物质的量之比,不同降温速度对应的质量分数和收率变化 Figure 3 Purity and yield for different molar ratios at various cooling-rates |
| |
由图 3可以看出,随着反应物物质的量之比的提高,即氢氧化钾用量增加,产品中硼氢化钾的含量降低。同时降温速度较慢时,这一影响较小,而降温速度较快,将大幅降低产品质量分数。与此同时,收率有所增加,且降温速度越快,收率越大。原因在于,一方面由于增加了反应物的浓度,反应平衡向右移动,反应结晶析出的硼氢化钾更多;而另一方面,由于产品中碱含量增大,粗产品中硼氢化钾含量降低,使得硼氢化钾含量相对减少。提高反应物物质的量之比相当于提高反应系统中硼氢化钾的过饱和度,提高了反应结晶过程的推动力,有助于析出晶体。因此,提高反应物物质的量之比可以提高产物硼氢化钾的收率。最新化工行标HG/T 3584-2011修订了硼氢化钾的质量分数要求,将原标准中一级品(不小于96.0%)和合格品(不小于95.0%)统一为质量分数要求不小于97.0%[13, 17],故综合考虑,反应物物质的量之比控制在1.05~1.10为宜,即沉淀剂氢氧化钾的用量过量5%~10%。
2.3 反应温度的影响利用反应结晶过程制备硼氢化钾,总体上可以分为2个过程:1)反应相硼氢化钠和沉淀相氢氧化钾反应生成硼氢化钾;2)硼氢化钾以晶体形式从溶液中析出。控制搅拌速度180 r/min,养晶温度0 ℃,进料速度0.7 mL·min-1,降温速度5 ℃·h-1,养晶时间1 h,在不同反应物质的量之比下,考察不同反应温度对于所制备产物硼氢化钾的质量分数和收率的影响。结果如表 2所示。
| 反应温度/℃ | 反应物物质的量之比 | 质量分数/% | 收率/% |
| 50 | 1.1 | 97.83 | 65.92 |
| 50 | 1.2 | 97.11 | 68.44 |
| 50 | 1.3 | 96.81 | 69.50 |
| 70 | 1.1 | 98.38 | 64.12 |
| 70 | 1.2 | 98.15 | 67.42 |
| 70 | 1.3 | 98.03 | 67.94 |
由表 2可以看出,反应温度从50 ℃上升到70 ℃时,最终产品质量分数有所增加,同时,反应物物质的量之比越大,产品质量分数增加幅度越大;而收率有一定程度下降,且在不同反应物质的量之比下变化幅度基本一致:这是由于高温下,在低浓度的碱性环境中,硼氢化钾的水解速度显著提高[18-19],引起了更大程度的水解;反应温度在70 ℃时,可以明显观察到三斜晶系的偏硼酸盐颗粒。可见,较高的反应温度是引发产品质量降低的原因。
实验结果充分证明,反应温度的控制对反应结晶过程制备硼氢化钾起着重要作用,结合其对于最终收率的影响,反应温度选择50 ℃时,能耗更小,且硼氢化物的水解程度较轻,同时制得的硼氢化钾产品粒度分布更为均匀。
2.4 养晶温度的影响分析Churikov等[20]绘制的多温度下KBH4-KOH-H2O三元物系相图,可以看出,随着温度降低,液相区面积减小,硼氢化钾的溶解性降低。据此,可通过冷却结晶逐渐促进溶液中硼氢化钾的含量超出平衡溶解度,从而形成过饱和析出。在反应物物质的量之比1.10、反应温度50 ℃、搅拌速度180 r/min、进料速度0.7 mL·min-1、养晶温度0 ℃条件下,利用冷却表面(热交换)夹套式冷媒间接降温,分别进行降温速度为5和10 ℃·h-1的冷却结晶过程。即在反应器内部从器壁沿径向向中心形成温度梯度,进而形成浓度梯度,从而产生过饱和度,析出晶态产物硼氢化钾。并考察养晶温度分别为-20、-10和0 ℃时反应特征。所得结果如表 3所示。
| 降温速度/(℃·h-1) | 养晶温度/℃ | 质量分数/% | 收率/% |
| 5 | -20 | 97.77 | 80.71 |
| 5 | -10 | 97.33 | 78.05 |
| 5 | 0 | 97.83 | 65.92 |
| 10 | -20 | 97.92 | 82.39 |
| 10 | -10 | 97.03 | 79.42 |
| 10 | 0 | 97.74 | 73.61 |
从表 3可以看出,养晶温度在-10 ℃时,降温速度无论是5还是10 ℃·h-1,产品最终质量分数均出现了最低点;而与此同时,随着养晶温度从0 ℃降至-20 ℃,产品的收率一直在增加,而且2个降温速度下变化趋势基本一致,结合图 3质量分数和收率的分析结果,选择降温速度10 ℃·h-1,养晶温度0 ℃。
2.5 粒度分布结果为定量确定产品粒度,利用马尔文粒度分析仪(Mastersizer 3000)进行产品测定。由于硼氢化钾在甲醇中的溶解性为0.7%(20 ℃下),故采用甲醇作为溶剂。所得结果如图 4所示。
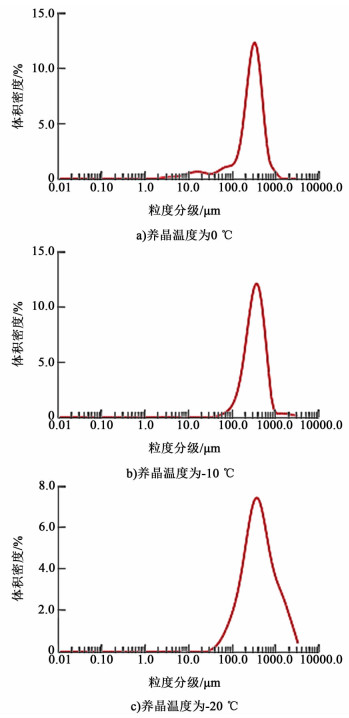
|
| 图 4 产品的粒度分布图 Figure 4 Distribution of particle size |
| |
如图 4所示,图 4a)、图 4b)和图 4c)分别得到了0、-10和-20 ℃养晶温度下产品硼氢化钾的粒度分布图。测得结果显示,养晶温度为0 ℃时,其Dv(50)为307.158 μm,比表面积为25.70 m2·kg-1,产品粒度分布出现了3个峰,并有一定程度交盖;养晶温度为-10 ℃时,其Dv(50)为396.101 μm,比表面积为13.04 m2·kg-1,产品粒度分布为单峰,且较窄;养晶温度为-20 ℃时,其Dv(50)为409.602 μm,比表面积为11.31 m2·kg-1,产品粒度分布为单峰,峰形有所变宽。
3 结论本研究以硼氢化钠碱性母液为反应相,以氢氧化钾溶液为沉淀相,利用反应结晶过程制备硼氢化钾,考察了影响产品性质的各种因素,得到了如下主要结论:适当提高反应物物质的量之比,增加了溶液中氢氧化钾的含量,有助于提高反应结晶过程的最终收率,但过多沉淀剂的使用将降低产品质量分数,导致产品不达标;对于此反应结晶过程,无论是反应温度,还是降温速度或养晶温度,对产品最终性质都有很大影响,体现出了温度控制的重要意义。
综上所述,以硼氢化钠碱性母液为反应相,以氢氧化钾溶液为沉淀相,采用反应结晶过程处理硼氢化钠生产工艺所得母液,能够有效降低硼氢化物的水解程度,提高母液中硼氢化物的收率,进而获得稳定性更好的产品硼氢化钾,带来经济效益。控制反应物物质的量之比为1.05~1.10,反应温度为50 ℃,降温速度10 ℃·h-1,养晶温度0 ℃,可以得到各项指标都较好的硼氢化钾产品,具有一定的实际意义。
| [1] | Schlesinger H I, Brown H C. Methods of preparing alkali metal borohydrides: US, 2534533[P]. 1950-12-19 |
| [2] | Banus M D, Gibb T R P. Method of purifying borohydrides of the alkali metals: US, 2542746[P]. 1951-02-20 |
| [3] | Martelli P, Caputo R, Remhof A, et al. Stability and decomposition of NaBH4[J]. Journal of Physical Chemistry C, 2010, 114(15): 7173–7177. DOI: 10.1021/jp909341z |
| [4] | Minkina V, Shabunya S, Kalinin V, et al. Long-Term stability of sodium borohydrides for hydrogen generation[J]. International Journal of Hydrogen Energy, 2008, 33(20): 5629–5635. DOI: 10.1016/j.ijhydene.2008.07.037 |
| [5] | Churikov A V, Gamayunova I M, Zapsis K V, et al. Influence of temperature and alkalinity on the hydrolysis rate of borohydride ions in aqueous solution[J]. International Journal of Hydrogen Energy, 2012, 37(1): 335–344. DOI: 10.1016/j.ijhydene.2011.09.066 |
| [6] | Fournier M C, Falk L, Villermaux J. A new parallel competing reaction system for assessing micromixing efficiency——Experimental approach[J]. Chemical Engineering Science, 1996, 51(22): 5053–5064. DOI: 10.1016/0009-2509(96)00270-9 |
| [7] | ljukić B, Santos D M F, Sequeira C A C, et al. Analytical monitoring of sodium borohydride[J]. Analytical Methods, 2013, 5(4): 829–839. DOI: 10.1039/c2ay26077h |
| [8] |
张忠林, 赵以芳, 段东红. 电化学法测定硼氢化钠浓度的研究[J].
山西化工, 2011, 31(6): 30–31.
Zhang Zhonglin, Zhao Yifang, Duan Donghong. Determination of the borohydride concentration using electrochemical methods[J]. Shanxi Chemical Industry, 2011, 31(6): 30–31. |
| [9] |
刘毅敏, 覃军, 王祥智, 等. 硼氢化钠样品纯度的测定[J].
理化检验:化学分册, 2003, 39(9): 555–556.
Liu Yimin, Tan Jun, Wang Xiangzhi. Determination of the of purity of sodium borohydride[J]. Physical Testing and Chemical Analysis, 2003, 39(9): 555–556. |
| [10] | 车瀛照, 庄英俊. 一种定量分析碱金属硼氢化物的方法: CN, 102901793A[P]. 2013-01-30 Che Yingzhao, Zhuang Yingjun. Method for quantitative analysis of alkali metal borohydride: CN, 102901793A[P]. 2013-01-30(in Chinese) |
| [11] | Lyttle D, Jensen E, Struck W. Simple volumetric assay for sodium borohydride[J]. Analytical Chemistry, 1952, 24(11): 1843–1844. DOI: 10.1021/ac60071a041 |
| [12] | Chaikin S W. Direct volumetric assay of sodium borohydride and potassium borohydride[J]. Analytical Chemistry, 1953, 25(5): 831–832. DOI: 10.1021/ac60077a054 |
| [13] | 中国石油和化学工业联合会. HG/T 3584-2011硼氢化钾[S]. 北京: 化学工业出版社, 2012 China Petroleum and Chemical Industry Federation. HG/T 3584-2011 Potassium borohydride[S]. Beijing: Chemical Industry Press, 2012(in Chinese) |
| [14] | 中国石油和化学工业协会. HG/T 3585-2009工业硼氢化钠[S]. 北京: 化学工业出版社, 2010 China Petroleum and Chemical Industry Federation. HG/T 3585-2009 Industrial sodium borohydride[S]. Beijing: Chemical Industry Press, 2010(in Chinese) |
| [15] |
杨裴, 范国强, 白莹, 等. 硼氢化钾分析方法改进[J].
无机盐工业, 2012, 44(6): 52–53.
Yang Pei, Fan Guoqiang, Bai Ying, et al. Improvement on analytical method for potassium borohydride[J]. Inorganic Chemicals Industry, 2012, 44(6): 52–53. |
| [16] |
陆思伟. 硼氢化钾化工行业标准简介[J].
化工标准化与质量监督, 2000, 8: 1–2.
Lu Siwei. Brief introduction of potassium hydrogen chemical industry standard[J]. Chemical Industry Standardization and Quality Supervision, 2000, 8: 1–2. |
| [17] | 中国石油和化学工业联合会. HG/T 3584-1999硼氢化钾[S]. 北京: 化学工业出版社, 1999 China Petroleum and Chemical Industry Federation. HG/T 3584-1999 Potassium borohydride[S]. Beijing: Chemical Industry Press, 1999(in Chinese) |
| [18] | Brown J, Svensson M. Additions and corrections:The stability of potassium borohydride in alkaline solutions[J]. Journal of the American Chemical Society, 1957, 79(24): 6581–6581. |
| [19] | Brown J B, Svensson M. The stability of potassium borohydride in alkaline solutions[J]. Journal of the American Chemical Society, 1957, 79(15): 4241–4242. DOI: 10.1021/ja01572a071 |
| [20] | Churikov A V, Zapsis K V, Khramkov V V, et al. Temperature-induced transformation of the phase diagrams of ternary systems NaBO2+NaOH+H2O and KBO2+KOH+H2O[J]. Journal of Chemical & Engineering Data, 2011, 56(3): 383–389. |
 2018, Vol. 35
2018, Vol. 35





