硫化氢(H2S)是石油炼制、天然气工业以及化学合成工艺中会大量产生的一种有毒酸性气体,我国硫化氢产生的总量每年可达到1 000万t[1]。它不仅会引起化工设备的腐蚀及金属催化剂的失活,而且会造成环境污染,并危及人的生命安全,因此实现H2S的有效治理和综合利用十分必要[2-3]。目前,工业上大多采用Claus工艺处理H2S气体,此过程能耗大,产生的有害物质会造成二次污染,且氢生成水,造成了氢资源的极大浪费[4]。光催化技术,可以利用储量丰富的太阳光能在半导体光催化剂的作用下将H2S分解,反应条件温和,不产生二次污染,不仅解决了环境污染问题,还合理地利用了氢资源,使太阳能以燃料氢的形式得以收集和储存,为处理H2S提供了一个新途径[5-6]。
研制开发具有高光子利用效率的光催化剂是光催化分解H2S制氢的关键。CdS是光催化分解H2S反应中被广泛研究的的材料,其禁带宽度为2.4 eV,可吸收波长小于517 nm的可见及紫外光,且对H2S具有良好的吸附亲和性,因此表现出较好的光催化分解H2S反应活性。但CdS光稳定性较差,易发生光腐蚀,在一定程度上限制了其在光催化中的应用[5, 7-9]。TiO2是一种已被广泛应用于光催化降解污染物及裂解水产氢等方面的材料,被称为最有应用前景的光催化剂[10-12]。但是纯TiO2应用于光催化H2S分解时,由于其对S2-和H2S等的吸附亲和性较差,很难取得高光催化效率[6]。而且,TiO2带隙过宽、光谱响应范围窄的特点限制了其光催化效率的提升。2011年,Mao等利用高温高压氢气还原的方法制备了一种新型的高效TiO2光催化剂[13],实现了可见光吸收并获得了稳定高效的光催化性能。随后的研究中发展出了诸多新型制备方法还原TiO2(r-TiO2),如常压氢气、CaH2、NaBH4还原等,通过在TiO2中引入大量缺陷(Ti3+,Vo),从而实现光吸收及催化效率的提升[14-18]。
CdS复合可以有效拓展TiO2的光谱响应范围,提高其光生电子和空穴的分离率,同时抑制CdS光腐蚀,并提供更多光催化分解H2S的反应活性位点,有利于获得高效光催化活性[19-21]。然而对于具有更高光吸收及光催化活性的r-TiO2材料与CdS的复合却尚未有研究。本研究采用溶胶凝胶联合溶剂热法,以NaBH4为还原剂,在还原TiO2的同时引入Cd源,随后通过离子交换成功制备了CdS/r-TiO2,并将其应用于光催化分解H2S中,考察了CdS负载量及NaBH4还原对TiO2光吸收性能及光催化分解H2S制氢效率的影响。
1 实验部分 1.1 光催化剂的制备 1.1.1 TiO2及r-TiO2的制备制备方法见参考文献[5]。配制a、b溶液:a)一定量的钛酸四丁酯(TBOT)+无水乙醇(EtOH),b)EtOH+H2O+HNO3;将b滴入a中搅拌一定时间进行水热反应,反应结束将样品用盐酸、去离子水洗涤,烘干后,获得TiO2。制备过程中向a、b混合后的溶胶中加入一定量的NaBH4,再在180 ℃条件下进行水热反应,即可获得Ti3+自掺杂的r-TiO2。
1.1.2 CdS/TiO2及CdS/r-TiO2的制备向上述b溶液中加入一定比例的乙酸镉作Cd源,再按上述步骤进行水热反应,随后将获得的粉末样品分散入Na2S溶液中进行离子交换,洗涤烘干后即获得CdS/TiO2和CdS/r-TiO2。
1.2 光催化剂的表征样品晶体结构测试采用Bruker X射线衍射仪(D8 Advance SS);微观形貌测试采用美国FET公司扫面电子显微镜(Nova Nano SEM 450 XL30 ESEM);吸收光谱测试采用安捷伦紫外-可见漫反射仪(Varian Cary 5000型);XPS测试采用英国Kratos公司X射线光电子能谱仪(Axis Ultra DLD)。
1.3 光催化性能测试光催化分解H2S产氢测试在顶端光源辐射的光催化反应釜中进行,光源采用300 W氙灯。将100 mg催化剂样品粉末分散于100 mL 0.7 mol·L-1 NaOH/0.25 mol·L-1 Na2SO3水溶液中,然后向上述溶液中加入0.5 mL H2PtCl6(1 g·L-1),使得样品负载质量分数约0.5%的Pt。装反应釜后,通H2S/N2混合气使NaOH吸收H2S至饱和。随后光照进行测试光催化性能,5 h后取密闭系统中的气氛样,利用气相色谱(安捷伦6890A,5A分子筛,N2)测试密闭系统中的氢含量。
2 结果与讨论 2.1 光催化剂表征结果图 1为合成光催化剂的X射线衍射图谱及紫外-可见-近红外漫反射吸收光谱。

|
| 图 1 TiO2,r-TiO2及不同比例CdS/r-TiO2样品的X射线衍射图谱及紫外-可见-近红外漫反射吸收光谱 Figure 1 XRD pattern and UV-Vis-NIR diffusive reflectance and absorption spectra of TiO2, r-TiO2 and CdS loaded r-TiO2 |
| |
由样品的XRD结果[图 1a)]可以看出,合成的TiO2为纯锐钛矿,加入NaBH4不影响所得样品的物相,获得的r-TiO2也为纯锐钛矿物相。由CdS负载样品的XRD图可以看出,当样品负载量较小(< 5%)时,样品保持锐钛矿物相不发生变化,负载量增大至5%时,样品出现较小的立方CdS(1 1 1)、(2 2 0)、(3 1 1)衍射峰,说明样品是由CdS和TiO2共同构成的,且负载量较小时,CdS是分散均匀的纳米晶粒[22]。当CdS负载量继续增加至10%时,样品中出现明显的立方CdS的衍射峰。图 1b)为吸收光谱的测试结果,可以看出,NaBH4还原后r-TiO2样品对可见及近红外光的吸收能力明显增加,测试光谱区间内,光吸收率由11.4%提升至19.5%,这与样品颜色由白色变为灰色相一致。这主要是由于NaBH4的强还原作用,将TiO2晶格中的少量Ti4+还原为Ti3+,从而在TiO2能带中引入了杂质能级,实现了可见光的吸收[16]。负载CdS后,样品吸收边红移,光响应范围增大,尤其是对可见光波段的光吸收明显增强。2%、5%、10% CdS负载的r-TiO2样品颜色逐渐变深,光吸收率分别为23.7%、35.1%及42.3%,由吸收边计算得光学带隙分别为2.28、2.24和2.22 eV。
为了测试NaBH4对CdS负载样品的还原作用,我们也对相应样品进行了XRD及吸收光谱测试,结果如图 2所示。

|
| 图 2 5% CdS/TiO2及CdS/r-TiO2样品的X射线衍射图谱和紫外-可见-近红外漫反射吸收光谱 Figure 2 XRD pattern and UV-Vis-NIR diffusive reflectance and absorption spectra of 5% CdS loaded TiO2 and r-TiO2 |
| |
由XRD图可以看出,NaBH4还原前后,CdS负载的TiO2样品都由锐钛矿TiO2及少量CdS组成,我们根据sherrer公式计算了TiO2及CdS的晶粒尺寸,还原前后分别为91、67、98、及71 nm,NaBH4还原对CdS/TiO2样品的物相及晶粒尺寸影响较小。由图 2b)可以看出,NaBH4还原对样品光吸收影响明显,CdS/r-TiO2样品在550~800 nm的可见光吸收性能与CdS/TiO2相比有明显提升,样品颜色也由黄色变为暗黄色。
图 3为所得样品的扫面电镜图像及能谱分析结果。
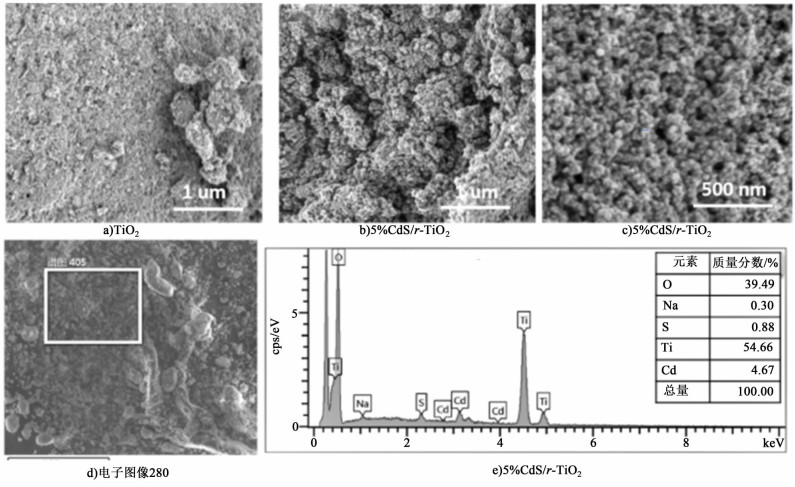
|
| 图 3 TiO2及CdS/r-TiO2样品的扫描电镜图像及能谱分析结果 Figure 3 SEM images and EDS results of the TiO2 and CdS/r-TiO2 |
| |
由图 3可以看出样品微观形貌为纳米颗粒,且尺寸较均匀。如图 3c)所示,5% CdS/r-TiO2纳米样品的颗粒尺寸约为50~80 nm。CdS/r-TiO2样品的EDS分析结果[图 3d)及3e)]说明样品中的主要元素为Ti、O、Cd、S,且Cd、S元素含量基本与原料配比相当,但样品中也可见有少量Na残留,可能是因为NaBH4或在后续Na2S交换过程中的残留所致。
图 4为CdS/r-TiO2样品的X射线光电子能谱。

|
| 图 4 5% CdS/r-TiO2样品的XPS谱图 Figure 4 XPS spectra of 5% CdS/r-TiO2 |
| |
由图 4a)可以看出,其Ti 2p3/2和Ti 2p1/2峰分别位于458.1和463.8 eV结合能处,低于TiO2的458.6和464.3 eV,这一结果与文献[5]中结果一致,证明NaBH4还原在TiO2中引入了Ti3+缺陷[16]。O 1s谱图中[图 4b)],样品在529.7 eV处的峰对应TiO2中的Ti—O键,而531.6 eV处的小峰,对应于TiO2中的氧空位(Vo)[16]。样品的Cd 3d5/2及Cd 3d3/2分别位于405.3及412.0 eV[(图 4c)],S 2p峰位于161.3 eV[图 4d)],分别对应于CdS中的Cd2+及S2-[23]。综上,XPS结果说明,CdS/r-TiO2中存在Ti3+缺陷,且通过实验方法制备的样品中CdS与TiO2得到了较好的复合。
2.2 光催化性能测试样品光催化分解H2S产氢结果如图 5所示。

|
| 图 5 TiO2,r-TiO2,CdS/TiO2及CdS/r-TiO2样品的光催化分解H2S产氢性能 Figure 5 Solar-light driven photocatalytic H2S splitting for H2 generation over TiO2, r-TiO2, CdS/TiO2 and CdS/r-TiO2 |
| |
由图 5可以看出,TiO2及r-TiO2样品光催化分解H2S产氢的性能都较差,低于0.5 mmol·h-1·g-1,负载CdS后,样品光催化性能明显提升,2%、5%和10% CdS负载的r-TiO2样品产氢率分别为0.98、2.33和2.12 mmol·h-1·g-1。5% CdS负载在本实验方法中具有最佳产氢效果,是最适宜负载量,这可能是由于负载量太小时,CdS的光吸收作用不足,负载量过大时,CdS晶粒过多,不能均匀分散,且会覆盖TiO2表面而使两者协同作用降低。与CdS/TiO2相比,5% CdS/r-TiO2样品的产氢也表现出了较高的反应活性,是前者的1.3倍,与样品光吸收规律一致,说明NaBH4还原也有效提升了CdS/TiO2复合光催化剂的光催化活性。
2.3 光催化机理分析结合相关文献报道[16, 24-25],我们提出了CdS/r-TiO2光催化材料的能带结构、电子转移过程示意图,如图 6所示。
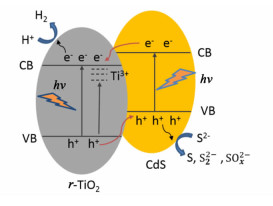
|
| 图 6 CdS/r-TiO2样品的光催化机理示意图 Figure 6 Schematic diagram showing the photocatalytic mechanism in CdS/r-TiO2 |
| |
受到光照时,CdS及r-TiO2分别吸收能量大于其带隙宽度Eg的光子,激发其价带中的电子脱离原子核的束缚,跃迁至导带成为自由电子e-,并在价带中形成空穴h+。由于CdS和r-TiO2满足能带匹配原则,两者复合后,CdS导带中的电子注入到r-TiO2的导带中,r-TiO2价带中的空穴注入到CdS的价带中,因此在CdS表面富集大量空穴,而r-TiO2表面则富集了大量电子,从而实现了光生载流子的有效分离。随后电子与空穴分别扩散迁移至催化剂表面,分别参与产氢及硫的氧化过程。另外,由于CdS本身可见光响应的特性,以及NaBH4还原在r-TiO2中引入了Ti3+缺陷能级,增加了TiO2自身的光吸收,最终使得CdS/r-TiO2表现出优异的光吸收及光催化性能。适当的CdS负载可以增强r-TiO2样品的光催化活性,当CdS负载量较小时,样品光吸收及光电子分离仍显不足,当CdS负载量过大时,其与r-TiO2不能有效复合,从而影响了光电子分离效率。
3 结论采用溶胶凝胶联合溶剂热法制备出了CdS/r-TiO2样品,加入NaBH4在TiO2中引入了Ti3+缺陷,获得的r-TiO2对可见及及红外光的吸收明显增强。CdS负载进一步增强了r-TiO2样品的可见光利用率,提高了样品的光生载流子分离传输能力,同时增加了光催化分解H2S的反应活性位点,从而获得了优异的光催化性能。负载量为5%的CdS/r-TiO2样品,其光催化分解H2S制氢产率提升至2.4 mmol·h-1·g-1,是初始r-TiO2样品的约5.5倍,本征TiO2样品的约6.5倍。
| [1] | 孙俊艳. 改性ACF/纳米TiO2光催化净化H2S气体的研究[D]. 石家庄: 河北科技大学, 2012 |
| [2] | Ma G, Ya N, Shi J, et al. Direct splitting of H2S into H2 and S on CdS-based photocatalyst under visible light irradiation[J]. J. Catalysis, 2008, 260(1): 134–140. DOI: 10.1016/j.jcat.2008.09.017 |
| [3] | Ma W, Han J, Yu W, et al. Integrating perovskite photovoltaics and free catalysts toward efficient solar energy conversion and H2S splitting[J]. ACS Catalysis, 2016, 6(9): 6198–6206. DOI: 10.1021/acscatal.6b01772 |
| [4] | Ma G, Yan H, Zong X, et al. Photocatalytic splitting of H2S to produce hydrogen by solid phase reaction[J]. Chin J Catal, 2008, 29(4): 313–315. DOI: 10.1016/S1872-2067(08)60029-7 |
| [5] | Preethi V, Kanmani S. Photocatalytic hydrogen production[J]. Materials Science in Semiconductor Processing, 2013, 16(3): 561–575. DOI: 10.1016/j.mssp.2013.02.001 |
| [6] | Yu S, Zhou Y. Advanced catalytic materials-photocatalysis and other current trends:Photochemical decomposition of hydrogen sulfide[M]. Intech: 2016. |
| [7] |
白雪峰, 吴丹, 王鹏. 硫化氢光催化分解制氢[J].
太阳能学报, 2008, 29(10): 1256–1261.
Xuefeng B, Dan W, Peng W. Photodecomposition of hydrogen sulfide to produce hydrogen[J]. Acta Energiae Solaris Sinica, 2008, 29(10): 1256–1261. DOI: 10.3321/j.issn:0254-0096.2008.10.014 |
| [8] | Shi J, Yan X, Cui H, et al. Low-Temperature synthesis of CdS/TiO2 composite photocatalysts:Influence of synthetic procedure on photocatalytic activity under visible light[J]. J Mol Catal A:Chemical, 2012, 356: 53–60. DOI: 10.1016/j.molcata.2012.01.001 |
| [9] | Zhang K, Guo L. Metal sulphide semiconductors for photocatalytic hydrogen production[J]. Catalysis Science & Technology, 2013, 31(7): 1672–1690. |
| [10] | Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238: 37–38. DOI: 10.1038/238037a0 |
| [11] | Liu L, Chen X. Titanium dioxide nanomaterials:Self-Structural modifications[J]. Chem Rev, 2014, 114(19): 98909–98918. |
| [12] | Kubacka A, Fernandez-Garcia M, Colon G. Advanced nanoarchitectures for solar photocatalytic applications[J]. Chem Rev, 2012, 112(3): 1555–1614. DOI: 10.1021/cr100454n |
| [13] | Chen X, Liu L, Yu P, et al. Increasing solar absorption for photocatalysis with black hydrogenated titanium dioxide nanocrystals[J]. Science, 2011, 331(6018): 746–750. DOI: 10.1126/science.1200448 |
| [14] | Wang G, Wang H, Ling Y, et al. Hydrogen-Treated TiO2 nanowire arrays for photoelectrochemical water splitting[J]. Nano Lett, 2011, 11(7): 3026–3033. DOI: 10.1021/nl201766h |
| [15] | Zhu G, Yin H, Yang C, et al. Black titania for superior photocatalytic hydrogen production and photoelectrochemical water splitting[J]. Chem Cat Chem, 2015, 7(17): 2614–2619. |
| [16] | Xing M, Fang W, Nasir M, et al. Self-Doped Ti3+-enhanced TiO2 nanoparticles with a high-performance photocatalysis[J]. Catalysis, 2013, 297: 236–243. DOI: 10.1016/j.jcat.2012.10.014 |
| [17] | Saputera W H, Mul G, Hamdy M S. Ti3+-Containing titania:Synthesis tactics and photocatalytic performance[J]. Catal Today, 2015, 246: 60–66. DOI: 10.1016/j.cattod.2014.07.049 |
| [18] | Zhu Q, Peng Y, Lin L, et al. Stable blue TiO2-nanoparticles for efficient visible light photocatalysts[J]. J Mater Chem A, 2014, 2(12): 4429–4437. DOI: 10.1039/c3ta14484d |
| [19] | Liu S, Zhang N, Tang Z, et al. Synthesis of one-dimensional CdS@TiO(2) core-shell nanocomposites photocatalyst for selective redox:The dual role of TiO(2) shell[J]. ACS Appl Mater Interfaces, 2012, 4(11): 6378–6385. DOI: 10.1021/am302074p |
| [20] | Baker D R, Kamat P V. Photosensitization of TiO2 nanostructures with CdS quantum dots:Particulate versus tubular support architectures[J]. Adv Funct Mater, 2009, 19(5): 805–811. DOI: 10.1002/adfm.v19:5 |
| [21] | Li J, Cushing S K, Zheng P, et al. Solar hydrogen generation by a CdS-Au-TiO2 sandwich nanorod array enhanced with Au nanoparticle as electron relay and plasmonic photosensitizer[J]. J Am Chem Soc, 2014, 136(23): 8438–8449. DOI: 10.1021/ja503508g |
| [22] | Daskalaki V M, Antoniadou M, Li P, et al. Solar light-responsive Pt/CdS/TiO2 photocatalysts for hydrogen production and simultaneous degradation of inorganic or organic sacrificial agents in wastewater[J]. Environ Sci Technol, 2010, 44(19): 7200–7205. DOI: 10.1021/es9038962 |
| [23] | Qin N, Liu Y, Wu W, et al. One-Dimensional CdS/TiO2 nanofiber composites as efficient visible-light-driven photocatalysts for selective organic transformation:synthesis, characterization, and performance[J]. Langmuir, 2015, 31(3): 1203–1209. DOI: 10.1021/la503731y |
| [24] | Chen X, Shen S, Guo L, et al. Semiconductor-Based photocatalytic hydrogen generation[J]. Chem Rev, 2010, 110(11): 6503–6570. DOI: 10.1021/cr1001645 |
| [25] | Schneider J, Matsuoka M, Takeuchi M, et al. Understanding TiO2 photocatalysis:Mechanisms and materials[J]. Chem Rev, 2014, 114(19): 9919–9986. DOI: 10.1021/cr5001892 |
 2018, Vol. 35
2018, Vol. 35





