2. 华北制药河北华民药业有限公司, 河北 052160;
3. 河北制药与化学工程研究中心, 石家庄 050018
2. NCPC Hebei Huamin Pharmaceutical Co, Ltd, Hebei, 052160, China;
3. Hebei Research Center of Pharmaceutical and Chemical Engineering, Shijiazhuang 050018, China
头孢拉定是第1代半合成的头孢菌素, 可以口服,吸收好,血药浓度较高,具有广谱性、不良反应小、抗菌能力较强及良好的药代动力学性能等优点[1-3],已被列入国家基本医药目录,有着广阔的应用前景,其化学结构式如图 1所示。头孢拉定的结晶一般采用反应结晶[4-6]的方法,反应结晶一般来说是工业结晶中最难掌握和控制的,是否能很好的掌握和控制对产品的最终质量有着决定性的影响。

|
| 图 1 头孢拉定结构式 Figure 1 Chemical structure of cephradine |
| |
现有的头孢拉定结晶文献均是传统的间歇结晶过程,难以控制结晶环境保持在介稳区内,2006年,褚睿智等[7]考察了不同结晶体系对头孢拉定结晶过程的影响,但得到的产品晶习较差,粒度分布不均匀。2010年,Du等[8]进行了头孢拉定的结晶优化,得到的产品晶习较好,但没有对粒度分布进行具体分析。另外,鲁冰[9]、孙海岚[10]和刘宁宁[11]等均对头孢拉定结晶工艺进行了不同程度研究,却均未对收率、晶习及粒度分布进行具体分析。
目前国内企业生产的头孢拉定普遍存在产品聚结,晶习差,粒度分布不均匀等问题。双股进料结晶工艺可有效解决这些问题。影响双股进料结晶产品质量的因素有初始浓度[12]、料液流加速率、搅拌速率[13]、结晶环境pH值[14]、晶种添加量[15-16]以及养晶时间等,本研究在双股进料结晶工艺下考察了以上因素对结晶产品收率,晶习及粒度分布的影响,找到一条合适的结晶工艺,得到了晶习好、主粒度大、粒度分布均匀的产品。
1 实验部分 1.1 实验材料药品:头孢拉定由华北制药集团提供;亚硫酸氢钠购自天津市永大化学试剂有限公司。
试剂:浓盐酸为分析纯,购自石家庄市试剂厂;浓氨水为分析纯,购自石家庄市试剂厂;去离子水为实验室自制二级去离子水;丙酮为分析纯,购自天津市永大化学试剂有限公司。
仪器:Mastersizer 3000激光粒度分析仪;H6303i生物显微镜;ME204E电子分析天平。
1.2 实验过程与实验装置 1.2.1 实验过程在结晶器中加入水和适量头孢拉定晶体,制得一定pH值的饱和溶液,再加入少量头孢拉定晶体混匀作为晶种底液。启动结晶器搅拌并通氮气,35 ℃恒温。另取头孢拉定粗品和去离子水混合,并用浓盐酸调节pH值使其溶解,加少量亚硫酸氢钠,然后将此溶液与浓氨水分别用蠕动泵同时匀速滴入晶种底液,以控制pH值处于一定范围,养晶0.5 h,继续调节pH值到等电点,再养晶,降温,过滤,用丙酮洗涤,真空干燥2 h得到头孢拉定结晶产品。
1.2.2 实验装置图 2为头孢拉定双股进料结晶装置图。

|
| 1-锥形瓶 2-蠕动泵 3-氮气瓶 4-滴管 5-电动搅拌器 6-搅拌控制器 7-pH计 8-集热式恒温加热磁力搅拌器 9-四口结晶器 10-搅拌桨 图 2 头孢拉定双股进料结晶装置图 |
| |
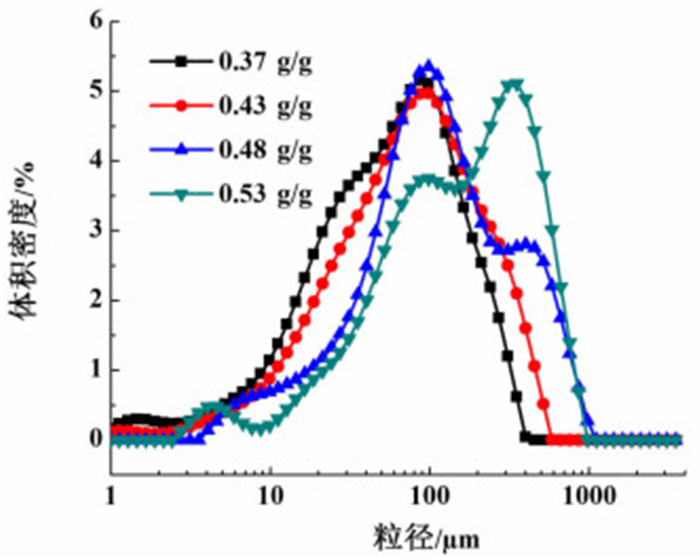
在其它条件一定(料液流加速率为2 mL/min,搅拌速率为140 r/min,结晶pH值控制在2.5~2.7,晶种添加量为原料质量的0.1%,养晶时间为45 min)的情况下,考察了结晶液初始浓度(溶质质量/溶剂质量)为0.37、0.43、0.48及0.53 g/g时,结晶产品的收率及粒度分布变化。表 1为不同结晶液初始浓度下产品的收率。图 3为不同结晶液初始浓度下产品的粒度分布图。
| 结晶液初始浓度/(g·g-1) | 0.37 | 0.43 | 0.48 | 0.53 |
| 收率/% | 82.40 | 89.13 | 90.33 | 90.70 |
|
| 图 3 不同结晶液初始浓度下产品的粒度分布图 Figure 3 The crystal size distribution under solution with different initial concentration |
| |
由实验结果可知,结晶液初始浓度越高产品收率越高,但初始浓度过高时产品粒度分布不均匀。对此可以解释为:料液浓度过高,不易搅拌均匀,过饱和度过高反应不易控制,一部分晶体聚结成簇。综上所述,选取0.43 g/g为结晶液初始浓度。
2.1.2 料液流加速率的影响在其它条件一定(结晶液初始浓度为0.43 g/g,搅拌速率为140 r/min,结晶pH值控制在2.5~2.7,晶种添加量为原料质量的0.1%,养晶时间为45 min)的情况下,考察了料液流加速率为1、2以及3 mL/min时,结晶产品的收率及粒度分布变化。表 2为不同料液流加速率下产品的收率。图 4为不同料液流加速率下产品的粒度分布图。
| 料液流加速率/(mL·min-1) | 1 | 2 | 3 |
| 收率/% | 89.51 | 89.57 | 89.53 |

|
| 图 4 不同料液流加速率下产品的粒度分布图 Figure 4 The crystal size distribution under solution with different feeding speed |
| |
由实验结果可知,料液流加速率对结晶收率无明显影响,但随着料液流加速率加快,产品粒度会逐渐变小。对此可以做出如下解释:溶质从溶液中析出生长在晶种上需要一定的时间,持续过快滴加料液会使溶液过饱和度过高超过介稳区,导致爆发成核,析出部分细小晶体,同时也有一部分晶体聚结成簇。而流加速率太慢会导致结晶时间过长,经济性不好。综上所述,选取2 mL/min为料液流加速率。
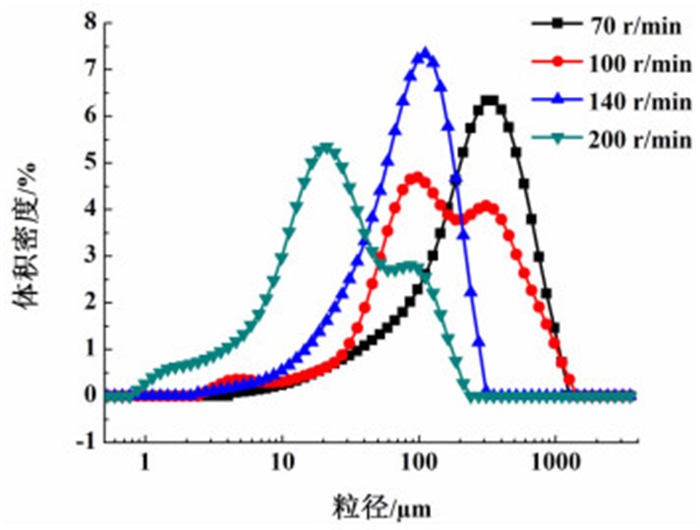
2.1.3 搅拌速率的影响在其它条件一定(结晶液初始浓度为0.43 g/g,料液流加速率为2 mL/min,结晶pH值控制在2.5~2.7,晶种添加量为原料质量的0.1%,养晶时间为45 min)的情况下,考察了搅拌速率为70、100、140以及200 r/min时,结晶产品的收率及粒度分布变化。表 3为不同搅拌速率下产品的收率。图 5为不同搅拌速率下产品的粒度分布图。
| 搅拌速率/(r·min-1) | 70 | 100 | 140 | 200 |
| 收率/% | 89.77 | 89.92 | 89.83 | 89.95 |
|
| 图 5 不同搅拌速率下产品的粒度分布图。 Figure 5 The crystal size distribution under solution with different stirring speed |
| |
由实验结果可知,搅拌速率对产品收率无显著影响,当搅拌速率为70和140 r/min时,粒度分布较好,且70 r/min时产品主粒度偏大,而当搅拌速率为100或200 r/min时,粒度分布不均匀,出现双峰。对此可以做出如下解释,搅拌缓慢时,晶体容易生长在一起而聚结成簇,主粒度偏大,搅拌速率过快,剪切力过大,溶液中的晶体容易被打碎,从而产生一部分细小的碎晶。综上所述,选取70和140 r/min为实验搅拌速率时,分别结晶出均匀簇状聚结体及均匀棒状晶体。
2.1.4 结晶pH值的影响在其它条件相同(结晶液初始浓度为0.43 g/g,料液流加速率为2 mL/min,搅拌速率为140 r/min,晶种添加量为原料质量的0.1%,养晶时间为45 min)的情况下,考察了结晶pH值为2.0~2.2、2.5~2.7、3.0~3.2以及3.5~3.7时,结晶产品的收率及粒度分布变化。表 4为不同结晶pH值下产品的收率。图 6为不同结晶pH值下产品的粒度分布图。
| 结晶pH值范围 | 2.0~2.2 | 2.5~2.7 | 3.0~3.2 | 3.5~3.7 |
| 收率/% | 89.97 | 90.02 | 89.86 | 90.11 |

|
| 图 6 不同结晶pH值范围下产品的粒度分布图 Figure 6 The crystal size distribution under solution with different pH scope |
| |
由实验结果可知,结晶pH值对产品收率无显著影响,当结晶pH值偏低或偏高时,产品粒度分布都不均匀。对此可以做出如下解释:结晶pH值偏低时,后期继续调节pH值至等电点的过程中,pH值跨度较大,过程不易控制,相比传统结晶失去优势,结晶pH值偏高时,结晶液滴入晶种底液的瞬间,容易造成局部过饱和度过高,超过结晶介稳区,出现爆发成核现象。综上所述,选取2.5~2.7为适宜的结晶pH值范围。
2.1.5 晶种添加量的影响在其它条件不变(结晶液初始浓度为0.43 g/g,料液流加速率为2 mL/min,搅拌速率为140 r/min,结晶pH值控制在2.5~2.7,养晶时间为45 min)的情况下,考察了晶种添加量对产品收率及粒度分布的影响。加入晶种的量由式(1)[17]计算得到。
| ${M_{\rm{s}}} = \lambda {M_{\rm{p}}}\left( {L_{\rm{s}}^3/L_{\rm{p}}^3} \right) $ | (1) |
式(1)中:MS和MP分别代表晶种和产品的质量,LS和LP分别代表晶种和产品预期平均粒度,λ为系数。实验所加晶种的平均粒度为11 μm,预期达到产品平均粒度为100 μm左右。表 5为不同晶种添加量下产品的收率。图 7为不同晶种添加量下产品的粒度分布图。
| 系数/λ | 0.1 | 0.5 | 1.0 | 1.5 |
| 收率/% | 89.64 | 89.77 | 89.78 | 90.02 |

|
| 图 7 不同晶种添加量下产品的粒度分布图。 Figure 7 The crystal size distribution under solution with different quantity of seed crystal |
| |
由实验结果可知,晶种添加量对产品收率无显著影响,晶种添加量越多,产品主粒度越小。对此可以做出如下解释:产品的晶体个数在一定程度上与晶种的个数相关,同等质量的产品,晶体个数越少,平均粒径自然越大。但是由于二次成核现象不可避免,产品的晶体个数往往大于加入晶种的个数。综上所述,为系数λ选取一定的取值范围0.1~1.0。
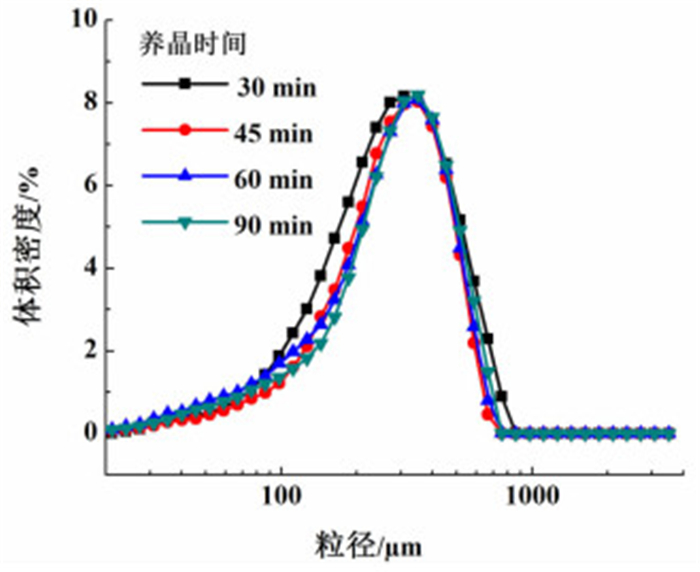
2.1.6 养晶时间的影响在其它条件一定[结晶液初始浓度为0.43 g/g,料液流加速率为2 mL/min,搅拌速率为70 r/min,结晶pH值控制在2.5~2.7,晶种添加量按公式(1)计算,λ取0.5]的情况下,考察了养晶时间为30、45、60以及90 min时,结晶产品的收率及粒度分布变化。表 6为不同养晶时间下产品的收率。图 8为不同养晶时间下产品的粒度分布图。
| 养晶时间/min | 30 | 45 | 60 | 90 |
| 收率/% | 87.84 | 90.06 | 92.03 | 92.25 |
|
| 图 8 不同养晶时间下产品的粒度分布图 Figure 8 The crystal size distribution under solution with different crystal growing time |
| |
由实验结果可知,随着养晶时间的延长,收率有所提高,但60 min以后收率几乎不再增长,养晶时间对产品粒度分布影响不大。综上所述,养晶时间选取60 min。
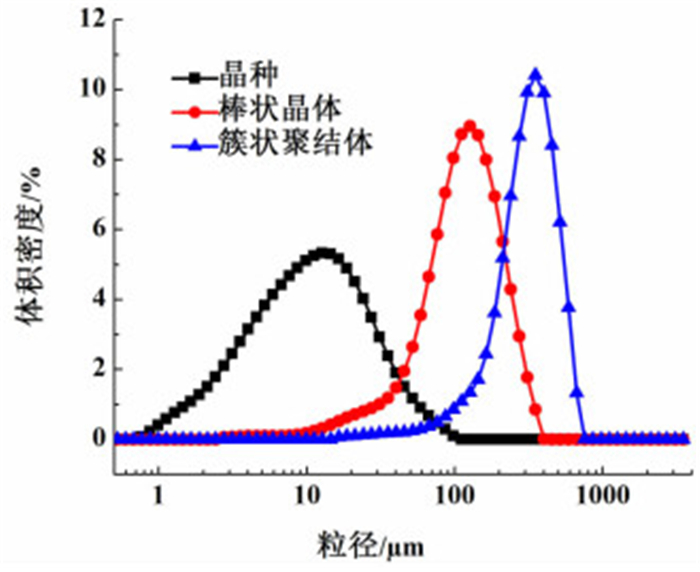
3 头孢拉定双股进料结晶工艺基于以上实验数据确定了头孢拉定双股进料结晶的优化操作条件,即结晶液初始浓度为0.43,料液流加速率为2 mL/min,结晶pH值控制在2.5~2.7,晶种添加量按公式(1)计算,λ取0.1~1.0,搅拌速率为140 r/min可以得到均匀的棒状晶体,搅拌速率为70 r/min可以得到均匀的簇状聚结体。图 9~图 11为结晶工艺优化前后产品显微镜下对比图,图 12为晶种及优化产品粒度分布图。

|
| 图 9 结晶工艺优化前产品显微镜图(PL 20/0.40) Figure 9 Optical micrographs of the products before optimizing(PL 20/0.40) |
| |

|
| 图 10 结晶工艺优化后棒状产品显微镜图(PL 20/0.40) Figure 10 Optical micrographs of the clubbed crystal products after optimizing(PL 20/0.40) |
| |

|
| 图 11 结晶工艺优化后簇状聚结体产品显微镜图(PL 10/0.25) Figure 11 Optical micrographs of the cluster crystal products after optimizing(PL 10/0.25) |
| |
|
| 图 12 晶种及优化后产品粒度分布图 Figure 12 The crystal size distribution of seed crystal and products after optimizing |
| |
通过考察结晶液初始浓度、料液流加速率、搅拌速率、结晶pH值范围、晶种添加量以及养晶时间对双股进料结晶产品收率、晶习及粒度分布的影响,对头孢拉定双股进料结晶新工艺的操作条件进行了优选,得到了晶习好、粒度分布均匀的头孢拉定结晶产品。
| [1] |
石焱, 弓小雪, 张洋, 等. 头孢拉定胶囊人体药代动力学和生物等效性[J].
临床军医杂志, 2009, 37(6): 1097–1099.
Shi Yan, Gong Xiaoxue, Zhang Yang, et al. Pharmacokinetics and bioequivalence of cephradine capsule[J]. Clin J Med Office, 2009, 37(6): 1097–1099. |
| [2] |
郭永泰. 浅析头孢拉定的药理作用[J].
海峡药学, 2004, 16(4): 120–121.
Guo Yongtai. Simply analyse the pharmacological effects of cephradine[J]. The Channel of Pharmaceutical, 2004, 16(4): 120–121. |
| [3] |
潘芳芳, 朱培曦, 黄巧巧, 等. 液相色谱-四极杆飞行时间质谱法分析头孢拉定中的主要杂质[J].
药物分析杂志, 2013, 33(1): 133–145.
Pan Fangfang, Zhu Peixi, Huang Qiaoqiao, et al. HPLC-Q-TOF-MS identification of major impurities in cefradine[J]. Chin J Pharm Anal, 2013, 33(1): 133–145. |
| [4] |
刘宝树, 王静康, 龚俊波, 等. 克拉维酸钾反应结晶研究[J].
中国抗生素杂志, 2005, 30(11): 656–698.
Liu Baoshu, Wang Jingkang, Gong Junbo, et al. Study on the reactive crystallization of potassium clavulanate[J]. Chinese Journal Of Antibiotics, 2005, 30(11): 656–698. DOI: 10.3969/j.issn.1001-8689.2005.11.005 |
| [5] | Schreiber F G. Method for the production of 3-methyl cephem derivatives: US, US5034522[P]. 1991-01-01 |
| [6] | 赵茜, 杜磊, 高大维. 加晶种提高头孢拉定反应结晶产品质量的研究[J]. 中国抗生素杂志, 2000, 25(4): 263–265. |
| [7] |
褚睿智, 孟献梁, 张宝. 头抱拉定结晶工艺[J].
化工进展, 2006, 25(10): 1211–1214.
Chu Ruizhi, Meng Xianliang, Zhang Bao. Crystallization process of cephradine[J]. Chemical Industry And Engineering Progress, 2006, 25(10): 1211–1214. DOI: 10.3321/j.issn:1000-6613.2006.10.020 |
| [8] | Du L, Luo W. Crystallization optimizing of cefradine[J]. The Open Catalysis Journal, 2010, 3: 19–23. DOI: 10.2174/1876214X01003010019 |
| [9] |
鲁冰, 李金凤. 头孢拉定的结晶工艺条件分析[J].
南北桥, 2009(3): 104–104.
Lu Bing, Li Jinfeng. Analysis of the crystallization process condition of cephradine[J]. South North Bridge, 2009(3): 104–104. |
| [10] |
孙海岚. 头孢拉定结晶工艺技术分析[J].
中国信息化, 2013(2): 346–347.
Sun Hailan. Analysis of the crystallization process technology of cephradine[J]. Chinese Information, 2013(2): 346–347. |
| [11] |
刘宁宁. 头孢拉定的结晶工艺过程及影响结晶的因素探析[J].
生物技术世界, 2015(5): 100–100.
Liu Ningning. Study on the process and influencing factors of cephradine crystallization[J]. Bio Tech World, 2015(5): 100–100. |
| [12] |
马博爱, 龚俊波. 阿奇霉素二水合物溶析结晶工艺优化[J].
化学工业与工程, 2015, 32(1): 37–40.
Ma Boai, Gong Junbo. Optimization of crystallization process of azithromycin Dihydrate[J]. Chemical Industry and Engineering, 2015, 32(1): 37–40. |
| [13] | 孙华. 洛伐他汀结晶过程研究[D]. 天津: 天津大学, 2006 Sun Hua. Study on the crystallization process of Lovastatin[D]. Tianjin: Tianjin University, 2006(in Chinese) |
| [14] | Lee C Y, Chen J, Chang W, et al. Effect of pH on the solubilities of divalent and trivalent amino acids in water at 298.15 K[J]. Fluid Phase Equilibr, 2013, 343: 30–35. DOI: 10.1016/j.fluid.2013.01.010 |
| [15] |
尹永恒, 鲍颖, 王永莉, 等. 诱导头孢噻肟钠结晶过程研究[J].
化学工业与工程, 2014, 31(2): 48–53.
Yin Yongheng, Bao Ying, Wang Yongli, et al. Induced crystallization of cefotaxime sodium[J]. Chemical Industry and Engineering, 2014, 31(2): 48–53. |
| [16] | Wang H Y, Jeffrey D W. Seeding and optimization of batch reactive crystallization[J]. Ind Eng Chem Res, 2015, 54(38): 9360–9368. DOI: 10.1021/acs.iecr.5b00185 |
| [17] |
丁绪淮, 谈遒. [J].
工业结晶, 1985: 138.
Ding Xuhuai, Tan Qiu. [J]. Industrial crystallization, 1985: 138. |
 2018, Vol. 35
2018, Vol. 35





