结晶是一种普遍存在的现象,从自然冰晶体到人体骨骼与牙齿的形成,从珍珠贝壳到日常可见水垢的形成[1]。同时结晶也是一项重要的分离纯化技术,广泛应用于化学工业,从大宗化学品到医药、食品和染料等高附加值精细化学品的生产过程[2]。结晶技术还被广泛应用于高新技术领域和高端产品制造中,如生物蛋白质晶体的结构解析[3-4],高纯度光学和电子材料的生产[5],纳米晶体材料的制备[6]等。现代结晶已成为产品精加工的重要手段,是实现产品高端高值化的关键共性技术。制备性能优异的晶体材料或产品离不开对结晶过程的控制,晶体成核是结晶过程的重要一步,不仅影响着晶体结构、手性、纯度和粒度分布等产品性能,还影响着结晶工艺的开发与过程放大。因而,研究晶体成核的分子机理从而实现结晶过程的精准调控,具有重要的理论意义与应用价值。
晶体成核的理论研究最早可追溯到1 700s年,Fahrenheit对过冷水的相变研究,并提出了“古老”的成核动力学模型[7],如今发展成为了经典成核理论(Classic Nucleation Theory,CNT)[7];直到1 800s后期,基于过饱和蒸汽相液滴的形成研究,Gibbs为此动力学模型赋予了热力学基础[7];到1 900s早期,Volmer和Weber提出了蒸汽冷凝的动力学机理,为此经典理论建立了动力学基础[8];随后到1 950s,Turnbull和Fisher将CNT应用到了凝聚相的成核研究中[9]。虽然经典成核理论在熔体和溶液成核现象的定性解释方面取得了成功,但是该模型仍无法实现晶体成核的预测。
近年来,随着晶体成核研究的不断发展,越来越多的实验和计算模拟证据表明溶液存在稳定的前驱聚集体,且成核路径可能是2步甚至多步的。这些新现象的发现,极大地推动了成核分子机理的研究,得到了化工、材料、地质、生物和医药等领域研究学者的广泛关注。本论文着重从经典成核理论与非经典成核机理2部分进行综述,介绍经典成核理论的发展及问题,溶液化学与多晶型,非经典成核现象与机理以及成核控制与晶体设计。
1 经典成核理论 1.1 理论发展经典成核理论[7](CNT)认为过饱和体系下团簇的形成是由能量有利的体自由能增加与不利的总表面能升高相互竞争的结果,因此,总自由能(两者加和)取决于团簇的尺寸。当团簇尺寸小于临界值时,表面自由能主导,团簇不稳定趋于溶解,而只有当达到临界晶核尺寸时,体自由能高于表面自由能,团簇才有可能成为晶核,得到进一步生长。对于由n个分子形成的团簇而言[图 1a)],总自由能gn为体自由能gb和表面自由能gs的加和[10],即:

|
| 图 1 晶体成核过程分子团簇形成及其自由能变化 Figure 1 Cluster formation and the free energy change during crystal nucleation |
| |
| ${g_n} = {n_{\rm{b}}}{g_{\rm{b}}} + {n_{\rm{s}}}{g_{\rm{s}}} $ | (1) |
式(1)中,nb和ns分别是团簇体分子数和表面分子数。
团簇与溶液界面张力γ可表示为:
| $\gamma = \frac{{\left( {{g_{\rm{s}}} - {g_{\rm{b}}}} \right)}}{A}{n_{\rm{s}}} $ | (2) |
式(2)中A为团簇表面积。综合式(1)和式(2),可得:
| ${g_n} = n{g_{\rm{b}}} + \mathit{\gamma A} $ | (3) |
式(3)中:gb≡μb=μ0+kBTlnxeq,A=c(nv0)2/3,μ0为参比化学势(选择为溶质的过冷液态),c为形状因子,v0为团簇中分子占有体积,从而,
| ${g_n} = n{\mathit{\mu }_{\rm{b}}} + c\gamma {\left( {n{v_0}} \right)^{2/3}} $ | (4) |
通常认为晶核是通过溶质分子的逐步聚集而形成的[11-12],即:
| $M+M\rightleftharpoons {{M}_{2}} $ |
| $M+{{M}_{2}}\rightleftharpoons {{M}_{3}} $ |
| $\begin{array}{l} M + {M_3}{M_4}\\ \;\;\;\;\;\; \cdots \cdots \end{array} $ |
| $M+{{M}_{{{n}^{*}}-1}}\rightleftharpoons {{M}_{{{n}^{*}}}} $ |
| $M+{{M}_{{{n}^{*}}}}\rightleftharpoons {{M}_{{{n}^{*}}+1}} $ |
在准平衡下,晶核的形成可近似简化为:
| $nM\rightleftharpoons {{M}_{{{n}^{*}}}} $ |
进而,晶核生成过程的总自由能变化ΔG=gn-nμ,单体化学势μ=μ0+kBTlnx,综合式(4)可得:
| $\Delta G = - n{k_{\rm{B}}}T\ln S + c\gamma {\left( {n{v_0}} \right)^{2/3}} $ | (5) |
| ${{n}^{*}}=\frac{8}{27}\frac{{{c}^{3}}{{\gamma }^{3}}v_{0}^{2}}{{{\left( {{k}_{\text{B}}}T\ln S \right)}^{3}}} $ | (6) |
| $\Delta {G_c} = \frac{4}{{27}}\frac{{{c^3}{\gamma ^3}v_0^2}}{{{{\left( {{k_{\rm{B}}}T\ln S} \right)}^2}}} $ | (7) |
由式(7)可知,ΔG取决于团簇大小和过饱和度[图 1b)],当团簇成长为临界簇n*,体系自由能开始下降,团簇成为临界晶核,得以继续生长,团簇转变为晶核的概率取决于临界能垒ΔGc高度与kBT的比值;并且临界团簇大小还取决于体系过饱和度,过饱度越高(Ⅱ>Ⅰ),能垒越低,n*越小,最终导致成核成为自发过程。成核速率故定义为团簇生长超过临界值成长为晶体的速度。
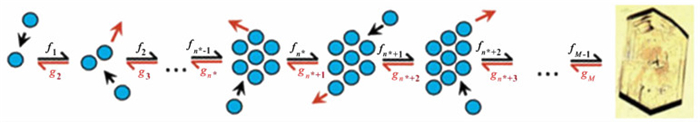
一般认为,成核动力学过程可用Szilard-Farkas的连续附着和脱附机理描述[12-13],图 2描绘了团簇形成的链“反应”模型,fn(s-1)和gn(s-1)分别表示单体附着和脱附的频率,为时间独立的参数且仅取决于体系过饱和度和温度。稳态过程的成核速率J等于临界核n*转化为n* +1超临界核的速率[13],即:
| $J = {f_{{n^ * }}}{X_{{n^ * }}} - {g_{{n^ * } + 1}}{X_{{n^ * } + 1}} = z{f_{{n^ * }}}{C_{{n^ * }}} $ | (8) |
式(8)中,
| $z = \frac{{{X_{{n^*}}}}}{{{C_{{n^*}}}}}\left( {1 - \frac{{{g_{{n^*} + 1}}{X_{{n^*} + 1}}}}{{{f_{{n^*}}}{X_{{n^*}}}}}} \right) = \frac{{\ln \mathit{S}\sqrt {RT} }}{{\sqrt {12{\rm{ \mathit{ π} }}\mathit{\Delta G}{\rm{c}}} }} $ | (9) |
| ${C_{{n^*}}} = {C_0}\exp \left( { - \frac{{\mathit{\Delta }{\mathit{G}_{\rm{c}}}}}{{{k_{\rm{B}}}T}}} \right) $ | (10) |
式(9)~式(10)中,Xn*表示晶核n*的真实浓度,Cn *为临界团簇浓度,C0为成核位点的浓度,对于均相成核近似等于1/v0,z为Zeldovich因子,用于校正临界团簇未能形成晶核的情形[11]。
团簇组装过程中,生长基元需要从溶剂化状态转移至吸附的部分溶剂化的晶核表面,此附着过程可分为体积扩散和界面传递2步。若附着为体积扩散控制,fn*可表达为生长基元向晶核表面的扩散通量(DC/r*,C=SCeq)与表面积c(n*v0)2/3的乘积[11],即:
| ${f_{{n^*}}} = \sqrt {4{\rm{ \mathit{ π} }}\mathit{c}} D{\left( {{n^*}{v_0}} \right)^{1/3}}{C_{{\rm{eq}}}}S $ | (11) |
式(11)中,D为生长基元的扩散系数,Ceq为平衡浓度。若附着为界面传递控制,生长基元可立即与晶核接触,随机跳动一段距离[d0≈(6v0/π)1/3]才能吸附到晶核表面。假设此跳动过程正比于扩散系数和基元的黏附系数λ,附着频率fn *可表达为[11]:
| ${f_{{n^*}}} = {\left( {{\rm{ \mathit{ π} }}{\mathit{v}_{\rm{0}}}/6} \right)^{1/3}}{\rm{ \mathit{ λ} }}\mathit{Dc}{\left( {{n^*}} \right)^{2/3}}{C_{{\rm{eq}}}}S $ | (12) |
综合式(8)~式(12),可得经典成核的速率表达式为:
| $ J = {A_0}S\exp \left( { - B/{\rm{l}}{{\rm{n}}^2}S} \right) $ | (13) |
式(13)中,
| $B = \frac{4}{{27}}\frac{{{c^3}{\mathit{\gamma }^{\rm{3}}}v_0^2}}{{{{\left( {{k_{\rm{B}}}T} \right)}^3}}} $ | (14) |
A0=(c3/27B)1/6DCeqlnS(扩散控制)或A0=(πB2c3/6)1/3λDCeq(界面传递控制)。
1.2 理论缺陷经典成核理论解释了成核的随机性现象,给出了成核动力学描述,经过多年的发展提出了较全面的成核动力学理论模型,但是,预测的成核速率与实验测量结果相差很大。在单组分的蒸汽冷凝成核体系,CNT预测的成核速率比实验值高出1~2个数量级[14];对于醇类蒸气冷凝,实验与预测的比值可以从10-10(甲醇的冷凝)变化到107(正己醇的冷凝)[15]。在单组分结晶体系,CNT预测的晶体成核动力学参数也显著高于实验测量值[8]。
为简化复杂的成核动力学模型,经典成核理论假定分子团簇与宏观晶体具有相同的表面张力,即忽略粒子曲率或大小对表面张力的影响,并且表面能还被假定为温度独立性。然而,研究表明仅含有20~50个分子的团簇或晶核的表面与宏观晶体完全不同,是急剧扭曲的[16]。Yau和Vekilov研究发现对于小于100分子数的团簇而言,其表面张力定义不明确,且晶核的形状不能用球形近似代替[17]。
此外,CNT无法解释某些蛋白质和无机物系的结晶现象[18-19]。在蛋白质、无机物和其它有机物小分子体系中,通过实验和计算模拟手段均发现了成核前溶液体系存在瞬时密集无序液滴或团簇聚集体[20-22],且晶体成核发生在这些密集无序液滴或无定型内部,因而质疑了CNT的单步活化能垒模型。
1.3 多晶型形成有机分子晶体的多晶型现象,由McCrone[23]定义为某一化合物在固态晶体中存在2个及以上不同分子排列的可能性。多晶型由于具有不同的内部晶体结构,常会表现出显著不同的理化性质[24-25]。例如,可可脂能够结晶成5种不同的晶体结构,但每种晶型都表现出不同的口感[26]。因而,多晶型自发现以来,在医药、食品和染料等精细化学品领域备受关注。
早在1822年,Mitscherlich等[27]发现砷酸盐和磷酸盐的不同晶体表现出了不同的物理和化学性质,从而认识到了多晶型的存在;到1832年,Liebig和Wöhler[28]最早研究了有机多晶型化合物——苯甲酰胺,但是由于介稳晶型极不稳定,很快转化为稳定晶型,直到170年后这一介稳晶型的晶体结构才得以确认[29]。在Liebig-Wöhler之后的一个多世纪里,多晶型得到了广泛的研究,许多存在多晶型的物质得以发现[27]。然而,目前对于多晶型的形成机理仍不清楚,晶体结构的准确预测与理性精准制备仍是挑战。
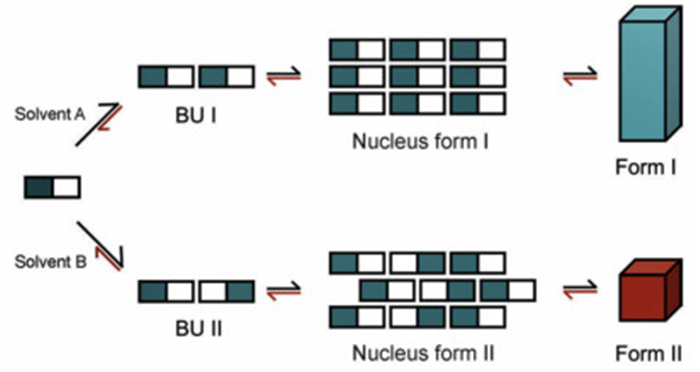
多晶型的形成通常认为是结晶热力学和动力学因素相互影响相互作用的结果[16],然而其微观本质是结晶操作条件对分子组装体结构演变过程的调控作用。在有机物系结晶中,成核发生前溶液存在的自组装体或自缔合体,也称为成核前聚体,此概念最先由Etter[30]和Weissbuch[31]提出,并认为溶液相溶质分子可自组装成不同缔合状态的聚集体,最稳定即含量最多的分子聚集体将被结晶析出。例如,2, 6-二羟基苯甲酸晶体的结晶研究发现:在甲苯溶液中溶质主要以氢键羧酸二聚体为主,结晶形成了基于此二聚体结构基元的晶型Ⅰ;而在氯仿溶液中主要以氢键连环体形式存在,从而导致了基于连环体为结构基元的晶型Ⅱ成核[32]。丁炔酸也观测到了类似的现象[33],氢键二聚体存在于氯仿中,形成了基于二聚体的多晶型;在乙醇中不存在此二聚体,基于连环体的晶型被结晶析出。此外,研究学者还发现许多类似的案例,如卡马西平在甲醇和氯仿[34],磺酰胺类化合物在丙酮[35],α-肌苷在水[36],异烟酰胺在甲醇和硝基甲烷[37]。这些案例均表明了溶剂影响了溶质自缔合进而造成了不同多晶型的成核。如图 3所示,溶液前聚体与晶体生长基元结构存在对应关系,表明了经典成核理论的适用性,但是,在许多其它物系中这一对应关系缺失。
溶液化学是连接分子与晶体的重要桥梁,为从结构角度揭示成核过程的分子路径提供了一条重要的研究途径,是理解与控制结晶过程的重要环节。传统溶液化学研究受限于高分辨仪器分析与高精度计算模拟手段,未能受到广泛的关注,造成结晶过程与晶体工程研究中存在一个“黑洞”。近年来,溶液化学在研究溶液聚集体、分子构象和溶液结构与晶体成核和生长关系以及成核分子机理的揭示方面扮演着愈发重要的角色。
为探究溶液前聚体与多晶型结晶关联,汤等[38]采用溶液FTIR、NMR、二维DOSY和NOESY手段系统分析研究了托灭酸在DMF、乙醇和甲苯3种不同极性溶剂体系下的分子聚集过程及其与托灭酸多晶型结晶关联,研究结果表明:托灭酸在强极性和非极性溶剂体系下,溶质前聚体均与成核多晶型存在关联,但在中等极性乙醇体系下,这一结构关联缺失,表明存在非经典成核路径。在苯甲酸-甲醇、扁桃酸-硝基甲烷、乙腈和甲醇、肌苷水合物-水等结晶体系中[13],研究学者也会观察到前聚体与成核多晶型的结构关联。
然而,还有些案例就是否存在溶液聚集体饱受争议,其中典型案例是甘氨酸在水中环状二聚体的形成[2, 39-42]。原子力显微镜AFM和掠入射X射线衍射GID研究表明甘氨酸在水中存在大量的环状氢键二聚体,是形成基于此结构基元α晶型的主要原因[41]。注意这一推论主要基于晶-液界面生长的观测。Myerson等[39-40]测量了甘氨酸在纯水中的互扩散系数,结果也表明了甘氨酸二聚体大量存在于水中,实验还发现了过饱和溶液的扩散系数随时间增加而减小,此下降趋势被解释为扩散系数在双节点处为有限值而在旋节点处为零,会随着过饱和溶液维持时间的增加而出现突变。但是Huang等[42]通过凝固点和扩散系数测量在过饱和溶液中并未发现大量二聚体的存在,甘氨酸主要以溶剂化单体存在于水溶液中,并且发现扩散系数不随过饱和溶液的维持时间而变化。汤等[43]结合溶液FTIR、NMR光谱与计算模拟手段,发现甘氨酸二聚体在水溶液中含量仅约为18%,并且以开环二聚体构型存在。除了在二聚体水平,汤等[44]借助1D-NMR和2D-DOSY手段,还发现了苯甲酸四聚体,苯甲酸分子首先形成羧酸-羧酸氢键二聚体,随后在高浓度下通过更弱的芳环π-π堆积相互作用形成四聚体,如图 4所示。
溶液化学途径可从热力学角度解释多晶型的成核机理,尤其是溶剂、温度和pH值的影响[45-47],然而,很难获得结晶动力学演变信息。
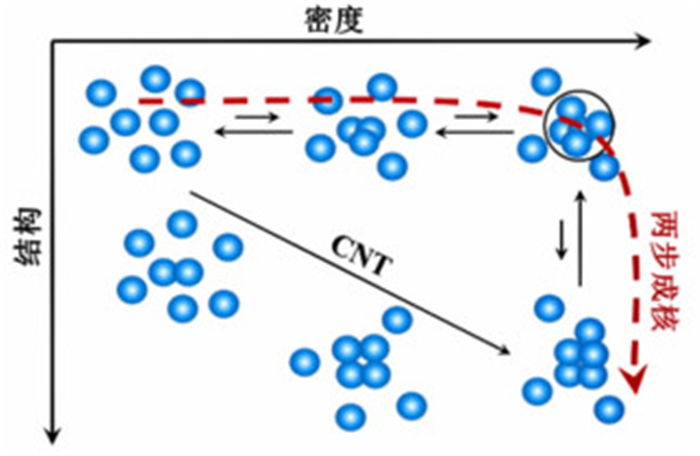
2 非经典成核机理 2.1 两步成核机理一些蛋白质和无机物结晶的计算模拟[48-49]和实验研究[18, 50-51]表明了成核过程至少包含2步:溶质分子堆积形成密集无序的团簇,以及随后无序团簇经过重组形成晶核。这一成核机理与主张密度和结构同时演变的CNT存在本质差异(图 5)。堆积结构形成前的过渡相的存在不仅常见于大分子体系[52],也发现于少许小分子体系[53]。甘氨酸水溶液的非光化学激光诱导成核(non-photochemical laser induced nucleation,NPLIN)研究发现激光脉冲的强度不仅可以增加成核的速率,而且改变激光的极化状态可以调控甘氨酸多晶型的成核,结果表明了成核前团簇分子存在重排,进而佐证了二步成核机理[54]。
|
| 图 5 两步成核机理与CNT对比示意图 Figure 5 A comparison of nucleation pathways between two-step mechanism and CNT |
| |
基于温度和浓度依赖的团簇生成速度u0(C, T)假设,Vekilov等[55]提出了两步成核的动力学模型,即:
| $0\rightleftharpoons 1\to 2 $ |
模型假设密集无序团簇的形成是动力学可逆过程,即溶质分子(状态0)可堆积形成无序团簇(状态1),同时团簇又可以速度u1(T)溶解,团簇亦或以速度u2(T)转变为有序的晶核(状态2),晶核进一步生长为宏观晶体。图 6描述了此过程的自由能演变图。若定义体系在时间t处状态Ω=0,1和2下的概率为PΩ(t),则稳态下形成一个晶核的平均时间τ可定义为:
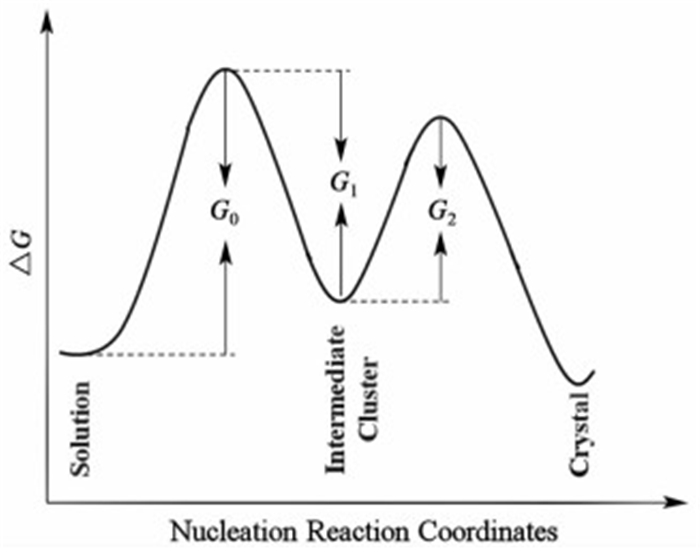
|
| 图 6 二步成核机理的自由能演变示意图 Figure 6 Free energy along nucleation pathway of crystals from solution for two-step nucleation mechanism |
| |
| ${\rm{ \mathit{ τ} = }}\int_0^\infty {t\left[{\frac{{{\rm{d}}{P_2}\left( t \right)}}{{{\rm{d}}\mathit{t}}}} \right]{\rm{d}}\mathit{t}} $ | (15) |
从而,从状态0到状态2转变的参数τ为:
| ${\rm{ \mathit{ τ} = }}\frac{1}{{{u_0}\left( {C, T} \right)}} + \frac{{{u_1}\left( T \right)}}{{{u_0}\left( {C, T} \right){u_2}\left( T \right)}} + \frac{1}{{{u_2}\left( T \right)}} $ | (16) |
式(16)中uΩ=UΩexp(-EΩ/RT),稳态成核速率可通过一级近似计算,即J=1/τ,得到:
| $J = \frac{{{U_0}{U_2}\exp \left( {\frac{{{G_0} + {G_2}}}{{RT}}} \right)}}{{{U_0}\exp \left( { - \frac{{{G_0}}}{{RT}}} \right) + {U_1}\exp \left( { - \frac{{{G_1}}}{{RT}}} \right) + {U_2}\exp \left( { - \frac{{{G_2}}}{{RT}}} \right)}} $ | (17) |
式(17)中,U0、U1和U2分别代表过渡态团簇形成、消亡以及有序晶核形成动力学过程的指前因子,G0、G1和G2分别为相应的动力学能垒。
两步成核机理辅助解释了某些蛋白质体系的结晶动力学现象,但是其应用局限于溶液中无序团簇的形成。尽管已有些蛋白质体系和碳酸钙溶液报道存在此种密集无序团簇,然而并非所有体系,并且对于过渡相的密集无序团簇的定义模糊。因模型假设旋节点去组成是形成类似于过冷溶质的密集无序团簇的原因,未考虑到微观溶质-溶剂相互作用,不能解释溶剂依赖的多晶型成核现象[56]。此外,把液-液相分离作为二步成核密集无序团簇形成的证据,也受到了广泛的质疑[13]。
2.2 团簇成核前驱体机理近年来,越来越多的证据表明无机物体系,如碳酸钙[20]和磷酸钙[57-58],在未饱和、过饱和溶液中均存在稳定的聚集体,也被称为团簇成核前驱体(pre-nucletaion clusters,PNCs)[19],并参与相分离过程[59]。这些聚集体的发现与CNT的单体缔合形成不稳定的团簇假定相悖,因而PNCs机理属于非经典成核机理。
如图 7所示,与经典成核理论不同,PNCs机理认为稳定溶液前聚体不会通过单体的逐渐累加形成晶核,而是通过聚集体团簇间的碰撞聚结形成较大的固体无定型,随后无定型内部分子结构重组形成结晶相,进而生长为宏观晶体。
PNCs也与两步成核机理不同,前者认为稳定的结构有序的溶质自缔合体是晶核形成的前体,而后者则认为不稳定的、密集无序的新中间相(过渡相)是成核的前体,且认为微观或宏观的液-液相分离是形成晶核的必须步骤。PNCs认为溶液聚集体不一定是随机堆积的,并且溶液聚集体结构可能与最终晶体结构相似,因而在解释多晶型方面展现了较大潜力。但是,目前报道的聚集体主要见于无机物系[19],在有机物系中报道较少且多为二聚体[22]。
3 成核控制与晶体设计在晶体工程领域中,为了实现晶体材料结构与性能的理性设计和可控制备,著名晶体工程学家Desiraju等[60]提出了超分子合成子的概念,将晶体形成过程比作超分子“合成”过程,并将晶体结构的最小构筑单元称为超分子合成子。超分子合成子概念在晶体材料设计制备中,取得了显著的成功与应用。例如,将氢键和卤键合成子应用到共晶的设计、筛选与制备中,研究学者成功获得一系列新型的共晶材料[61-62]。但是,对于2种及以上复杂合成子体系,由于晶体成核分子组装方式与机理不清晰,无法利用合成子系统实现晶体的理性设计与目标晶体结构与性能的制备。
研究表明,若溶液中存在2种及以上合成子,如羧酸-羧酸和羧酸-吡啶氢键合成子,氢键和卤键合成子,以及氢键与π…π合成子,合成子彼此之间不仅存在相互竞争关系,还存在一定的协同作用,这种竞争与协同共同决定着特定晶体结构的形成[63-65]。丁炔酸和醋酸在CCl4溶液中的分子动力学模拟发现,溶质分子不仅能形成氢键相互作用更强的环状聚集体,也会形成相互作用更弱的氢键链,表明了相互作用力的层级性在分子组装过程中的重要性[66-67]。结晶条件(如溶剂、温度和过饱和度)的改变常会影响分子的缔合与聚集,进而可能会形成具有特定前聚体结构的多晶型[16, 68]。如羧酸化合物在非极性溶剂中常形成羧酸氢键二聚体,导致某一晶型的形成;而在极性强溶剂化环境下,这种缔合结构将会被破坏,形成其它晶型[69-71]。利用这种对应关系,Kulkarni等[72]通过控制溶剂氢键受体与供体的能力,成功制备得到异酰胺晶型Ⅰ、Ⅱ、Ⅳ以及无分子间缔合的新晶型Ⅵ。Davey等[73]使用类似的方法成功制备得到了丁炔酸的二氧六环溶剂化物新晶型。
4 总结与展望晶体成核研究虽已经历了数百年的发展,然而,时至今日晶体成核的理论仍有待进一步完善。经典成核理论与非经典成核机理的主要争论焦点在于密度有序是否与结构有序同步形成。前者认为两者是同步的,而后者则认为密度有序先于结构有序的发生。因而,进一步探索晶体成核过程的结构演变规律与分子机制已成为晶体成核未来研究的发展趋势。
尽管在蛋白质和无机物体系,已经发现了越来越多的证据表明非经典成核机理的适用性,然而,在有机小分子结晶体系中,晶体成核是否遵从两步机理或PNCs路径,仍缺少直接证据,且溶液化学在揭示晶体成核机理方面的研究尚处于初期研究阶段。
晶体成核机理的理论研究将为晶体材料或产品的理性设计与精准制备提供新的科学依据和理论基础,因此将会在晶体工程、结晶分离、新材料、新药研发等领域具有广阔的应用价值。
| [1] | Khamar D, Zeglinski J, Mealey D, et al. Investigating the role of solvent-solute interaction in crystal nucleation of salicylic acid from organic solvents[J]. Journal of the American Chemical Society, 2014, 136(33): 11664–11673. DOI: 10.1021/ja503131w |
| [2] | Chattopadhyay S, Erdemir D, Evans J M B, et al. SAXS study of the nucleation of glycine crystals from a supersaturated solution[J]. Crystal Growth & Design, 2005, 5(2): 523–527. |
| [3] | Jackson R N, Golden S M, van Erp P B G, et al. Crystal structure of the CRISPR RNA-guided surveillance complex from Escherichia coli[J]. Science, 2014, 345(6203): 1473–1479. DOI: 10.1126/science.1256328 |
| [4] | Mulepati S, Heroux A, Bailey S. Crystal structure of a CRISPR RNA-guided surveillance complex bound to a ssDNA target[J]. Science, 2014, 345(6203): 1479–1484. DOI: 10.1126/science.1256996 |
| [5] | Zhao S, Gong P, Luo S, et al. Beryllium-Free Rb3Al3B3O10F with reinforced inter layer bonding as a deep-ultraviolet nonlinear optical crystal[J]. Journal of the American Chemical Society, 2015, 137(6): 2207–2210. DOI: 10.1021/ja5128314 |
| [6] | Schiotz J, DiTolla F D, Jacobsen K W. Softening of nanocrystalline metals at very small grain sizes[J]. Nature, 1998, 391(6667): 561–563. DOI: 10.1038/35328 |
| [7] | Mullin J W. Crystallization[M]. Oxford: Butterworth-Heinemann, 2001. |
| [8] | Davey R J, Schroeder S L M, ter Horst J H. Nucleation of organic crystalsa molecular perspective[J]. Angewandte Chemie-International Edition, 2013, 52(8): 2166–2179. DOI: 10.1002/anie.201204824 |
| [9] | Kelton K F, Frenkel D. Preface:Special topic on nucleation:New concepts and discoveries[J]. Journal of Chemical Physics, 2016, 145(21): 211501. DOI: 10.1063/1.4967522 |
| [10] | Davey R J, Garside J. From molecules to crystallizers[M]. Oxford: Butterworth-Heinemann, 2000. |
| [11] | Kashchiev D. Nucleation:Basic theory with applications[M]. Oxford: Butterworth-Heinemann, 2000. |
| [12] | Kashchiev D, van Rosmalen G M. Review:Nucleation in solutions revisited[J]. Crystal Resesrch Technology, 2003, 38(7/8): 555–574. |
| [13] | Davey R J, Schroeder S L, ter Horst J H. Nucleation of organic crystals-A molecular perspective[J]. Angewandte Chemie-International Edition, 2013, 52(8): 2166–2179. DOI: 10.1002/anie.201204824 |
| [14] | Sharaf M A, Dobbins R A. A comparison of measured nucleation rates with the predictions of several theories of homogeneous nucleation[J]. Journal of Chemical Physics, 1982, 77(3): 1517–1526. DOI: 10.1063/1.443932 |
| [15] | Strey R, Wagner P E, Schmeling T. Homogeneous nucleation rates for n-alcohol vapors measured in a two-piston expansion chamber[J]. Chemischer Informationsdienst, 1986, 17(27): 2325–2335. |
| [16] | Bernstein J, Davey R J, Henck J O. Concomitant polymorphs[J]. Angewandte Chemie International Edition, 1999, 38(23): 3440–3461. DOI: 10.1002/(SICI)1521-3773(19991203)38:23<>1.0.CO;2-U |
| [17] | Desiraju G R. Crystal engineering:Outlook and prospects[J]. Currentence, 2001, 81(8): 1038–1042. |
| [18] | Erdemir D, Lee A Y, Myerson A S. Nucleation of crystals from solution:Classical and two-step models[J]. Accounts of Chemical Research, 2009, 42(5): 621–629. DOI: 10.1021/ar800217x |
| [19] | Gebauer D, Kellermeier M, Gale J D, et al. Pre-Nucleation clusters as solute precursors in crystallisation[J]. Chemical Society Reviews, 2014, 43(7): 2348–2371. DOI: 10.1039/C3CS60451A |
| [20] | Gebauer D, Völkel A, Cölfen H. Stable prenucleation calcium carbonate clusters[J]. Science, 2008, 322(5909): 1819–1822. DOI: 10.1126/science.1164271 |
| [21] | Myerson A S, Trout B L. Nucleation from solution[J]. Science, 2013, 341(6148): 855–856. DOI: 10.1126/science.1243022 |
| [22] | Vekilov P G. Nucleation[J]. Crystal Growth & Design, 2010, 10(12): 5007–5019. |
| [23] | McCrone W C. Polymorphism[J]. Physics and chemistry of the organic solid state, 1965, 2: 725–767. |
| [24] | Byrn S R, Pfeiffer R R, Stowell J G. Solid-State chemistry of drugs[J]. Indiana:SSCI Inc, 1999. |
| [25] | Brittain H G. Polymorphism in pharmaceutical solids[M]. New York: CRC Press, 2009. |
| [26] | Peschar R, Pop M M, De Ridder D J A, et al. Crystal structures of 1, 3-distearoyl-2-oleoylglycerol and cocoa butter in the β(V) phase reveal the driving force behind the occurrence of fat bloom on chocolate[J]. Journal of Physical Chemistry B, 2004, 108(40): 15450–15453. DOI: 10.1021/jp046723c |
| [27] | Cruz-Cabeza A J, Bernstein J. Conformational polymorphism[J]. Chemical Reviews, 2014, 114(4): 2170–2191. DOI: 10.1021/cr400249d |
| [28] | Liebig J, Wohler F. Untersuchungen iiber das Radical der Benzoesaure[J]. Pharm Anntiinflam, 1832, 249: 514. |
| [29] | David W I F, Shankland K, Pulham C R, et al. Polymorphism in benzamide[J]. Angewandte Chemie-International Edition, 2005, 44(43): 7032–7035. DOI: 10.1002/(ISSN)1521-3773 |
| [30] | Etter M C. Hydrogen bonds as design elements in organic chemistry[J]. Journal of Physical Chemistry B, 1991, 95(12): 4601–4610. DOI: 10.1021/j100165a007 |
| [31] | Weissbuch I, Meir Lahav A, Leiserowitz L. Toward stereochemical control, monitoring, and understanding of crystal nucleation[J]. Crystal Growth & Design, 2003, 3(2): 125–150. |
| [32] | Davey R J, Blagden N, Righini S, et al. Crystal polymorphism as a probe for molecular self-assembly during nucleation from solutions:The case of 2, 6-dihydroxybenzoic acid[J]. Crystal Growth & Design, 2001, 1(1): 59–65. |
| [33] | Parveen S, Davey R J, Dent G, et al. Linking solution chemistry to crystal nucleation:The case of tetrolic acid[J]. Chemical Communications, 2005, 12(12): 1531. |
| [34] | Hunter C A, McCabe J F, Spitaleri A. Solvent effects of the structures of prenucleation aggregates of carbamazepine[J]. Cryst Eng Comm, 2012, 14(21): 7115–7117. DOI: 10.1039/c2ce25941a |
| [35] | Spitaleri A, Hunter C A, Mccabe J F, et al. A 1H NMR study of crystal nucleation in solution[J]. Crystal Engineering Communication, 2004, 6(80): 489–493. DOI: 10.1039/b407163h |
| [36] | Chiarella R A, Gillon A L, Burton R C, et al. The nucleation of inosine:The impact of solution chemistry on the appearance of polymorphic and hydrated crystal forms[J]. Faraday Discussions, 2007, 136(1): 179–193. |
| [37] | Kulkarni S A, Mcgarrity E S, Meekes H, et al. Isonicotinamide self-association:The link between solvent and polymorph nucleation[J]. Chemical Communications, 2012, 48(41): 4983–4985. DOI: 10.1039/c2cc18025a |
| [38] | Tang W, Mo H, Zhang M, et al. Persistent self-association of solute molecules in solution[J]. Journal of Physical Chemistry B, 2017, 121(43): 10118–10124. DOI: 10.1021/acs.jpcb.7b07763 |
| [39] | Chang Y, Myerson A S. Diffusivity of glycine in concentrated saturated and supersaturated aqueous solutions[J]. AIChE J, 1986, 32(9): 1567–1569. DOI: 10.1002/(ISSN)1547-5905 |
| [40] | Myerson A S, Lo P Y. Diffusion and cluster formation in supersaturated solutions[J]. Journal of Crystal Growth, 1990, 99(1/4): 1048–1052. |
| [41] | Gidalevitz D, Feidenhans'l R, Matlis S, et al. Monitoring in situ growth and dissolution of molecular crystals:Towards determination of the growth units[J]. Angewandte Chemie-International Edition, 1997, 36(9): 955–959. DOI: 10.1002/(ISSN)1521-3773 |
| [42] | Huang J, Stringfellow T C, Yu L. Glycine exists mainly as monomers, not dimers, in supersaturated aqueous solutions:Implications for understanding its crystallization and polymorphism[J]. Journal of the American Chemical Society, 2008, 130(42): 13973–13980. DOI: 10.1021/ja804836d |
| [43] | Tang W, Mo H, Zhang M, et al. Glycine's pH-dependent polymorphism:A perspective from self-association in solution[J]. Crystal Growth & Design, 2017, 17(10): 5028–5033. |
| [44] | Tang W, Zhang M, Mo H, et al. Higher-Order self-assembly of benzoic acid in solution[J]. Crystal Growth & Design, 2017, 17(10): 5049–5053. |
| [45] | Threlfall T. Crystallisation of polymorphs:Thermodynamic insight into the role of solvent[J]. Organic Process Research & Development, 2000, 4(5): 384–390. |
| [46] | Lahav M, Leiserowitz L. The effect of solvent on crystal growth and morphology[J]. Chemical Engineering Science, 2001, 56(7): 2245–2253. DOI: 10.1016/S0009-2509(00)00459-0 |
| [47] | Long S, Parkin S, Siegler M A, et al. Polymorphism and phase behaviors of 2-(phenylamino)nicotinic acid[J]. Crystal Growth & Design, 2008, 8(11): 4006–4013. |
| [48] | Wallace A F, Hedges L O, Fernandezmartinez A, et al. Microscopic evidence for liquid-liquid separation in supersaturated CaCO3 solutions[J]. Science, 2013, 341(6148): 885–889. DOI: 10.1126/science.1230915 |
| [49] | Shore J D, Perchak D, Shnidman Y. Simulations of the nucleation of AgBr from solution[J]. Journal of Chemical Physics, 2000, 113(15): 6276–6284. DOI: 10.1063/1.1308517 |
| [50] | Vekilov P G. Dense liquid precursor for the nucleation of ordered solid phases from solution[J]. Crystal Growth & Design, 2004, 4(4): 671–685. |
| [51] | Galkin O, Pan W, Filobelo L, et al. Two-Step mechanism of homogeneous nucleation of sickle cell hemoglobin polymers[J]. Biophysical Journal, 2007, 93(3): 902–913. DOI: 10.1529/biophysj.106.103705 |
| [52] | Asherie N, Lomakin A, Benedek G B. Phase diagram of colloidal solutions[J]. Physical Review Letters, 1996, 77(23): 4832–4835. DOI: 10.1103/PhysRevLett.77.4832 |
| [53] | Sommerdijk N A J M, With G D. Biomimetic CaCO3 mineralization using designer molecules and interfaces[J]. Chemical Reviews, 2008, 108(11): 4499–4550. DOI: 10.1021/cr078259o |
| [54] | Garetz B A, Matic J, Myerson A S. Polarization switching of crystal structure in the nonphotochemical light-induced nucleation of supersaturated aqueous glycine solutions[J]. Physical Review Letters, 2002, 89(17): 175501. DOI: 10.1103/PhysRevLett.89.175501 |
| [55] | Pan W, Kolomeisky A B, Vekilov P G. Nucleation of ordered solid phases of proteins via a disordered high-density state:Phenomenological approach[J]. The Journal of Chemical Physics, 2005, 122(17): 174905. DOI: 10.1063/1.1887168 |
| [56] | Chen J, Sarma B, Evans J M B, et al. Pharmaceutical crystallization[J]. Crystal Growth & Design, 2011, 11(4): 887–895. |
| [57] | Betts F, Posner A S. An X-ray radial distribution study of amorphous calcium phosphate[J]. Materials Research Bulletin, 1974, 9(3): 353–360. DOI: 10.1016/0025-5408(74)90087-7 |
| [58] | And K O, Atsuo I. Cluster growth model for hydroxyapatite[J]. Chemistry of Materials, 1998, 10(11): 3346–3351. DOI: 10.1021/cm980062c |
| [59] | Gebauer D, Cölfen H. Prenucleation clusters and non-classical nucleation[J]. Nano Today, 2011, 6(6): 564–584. DOI: 10.1016/j.nantod.2011.10.005 |
| [60] | Desiraju G R. Supramolecular synthons in crystal engineering-A new organic synthesis[J]. Angewandte Chemie International Edition, 1995, 34(21): 2311–2327. DOI: 10.1002/(ISSN)1521-3773 |
| [61] | Duggirala N K, Perry M L, Almarsson O, et al. Pharmaceutical cocrystals:Along the path to improved medicines[J]. Chemical Communications, 2016, 52(4): 640–655. DOI: 10.1039/C5CC08216A |
| [62] | Qiao N, Li M, Schlindwein W, et al. Pharmaceutical cocrystals:An overview[J]. International journal of pharmaceutics, 2011, 419(1): 1–11. |
| [63] | Dunitz J D, Gavezzotti A. Supramolecular synthons:Validation and ranking of intermolecular interaction energies[J]. Crystal Growth & Design, 2012, 12(12): 5873–5877. |
| [64] | Aakeröy C B, Baldrighi M, Desper J, et al. Supramolecular hierarchy among halogen-bond donors[J]. Chemistry, 2013, 19(48): 16240–16247. DOI: 10.1002/chem.v19.48 |
| [65] | Aakeröy C B, Epa K N, Forbes S, et al. Competing hydrogen-bond donors:Phenols vs. cyanooximes[J]. Cryst Eng Comm, 2013, 15(30): 5946–5949. DOI: 10.1039/c3ce41023d |
| [66] | Gavezzotti A. Molecular aggregation of acetic acid in a carbon tetrachloride solution:A molecular dynamics study with a view to crystal nucleation[J]. Chemistry-A European Journal, 1999, 5(2): 567–576. DOI: 10.1002/(ISSN)1521-3765 |
| [67] | Gavezzotti A, Filippini G, Kroon J, et al. The crystal polymorphism of tetrolic acid (CH3C-CCOOH):A molecular dynamics study of precursors in solution, and a crystal structure generation[J]. Chemistry-A European Journal, 1997, 3(6): 893–899. DOI: 10.1002/(ISSN)1521-3765 |
| [68] | Bernstein J. Polymorphism in molecular crystals[M]. Oxford University Press, 2008. |
| [69] | Reeves L W. Studies of hydrogen bonding in carboxylic acids[J]. Transactions of the Faraday Society, 1959, 55: 1684–1688. DOI: 10.1039/tf9595501684 |
| [70] | Gavezzotti A, Filippini G. Geometry of the intermolecular X-H…Y (X, Y=N, O) hydrogen bond and the calibration of empirical hydrogen-bond potentials[J]. Journal of Physical Chemistry, 1994, 98(18): 4831–4837. DOI: 10.1021/j100069a010 |
| [71] | Bernstein J, Davis R E, Shimoni L, et al. Patterns in hydrogen bonding:Functionality and graph set analysis in crystals[J]. Angewandte Chemie International Edition, 1995, 34(15): 1555–1573. DOI: 10.1002/(ISSN)1521-3773 |
| [72] | Kulkarni S, McGarrity E, Meeks H, et al. Isonicotinamide self-association:The link between solvent and polymorph nucleation[J]. Chemical Communications, 2012, 48(41): 4983–4985. DOI: 10.1039/c2cc18025a |
| [73] | Parveen S, Davey R, Dent G, et al. Linking solution chemistry to crystal nucleation:the case of tetrolic acid[J]. Chemical Communications, 2005(12): 1531–1533. DOI: 10.1039/b418603f |
 2018, Vol. 35
2018, Vol. 35