2. 化学工程联合国家重点实验室(天津大学);
3. 天津市膜科学与海水淡化技术重点实验室, 天津 300072
2. State Key Laboratory of Chemical Engineering, Tianjin 300072, China;
3. Tianjin Key Laboratory of Membrane Science and Desalination Technology, Tianjin 300072, China
进入21世纪后,人类面临着越来越严重的经济增长和环境保护双重压力。化石燃料不可再生,还会造成环境污染,寻找开发方便实用的清洁能源迫在眉睫。生物质作为一种分布广泛、方便取用、污染低的新型可再生资源,受到广泛关注。其中,由生物质制备高附加值化学品成为近年来研究的热点之一[1-2]。
在众多生物基化学品中,5-羟甲基糠醛(5-HMF),是一种重要的平台化学品。5-HMF结构中具有醛、羟基和呋喃环,性质比较活泼,可通过后续催化转化合成一系列重要的生物基材料单体或作为高分子塑料的原材料[1-2]。例如,选择性氧化5-HMF可生成2, 5-呋喃二甲酸(FDCA),FDCA是制备聚对苯二甲酸乙二醇酯(PET)和聚对苯二甲酸丁二醇酯(PBT)等聚酯纤维的原材料[3],被美国能源部确认为用于建立未来“绿色”化学工业的12种优先化合物之一。因此,5-HMF的制备成为了生物质领域研究的热点[4]。
已有文献报道,多种生物质都可以通过不同的路径生成5-HMF,较典型的反应路径为:纤维素、淀粉等大分子原料,通过酸解、酶解等一系列反应,生成己糖(包括葡萄糖和果糖),其中葡萄糖通过异构化可以转化为果糖,果糖在氢离子(酸性)的作用下能够生成特定中间体,进一步脱水生成5-HMF[5]。反应介质主要为水、有机溶剂或离子液体,由于5-HMF在水中易发生水解反应,离子液体虽然收率高但价格昂贵,因此目前研究多以水和有机溶剂的混合反应体系为主。常用的催化剂有固体酸催化剂(TiO2、ZrO2等)[6-9]和均相酸催化剂(盐酸、硫酸、磷酸等无机酸和草酸、甲酸等有机酸)[10],而均相酸催化剂存在相对严重的污染问题。
芬顿试剂由H2O2和Fe2+组成,二者相互作用,形成Fe3+和·OH羟基自由基,具有超强的氧化能力[11],被广泛应用在工业废水和生活污水的处理中[12],同时也用于很多复杂生物质原料的预处理,例如芬顿法预处理木质纤维素,可使后继酶解反应更加高效[13]。芬顿试剂可以降解大分子生物质,自身又具有酸性,因此合理调控芬顿试剂的氧化能力和酸性,有可能将其开发为一种由糖类原料制备5-HMF的催化剂。
本研究以淀粉、葡萄糖和果糖为原料,以H2O2和Fe2+组成的芬顿试剂为催化剂,水-正丁醇双相体系为溶剂[14-15],考察了不同温度、时间、溶剂比例、芬顿试剂加入量对5-HMF收率的影响,获得了理想的工艺条件,并探讨了芬顿试剂催化糖类制备5-HMF的原理,该催化体系可为5-HMF的制备提供新的思路。
1 实验材料与方法 1.1 试剂葡萄糖、淀粉[分析纯,> 99%(质量分数,下同),天津科威试剂有限公司];D-果糖(分析纯,> 99%,阿拉丁科技有限公司);5-HMF(分析纯,> 99%,阿拉丁试剂有限公司);浓盐酸(70%,天津市光复精细化工研究所);正丁醇(色谱纯,> 99%,天津市光复精细化工研究所);氯化亚铁(分析纯,天津市光复精细化工研究所);双氧水(分析纯,30%,天津市元立化工有限公司);其他试剂均为分析纯,市售。
1.2 仪器电子天平(精度为0.1 mg),Sartotius BT125D型,瑞士;真空干燥箱,上海一恒科学仪器有限公司;反应釜,25 mL水热合成釜,东台市中凯亚不锈钢制品厂;高效液相色谱系统(HPLC):Agilent公司,1200Series高效液相色谱仪;HPX-87H(300×7.8 mm)色谱柱,美国Bio-Rad公司,柱温箱温度为338 K;示差折光检测器,日本SHODEX公司;恒温磁力搅拌器:上海沪西分析仪器厂,90-1型。
1.3 芬顿法反应步骤向25 mL反应釜中依次加入指定量蒸馏水、正丁醇作为溶剂[15],0.2 g反应物(淀粉、葡萄糖或果糖),指定量FeCl2和H2O2,10 μL浓盐酸,测试pH值为3~5之间[16],加入磁力转子后密封,放入已设定好温度的油浴锅中反应。反应指定时间后将反应釜置于冰水中迅速降至室温,然后将反应液全部倒入分液漏斗,静置分层,记录下层水相体积V水和上层油相体积V油,待分析。
1.4 分析方法首先绘制5-HMF和果糖标准曲线,配制不同浓度的5-HMF、果糖标准溶液,进高效液相色谱分析测定,流动相:0.004 mol·L-1 H2SO4,流速:0.6 mL·min-1,进样量:20 μL,进样前样品需用0.45 μm微滤膜过滤。将标准溶液依次进样,以5-HMF和果糖浓度为横坐标,以峰面积为纵坐标,得到拟合方程,绘制标准曲线。
取油相和水相反应液适量分别进行测定。根据5-HMF标准曲线拟合方程计算得到两相中5-HMF的浓度,由式(1)计算反应液中5-HMF的收率,根据果糖标准曲线拟合方程计算果糖浓度,由式(2)计算果糖的转化率。
| $ Y = \frac{{({V_{\rm{水}}} \times {C_{\rm{水}}} + {V_{\rm{ 油 }}} \times {C_{\rm{油}}}) \times 0.001 \times M}}{{126 \times m}} $ | (1) |
| $ X = 1-\frac{{({V_{\rm{水}}} \times {f_{\rm{水}}} + {V_{\rm{油}}} \times {f_{\rm{油}}}) \times 0.001}}{m} $ | (2) |
| $ Z = \frac{Y}{X} $ | (3) |
式(1)~(3)中,Y是以淀粉、果糖和葡萄糖为底物反应时5-HMF的收率,X是转化率,Z是反应选择性;V水和V油是反应液水相和油相最终体积,mL;C水和C油是由拟合标准曲线计算得到的水、油两相中5-HMF的浓度,f水和f油是由拟合标准曲线计算得到的水、油两相中果糖的浓度,g·L-1;m是反应底物的质量,0.2 g;M是反应底物的相对分子质量,以葡萄糖和果糖为底物时,M为180,以淀粉为底物时,M为162(淀粉结构单体的相对分子质量);“126”是5-HMF的相对分子质量。
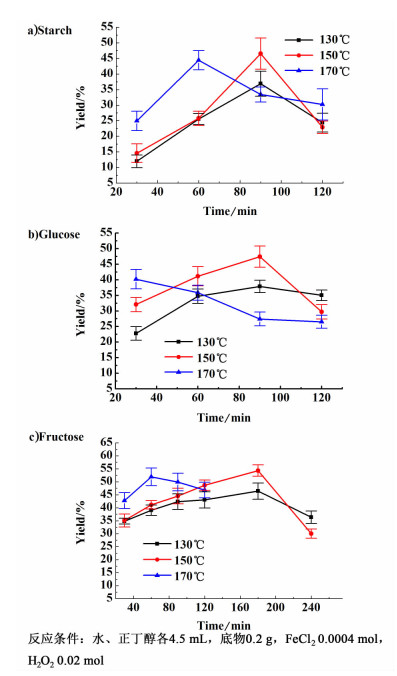
2 结果与讨论 2.1 温度和时间对反应效率的影响在糖类制备5-HMF的过程中,反应温度和反应时间对5-HMF的收率有很大影响,因此对这2个因素进行了考察。在130、150和170 ℃ 3个温度下反应不同时间,5-HMF的收率结果如图 1所示。
|
| 图 1 温度和时间对芬顿试剂催化糖类制备5-HMF收率的影响 Figure 1 Effects of temperature and time on 5-HMF yield of carbohydrate-to-5-HMF reaction via Fenton |
| |
由图 1a)可知,在以淀粉为底物制备5-HMF时,反应30 min,3个温度下5-HMF收率分别只达到12.0%,14.6%和24.9%,之后随着时间延长,5-HMF收率逐渐达到最高值,150 ℃下反应90 min为最适宜反应条件,此时5-HMF收率为46.5%。这是由于随着时间延长,淀粉逐步降解为葡萄糖,葡萄糖又异构化为果糖,进而脱水生成了5-HMF。5-HMF收率达到峰值后继续延长反应时间,收率开始下降,说明5-HMF水解和交联聚合的副反应加剧,降低了5-HMF的收率[2]。葡萄糖作为淀粉水解的单糖,一直是制备5-HMF的重要原料。如图 1b)所示,在170 ℃时,5-HMF收率随着时间延长不断降低;在150和130 ℃下,5-HMF收率随时间延长先升高后降低,在150 ℃、反应90 min时达到最高值47.4%,与淀粉制备5-HMF的收率基本持平。果糖是制备5-HMF最有效的反应物[17],果糖在氢离子(酸性)作用下可生成特定的中间体,之后经多步脱水生成5-HMF,目前文献中报道的5-HMF最高收率来自果糖降解[18]。如图 1c)所示,在3个温度下,随时间的延长5-HMF收率均呈现先升高后降低的趋势,并在150 ℃反应180 min的条件下达到最高值54.3%,略高于淀粉和葡萄糖制备5-HMF的收率。
同时可以发现,在反应时间小于60 min时,温度越高5-HMF收率越大,这是由于升高温度有助于反应的进行,但升高温度和延长时间在促进3种底物转化为5-HMF的同时也加剧了5-HMF的分解和交联聚合的副反应,当副反应的速率超过5-HMF的生成速率,收率便开始下降。
对比图 1a)、图 1b)和图 1c)发现,在较短的反应时间内,相同温度下5-HMF收率相比果糖 > 葡萄糖 > 淀粉,也验证了3种底物制备5-HMF的难易程度:果糖最易,淀粉最难。同时发现,果糖的最适宜反应时间为180 min,长于葡萄糖和淀粉的90 min,这是因为反应中加入的芬顿试剂并不过量,过量的芬顿试剂会将糖类氧化为二氧化碳和水[19]。由于果糖相对于葡萄糖和淀粉更容易发生反应,不过量的芬顿试剂在更短时间内完全反应,反应液中剩余未反应的果糖在酸性和高温作用下继续生成5-HMF,直到180 min时达到峰值。
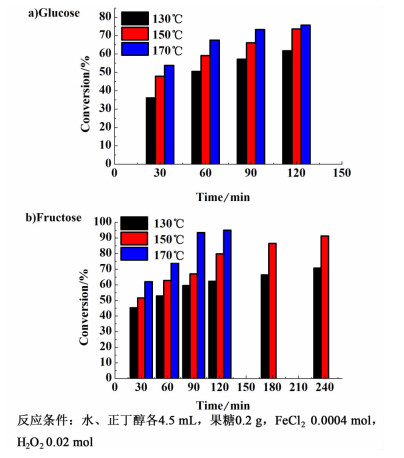
如图 2所示,葡萄糖和果糖的转化率随着温度的升高和时间的延长不断增加。如图 2b),反应30 min时果糖转化率在45.4%~62.0%之间,随着反应时间延长,其转化率不断增加,最高达到95%。葡萄糖和淀粉在90 min收率达到峰值前芬顿试剂已完全反应,由于二者在酸催化下不能或极少生成5-HMF,所以90 min后再延长反应时间,将加剧5-HMF副反应的发生,收率持续降低。如图 2a),葡萄糖在90 min达到收率峰值后,其转化率还在增加,但增速远小于90 min前,也小于果糖在相同时间时的转化率增速,这是由于芬顿试剂反应完全后,葡萄糖在高温下仅发生了少量的水解反应。
|
| 图 2 温度和时间对反应转化率的影响 Figure 2 Effects of temperature and time on conversion |
| |
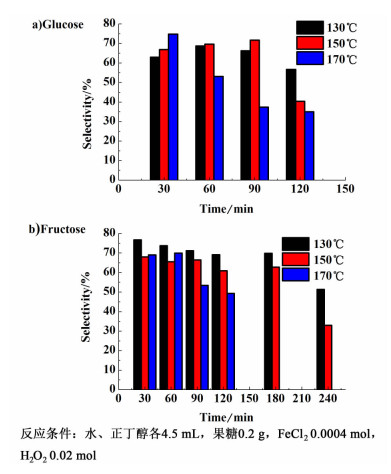
温度和时间对反应选择性的影响比较复杂,正如图 3所示。这是由于温度和时间对芬顿试剂的催化过程、溶液酸性的催化反应、副产物的生成和副反应过程等均有不同的影响,因而对选择性的影响规律不明显。
|
| 图 3 温度和时间对反应选择性的影响 Figure 3 Effects of temperature and time on selectivity |
| |
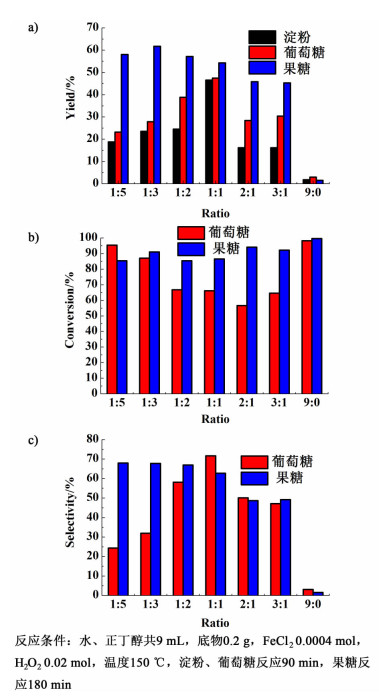
由于淀粉、葡萄糖和果糖生成5-HMF的反应和5-HMF降解的副反应都需在水中进行,正丁醇与水不互溶,可以在反应过程中萃取产物5-HMF,从而减少生成的5-HMF进一步降解,提高5-HMF收率。因此根据2.1确定的最适宜反应温度和时间,探讨水、正丁醇比例对5-HMF收率的影响。
如图 4所示,当水、正丁醇比例为1:5时,以淀粉、葡萄糖和果糖为底物的5-HMF收率分别为18.8%、23.2%和58.0%,随着水比例提高,5-HMF收率也逐渐升高。当水、正丁醇比例为1:1时,淀粉和葡萄糖反应的5-HMF收率达到峰值,分别为46.5%和47.4%;当水、正丁醇比例为1:3时,果糖制备5-HMF的收率达到最高值61.7%。这是因为糖类水解为5-HMF需要在水中进行,当水比例过低时会影响反应。但是随着水比例继续提高,5-HMF收率开始下降,当只加入水时,反应变为单相体系,5-HMF收率分别低至1.8%、3.0%和1.5%,几乎可以忽略不计。说明此时5-HMF的水解和交联聚合的副反应已经很剧烈,在最终产物中发现了大量黑褐色腐殖质,也验证了这一结论[20]。
|
| 图 4 水和正丁醇溶剂比例对芬顿试剂催化糖类制备5-HMF反应效果的影响 Figure 4 Effect of reaction solvent ratio on the efficiency of carbohydrate-to-5-HMF reaction via Fenton |
| |
在不同的水、正丁醇比例反应中,果糖的转化率均高于85%,选择性随着水比例增大而减小,1:5时选择性为68.0%,与1:3时的67.8%接近。葡萄糖的转化率随着水比例的增大先减小,在2:1时达到最小值后又随着水比例增大而增大,选择性却随着水比例的增大先增大,在1:1时达到最大值71.1%,而后又随着水比例的增大而减小。
同时可以发现,在相同的水、正丁醇比例下,以果糖为底物的5-HMF收率都要高于葡萄糖,以葡萄糖为底物的5-HMF收率均高于淀粉,这也说明了芬顿试剂催化3种糖类生成5-HMF的难易程度。由于果糖最易生成5-HMF,较高比例的正丁醇能及时从水中萃取更多的5-HMF而减少其在水中的副反应,所以果糖为底物时最适宜的正丁醇比例要高于淀粉和葡萄糖的反应。
综合考虑收率、转化率和选择性,以水和正丁醇体积比1:1作为淀粉和葡萄糖反应的最适宜比例,以1:3作为果糖反应的最适宜比例。
2.3 芬顿试剂Fe2+和H2O2比例对收率的影响芬顿试剂经常被用在废水处理、生物质降解以及生物材料预处理上,根据文献报道,Fe2+和H2O2的反应属于游离基反应,羟基自由基(·OH)能使糖类分子的羟甲基变为羰基[21],是促进多糖类物质降解的重要因素。又因为使用芬顿试剂需要弱酸性环境,酸同时也是果糖制备5-HMF的催化剂,因而芬顿试剂的配制对本反应有重要影响。由此设计了表 1的实验,探索H2O2或Fe2+的单独作用效果以及同时加入H2O2和Fe2+的比例对5-HMF收率的影响。
| 序号 | 底物 | FeCl2/mol | H2O2/mol | 收率/% |
| 1 | 淀粉 | 0 | 0.02 | 18.4 |
| 2 | 淀粉 | 0.0001 | 0.02 | 29.6 |
| 3 | 淀粉 | 0.0004 | 0.02 | 46.5 |
| 4 | 淀粉 | 0.0016 | 0.02 | 7.2 |
| 5 | 淀粉 | 0.0040 | 0.02 | 3.8 |
| 6 | 淀粉 | 0.0004 | 0 | 1.3 |
| 7 | 葡萄糖 | 0 | 0.02 | 28.5 |
| 8 | 葡萄糖 | 0.0001 | 0.02 | 41.8 |
| 9 | 葡萄糖 | 0.0004 | 0.02 | 47.4 |
| 10 | 葡萄糖 | 0.0016 | 0.02 | 16.8 |
| 11 | 葡萄糖 | 0.0040 | 0.02 | 10.3 |
| 12 | 葡萄糖 | 0.0004 | 0 | 1.7 |
| 13 | 果糖 | 0 | 0.02 | 24.4 |
| 14 | 果糖 | 0.0001 | 0.02 | 44.3 |
| 15 | 果糖 | 0.0004 | 0.02 | 61.7 |
| 16 | 果糖 | 0.0016 | 0.02 | 27.9 |
| 17 | 果糖 | 0.0040 | 0.02 | 12.9 |
| 18 | 果糖 | 0.0004 | 0 | 36.3 |
| (反应条件:底物0.2 g,H2O2 0.02 mol,温度150 ℃,1~12反应90 min,水、正丁醇各4.5 mL;13~18反应180 min,水2.25 mL,正丁醇6.75 mL)。 | ||||
对比反应6、12、18发现,当只加入Fe2+时,果糖可以生成较多的5-HMF,而淀粉和葡萄糖没有或极少生成5-HMF,这是因为强酸弱碱盐FeCl2和HCl使反应液呈酸性,酸性(氢离子)可以催化果糖脱水转化为5-HMF。当只加入H2O2时,3种底物都可生成5-HMF(如反应1、7、13所示),这是因为常温下H2O2可以分解生成·OH,且升高温度会增加·OH的生成[21],而·OH在反应中可起到促进淀粉降解和葡萄糖异构化为果糖的作用。当同时加入H2O2和Fe2+时,Fe2+能使产生·OH的链式反应更容易进行,所以3种底物不但都可以生成5-HMF,而且5-HMF收率会随Fe2+的增加而提高(反应2大于反应1,反应8大于反应7,反应14大于反应13);但过量的Fe2+会导致H2O2迅速分解成H2O和O2,生成的·OH反而减少,降低了5-HMF收率,对比反应3、4和5,反应9、10和11,反应15、16和17,可以发现这一规律。最终得到Fe2+和H2O2比例为1:50时5-HMF收率最大,以淀粉、葡萄糖和果糖为底物时芬顿试剂催化制备5-HMF的最高收率分别达到46.5%,47.4%和61.7%。
综上,推测芬顿试剂在催化糖类制备5-HMF时起到了3个作用:1)降解淀粉为葡萄糖,催化葡萄糖异构化为果糖,催化果糖生成5-HMF。已有文献报道芬顿试剂生成的·OH能够使大分子糖中的糖苷键断裂,降解生成低分子产物[23],例如范金石等[24]成功使用芬顿试剂降解壳聚糖为小分子物质;2)根据芬顿体系反应原理,·OH能够攻击有机物的羟甲基[21],而Qian等[25]研究发现,葡萄糖异构化为果糖的反应正是因为其C-2羟基被攻击,脱去1分子水后重排,发生C-2到C-1的氢转移,1分子水再进攻C-2,生成果糖,而且由于果糖能够继续被转化为5-HMF,因此还可拉动葡萄糖异构化为果糖的过程;3)芬顿试剂自身的酸性以及反应溶液的酸性均可催化果糖转化为5-HMF。
3 结论以芬顿试剂为催化剂,考察了淀粉、葡萄糖、果糖3种糖类在水和正丁醇的双相体系中制备5-HMF的影响因素,包括反应温度和时间、水和正丁醇比例、芬顿试剂Fe2+和H2O2比例,得到最适宜反应条件,结论如下:
1) 在淀粉、葡萄糖、果糖芬顿法制备5-HMF时,反应温度和时间对收率有着较大影响,随时间延长收率先升高后降低;温度对收率的影响比较复杂,升高温度同时促进了5-HMF的生成和分解,在短时间内,温度升高有助于提高5-HMF收率,长时间反应时,温度越高5-HMF收率越低。随着温度的升高和时间的延长,葡萄糖和果糖的转化率不断提高,但对选择性的影响较为复杂。
2) 双相体系中水和正丁醇的比例对收率、转化率和选择性有很大影响,随着水比例提高,3种底物的5-HMF收率先升高后降低;葡萄糖转化率随着水比例提高先降低后升高,选择性却先升高后降低;果糖转化率均在85%以上,变化规律不明显,选择性随水比例提高不断降低。综合考虑收率和选择性,以淀粉和葡萄糖为底物时水和正丁醇最适宜比例为1:1,以果糖为底物时水和正丁醇最适宜比例为1:3。
3) 芬顿试剂Fe2+和H2O2的比例对收率有较大影响,随着Fe2+的增加,5-HMF收率先升高后降低,1:50是最适宜比例;芬顿试剂在反应中起到3个作用:降解淀粉为葡萄糖,催化葡萄糖异构化为果糖,催化果糖生成5-HMF。
4) 芬顿法催化淀粉、葡萄糖制备5-HMF反应的最适宜条件为150 ℃,90 min,水和正丁醇比例1:1,Fe2+和H2O2比例1:50,此时最大收率分别为46.5%和47.4%;以果糖为底物制备5-HMF反应的最适宜条件为150 ℃,180 min,水和正丁醇比例1:3,Fe2+和H2O2比例1:50,此时最大收率为61.7%。
| [1] | Gallezot P. Conversion of biomass to selected chemical products[J]. Chemical Society Reviews, 2012, 41(4): 1538–1558. DOI: 10.1039/C1CS15147A |
| [2] | Vlachos D G, Caratzoulas S. The roles of catalysis and reaction engineering in overcoming the energy and the environment crisis[J]. Chemical Engineering Science, 2010, 65(1): 18–29. DOI: 10.1016/j.ces.2009.09.019 |
| [3] |
王军, 张春鹏, 欧阳平凯. 5-羟甲基糠醛制备及应用的研究进展[J].
化工进展, 2008, 27(5): 702–707.
Wang Jun, Zhang Chunpeng, Ouyang Pingkai. Advances in production and application of 5-hydroxymethyl furfural[J]. Chemical Industry and Engineering Progress, 2008, 27(5): 702–707. |
| [4] | Rosatella A A, Simeonov S P, Frade R F M, et al. 5-Hydroxymethylfurfural (HMF) as a building block platform:Biological properties, synthesis and synthetic applications[J]. Green Chemistry, 2011, 13(4): 754–793. DOI: 10.1039/c0gc00401d |
| [5] | Román-Leshkov Y, Chheda J N, Dumesic J A. Phase modifiers promote efficient production of hydroxymethylfurfural from fructose[J]. Science, 2006, 312(5782): 1933–1937. DOI: 10.1126/science.1126337 |
| [6] | Gliozzi G, Innorta A, Mancini A, et al. Zr/P/O catalyst for the direct acid chemo-hydrolysis of non-pretreated microcrystalline cellulose and softwood sawdust[J]. Applied Catalysis B:Environmental, 2014(145): 24–33. |
| [7] | Qi X, Watanabe M, Aida T M, et al. Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating[J]. Green Chemistry, 2008, 10(7): 799–805. DOI: 10.1039/b801641k |
| [8] | Qi X, Watanabe M, Aida T M, et al. Sulfated zirconia as a solid acid catalyst for the dehydration of fructose to 5-hydroxymethylfurfural[J]. Catalysis Communications, 2009, 10(13): 1771–1775. DOI: 10.1016/j.catcom.2009.05.029 |
| [9] | Yan H, Yang Y, Tong D, et al. Catalytic conversion of glucose to 5-hydroxymethylfurfural over SO42-/ZrO2 and SO42-/ZrO2-Al2O3 solid acid catalysts[J]. Catalysis Communications, 2009, 10(11): 1558–1563. DOI: 10.1016/j.catcom.2009.04.020 |
| [10] | Chheda J N, An-Leshkov Y R, Dumesic J A. Production of 5-hydroxymethylfurfural and furfural by dehydration of biomass-derived mono-and poly-saccharides[J]. Green Chemistry, 2007, 9(4): 342–350. DOI: 10.1039/B611568C |
| [11] | Wink D A, Nims R W, Saavedra J E, et al. The Fenton oxidation mechanism:Reactivities of biologically relevant substrates with two oxidizing intermediates differ from those predicted for the hydroxyl radical[J]. Proceedings of the National Academy of Sciences, 1994, 91(14): 6604–6608. DOI: 10.1073/pnas.91.14.6604 |
| [12] | Chemizmu K, Fentona R. Fenton reaction-controversy concerning the chemistry[J]. Ecological Chemistry and Engineering, 2009(16): 347–358. |
| [13] | Kato D M, Elía N, Flythe M, et al. Pretreatment of lignocellulosic biomass using Fenton chemistry[J]. Bioresource Technology, 2014, 162: 273–278. DOI: 10.1016/j.biortech.2014.03.151 |
| [14] | Guo N, Caratzoulas S, Doren D J, et al. A perspective on the modeling of biomass processing[J]. Energy & Environmental Science, 2012, 5(5): 6703. |
| [15] | Román-Leshkov Y, Barrett C J, Liu Z Y, et al. Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates[J]. Nature, 2007, 447(7147): 982–985. DOI: 10.1038/nature05923 |
| [16] | Kang S, Liao C, Po S. Decolorization of textile wastewater by photo-Fenton oxidation technology[J]. Chemosphere, 2000, 41(8): 1287–1294. DOI: 10.1016/S0045-6535(99)00524-X |
| [17] | Qi X, Guo H, Li L. Efficient conversion of fructose to 5-hydroxymethylfurfural catalyzed by sulfated zirconia in ionic liquids[J]. Engineering Chemistry Research, 2011, 50(13): 7985–7989. DOI: 10.1021/ie200488k |
| [18] | 王超. 金属氯化物催化葡萄糖和蔗糖高效转化为5-羟甲基糠醛的研究[D]. 天津: 天津大学, 2012 Wang Chao. Efficient cnoversion of glucose and sucrose to 5-hydroxymethy1furfural catalyzed by metal chlorides[D]. Tianjin: Tianjin University, 2012(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10056-1013005649.htm |
| [19] |
邓小晖, 张海涛, 曹国民, 等. 芬顿试剂处理废水的研究与应用进展[J].
上海化工, 2007, 32(8): 1–5.
Deng Xiaohui, Zhang Haitao, Cao Guomin, et al. Progress of the research and application of Fenton reagent for wastewater treatment[J]. Shanghai Chemical Industry, 2007, 32(8): 1–5. |
| [20] | Qi X, Watanabe M, Aida T M, et al. Efficient process for conversion of fructose to 5-hydroxymethylfurfural with ionic liquids[J]. Green Chemistry, 2009, 11(9): 1327–1331. DOI: 10.1039/b905975j |
| [21] | 苏琼, 王彦斌. 淀粉精细化学品合成及其应用[M]. 北京: 民族出版社, 2004 |
| [22] |
王伟, 初本莉, 王嘉承. 过硫酸盐法和芬顿法降解有机物的对比研究[J].
广州化工, 2013, 41(22): 4–7.
Wang Wei, Chu Benli, Wang Jiachen. The comparative study of degradation of organic pollutants between persulfate method and Fenton method[J]. Guangzhou Chemical Industry, 2013, 41(22): 4–7. DOI: 10.3969/j.issn.1001-9677.2013.22.002 |
| [23] | 邵晓梅. 室温芬顿试剂高级氧化技术条件选择及效果评价研究[D]. 江苏苏州: 苏州大学, 2009 Shao Xiaomei. Study on the effect appraisal and factor choice of Fenton advanced oxidation processes at room temperature[D]. Jiangsu Suzhou: Suzhou University, 2009(in Chinese) 室温芬顿试剂高级氧化技术条件选择及效果评价研究 |
| [24] |
范金石, 赵剑雄, 陈国华. 芬顿试剂降解壳聚糖[J].
化学工程师, 2007(5): 3–6.
Fan Jinshi, Zhao Jianxiong, Chen Guohua. Degradation of chitosan by Fenton reagent[J]. Chemical Engineer, 2007(5): 3–6. |
| [25] | Qian X. Mechanisms and energetics for Brønsted acid-catalyzed glucose condensation, dehydration and isomerization reactions[J]. Topics in Catalysis, 2012, 55(3/4): 218–226. |
 2018, Vol. 35
2018, Vol. 35





