随着化石能源的日益消耗,高效利用生物质资源受到了人们的广泛关注[1]。1, 2-丙二醇(1, 2-PDO)作为一种重要的化学品,被广泛的应用在防冻剂、吸湿剂、润滑剂等方面[2],具有重要的研究价值。从绿色化学的角度,利用生物质资源生产1, 2-丙二醇逐渐得到人们认可。乳酸酯,尤其是乳酸乙酯可以通过乳酸和乙醇的酯化反应得到,这2种酯化原料都易从可再生的生物质(如木质素、纤维素和糖类)发酵得到。因此,利用乳酸乙酯加氢生产1, 2-PDO是一种绿色环保的路线[3-5]。
过渡金属纳米材料具有尺寸小、比表面积大、表面活性中心多等优点,逐渐成为当今世界的一个重要研究方向和热点。Co纳米材料广泛地应用于硬质合金、陶瓷化工、电池、催化材料等领域,是生产耐高温、耐腐蚀合金的重要原料。目前国内外合成Co纳米粒子的方法有多种,如电解法、草酸盐热分解法、高压水喷雾法、多元醇法、微乳液法、氧化还原法、高压氢还原法等[6-9]。Co纳米材料作为一种高效催化剂在乳酸乙酯加氢反应中具有重要的应用价值[10-11]。据报道[12],金属Co不同的晶面和离散的能带使其在吸附和活化反应物分子以及调节催化活性方面具有显著的优势。通过调控金属Co的形貌和形成温度可以调节金属Co的晶型及暴露的晶面。而目前国内外关于金属Co的不同晶型在乳酸乙酯加氢反应中的影响,相关报道并不多。
本实验制备了不同形貌的Co3O4纳米材料,并采用简单的氢气热还原纳米Co3O4的方法制备了纳米Co。利用TEM研究了纳米Co3O4和纳米Co的形貌特征,通过H2-TPR考察了不同形貌Co3O4的还原行为,考察了不同形貌的纳米Co对乳酸乙酯加氢活性的影响。针对颗粒状的纳米Co粒子,考察了不同的还原温度对金属Co的晶型转变的影响,并研究了晶型转变对于乳酸乙酯加氢制备1, 2-丙二醇反应的影响。为进一步理解Co催化剂在乳酸乙酯加氢反应中的催化机理奠定了基础。
1 实验部分 1.1 试剂四水合乙酸钴(AR),结晶碳酸钠(AR),无水乙醇(GR),天津市科密欧化学试剂有限公司;乙二醇(AR),天津市元立化工有限公司;乳酸乙酯(AR),北京百灵威科技有限公司;正丁醇(GR),1, 2-丙二醇(GR),上海阿拉丁生化科技股份有限公司;高纯氢(体积分数为99.999%),高纯氮(体积分数为99.999%),天津市六方气体有限公司。制备Co3O4纳米材料过程中使用的水均为去离子水。
1.2 催化剂表征X射线粉末衍射谱(XRD)在日本理学公司D/MAX-2500型衍射仪上进行,以Cu_Kα射线为X光光源,管电流100 mA,管电压40 kV,2θ扫描角度范围5°~90°,扫描速度8(°)/min。采用日本电子公司的JEM-2100F型场发射透射电子显微镜观察样品微观结构和金属粒径大小,测试前样品需仔细研磨,以乙醇为溶剂用超声波处理30 min,使其均匀分散,然后覆盖在微栅(铜网)上自然通风干燥。程序升温还原(H2-TPR)采用美国Micromeritics公司的2750化学吸附仪进行分析。将40 mg的催化剂先在N2气氛中升温至523 K并保持1 h,吹扫净化其表面,然后降至室温进行氢气升温还原。还原气为体积分数为10%的H2/Ar混合气,流速为25 mL/min,用TCD检测器检测H2量的变化,升温速率为15 ℃/min,由25 ℃升温至1 000 ℃。用Ag2O矫正了氢气的消耗量。
1.3 材料制备根据文献[13-14]的方法制备得到不同形貌的Co3O4纳米材料,利用氢气热还原法制备得到相应的Co纳米材料。
Co纳米颗粒的制备:4.98 g的C4H6CoO4溶于60 mL的乙二醇中,搅拌5 min后,混合物被加热到80 ℃,然后加入200 mL的0.2 mol/L的Na2CO3(滴加速度1.11 mL/min),继续在N2氛围中搅拌1 h,过滤,蒸馏水和乙醇洗涤3次,所得固体在50 ℃真空干燥箱中过夜干燥,450 ℃焙烧4 h[升温速率2(°)/min],制备得到Co3O4纳米颗粒。将上述得到的Co3O4纳米颗粒在不同温度下还原3 h得到Co纳米颗粒。
Co纳米棒的制备:4.98 g的C4H6CoO4溶于60 mL的乙二醇中,搅拌5 min后,混合物被加热到160 ℃,然后加入200 mL的0.2 mol/L的Na2CO3(滴加速度1.11 mL/min),继续在N2氛围中搅拌1 h,过滤,蒸馏水和乙醇洗涤3次,所得固体在50 ℃真空干燥箱中过夜干燥,450 ℃焙烧4 h[升温速率2(°)/min],制备得到Co3O4纳米棒,将制备的Co3O4纳米棒在250 ℃还原得到Co纳米棒。
1.4 催化剂性能评价乳酸乙酯加氢反应在50 mL的不锈钢间歇反应釜中进行,将原料和催化剂加入反应釜并密封后,用高纯H2置换反应釜中的空气3次,充入高纯H2至设定压力,反应釜搅拌加热,达到设定温度后开始计时,反应一段时间后,用冰水浴冷却,然后放出釜中气体,离心分离得到反应液体和剩余固体。具体反应条件如下:反应温度160 ℃,氢压6.0 MPa,1 g乳酸乙酯,9 g乙醇溶剂,0.03 g催化剂,搅拌速度400 r/min,反应时间2 h。
1.5 产物分析和计算液体产物用高效气相色谱(美国Bruker-456)进行分析,色谱柱为HP-INNOWax(30 m×0.25 mm×0.25 μm),使用正丁醇为内标物进行定量分析。
气相色谱条件为:50 ℃保持3 min,10 ℃/min升至180 ℃,保持5 min,20 ℃/min升到220 ℃,保持15 min,分流比150:1,进样量0.1 μL,载气流速35 mL/min,H2流速25 mL/min,空气流速300 mL/min(进样口温度250 ℃,检测器温度250 ℃)。乳酸乙酯的转化率和1, 2-丙二醇的选择性计算公式为式(1)和式(2)。
| $ {\rm{Conversion = }}\frac{{{\rm{moles}}\;{\rm{of}}\;{\rm{ethyllactate}}\;{\rm{consumed}}}}{\begin{array}{l} {\rm{moles}}\;{\rm{of}}\;{\rm{ethyllactate}}\;{\rm{initially}}\;{\rm{charged}}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\; \times {\rm{100\% }} \end{array}} $ | (1) |
| $ {\rm{Selectivity = }}\frac{{{\rm{moles}}\;{\rm{of}}\;{\rm{1, 2-PDO}}}}{{{\rm{moles}}\;{\rm{of}}\;{\rm{ethyllactate}}\;{\rm{consumed}}}} \times 100\% $ | (2) |
实验合成了不同形貌的Co3O4纳米材料,它们经250 ℃氢气还原前后样品的TEM表征结果如图 1所示。

|
| 图 1 不同形貌的Co3O4纳米材料经250 ℃氢还原前后样品的TEM图 Figure 1 TEM images of Co3O4 nanocrystal and their morphologies after reduction at 250 ℃ |
| |
从图 1a)和图 1c)可以看出,根据文献[13-14]制备得到的Co3O4纳米颗粒和纳米棒形状规则清晰。2种Co3O4纳米材料在250 ℃条件下经氢气还原后得到的样品分别为Co纳米颗粒和Co纳米棒。图 1b)和图 1d)所示的纳米粒子和纳米棒的形貌保持不变,但出现一定程度聚集。
表 1列出了不同形貌的Co纳米材料催化乳酸乙酯加氢的活性结果。从表 1中可以看出,Co纳米颗粒对乳酸乙酯具有较高的转化率,Co纳米棒对乳酸乙酯的转化率几乎没有活性。无论是颗粒状的还是棒状的Co纳米材料,它们对1, 2-丙二醇均具有较高的选择性。
| 催化剂 | 乳酸乙酯转化率/% | 1, 2-丙二醇选择性/% |
| Co纳米颗粒 | 67.1 | 100 |
| Co纳米棒 | 2.0 | 99 |
| 注:Co3O4纳米颗粒和纳米棒的还原温度为250 ℃。 | ||
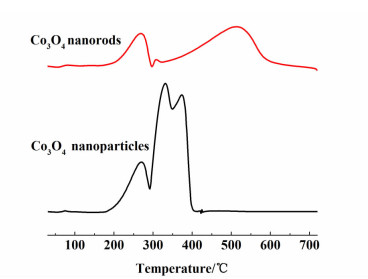
为了探究不同形貌的Co纳米材料加氢活性差异的原因,本实验对2种Co3O4纳米材料进行了H2-TPR表征(见图 2)。
|
| 图 2 Co3O4纳米颗粒和纳米棒的H2-TPR图谱 Figure 2 H2-TPR profiles of Co3O4 nanoparticles and nanorods |
| |
根据文献[14-17],Co3O4还原得到金属Co需要经历2步还原,第1步还原由Co3O4到CoO,第2步还原由CoO到Co。从图 2中可以看出,Co3O4纳米颗粒和纳米棒的第1步还原温度相近(250 ℃附近);但第2步还原温度不同,Co3O4纳米颗粒的第2步还原出现在350 ℃附近,而Co3O4纳米棒的第2步还原则出现在500 ℃附近,说明Co3O4纳米颗粒比Co3O4纳米棒更容易经氢气还原得到金属Co。图 2所示的H2-TPR中的还原温度与文献[18]相似,而该文献中提到Co3O4纳米颗粒在氢气氛围中还原出现金属Co的最低温度为190 ℃。另外,根据文献[19],Co3O4纳米颗粒的尺寸位于12.1~20.3 nm范围时,300 ℃还原即生成部分金属Co,此时颗粒为Co3O4、CoO和Co的混合物,而低温下出现金属Co是由还原过程中的扩散限制和颗粒的微观结构特点决定的。本实验方法合成的Co3O4纳米颗粒的平均粒径为16 nm,属于此粒径范围。由上可知,在本实验的还原温度下,Co3O4纳米颗粒可以部分转化成金属Co,Co是乳酸乙酯加氢的活性位[20],因此,其催化乳酸乙酯加氢的活性明显优于相同温度下Co3O4纳米棒还原后的结果。
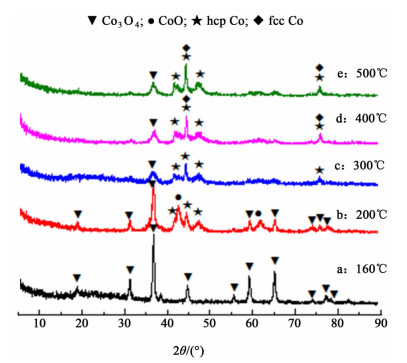
2.2 氢还原温度对Co纳米颗粒的影响及催化乳酸乙酯性能 2.2.1 XRD表征图 3列出了Co3O4纳米颗粒经不同温度还原后所得样品的XRD图,各物种对应的2θ值及晶面见表 2。
|
| 图 3 Co3O4颗粒经不同温度还原后所得样品的XRD图 Figure 3 XRD patterns for the Co3O4 nanoparticles after reduction at different temperature |
| |
| 名称 | 2θ (晶面) |
| Co3O4 | 19.0°(111), 31.3°(220), 36.8°(311), 38.5°(222), 44.8°(400), 55.7°(422), 59.4°(511), 65.2°(440), 74.1°(620), 77.3°(533), 78.4°(622) |
| CoO | 42.4°(200), 61.5°(220) |
| Co(hcp) | 41.7°(100), 44.7°(002), 47.5°(101), 75.9°(110) |
| Co(fcc) | 44.2°(111), 51.5°(200), 75.9°(220) |
从图 3中可以看出,160 ℃还原后得到的样品全部以Co3O4存在,说明样品没有被还原;200 ℃还原后得到的样品表现出CoO和hcp晶型Co的衍射峰,Co3O4的特征峰减弱;300 ℃还原的样品中CoO的特征峰基本消失,Co3O4的特征峰进一步减弱,Co的特征峰增强;400和500 ℃还原的样品中hcp晶型金属Co在41.7°和47.5°处的衍射峰强度基本不变,说明hcp型金属Co没有明显增加;而44.7°和75.9°处的衍射峰强度明显增强,这是由于fcc晶型金属Co的出现造成了2种晶型的金属Co叠加。从XRD的结果可知低温下氢气还原Co3O4制得的Co纳米颗粒中的金属Co主要是hcp晶型,随着还原温度增加到400 ℃,出现了fcc晶型的金属Co。
2.2.2 TEM表征图 4为Co3O4纳米颗粒经不同温度还原后的TEM图。

|
| 图 4 Co3O4颗粒经不同温度还原后的TEM图 Figure 4 TEM images of Co3O4 nanoparticles after reduction at different temperature |
| |
由图 4可知,200和450 ℃还原温度制备的Co纳米粒子产生了一定的聚集现象。
图 5为Co3O4纳米颗粒经不同温度还原后相应的HRTEM图。

|
| 图 5 Co3O4颗粒经不同温度还原后的HRTEM图 Figure 5 HRTEM images of Co3O4 nanoparticles after reduction at different temperature |
| |
从图 5a)可知,200 ℃还原Co3O4后的样品中出现了晶面间距为0.193 nm的hcp晶型金属Co和CoO,同时还有一部分的Co3O4存在,符合XRD的表征结果。从图 5b)可知,450 ℃还原Co3O4后的样品中出现了晶面间距为0.2 048 nm的fcc晶型金属Co,另外,还有一部分的hcp晶型的金属Co、CoO和Co3O4。HRTEM图中观察到的晶面间距为0.233 nm,对应于(222)晶面,不同于Co3O4的主要晶面(311)(间距0.242 nm),说明大部分Co3O4被还原,与前面的XRD结果一致。
金属Co的晶型转变存在1个固定的转变温度。Ducreux等[21]的研究发现,还原温度在450 ℃以上时,金属Co表面为fcc晶型,但是在较低的温度下,金属Co表现为hcp晶型;Bulavchenko等[18]也提到金属Co的晶型转变温度在400 ℃,400 ℃以下,hcp晶型是稳定结构,400 ℃以上,fcc晶型是稳定结构,同时在加热过程中,hcp向fcc晶型的转变非常缓慢。因此,本实验中的Co3O4在低温下还原得到的金属Co以hcp晶型的形式稳定存在,随着温度的升高,逐渐转变成fcc晶型Co。
2.3 催化活性 2.3.1 Co3O4还原温度对乳酸乙酯加氢活性的影响表 3为Co3O4还原温度对乳酸乙酯加氢制备1, 2-PDO活性的影响。
| 还原温度/℃ | 乳酸乙酯转化率/% | 1, 2-丙二醇选择性/% |
| Co3O4 | 3 | 100 |
| 160 | 2 | 100 |
| 200 | 50 | 99 |
| 250 | 67 | 100 |
| 300 | 71 | 100 |
| 350 | 65 | 99 |
| 380 | 57 | 100 |
| 450 | 55 | 100 |
| 500 | 48 | 100 |
从表 3中可以看出,随着Co3O4还原温度从160 ℃增加到300 ℃,乳酸乙酯的转化率表现出增加的趋势,继续升高还原温度,乳酸乙酯转化率逐渐降低。由XRD表征可知,随着还原温度的增加,Co3O4逐渐被还原成hcp型金属Co,金属Co是乳酸乙酯加氢的活性位[20-22]。然而还原温度增加到300 ℃以上时乳酸乙酯的转化率逐渐减小,这是高温还原得到金属Co由hcp晶型向fcc晶型转化的结果。以上结果表明hcp晶型的金属Co有利于乳酸乙酯加氢,而fcc晶型的金属Co不利于乳酸乙酯加氢。另外,还原温度高于300 ℃,Co纳米粒子的聚集也可能造成乳酸乙酯活性降低,由TEM结果,200 ℃还原Co3O4时,样品已经出现聚集现象。但是还原温度从160 ℃升高到300 ℃,乳酸乙酯的转化率却从2%增加到71%,表现为增加的趋势,因此认为颗粒聚集并不是影响催化剂活性的主要原因。继续升高还原温度至500 ℃,乳酸乙酯的转化率从71%降低到48%,除了fcc晶型金属Co的出现,颗粒聚集也可能造成催化剂活性降低。
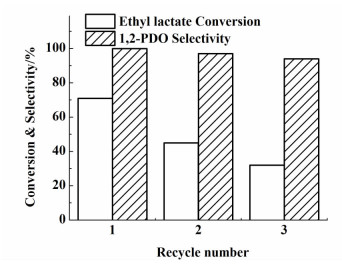
2.3.2 催化剂重复使用性能考察以乳酸乙酯的转化率和1, 2-丙二醇的选择性为指标对还原温度为300 ℃条件下制备的纳米Co催化剂进行重复使用性考察。每次反应后, 剩余的固体催化剂用乙醇洗涤,50 ℃真空干燥,用于下一次反应,催化剂重复使用3次的结果如图 6所示。
|
| 图 6 催化剂的循环使用性 Figure 6 Reusability of the catalyst |
| |
从图 6可以看出,催化剂使用3次后,乳酸乙酯转化率从71%降低到32%,1, 2-丙二醇的选择性没有明显降低。催化剂失活的原因可能是由于多次使用后Co颗粒的聚集。
3 结论利用氢气还原Co3O4法制备得到了2种不同形貌的Co纳米粒子,较低温下,Co纳米颗粒的形貌基本保持并且具有较好的乳酸乙酯加氢活性,而Co纳米棒不易被还原成金属状态的Co,对乳酸乙酯加氢反应没有活性。考察了还原温度对于Co纳米颗粒中Co晶型的影响,发现随着还原温度的增加,金属Co由hcp晶型向fcc晶型转化。同时,研究了金属Co的晶型对于乳酸乙酯加氢活性的影响,发现hcp晶型的金属Co有利于乳酸乙酯加氢,fcc晶型的金属Co不利于乳酸乙酯加氢,另外,高温下催化剂颗粒的聚集也可能造成乳酸乙酯加氢活性降低。催化剂的重复使用性3次后,乳酸乙酯加氢转化率从71%降低到32%,1, 2-丙二醇选择性保持不变。
| [1] | Ruppert A M, Weinberg K, Palkovits R. Hydrogenolysis goes bio:From carbohydrates and sugar alcohols to platform chemicals[J]. Angewandte Chemie International Edition in English, 2012, 51(11): 2564–2601. DOI: 10.1002/anie.201105125 |
| [2] | Besson M, Gallezot P, Pinel C. Conversion of biomass into chemicals over metal catalysts[J]. Chemical Reviews, 2014, 114(3): 1827–1870. DOI: 10.1021/cr4002269 |
| [3] | Feng J, Xiong W, Jia Y, et al. Hydrogenation of ethyl lactate over ruthenium catalysts in an additive-free catalytic system[J]. Reaction Kinetics, Mechanisms and Catalysis, 2011, 104(1): 89–97. DOI: 10.1007/s11144-011-0329-9 |
| [4] | Luo G, Yan S, Qiao M, et al. Effect of promoters on the structures and properties of the RuB/γ-Al2O3 catalyst[J]. Journal of Molecular Catalysis A:Chemical, 2005, 230(1/2): 69–77. |
| [5] | Luo G, Yan S, Qiao M, et al. Effect of tin on Ru-B/γ-Al2O3 catalyst for the hydrogenation of ethyl lactate to 1, 2-propanediol[J]. Applied Catalysis A:General, 2004, 275(1/2): 95–102. |
| [6] | Joseyphusa R J, Matsumotob T, Takahashi H, et al. Designed synthesis of cobalt and its alloys by polyol process[J]. Journal of Solid State Chemistry, 2007, 180(11): 3008–3018. DOI: 10.1016/j.jssc.2007.07.024 |
| [7] | Osorio-Cantillo C, Santiago-Miranda A N, Perales-Perez O, et al. Size-and phase-controlled synthesis of cobalt nanoparticles for potential biomedical applications[J]. Journal of Applied Physics, 2012, 111(7): 2532–2595. |
| [8] | Yang J, Liu Q, Sun W. Co(Ⅱ)-doped MOF-5 nano/microcrystals:Solvatochromic behaviour, sensing solvent molecules and gas sorption property[J]. Journal of Solid State Chemistry, 2014, 218: 50–55. DOI: 10.1016/j.jssc.2014.06.004 |
| [9] |
龚晓钟, 汤皎宁, 李均钦, 等. 微波法制备金属钴纳米晶棒及其表征[J].
应用化学, 2005, 22(12): 1291–1294.
Gong Xiaozhong, Tang Jiaoning, Li Junqin, et al. Preparation of cobalt nanocrystals rods by microwave method and characterization[J]. Applied Chemistry, 2005, 22(12): 1291–1294. DOI: 10.3969/j.issn.1000-0518.2005.12.004 |
| [10] | Xue J, Cui F, Huang Z, et al. Liquid phase hydrogenolysis of biomass-derived lactate to 1, 2-propanediol over silica supported cobalt nanocatalyst[J]. Chinese Journal of Chemistry, 2011, 29(7): 1319–1325. DOI: 10.1002/cjoc.v29.7 |
| [11] | Ma X, Sun D, Zhao F, et al. Liquid phase hydrogenation of biomass-derived ethyl lactate to propane-1, 2-diol over a highly active CoB amorphous catalyst[J]. Catalysis Communications, 2015, 60: 124–128. DOI: 10.1016/j.catcom.2014.11.027 |
| [12] | Liu Q, Cao X, Wang T, et al. Synthesis of shape-controllable cobalt nanoparticles and their shape-dependent performance in glycerol hydrogenolysis[J]. RSC Advances, 2015, 5(7): 4861–4871. DOI: 10.1039/C4RA13395A |
| [13] | Xie X, Shen W. Morphology control of cobalt oxide nanocrystals for promoting their catalytic performance[J]. Nanoscale, 2009, 1(1): 50–60. DOI: 10.1039/b9nr00155g |
| [14] | Xie X, Li Y, Liu Z, et al. Low-Temperature oxidation of CO catalysed by Co3O4 nanorods[J]. Nature, 2009, 458(7239): 746–749. DOI: 10.1038/nature07877 |
| [15] | Wang W, Lin H, Chen Y. Carbon monoxide hydrogenation on cobalt/zeolite catalysts[J]. Journal of Porous Materials, 2005, 12(1): 5–12. DOI: 10.1007/s10934-005-5227-y |
| [16] | Khodakov A Y, Lynch J, Bazin D, et al. Reducibility of cobalt species in silica-supported Fischer-Tropsch catalysts[J]. Journal of Catalysis, 1997, 168(1): 16–25. DOI: 10.1006/jcat.1997.1573 |
| [17] | Shi L, Zeng C, Lin Q, et al. Citric acid assisted one-step synthesis of highly dispersed metallic Co/SiO2 without further reduction:As-Prepared Co/SiO2 catalysts for Fischer-Tropsch synthesis[J]. Catalysis Today, 2014, 228: 206–211. DOI: 10.1016/j.cattod.2013.10.013 |
| [18] | Bulavchenko O A, Cherepanova S V, Malakhov V V, et al. In situ XRD study of nanocrystalline cobalt oxide reduction[J]. Kinetics and Catalysis, 2009, 50(2): 192–198. DOI: 10.1134/S0023158409020086 |
| [19] | Potoczna-Petru D, Kepinski L. Reduction study of Co3O4 model catalyst by electron microscopy[J]. Catalysis Letters, 2001, 73(1): 41–46. DOI: 10.1023/A:1009022202448 |
| [20] | Huang L, Zhu Y, Zheng H, et al. Vapor-Phase hydrogenolysis of biomass-derived lactate to 1, 2-propanediol over supported metal catalysts[J]. Applied Catalysis A:General, 2008, 349(1/2): 204–211. |
| [21] | Ducreux O, Rebours B, Lynch J, et al. Microstructure of supported cobalt Fischer-Tropsch catalysts[J]. Oil & Gas Science and Technology, 2008, 64(1): 49–62. |
| [22] | Xue J, Fang C, Huang W, et al. Effect of metal additives on structure and properties of a Co/SiO2 hydrogenation catalyst[J]. Chinese Journal of Catalysis, 2012, 33(9/10): 1642–1649. |
 2018, Vol. 35
2018, Vol. 35





