随着人们对保护环境、节约能源愈加重视,锂离子电池作为下一代混合动力电动车、纯电动车和储能系统的能量来源受到人们越来越多的关注[1],但目前锂离子电池所能提供的能量密度还无法满足人们日益增强的需求。已知锂离子电池正极材料对锂离子电池的电化学性能和成本有着更为直接的影响[2-3]。富锂层状氧化物(LLOs)是由LiMO2和Li2MnO3以固溶体的形式组成,写作xLiMO2·(1-x)Li2MnO3 (M代表Mn、Ni和Co等),因其具有高比容量和高电压的优点而受到广泛关注[4-5],但富锂正极材料仍存在倍率性能较差等问题[6]。研究表明,可采用缩小材料粒径以缩短锂离子迁移距离的方法尝试改善材料的倍率性能[7]。
溶胶-凝胶法是制备正极材料常见的方法之一,具有产物化学均匀性好、纯度高的优点[8],尤其适合于制备组成复杂的三元富锂正极材料。溶胶-凝胶法的过程主要包括:溶胶的形成、溶胶向凝胶的转化、陈化、干燥和最终煅烧。值得注意的是,陈化过程将影响材料的均一性和形貌[9],从而改变材料的电化学性能。Ren等利用碳酸盐共沉淀法制备了微米级球体状Li1.2Ni0.2Mn0.6O2正极材料,发现陈化时间不同,样品的最终形貌和电化学性能也不同,当陈化时间为9 h时,材料具有较大的放电容量和最佳的倍率性能[10]。赖德聪也发现在共沉淀法制备富锂三元正极材料的过程中陈化时间将影响样品的电化学性能[11]。但目前还没有涉及溶胶-凝胶法中陈化时间对富锂正极材料形貌和性能影响的报道。
本工作研究了溶胶-凝胶法中煅烧温度和陈化时间对Li1.2Mn0.54Ni0.13Co0.13O2材料结构和形貌的影响,并对材料的电化学性能进行了测试。
1 实验方法 1.1 Li1.2Mn0.54Ni0.13Co0.13O2材料的制备采用柠檬酸作为螯合剂的溶胶-凝胶法制备Li1.2Mn0.54Ni0.13Co0.13O2材料,且所有原料均为分析纯。首先将四水合乙酸锰[Mn(CH3COO)2·4H2O],四水合乙酸镍[Ni(CH3COO)2·4H2O]和四水合乙酸钴[Co(CH3COO)2·4H2O]以n(Mn):n(Ni):n(Co)=54:13:13溶解于50 mL蒸馏水中,制成过渡金属(TM)混合溶液。再以n(Li):n(TM)=3:2称取一定量的氢氧化锂(LiOH·H2O)溶解于50 mL的蒸馏水中,紧接着向溶液中加入一定量的柠檬酸(CA,C6H8O7·H2O)作为螯合剂[n(Li):n(TM):n(CA)=6:4:5]。当氢氧化锂与柠檬酸完全反应后,向溶液中缓慢滴加过渡金属混合溶液并不断搅拌。利用氨水调节混合溶液的pH值稳定在7~8之间。在80 ℃水浴条件下搅拌数小时,蒸发溶剂直至形成紫色胶状物。将溶胶密封保存并在室温中陈化一定的时间,随后将其置于烘箱中55 ℃烘干数小时,得到紫蓝色凝胶。将凝胶在450 ℃的马弗炉中热处理8 h,升温速率为0.5 ℃/min。取出中间体粉末,研磨后继续在马弗炉中以4 ℃/min的速率升温到800~900 ℃煅烧5 h,并阶段冷却至室温得到最终产物。煅烧温度为800、850和900 ℃的样品分别记为LLO-800、LLO-850和LLO-900,陈化时间为0、5和10 d的样品分别记为LLO-0、LLO-5和LLO-10。
1.2 结构和形貌的表征材料的晶型结构采用德国布鲁克AXS有限公司的D8-Focus型X射线衍射仪进行XRD分析,使用Cu靶的Kα为辐射源,扫描范围为15°~70°,扫描速率为2 (°)/min。采用日本日立公司的S-4800型场发射扫描电子显微镜(SEM)对样品的颗粒和形貌进行分析。
1.3 电化学性能测试将所制得的样品与乙炔黑、聚偏氟乙烯(PVDF)以8:1:1的质量比混合,加入适量N-甲基-2-吡咯烷酮(NMP)溶液在玛瑙研钵中研磨混合并涂敷在铝箔上。120 ℃下真空干燥10 h后,裁剪成直径为14 mm的正极极片。使用金属锂作为负极,Celgard 2000型多孔聚乙烯膜为隔膜,1 mol/L LiPF6的EC-EMC-DMC混合溶液(体积比为1:1:1)为电解液组装成CR2032型扣式电池。电池的充放电循环测试在25 ℃恒温箱中使用LandCT 2 001 A电池测试系统,采用恒电流充放电方法(1 C=250 mA·g-1),电压范围为2.0~4.8 V。
2 结果与讨论 2.1 煅烧温度对材料结构和形貌的影响图 1为不同煅烧温度条件下得到样品的XRD图谱。所得样品均为α-NaFeO2型结构,属于R-3m空间群。在2θ为20°~25°区间存在弱的衍射峰对应于Li2MnO3组分中LiM6型超晶格结构[12]。
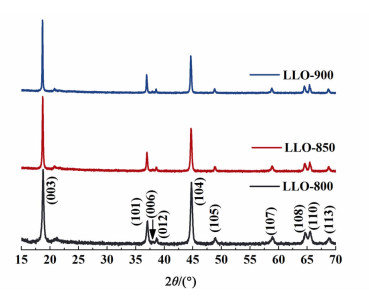
|
| 图 1 不同煅烧温度下得到样品的XRD图谱 Figure 1 XRD patterns of samples synthesized at different temperatures |
| |
表 1列出了不同煅烧温度下样品的晶胞参数与特征峰强度比。
| Samples | Lattice parameters | I(003)/I(104) | ||
| a/nm | c/nm | c/a | ||
| LLO-800 | 0.2848 | 1.4184 | 4.9797 | 1.1774 |
| LLO-850 | 0.2850 | 1.4212 | 4.9875 | 1.5425 |
| LLO-900 | 0.2852 | 1.4234 | 4.9917 | 1.6401 |
从表 1中可以看出随着煅烧温度的升高,所有样品的a值基本不变,但c值、c/a值和I(003)/I(104)值均逐渐变大。已知当I(003)/I(104)值大于1.2,c/a值大于4.899时,材料的层状结构良好[13-14]。可见LLO-850和LLO-900样品均具有较好的层状结构,但LLO-800因煅烧温度较低,晶体未生长完全,没有形成良好的层状结构。
图 2a)为样品经过450 ℃热处理后所得中间体的SEM图,从图 2中可以看到颗粒粒径远远小于产物,可见材料最终的颗粒大小与最后一步高温煅烧有直接的关系。图 2b)~图 2d) 为不同煅烧温度下合成样品的SEM图。通过对比发现随着温度的升高,样品颗粒粒径逐渐增大。样品LLO-900的颗粒粒径最大,平均粒径为199.6 nm,LLO-800样品最小,平均粒径为113.7 nm。但LLO-800样品晶体表面不平滑,再结合XRD的分析结果,推测在煅烧时间一定的情况下,较低的煅烧温度无法得到生长完全的晶体。LLO-850样品的平均粒径为183.1 nm,是在所有样品中能保持良好层状结构基础上最小的粒径。在粒径较小的颗粒中,锂离子扩散所需的路径更短,将有利于材料的电化学性能,尤其是倍率性能。因此选用850 ℃为后续样品的最终煅烧温度。

|
| 图 2 不同煅烧温度下得到样品的SEM图 Figure 2 SEM images of samples synthesized at different temperatures |
| |
图 3是不同陈化时间所制得最终样品的XRD图。
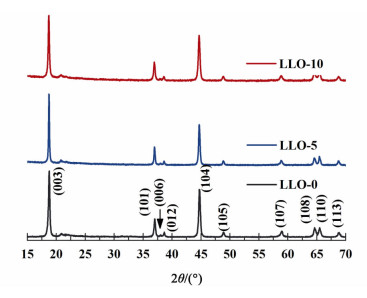
|
| 图 3 不同陈化时间下得到样品的XRD图谱 Figure 3 XRD patterns of samples synthesized with different aging time |
| |
从图 3中可以看出样品均属于R-3m空间群的α-NaFeO2型层状结构。其中2对衍射峰(006)/(012)和(108)/(110)分裂明显,表明材料均具有良好的层状结构。
表 2列出了不同陈化时间所对应材料的晶胞参数。3种样品的c/a均大于4.899,且随着陈化时间的延长,其值逐渐增大,可见适当的延长陈化时间可以获得更好层状结构的样品。
| Sample | a/nm | c/nm | c/a |
| LLO-0 | 0.2848 | 1.4184 | 4.9797 |
| LLO-5 | 0.2850 | 1.4213 | 4.9876 |
| LLO-10 | 0.2851 | 1.4233 | 4.9933 |
图 4a)、图 4b)和图 4c)为在不同陈化时间下合成的富锂层状材料的SEM图像。
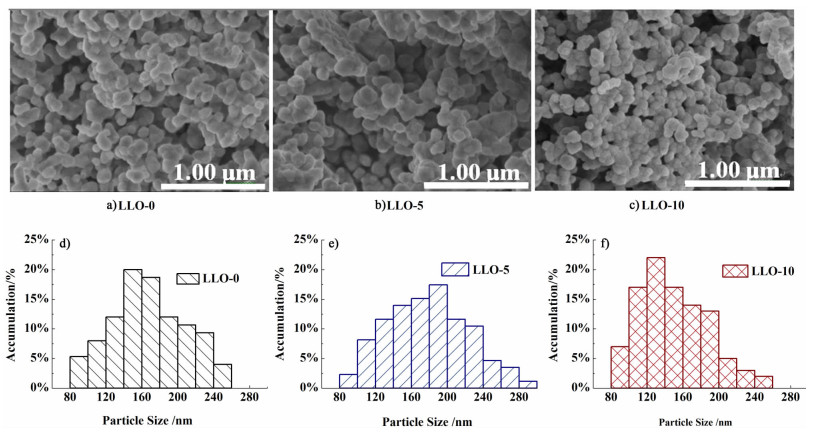
|
| 图 4 不同陈化时间下得到样品的SEM图a)~c)及粒径分布图d)~f) Figure 4 SEM images a)~c) and particle size distribution cures d)~f) of samples synthesized with different aging time |
| |
从图 4中可以看出,样品均为类球形颗粒,随着陈化时间的增加,样品颗粒的大小存在明显的不同。LLO-0、LLO-5和LLO-10样品颗粒的粒径分布图见图 4d)、图 4e)和图 4f)。LLO-0样品的平均粒径为180.6 nm,LLO-5样品的平均粒径比LLO-0略有增大,为183.4 nm,且从分布图中可以还看出小粒径(80~160 nm)的颗粒比例有所增加。而LLO-10样品的平均粒径最小,为151.47 nm。随着陈化时间的增加,样品粒径存在先增大后减小的趋势。推测产生这种现象的原因是:在溶胶形成的过程中,依靠柠檬酸为螯合剂,碱性条件下金属离子与氢氧根、乙酸根和柠檬酸根形成复杂的金属-柠檬酸螯合物,减少了溶液中的自由离子,如图 5所示[15]。虽然目前对溶胶中螯合物的组成与结合方式尚不明确,但通过参考其他溶胶-凝胶过程[16-17]可以推测出陈化过程促进了该螯合反应的进行程度,并通过缩聚反应形成的网络结构逐渐完善,相应的使最终颗粒的粒径增大。但陈化一定时间后,三维网络发生收缩团聚,使粒径减小。
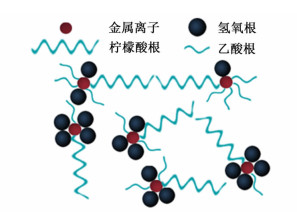
|
| 图 5 金属螯合物示意图 Figure 5 Schematic view of metal-chelated complexes |
| |
图 6为不同陈化时间下合成材料在0.1 C,电压范围为2.0~4.8 V条件下的首次充放电曲线。
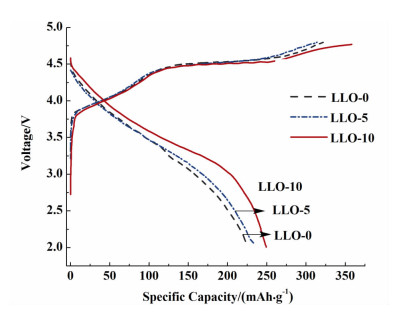
|
| 图 6 不同陈化时间下得到样品的首次充放电曲线 Figure 6 The initial charge-discharge curves of samples synthesized with different aging time |
| |
从图 6中可以看出,所有样品在首次充电过程中,存在2个充电平台:3.9~4.5 V和4.5 V左右的平台。当首次充电电压小于4.5 V时,材料发生的电化学反应主要来源于材料中LiMO2组分。随着充电的进行,当电压高于4.5 V时,材料中的Li2MnO3组分被活化,Li+从Li2MnO3组分锂层中脱出,同时伴随着O2-的释放,最终以“Li2O”的形式脱出,Li2MnO3组分形成具有电化学活性的类MnO2物质。这是富锂材料具有较高首次放电比容量的原因[18]。LLO-10的充电平台最长,且首次放电容量明显高于LLO-0和LLO-5样品,为253.8 mAh·g-1。
图 7是在不同陈化时间下合成材料在电压窗口为2.0~4.8 V,电流密度为0.1 C时循环60周放电比容量对比图。随着循环次数的增加,所有材料的放电容量递减,循环60周后,LLO-10的放电比容量最高,为206.7 mAh·g-1,对应首次放电容量而言,容量保持率为81%。适当的陈化时间所制备出的晶型完整、粒径较小的颗粒可缩短锂离子在材料内部扩散的距离,利于锂离子在材料晶格内部的脱嵌,同时减小了锂离子脱嵌对材料晶格的破坏和冲击。
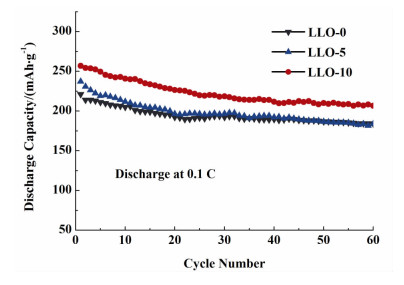
|
| 图 7 不同陈化时间下得到样品的循环性能曲线 Figure 7 The cycling performance of samples synthesized with different aging time |
| |
图 8是在不同陈化时间下所制得样品在2.0~4.8 V内,以0.1 C、0.2 C、0.5 C、1.0 C、2.0 C和5.0 C再重新回到0.1 C充放电的倍率性能对比图。可以看出,随着充放电电流的增大,所有样品的放电容量均下降。在相同的充放电电流下,尤其是大电流(2.0 C和5.0 C)充放电时,LLO-10样品具有更高的放电比容量。在2.0 C和5.0 C时LLO-10的放电比容量为125.6和92.6 mAh·g-1。LLO-10样品具有更好倍率性能的原因为小粒径的颗粒中,锂离子在材料内部迁移的路径更短,扩散面积更大,有利于锂离子的快速脱嵌。
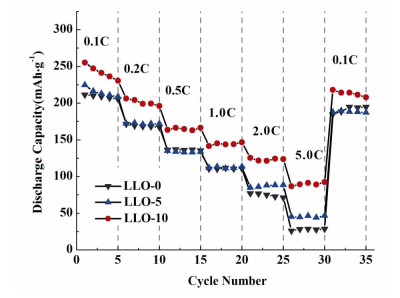
|
| 图 8 不同陈化时间下得到样品的倍率性能图 Figure 8 The rate capability of samples synthesized with different aging time |
| |
为了更好地理解陈化时间对材料倍率性能的影响,对所有样品在未充放电循环的状态下进行了交流阻抗测试,如图 9所示。
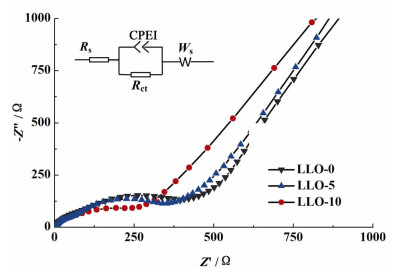
|
| 图 9 不同陈化时间下得到样品的交流阻抗图谱 Figure 9 EIS spectra of samples synthesized with different aging time |
| |
从图 9中可以看出,所有材料样品的交流阻抗图谱均由2部分组成:位于高频区的半圆和低频区的斜线。高频区的半圆与阻抗实轴的截距用来表示锂离子在电解液内部的迁移阻抗,用Rs表示;高频区的半圆直径对应电荷转移阻抗,用Rct表示;低频区的斜线表示Warburg阻抗,与锂离子在材料内部的扩散过程有关,用Zw表示。图中所有交流阻抗曲线均能与图中的等效模拟电路较好的吻合。
表 3为使用Zview进行交流阻抗谱拟合后各样品电路元件的拟合数据表。LLO-10具有最小的电荷转移阻抗,这说明锂离子能快速穿过材料界面进行脱嵌,与倍率性能测试中的结果一致。
| Sample | Rs/Ω | Rct/Ω |
| LLO-0 | 1.351 | 355 |
| LLO-5 | 1.432 | 351.8 |
| LLO-10 | 1.386 | 203.9 |
利用调节溶胶-凝胶法中煅烧温度和陈化时间,制备出了不同粒径的富锂层状材料Li1.2Mn0.54Ni0.13Co0.13O2。当煅烧温度为850 ℃时,可制备出在保证良好层状结构的同时粒径最小的富锂正极材料。在此基础上,改变陈化时间也能通过影响材料最终的粒径大小影响其电化学性能。陈化10 d所制备的材料具有最佳的电化学性能,0.1 C时首次放电比容量为253.8 mAh·g-1,循环60周后,放电比容量达206.7 mAh·g-1,容量保持率为81%。同时倍率性能也因适当的陈化时间得到改善,2.0 C和5.0 C时的放电比容量为125.6和92.6 mAh·g-1。
| [1] | Goodenough J B, Kim Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587–603. DOI: 10.1021/cm901452z |
| [2] | Yu H, Zhou H. High-Energy cathode materials (Li2MnO3-LiMO2) for lithium-ion batteries[J]. Journal of Physical Chemistry Letters, 2013, 4(8): 1268–1280. DOI: 10.1021/jz400032v |
| [3] |
田建华, 李向军, 位辰先, 等. LiFePO4/C复合材料的制备和性能[J].
化学工业与工程, 2007, 24(1): 1–4.
Tian Jianhua, Li Xiangjun, Wei Chenxian, et al. Preparation and performance of LiFePO4/C composites[J]. Chemical Industry and Engineering, 2007, 24(1): 1–4. |
| [4] | Thackeray M M, Johnson C S, Vaughey J T, et al. Advances in manganese-oxide 'composite' electrodes for lithium-ion batteries[J]. Journal of Materials Chemistry, 2005, 15(23): 2257–2267. DOI: 10.1039/b417616m |
| [5] |
苏银利, 王丹, 陈丽, 等. ZrO2包覆富锂正极材料Li[Li0.2Ni0.2Mn0.6]O2[J].
化学工业与工程, 2015, 32(4): 30–33.
Su Yinli, Wang Dan, Chen Li, et al. Modification of ZrO2-coated Li[Li0.2Ni0.2Mn0.6]O2[J]. Chemical Industry and Engineering, 2015, 32(4): 30–33. |
| [6] | Zheng J, Gu M, Xiao J, et al. Corrosion/fragmentation of layered composite cathode and related capacity/voltage fading during cycling process[J]. Nano Letters, 2013, 13(8): 3824–3830. DOI: 10.1021/nl401849t |
| [7] | Zheng J, Wu X, Yang Y. A comparison of preparation method on the electrochemical performance of cathode material Li[Li0.2Mn0.54Ni0.13Co0.13]O2 for lithium ion battery[J]. Electrochimica Acta, 2011, 56(8): 3071–3078. DOI: 10.1016/j.electacta.2010.12.049 |
| [8] | Li L, Xu M, Chen Z, et al. High-Performance lithium-rich layered oxide materials:Effects of chelating agents on microstructure and electrochemical properties[J]. Electrochimica Acta, 2015, 174: 446–455. DOI: 10.1016/j.electacta.2015.05.171 |
| [9] | Wang F, Li M S, Lu Y P, et al. A simple sol-gel technique for preparing hydroxyapatite nanopowders[J]. Materials Letters, 2005, 59(8/9): 916–919. |
| [10] | Ren W, Zhao Y, Hu X, et al. Preparation-Microstructure-Performance relationship of Li-rich transition metal oxides microspheres as cathode materials for lithium ion batteries[J]. Electrochimica Acta, 2016, 191: 491–499. DOI: 10.1016/j.electacta.2016.01.089 |
| [11] | 赖德聪. 过锂三元复合材料作为锂电池正极材料的研究[D]. 重庆: 重庆大学, 2010 Lai Decong. Synthesis and characterization of Li-rich triplets compound cathodes for lithium ion batteries[D]. Chongqing: Chongqing University, 2010(in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10611-2010217876.htm |
| [12] | Thackeray M M, Kang S H, Johnson C S, et al. Li2MnO3-Stabilized LiMO2 (M=Mn, Ni, Co) electrodes for lithium-ion batteries[J]. Journal of Materials Chemistry, 2007, 17(30): 3112–3125. DOI: 10.1039/b702425h |
| [13] | Gong Z, Liu H, Guo X, et al. Effects of preparation methods of LiNi0.8Co0.2O2 cathode materials on their morphology and electrochemical performance[J]. Journal of Power Sources, 2004, 136(1): 139–144. DOI: 10.1016/j.jpowsour.2004.05.022 |
| [14] | Wu F, Wang Z, Su Y, et al. Synthesis and characterization of hollow spherical cathode Li1.2Mn0.54Ni0.13Co0.13O2 assembled with nanostructured particles via homogeneous precipitation-hydrothermal synthesis[J]. Journal of Power Sources, 2014, 267: 337–346. DOI: 10.1016/j.jpowsour.2014.05.097 |
| [15] | Predoana L, Jitianu A, Voicescu M, et al. Study of formation of LiCoO2 using a modified Pechini aqueous sol-gel process[J]. Journal of Sol-Gel Science and Technology, 2015, 74(2): 406–418. DOI: 10.1007/s10971-014-3611-2 |
| [16] | 唐天洪. 前躯体溶胶液陈化时间与钙磷比对Bioglass@CNF结构演变及生物学性能影响机制的研究[D]. 北京: 北京化工大学, 2015 Tang Tianhong. The influence of aging time and CA/P ratio of precursor solution on structure evolution and biological properties of bioglass@CNF[D]. Beijing: Beijing University of Chemical Technology, 2015(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10010-1015726327.htm |
| [17] | Cheng D, Xie R, Tang T, et al. Regulating micro-structure and biomineralization of electrospun PVP-based hybridized carbon nanofibers containing bioglass nanoparticles via aging time[J]. RSC Advances, 2016, 6(5): 3870–3881. DOI: 10.1039/C5RA23337B |
| [18] | Zheng J, Gu M, Genc A, et al. Mitigating voltage fade in cathode materials by improving the atomic level uniformity of elemental distribution[J]. Nano Letters, 2014, 14(5): 2628–2635. DOI: 10.1021/nl500486y |
 2018, Vol. 35
2018, Vol. 35





