2. 中国电子科技集团第十八研究所, 天津 300381
2. Tianjin Institute of Power Sources, Tianjin 300381, China
锂硫电池是以单质硫为正极、金属锂为负极的高能二次电池体系。高达2 600 W·h/kg的理论能量密度,以及硫单质环保、价格便宜等诸多优点,使其受到广泛关注。目前有关锂硫电池的研究主要集中于电池的性能提高和模拟仿真2个方向。在模型仿真研究中,尽管Kumaresan[1]、Ghaznavi[2-4]、Fronczek等[5]分别建立了锂硫电池硫单质连续还原模型并对各个因素,诸如:浓度、沉淀反应速率等对锂硫电池放电容量的影响进行了系统讨论,然而在上述模型中未充分考虑绝缘体——多硫化物沉淀会导致正极活性比表面积损失,造成拟合的前期放电曲线电压平台平坦,末期陡降的结果,这与实验曲线相差甚远,因此上述的研究尚有待改进。本论文借鉴锂空电池Li2O2沉淀反应造成多孔碳活性表面积堵塞,在锂硫电池多硫化物沉淀过程中引入活性反应表面积失效的影响。同时考虑多硫化物形核、生长沉淀过程,完善了锂硫电池反应模型。
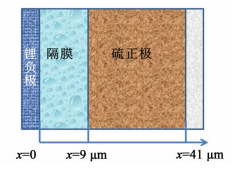
1 模型 1.1 模型建立锂硫电池电化学总反应按16Li+S8(s)⇌8Li2S进行,正极为硫单质的多步还原反应[1]。锂硫电池硫单质S8(l)和多硫离子S82-、S62-、S42-、S22-各分步还原反应以及多硫化物的沉淀反应如表 1所示。锂硫电池模型几何结构如图 1所示。模拟区间包括金属锂负极,多孔碳与硫单质组成的正极,以及多孔隔膜3部分。模型对应的几何尺寸参数和多硫化物体积分数如表 2所示。由于锂负极相对于硫正极反应速率快,电极过电势小,因此可忽略其电极厚度对电池反应的影响。模拟区间以锂负极与隔膜的接触面为原点开始计算。
| 反应 | 正极 | 隔膜 | 负极 | |
| 电化学反应 | (1) Li⇌Li++e- | √ | ||
| (2)1/2S8(l)+e-⇌1/2S82- | √ | |||
| (3)1/2S82-+e-⇌2S62- | √ | |||
| (4) S62-+e-⇌3/2S42- | √ | |||
| (5)1/2S42-+e-⇌S22- | √ | |||
| (6)1/2S22-+e-⇌S2- | √ | |||
| 沉淀与溶解反应 | (7) S8(s)⇌S8(l) | √ | √ | √ |
| (8)2Li++S82-⇌Li2S8 | √ | √ | √ | |
| (9)2Li++S42-⇌Li2S4 | √ | √ | √ | |
| (10)2Li++S22-⇌Li2S2 | √ | √ | √ | |
| (12)2Li++S2-⇌Li2S | √ | √ | √ |
|
| 图 1 锂硫电池模拟区间 Figure 1 Schematic of lithium-sulfur cell |
| |
| 参数 | 正极 | 隔膜 | 负极 |
| 厚度/m | 41×10-6 | 9×10-6 | 100×10-6 |
| ε0 | 0.778 | 0.37 | 0.37 |
| εS8(S) | 0.16 | 1×10-12 | 1×10-12 |
| εLi2S8(S)0 | 1×10-6 | 1×10-6 | 1×10-6 |
| εLi2S4(S)0 | 1×10-6 | 1×10-6 | 1×10-6 |
| εLi2S2(S)0 | 1×10-6 | 1×10-6 | 1×10-6 |
| εLi2S(S)0 | 1×10-7 | 1×10-7 | 1×10-7 |
| a0 | 132 762 | 1×106 |
锂硫电池多孔介质中,包括各物质的质量守恒方程如式(1) 所示。
| $ \frac{{\partial \varepsilon {C_i}}}{{\partial t}} = - \nabla {N_i} + {r_i} - {R_i} $ | (1) |
以及对应的各物质通量如式(2) 所示。
| $ {N_i} = - {D_{i,0}}{\varepsilon ^b}\nabla {C_i} - {Z_i}\frac{{{D_i}}}{{RT}}F{C_i}\nabla {\varphi _l} $ | (2) |
各物质体相溶液的扩散系数为Di, 0,分别由b=1.5进行修正,以反映多孔电极孔隙率和曲折度对各物质传递的影响。其中各物质的扩散系数与参考浓度如表 3所示。电化学反应(1)~(6) 中,各物质生成或者消耗的速率可表示为:
| 物质(i) | Zi | Di, 0/(m2·s-1) | Ci, ref/(mol·m-3) |
| Li+ | +1 | 1×10-10 | 1 001.08 |
| S8(l) | 0 | 10×10-10 | 19.0 |
| S82- | -2 | 6×10-10 | 0.1832 |
| S62- | -2 | 6×10-10 | 0.3351 |
| S42- | -2 | 1×10-10 | 0.02146 |
| S22- | -2 | 1×10-10 | 5.999×10-7 |
| S2- | -2 | 1×10-10 | 9.94×10-10 |
| A- | -1 | 4×10-10 | 1 000 |
| $ {r_i} = a\sum\limits_j {\frac{{{s_{ij}}{i_j}}}{{{n_j}F}}} $ | (3) |
Ri表示为为沉淀/溶解反应速率,均作为式(1) 中的来源项。
1.3 质子和电子守恒方程液相电流密度由各带电粒子流量乘以所带电荷得到,如式(4) 所示。
| $ {i_l} = F\sum\limits_i {{Z_i}{N_i}} $ | (4) |
固相电流密度遵循欧姆定律,如式(5) 所示。
| $ {i_s} = - \sigma \nabla {\varphi _s} $ | (5) |
电荷离开或者进入液相都是基于电极电化学反应。因此,固液界面对应的界面电流密度传输为:
| $ \nabla \cdot {i_l} = a\sum\nolimits_j {{i_j}} $ | (6) |
以及对应的电荷守恒,如式(7) 所示。
| $ \nabla {i_s} + \nabla {i_l} = 0 $ | (7) |
锂硫电池中各物质电化学反应电流密度可由浓度修正的Butler-Volmer方程表示,如式(9) 所示。
| $ \begin{array}{l} {i_j} = {i_{0,jref}}\left\{ {\prod\limits_i {{{\left( {\frac{{{C_{ij}}}}{{{C_{i,{\rm{ref}}}}}}} \right)}^{\left| {{s_{ij}}} \right|}}\exp \left( {\frac{{{\alpha _{aj}}F}}{{RT}}{\eta _j}} \right)} - } \right.\\ \;\;\;\;\;\;\left. {\prod\limits_i {{{\left( {\frac{{{C_{ij}}}}{{{C_{i,{\rm{ref}}}}}}} \right)}^{\left| {{s_{ij}}} \right|}}\exp \left( { - \frac{{{\alpha _{cj}}F}}{{RT}}{\eta _j}} \right)} } \right\} \end{array} $ | (8) |
反应过电势为:
| $ {\eta _j} = {\varphi _s} - {\varphi _l} - {U_{j,{\rm{ref}}}} $ | (9) |
因为各物质初始浓度并不是标准活性物质浓度,Uj, ref由式(10) 进行修正。锂硫电池各反应的热力学与动力学参数如表 4所示。
| $ {U_{j,{\rm{ref}}}}{\rm{ = }}U_j^\Theta - \frac{{RT}}{{{n_j}F}}\sum\limits_i {{s_{i,j}}\ln \left( {\frac{{{C_{i,{\rm{ref}}}}}}{{1000}}} \right)} $ | (10) |
锂硫电池多硫化物的沉淀反应和正极固体硫单质的溶解反应由(11) 式表示。
| $ {R_i} = \sum\limits_k {{\gamma _{i,k}}R{'_k}} $ | (11) |
沉淀/溶解反应速率,如式(12) 所示。
| $ R{'_k}{\rm{ = }}\left\{ {{k_{\rm{N}}} + {k_{\rm{G}}}{{\left( {{\varepsilon _k}} \right)}^m}} \right\}\left( {\prod\limits_i {C_i^{{\gamma _{i,k}}} - {K_{{\rm{sp}},k}}} } \right) $ | (12) |
各多硫化合物沉淀体积分数变化为
| $ \frac{{\partial {\varepsilon _k}}}{{\partial t}} = {V_k}R{'_k} $ | (13) |
电极孔隙率变化可由(14) 式表示。
| $ \frac{{\partial \varepsilon }}{{\partial t}} = {\varepsilon _0} - \sum\limits_k {{V_k}R{'_k}} $ | (14) |
锂硫电池硫单质和多硫化合物的溶解/沉淀反应参数如表 5所示。
| 沉淀物k | 生长速率常数kG/(m6·mol-2·s-1) | 形核速率常数kN/(m6·mol-2·s-1) | 溶度积Ksp, k/(mol3·m-9) | 摩尔体积分数Vk/(m3·mol-1) |
| S8(S) | 1 s-1 | 1.000×10-3s-1 | 19 mol/m3 | 1.239×10-4 |
| Li2S8(S) | 1.000×10-11 | 1.000×10-14 | 183 400 | 1.361×10-4 |
| Li2S4(S) | 9.980×10-12 | 9.980×10-15 | 21 480 | 7.415×10-4 |
| Li2S2(S) | 9.980×10-9 | 9.980×10-12 | 0.6006 | 4.317×10-5 |
| Li2S(S) | 6.875×10-5 | 6.875×10-8 | 9.95×10-4 | 2.768×10-5 |
锂硫电池反应比表面积由(15) 式和(16) 式表示。
| $ a = {a_0}{\left( {\frac{\varepsilon }{{{\varepsilon _0}}}} \right)^\xi } $ | (15) |
| $ a = {a_0}\left( {1 - {\rm{erf}}\left( {\frac{{{\varepsilon _{{\rm{prep}}}}}}{{{\varepsilon _{{\rm{init}}}}}}} \right)} \right) $ | (16) |
其中,ξ用于描述多硫化物形貌系数对电化学反应活性比表面积的影响。a0为正极初始比表面积,ε0为正极初始孔隙率。εprep为多硫化物沉淀体积分数,εinit为活性比表面积完全失效时多硫化物沉淀体积分数。
式(15) 反映正极由于S8(s)的溶解和多硫化物的沉淀导致孔隙率变化,引起电极活性比表面积变化。鉴于以往的研究结果不能反映真实的锂硫电池放电曲线,引入微观-宏观均相模型[6](micro-macro homogeneous model),多硫化物的沉淀使多孔碳活性表面积堵塞,造成活性反应表面积失效的影响[7]。同时结合锂/亚硫酰氯电池的LiCl沉淀模型[8],使用误差函数erf(x)来模拟具有绝缘性质的多硫化物沉淀反应对电极活性比表面积的影响。本文采用式(16) 加大了多硫化合物沉淀对电极活性比表面积的影响,完善了多硫化物沉淀过程,以此来优化沉淀反应对锂硫电池放电性能的影响。
1.6 边界条件锂硫电池边界条件设定如下:正极边界条件
| $ {N_i} = 0,\;{i_s} = {I_{{\rm{app}}}},\;{i_l} = 0 $ | (17) |
隔膜与正极/负极边界条件
| $ {N_{i,{\rm{sep}}}} = {N_{i,{\rm{cat}}/{\rm{anode}}}} $ | (18) |
| $ {i_{l,{\rm{sep}}}} = {i_{l,{\rm{cat}}/{\rm{anode}}}} = \left| {{I_{app}}} \right| $ | (19) |
负极边界条件
| $ {i_{\rm{s}}} = 0,\;{\varphi _{\rm{s}}} = 0,\;{N_i} = \frac{{{i_i}}}{{{Z_i}F}} $ | (20) |
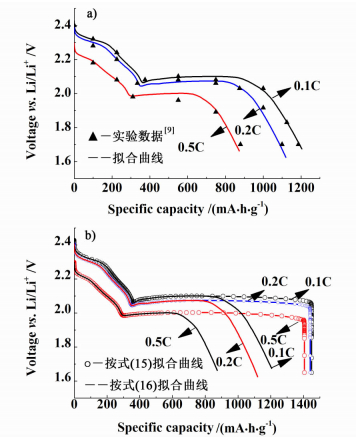
采用商业化COMSOL Multiphysics 4.3b数值模拟软件,构建偏微分方程来描述锂硫电池反应的物理现象。本论文拟合了放电倍率分别为0.1 C,0.2 C和0.5 C的放电曲线,结果如图 2a)所示。从图 2a)可看到,放电曲线出现2段,特别是放电末期出现了明显的电压降,拟合结果与Yang等[9]的实验数据相符。由于放电电流密度增加导致欧姆压降增大,电压平台末期会出现下降。同时,导致锂硫电池放电容量衰减。图 2b)为采用Kumaresan等[1]的活性比表面积表达式(15),与本研究修正的活性比表面积表达式(16) 得到的不同倍率放电曲线对比图。按式(15) 的拟合结果与Kumaresan等[1]研究结果一致。这表明,由于未充分考虑活性表面积被绝缘体——多硫化物覆盖,正极活性面积大量减少的影响,锂硫电池反应末期出现了电压垂直下降,与前述的实际放电曲线不符。这可能是由于固体S8的溶解,造成该方程中孔隙率ε数值在计算中从初始值0.78增加到0.94,最后只下降到0.64。ε在整个放电过程中维持较大数值,沉淀反应对活性表面积a前后变化影响不大,以致式(15) 未准确反映活性比表面积损失。在实际情况下,固体S8的绝缘性,造成电极活性反应比表面积应主要与导电多孔碳的比表面积有关。因此,从图 2b)可以看出,本研究采用式(16),修正锂硫电池沉淀反应导致活性面积损失的影响,计算结果符合实验数据,模型更符合锂硫电池的实际情况。
|
| 图 2 锂硫电池的不同倍率放电曲线拟合曲线 Figure 2 The discharge curves of lithium-sulfur cell at different discharge current rate |
| |
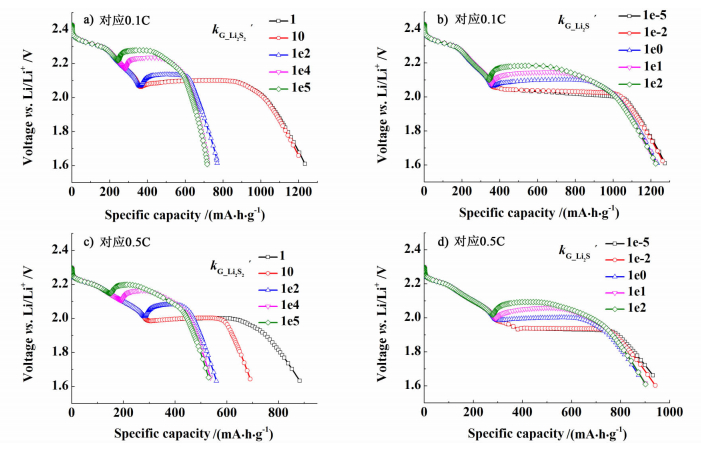
分别选取放电倍率为0.1 C和0.5 C,研究Li2S2和Li2S不同生长速率kG对锂硫电池放电曲线的影响,拟合结果如图 3所示。
|
| 图 3 锂硫电池中Li2S2和Li2S不同生长速率kG对应0.1 C和0.5 C放电曲线 Figure 3 The discharge curves of lithium-sulfur cell for different growth rate constants of Li2S2 and Li2Sat 0.1 C and 0.5 C |
| |
从图 3a)和图 3c)可看到,Li2S2较大的生长速率kG有利于提高电压平台,但同时使得锂硫电池放电容量出现衰减。主要原因可能是较大的Li2S2生长速率kG,使得沉淀反应先于第2个电压平台进行,导致电压平台升高。而S22-主要以多Li2S2沉淀物的形式存在,电化学反应方程式(6) 未能充分进行,锂硫电池容量衰减严重。
从图 3b)和图 3d)可看到,Li2S不同生长速率kG对锂硫电池放电容量的变化影响不大。同时Li2S较大的生长速率kG有利于第2阶段放电电压平台的提高,甚至电压平台出现拐点,但对第1阶段放电电压平台无影响。该现象与锂硫电池采用不同锂盐的电解质溶液对应的放电实验数据[10]表现一致。因此,上述放电实验数据中第2阶段初始放电电压平台出现一定程度提高的现象,可能与其选用的电解质溶液有利于Li2S沉淀有关。从图 3b)和图 3d)拟合结果还可看出,Li2S较小的生长速率kG会使得第2阶段放电电压平台出现一定坡度的下降。特别是在0.5 C放电倍率下,出现了电压平台向下滑移和放电容量减小。Mikhaylik的实验结果[10]显示,较低温度下,第1阶段放电电压平台对应的放电容量反而要大于常温下锂硫电池的放电容量。出现这种现象的原因很可能是低温条件Li2S较小的生长速率kG导致了第2阶段电压平台向下滑移,从而使得第1阶段放电容量有所增大。
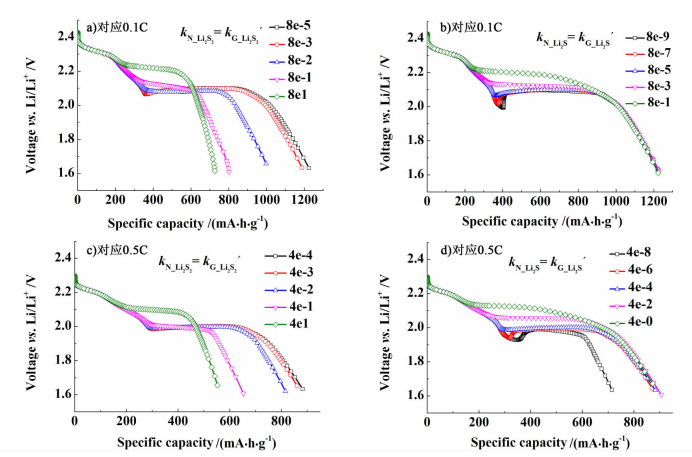
2.3 多硫化物形核速率kN对沉淀反应的影响分别选取放电倍率为0.1 C和0.5 C,研究Li2S2和Li2S不同形核速率kN对锂硫电池放电曲线的影响,拟合结果如图 4所示。
|
| 图 4 锂硫电池中Li2S2和Li2S不同形核速率kN对应0.1 C和0.5 C放电曲线 Figure 4 The discharge curves of lithium-sulfur cell for different nucleation rate constants of Li2S2 and Li2Sat 0.1 C and 0.5 C |
| |
模拟结果显示,由方程(12) 得知多硫化物生长速率kG与沉淀物体积分数成比例,故较小的多硫化物体积分数使得在沉淀反应初期形核速率kN占主导地位,形核速率kN对放电曲线的影响在沉淀反应初期要大于生长速率kG。由图 4a)和图 4c)可以看出,Li2S2形核速率kN对放电曲线的影响与其生长速率kG类似,较大的Li2S2生长速率kG,同样会造成锂硫电池放电电压平台升高和放电容量衰减。而由图 4c)和图 4d)可以看出,Li2S较大的形核速率kN,使得第2阶段电压平台有所提高,同时缩小了第1阶段的放电容量,这与其生长速率kG对应的影响有所不同。比较图 3和图 4可知,较快的形核速率会导致放电曲线在200~450 mA·h·g-1之间出现拐点,其拟合曲线与Ghaznavi模拟结果[3]相吻合。
2.4 多硫化物沉淀形貌系数m对沉淀反应的影响分别选取放电倍率为0.1 C和0.5 C,研究Li2S2和Li2S沉淀形貌系数m[见式(12) 指数项]对锂硫电池放电曲线的影响,拟合结果如图 5所示。
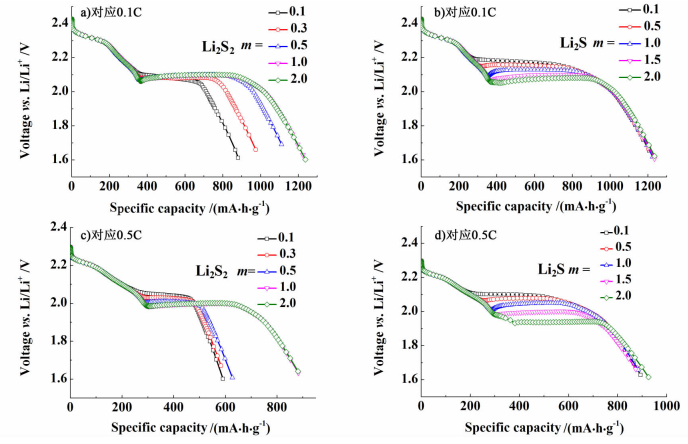
|
| 图 5 锂硫电池中Li2S2和Li2S沉淀形貌系数m对应0.1 C和0.5 C放电曲线 Figure 5 The discharge curves of lithium-sulfur cell for different morphological parameters of Li2S2 and Li2Sat 0.1 C and 0.5 C |
| |
当锂硫电池充分反应时,多硫化物主要以Li2S2和Li2S形式存在[3]。本研究主要研究了沉淀形貌系数m对Li2S2和Li2S沉淀反应以及对应放电曲线的影响。沉淀形貌系数m表现为多硫化物在活性表面积上的沉淀形貌,较小的m值意味着多硫化物沉淀更加均匀、平坦,而较大的m值类似针状沉淀,沉淀效果较差[6]。由图 5a)和图 5c)可知,随着沉淀形貌系数m变小,Li2S2沉淀反应速率加快,拟合结果与Li2S2不同形核速率kN对锂硫电池放电性能的影响类似,放电容量减小,放电电压平台略有升高。同时,在较大放电倍率条件下,m的大小对Li2S2沉淀反应的影响增大,放电容量衰减程度加大。由图 5b)和图 5d)可知,Li2S沉淀形貌系数m的大小对锂硫电池放电容量影响不大,但对电压平台高低变化有较大影响。较小的m沉淀效率更高,加快了Li2S沉淀体积分数对kG的影响,有利于提高电压平台。而较大的m导致Li2S沉淀速率降低,特别是造成大电流放电电压平台下降明显。因此,选择适宜的有机电解质溶液提高多硫化物沉淀速率有利于提高锂硫电池放电平台和放电容量。
3 结论使用COMSOL Multiphysics建立了锂硫电池数值模型,着重修正了原有模型因为对活性比表面积变化考虑不足,造成锂硫电池放电性能预测不准确的影响。通过与实验数据对比,模拟放电曲线和实验结果吻合,验证了模型的正确性,利用该模型可得到以下结论。
1) 多硫化物沉淀过程造成电极活性比表面积大量减少,是锂硫电池放电性能降低的主要原因。通过误差函数erf(x)来表示活性比表面积变化,以及采用形核-生长沉淀模型能够准确的模拟锂硫电池放电过程。
2) 由于多硫化物的绝缘性和沉淀反应都会造成锂硫电池活性比表面积逐渐减少,放电性能逐渐降低。原有模型假设不准确的原因在于固体硫的溶解会使得电极孔隙率增大,而孔隙率ε主要表现为电解液的空间体积分数,更多的是影响电解液传输性质。
3) Li2S较大的生长速率kG和形核速率kN均有利于锂硫电池第2阶段放电电压平台和放电容量的提高。Li2S2较大的生长速率kG和形核速率kN在提高第2阶段放电电压平台的同时,会压缩第1阶段放电电压平台,同时造成放电容量衰减。Li2S2沉淀形貌系数m减小,会使Li2S2沉淀反应速率加快,放电容量减小,放电电压平台略有升高。而Li2S沉淀形貌系数m的大小对锂硫电池放电容量影响不大,但对电压平台高低变化有较大影响。
符号说明:
a—正极比表面积;
a0—正极初始比表面积;
b—Bruggeman系数;
ci—物质i浓度(i=Li+, S8(l), S82-, S62-, S42-, S22-, S2-, A-), mol·m-3;
Di, 0—物质i体相扩散系数, m2·s-1;
F—法拉第常数, 96485 C·mol-1;
ij—反应j电流密度, A·m-2;
il—液相表面电流密度, A·m-2;
is—固相表面电流密度, A·m-2;
Ksp—多硫化物溶度积;
kG—生长速率常数;
kN—形核速率常数;
m—多硫化物形貌系数对沉淀反应[式(12)]的影响;
ξ—多硫化物形貌系数对电化学反应[式(15)]的影响;
σ—正极固相有效电导率, S·m-1;
ηj—电化学反应j过电势;
φs—固相电势, V;
φl—液相电势, V;
αaj—反应j阳极传输系数;
αcj—反应j阴极传输系数;
Zi—物质i电荷数;
Vk—多硫化物k摩尔体积分数, m3·mol-1;
ri—物质i基于电化学反应的反应速率, mol·m-3·s-1;
Ri—物质i基于沉淀反应的反应速率, mol·m-3·s-1;
sij—物质i基于电化学反应的化学计量系数;
nj—电化学反应电荷传输个数;
T—锂硫电池温度;
ε—正极和隔膜孔隙率;
ε0—正极初始孔隙率;
εk—正极和隔膜多硫化物沉淀体积分数;
εprep—多硫化物沉淀体积分数;
εinit—活性比表面积完全失效时多硫化物沉淀体积分数。
| [1] | Kumaresan K, Mikhaylik Y, White R E. A mathematical model for a lithium-sulfur cell[J]. Journal of The Electrochemical Society, 2008, 155(8): A576–A582. DOI: 10.1149/1.2937304 |
| [2] | Ghaznavi M, Chen P. Sensitivity analysis of a mathematical model of lithium-sulfur cells part Ⅰ: Applied discharge current and cathode conductivity[J]. Journal of Power Sources, 2014, 257: 394–401. DOI: 10.1016/j.jpowsour.2013.10.135 |
| [3] | Ghaznavi M, Chen P. Sensitivity analysis of a mathematical model of lithium-sulfur cells: Part Ⅱ: Precipitation reaction kinetics and sulfur content[J]. Journal of Power Sources, 2014, 257: 402–411. DOI: 10.1016/j.jpowsour.2013.12.145 |
| [4] | Ghaznavi M, Chen P. Analysis of a mathematical model of lithium-sulfur cells Part Ⅲ: Electrochemical reaction kinetics, transport properties and charging[J]. Electrochimica Acta, 2014, 137: 575–585. DOI: 10.1016/j.electacta.2014.06.033 |
| [5] | Fronczek D N, Bessler W G. Insight into lithium-sulfur batteries: Elementary kinetic modeling and impedance simulation[J]. Journal of Power Sources, 2013, 244: 183–188. DOI: 10.1016/j.jpowsour.2013.02.018 |
| [6] | Sahapatsombut U, Cheng H, Scott K. Modelling the micro-macro homogeneous cycling behaviour of a lithium-air battery[J]. Journal of Power Sources, 2013, 227: 243–253. DOI: 10.1016/j.jpowsour.2012.11.053 |
| [7] | Xue K, Nguyen T K, Franco A A. Impact of the cathode microstructure on the discharge performance of lithium air batteries: A multiscale model[J]. Journal of the Electrochemical Society, 2014, 161(8): E3 028–E3 035. DOI: 10.1149/2.002408jes |
| [8] | Tsaur K C, Pollard R. Precipitation of solids in electrochemical cells[J]. Journal of the Electrochemical Society, 1986, 133(11): 2 296–2 308. DOI: 10.1149/1.2108398 |
| [9] | Yang Y, Yu G, Cha J, et al. Improving the performance of lithium sulfur batteries by conductive polymer coating[J]. ACS, 2011, 5(11): 9 187–9 193. |
| [10] | Mikhaylik Y V, Akridge J R. Low temperature performance of Li/S batteries[J]. Journal of the Electrochemical Society, 2003, 150(3): A306–A311. DOI: 10.1149/1.1545452 |
 2017, Vol. 34
2017, Vol. 34





