2. 北京中寰工程项目管理有限公司, 北京 100176
2. Beijing Zhonghuan Engineering Project Management Co. Ltd, Beijing 100176, China
邻苯二酚和对苯二酚都是重要的有机化工原料中间体,广泛应用在农药、医药、香料、染料和感光材料等工业领域[1-2]。传统的制备邻苯二酚的方法有邻氯苯酚水解法和2, 4-二磺酸基苯酚碱熔法,而对苯二酚则通过苯胺氧化法、对二异丙苯氧化法制得;但这些方法大都生产工艺复杂,操作条件苛刻,生产过程用到的浓酸浓碱对设备腐蚀性较大,产生的废物污染严重。而新型的苯酚羟基化反应以过氧化氢为氧化剂,生成苯二酚,副产物为焦油和水,反应原料易得,反应温度温和,产生的废水可以通过生化处理达标排放,符合绿色化学的要求,因此成为广大研究者的关注热点。目前,应用此方法的催化剂研究包括无机酸[3]、金属氧化物[4]、分子筛[5-6]、水滑石[7]、离子交换树脂[8]等。无机酸对设备的耐腐蚀性要求较大,分子筛合成过程比较复杂、应用成本较高,相比而言离子交换树脂具有较大的离子交换容量、较大的比表面积,制备工艺成熟,成本低廉,逐渐成为一种新型的催化剂制备选择。
目前,离子交换树脂大多用于去除废水中的金属离子[9-11],如Ca2+,Ni2+,Pb2+,Al3+,Cr(Ⅵ)和Fe3+;另外,在有机合成中离子交换树脂常作为催化剂用于催化酯化、脱水[12-13]等反应。将离子交换树脂作为催化剂载体应用到苯酚羟基化反应中的报道并不多[14-15],而铁离子是苯酚羟基化反应的主要活性中心,故本文选择抗氧化性较强、具有较大离子交换容量的D72离子交换树脂作为载体,运用离子交换法制备Fe-D72树脂催化剂应用到苯酚羟基化反应中,考察不同反应条件对催化效果的影响,为实际应用奠定理论基础。
1 实验部分 1.1 实验试剂与仪器| 化学试剂种类 | 质量分数 | 生产厂家 |
| 氯化铁 | ≥99% | 天津市科密欧化学试剂公司 |
| 浓盐酸 | 36%~38% | 天津市江天化工技术有限公司 |
| 氢氧化钠 | ≥96.0% | 天津市江天化工技术有限公司 |
| 过氧化氢(H2O2) | ≥30% | 天津市江天化工技术有限公司 |
| 乙醇 | ≥99.7% | 天津市光复精细化工研究所 |
| 苯甲醇 | ≥99.5% | 北京百灵威科技有限公司 |
| 苯酚(PH) | ≥99.0% | 北京百灵威科技有限公司 |
| 邻苯二酚 | ≥99.1% | 北京百灵威科技有限公司 |
| 对苯二酚 | ≥99.0% | 北京百灵威科技有限公司 |
| D72树脂 | 南开大学化工厂 |
| 实验仪器种类 | 生产厂家 |
| 紫外可见分光光度计(752型) | 上海菁华科技仪器有限公司 |
| 数显水浴恒温振荡器(SHA-CA) | 天津津立仪器设备科技发展有限公司 |
| 毛细管柱(DB-5) | 天津市谱析科学仪器有限公司 |
| 气相色谱仪(SP-6800A) | 山东鲁南瑞虹化工仪器有限公司 |
首先对D72树脂进行预处理:采用去离子水冲洗数次至水质清亮为止,用1 mol·L-1 HCl溶液浸泡4 h,然后用去离子水清洗至中性,再将其置于1 mol·L-1 NaOH溶液内浸泡4 h,然后用去离子水清洗至中性,重复以上操作2遍,最后再用1 mol·L-1的NaOH溶液浸泡4 h使树脂转成钠型,再用去离子水洗至中性,干燥备用。
Fe-D72树脂催化剂制备:称取0.1 g预处理之后的D72树脂放置在150 mL锥形瓶中,加入100 mL氯化铁溶液进行离子交换,溶液pH值通过HCl和NaOH溶液调节至1.8,并将锥形瓶放置在恒温振荡器中转动24 h,控制温度为30 ℃,转速为180 r/min以确保更多的铁离子与树脂上的磺酸功能基结合[16];之后离心过滤分离Fe-D72树脂,用去离子水清洗多次直至洗液中无多余的3价铁离子;然后将上述树脂置于干燥箱,70 ℃条件下干燥处理72 h,最终得到实验所需的催化剂记为Fe-D72,通过控制不同的初始氯化铁浓度(100~400 mg·L-1)可以得到具有不同含铁量的催化剂[8]。
1.3 苯酚羟基化反应苯酚羟基化反应在三口烧瓶中进行,配有恒温回流和磁力搅拌装置,先放入一定量的苯酚、催化剂、去离子水,待升温至一定温度时,缓慢滴加一定量的质量分数为30%的过氧化氢溶液,每间隔一段时间进行取样分析。
1.4 分析方法通过邻氮二菲分光光度法测量氯化铁溶液中铁离子与D72树脂离子交换前后的浓度变化,按公式(1) 计算催化剂含铁量。
| ${q_{\rm{e}}} = \frac{{V({C_0} - {C_{\rm{e}}})}}{m}$ | (1) |
式(1) 中,qe为催化剂含铁量,mg·g-1;C0为溶液初始铁离子浓度,mg·L-1;Ce为离子交换平衡时溶液含铁离子浓度,mg·L-1;V为溶液的体积,mL;m为树脂的质量,g。
气相色谱的操作条件:N2为载气,FID检测器温度为260 ℃,汽化室温度为290 ℃,柱温为170 ℃。苯酚羟基化反应液的分析采用内标法,内标物选用苯甲醇。苯酚的转化率、苯二酚的选择性和收率计算见式(2)、式(3) 和式(4)。
| ${X_{{\rm{phenol}}}} = \frac{{{m_{{\rm{phenol}}}} - {m_{{\rm{phenol}}末}}}}{{{m_{{\rm{phenol}}}}}}$ | (2) |
| ${S_{{\rm{DHB}}}} = \frac{{94({m_{{\rm{CAT}}}} + {m_{{\rm{HQ}}}})}}{{110({m_{{\rm{phenol}}初}} - {m_{{\rm{phenol}}末}})}}$ | (3) |
| ${Y_{{\rm{DHB}}}} = {X_{{\rm{phenol}}}} \cdot {S_{{\rm{DHB}}}}$ | (4) |
mCAT,生成的邻苯二酚的质量,g;mHQ,生成的对苯二酚的质量,g;YDHB,苯二酚的收率;SDHB,苯二酚的选择性;Xphenol,苯酚的转化率。
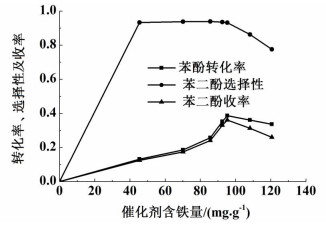
2 结果与讨论 2.1 不同含铁量及催化剂载体对苯酚羟基化反应的影响为了验证树脂载体和Fe-D72树脂的含铁量对苯酚羟基化反应的影响,保持其它反应条件一致:反应温度为50 ℃,反应时间为0.5 h,催化剂用量为0.1 g,n(PH)/n(H2O2)=1,m(H2O)/m(PH)=21;分别以D72空白树脂,具有不同含铁量的Fe-D72树脂做对比实验,具体反应结果如图 1所示。
|
| 图 1 催化剂含铁量对苯酚羟基化反应的影响 Figure 1 Influence of catalyst' iron content on the phenol hydroxylation |
| |
从图 1可以看到,空白树脂并没有任何催化效果,因为离子交换树脂的磺酸基功能基团对反应物苯酚并没有催化作用;而随着Fe-D72树脂的含铁量从45.5 mg·g-1增加到120.6 mg·g-1,苯酚转化率、苯二酚选择性和收率均先增加后降低。这是因为铁离子是苯酚羟基化反应的活性中心,铁离子与树脂进行离子交换后,铁离子稳定均匀的分散在树脂表面上。铁含量增加,促进苯酚羟基化反应进行,提高苯酚转化率和苯二酚的选择性;而当铁离子含量过高时,Fe-D72树脂表面酸量过大[17],增加苯二酚的过度氧化反应,同时过多的铁离子和羟基自由基诱导更多的过氧化氢直接分解,导致有效进行羟基化反应的苯酚量减少,故苯酚的转化率、苯二酚的选择性和收率降低。当催化剂的含铁量为95.4 mg·g-1时,催化效果最佳:苯酚转化率为38.7%,苯二酚选择性为93.2%,苯二酚收率为36.1%。对比类似的文献,何丽娟[14]在D001-SS树脂孔道内制备铁的氧化物,苯酚转化率为39%,苯二酚选择性为99%;Wang等[15]在大孔树脂孔道内制备纳米级的β-FeOOH,树脂含铁量为63 mg·g-1,苯酚转化率为20.97%,苯二酚选择性为95.27%;本研究运用离子交换法制备Fe-D72树脂催化剂,铁离子与D72树脂的磺酸基存在分子作用力,相对于铁的氧化物而言,铁直接以金属离子形式稳定存在导致生成的Fe-D72树脂含铁量较多,表面活性中心增多,催化效果增强。
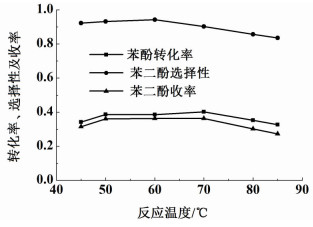
2.2 反应温度对苯酚羟基化反应的影响反应温度对苯酚羟基化反应影响如图 2所示。其它反应条件为:反应时间为0.5 h,催化剂含铁量95.4 mg·g-1,催化剂用量为0.1 g,n(PH)/n(H2O2)=1,m(H2O)/m(PH)=21。
|
| 图 2 反应温度对苯酚羟基化反应的影响 Figure 2 Influence of temperature on the phenol hydroxylation |
| |
从图 2可以看到,随着温度的升高,苯酚转化率、苯二酚的选择性和收率先增加后减低。适当的温度促使过氧化氢在Fe-D72树脂催化下产生更多的羟基自由基,从而诱导更多的苯酚与羟基自由基反应生成苯二酚;但温度过高时,过氧化氢直接分解的速率加快,导致有效进行羟基化反应的苯酚量减少,同时过度活泼的羟基自由基与苯酚生成苯二酚之后更容易发生过度氧化反应,对苯二酚生成对苯醌,对苯醌继续氧化为复杂的焦油物质[18]。当反应温度在85 ℃时,苯酚羟基化反应液呈现深度酱黑色,同时变成黏稠状,这为催化剂和反应液的分离、反应液中苯二酚的提纯分离都带来很大的操作成本,故更高的温度不再进行探究。当反应温度为60 ℃时,催化效果最佳:苯酚转化率为38.5%,苯二酚选择性为94.3%,苯二酚收率为36.3%。
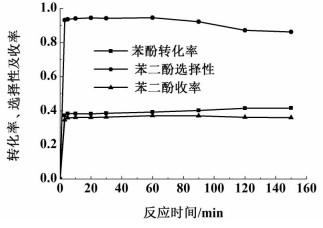
2.3 反应时间对苯酚羟基化反应的影响反应时间对苯酚羟基化反应的影响如图 3所示,其它反应条件为:反应温度为60 ℃,催化剂含铁量为95.4 mg·g-1,催化剂用量为0.1 g,n(PH)/n(H2O2)=1,m(H2O)/m(PH)=21。
|
| 图 3 反应时间对苯酚羟基化反应的影响 Figure 3 Influence of reaction time on phenol hydroxylation |
| |
从图 3可以看出,在反应开始3 min时,苯酚转化率、苯二酚选择性和收率迅速增加,说明Fe-D72树脂对苯酚羟基化反应的诱导期较短;随着反应时间的延长,苯酚转化率趋于稳定,苯二酚选择性则先增加后减少。原因在于反应初始,一定浓度的过氧化氢在Fe-D72树脂催化下产生的羟基自由基迅速诱导苯酚羟基化反应进行,苯酚转化率、苯二酚选择性和收率迅速上升;而随着反应的进行,过氧化氢溶液浓度变低,苯酚转化率增长幅度变小最终稳定不变;而生成的苯二酚随着反应时间的增长深度氧化反应程度加深[19],从而解释苯二酚选择性随时间增长出现减少趋势的现象。当反应时间为1 h时,催化效果最佳:苯酚转化率为39.3%,苯二酚选择性为94.6%,苯二酚收率为37.2%。
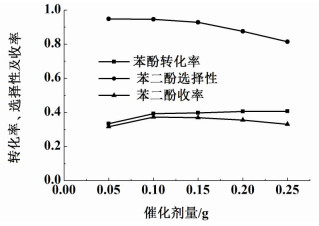
2.4 催化剂用量对苯酚羟基化反应的影响催化剂的用量对苯酚羟基化反应的影响如图 4所示,其它反应条件为:反应温度为60 ℃,反应时间为1 h,催化剂含铁量95.4 mg·g-1,n(PH)/n(H2O2)=1,m(H2O)/m(PH)=21。
|
| 图 4 催化剂量对苯酚羟基化反应的影响 Figure 4 Influence of catalyst mass on phenol hydroxylation |
| |
从图 4可以看出,随着催化剂用量的增加,苯酚转化率逐渐增加,苯二酚选择性先是趋于稳定后呈现减少状态。催化剂适量增加,活性中心增多,促进羟基化反应进行;而当催化剂量过多时,过氧化氢会快速的产生大量的羟基自由基,过量的羟基自由基加大苯二酚过度氧化为焦油的副反应,同时生成的焦油堵塞部分活性中心,导致苯酚的转化率后期增长幅度缓慢[20]。当催化剂量为0.1 g时,催化效果最佳:苯酚转化率为39.3%,苯二酚选择性为94.6%,苯二酚收率为37.2%。
2.5 n(PH)/n(H2O2)对苯酚羟基化反应的影响n(PH)/n(H2O2)对苯酚羟基化反应影响如图 5所示,其它反应条件为:反应温度为60 ℃,反应时间为1 h, 催化剂含铁量95.4 mg·g-1,催化剂用量为0.1 g,m(H2O)/m(PH)=21。
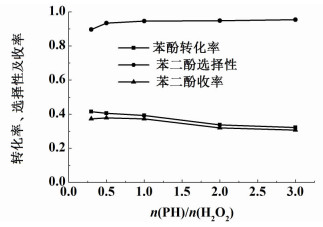
|
| 图 5 n(PH)/n(H2O2)对苯酚羟基化反应的影响 Figure 5 Influence of mole ratio of H2O2 to phenol on the phenol hydroxylation |
| |
从图 5可以看出,当n(PH):n(H2O2)从1:3增加到3:1时,苯酚转化率和苯二酚收率逐渐下降,而苯二酚选择性逐渐增长。过氧化氢加入量较少时,产生较少的羟基自由基与过量的苯酚反应,苯酚羟基化反应温和,减少苯二酚的深度氧化反应,但是苯酚的转化率低;过氧化氢加入量较多时,生成过量的羟基自由基使苯酚充分反应,同时加深苯二酚生成焦油的反应程度[18, 20]。当n(PH):n(H2O2)为1:2时,催化效果最佳:苯酚转化率为40.5%,苯二酚选择性为93.4%,苯二酚收率为37.8%。
2.6 正交试验经过分析,反应温度、反应时间、催化剂量、n(PH)/n(H2O2)对苯酚羟基化反应均有影响,为探究最适宜工艺条件设定正交试验,正交试验的因素和水平见表 3。根据表 3中的因素和水平选择了L9(34)正交表进行正交试验,正交试验的参考指标为苯二酚的收率,正交试验的安排及结果详见表 4。
| 水平 | n(PH):n(H2O2)A | 反应温度B/℃ | 反应时间C/h | 催化剂用量D/g |
| 1 | 1:2 | 50 | 1 | 0.05 |
| 2 | 1:1 | 60 | 2 | 0.10 |
| 3 | 2:1 | 70 | 3 | 0.20 |
| 序号 | 试验因素 | 分析目标 | |||
| A | B | C | D | 苯二酚收率/% | |
| 1 | 1 | 1 | 1 | 1 | 32.7 |
| 2 | 1 | 2 | 2 | 2 | 35.6 |
| 3 | 1 | 3 | 3 | 3 | 35.8 |
| 4 | 2 | 1 | 2 | 3 | 26.9 |
| 5 | 2 | 2 | 3 | 1 | 32.8 |
| 6 | 2 | 3 | 1 | 2 | 39.8 |
| 7 | 3 | 1 | 3 | 2 | 33.0 |
| 8 | 3 | 2 | 1 | 3 | 26.6 |
| 9 | 3 | 3 | 2 | 1 | 31.0 |
| k1 | 34.7 | 27.5 | 33.1 | 35.0 | |
| k2 | 35.9 | 31.7 | 31.2 | 36.1 | |
| k3 | 26.9 | 35.6 | 30.6 | 29.8 | |
| 极差R | 9.0 | 8.1 | 2.5 | 6.3 | |
| 因素主次顺序 | A > B > D > C | ||||
| 最适宜水平 | A2 | B3 | C1 | D2 | |
| 最适宜组合 | A2B3C1D2 | ||||
分析结果表明:n(PH):n(H2O2)和反应温度对苯二酚收率的影响最大,其次为催化剂的量,之后是反应时间;反应温度升高、反应时间减少有利于苯二酚收率的提高,n(PH):n(H2O2)为1:1,催化剂量为0.1 g时收率最好。综合极差分析结果,在考察的正交范围内,选择A2B3C1D2组合:n(PH):n(H2O2)为1:1,反应温度为70 ℃,反应时间为1 h,催化剂量为0.1 g时效果最好,此时苯酚转化率为42.4%,苯二酚选择性为94.1%,苯二酚收率为39.8%。
2.7 催化剂的回收利用率和实验重复性在催化剂的含铁量为95.4 mg·g-1,催化剂0.1 g,苯酚1.88 g,质量分数为30%的过氧化氢4.2 mL,n(PH):n(H2O2)为1:2,反应温度70 ℃,去离子水40 mL的反应条件下,过氧化氢通过微型注射器在10 min之内滴加完成,反应时间控制在1 h。反应结束后,离心分离催化剂和反应液。取适量反应液进行色谱分析,而分离之后的催化剂用适量丙酮浸泡,在50 ℃加热搅拌回流90 min,离心分离,重复上述操作3次,以保证催化剂和表面覆盖的反应物、焦油尽可能分离[21],然后干燥回收,缺少的催化剂量用少量新鲜催化剂代替。继续采用相同的苯酚羟基化反应条件,重复使用催化剂4次,观察催化剂的回收利用率,具体结果如图 6所示。
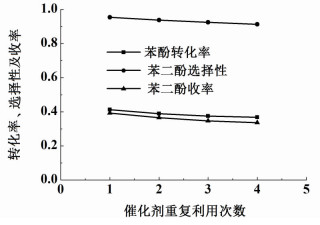
|
| 图 6 Fe-D72树脂催化剂的重复使用 Figure 6 Reusability of Fe-D72 resin catalysts for phenol hydroxylation |
| |
从图 6可以看出,催化剂重复用4次之后,苯酚转化率、苯二酚选择性和收率呈现下降趋势,这是因为催化剂表面焦油未完全除尽,部分活性中心被焦油覆盖,同时少量铁离子浸出导致催化剂含铁量降低,催化效果减弱。但总体来说,苯酚转化率基本稳定在36%~41%,苯二酚选择性稳定在91%~95%,苯二酚收率则在33%~39%,Fe-D72离子交换树脂仍然可以作为一种新型催化剂应用到苯酚羟基化反应中。
3 结论运用离子交换法制备Fe-D72树脂催化剂,应用到苯酚羟基化反应中,通过单因素法考察反应温度、反应时间、催化剂用量、n(PH)/n(H2O2)对反应效果的影响,同时设计L9(34)正交试验,结果表明:n(PH)/n(H2O2)和反应温度对苯二酚收率的影响最大,其次为催化剂的用量,之后是反应时间;在考察的正交范围内,n(PH):n(H2O2)为1:1,反应温度为70 ℃,反应时间为1 h,催化剂量为0.1 g时效果最好,此时苯酚转化率为42.4%,苯二酚选择性为94.1%,苯二酚收率为39.8%;重复利用Fe-D72树脂催化剂4次,苯酚转化率、苯二酚选择性和收率呈现微幅下降趋势但总体保持稳定,Fe-D72树脂可以视为一种新型的苯酚羟基化反应催化剂制备选择。
| [1] | Liang X, Yang R, Li G, et al. Phenol hydroxylation over Fe-incorporated mesoporous materials prepared by coprecipitation[J]. Microporous and Mesoporous Materials, 2013, 182(6): 62–72. |
| [2] | Shi F, Li M, Peng Y, et al. Liquid-Phase catalytic hydroxylation of phenol using metal crosslinked alginate catalysts with hydrogen peroxide as an oxidant[J]. Journal of Molecular Catalysis A Chemical, 2014, 391: 66–73. DOI: 10.1016/j.molcata.2014.04.006 |
| [3] |
冯惠生, 张俊梅, 李小平. H2O2法制苯二酚反应催化剂的研究进展[J].
化学工业与工程, 2002, 19(6): 467–470.
Feng Huisheng, Zhang Junmei, Li Xiaoping. Progress in study of catalysts in the catalytic hydroxylation of phenol by hydrogen peroxide[J]. Chemical Industry and Engineering, 2002, 19(6): 467–470. |
| [4] | Fatimah I. Preparation of ZrO2/Al2O3-montmorillonite composite as catalyst for phenol hydroxylation[J]. Journal of Advanced Research, 2014, 5(6): 663–670. DOI: 10.1016/j.jare.2013.10.003 |
| [5] | Nethravathi B P, Reddy K R, Mahendra K N. Catalytic activity of supported solid catalysts for phenol hydroxylation[J]. Journal of Porous Materials, 2014, 21(3): 285–291. DOI: 10.1007/s10934-013-9773-4 |
| [6] | Timofeeva M N, Hasan Z, Orlov A Y, et al. Fe-containing nickel phosphate molecular sieves as heterogeneous catalysts for phenol oxidation and hydroxylation with H2O2[J]. Applied Catalysis B Environmental, 2011, 107(1): 197–204. |
| [7] | Zhou S, Qian Z, Sun T, et al. Catalytic wet peroxide oxidation of phenol over Cu-Ni-Al hydrotalcite[J]. Applied Clay Science, 2011, 53(4): 627–633. DOI: 10.1016/j.clay.2011.05.013 |
| [8] | Rey-May L, Shih-Hsiung C, Mu-Ya H, et al. Fe (Ⅲ) supported on resin as effective catalyst for the heterogeneous oxidation of phenol in aqueous solution[J]. Chemosphere, 2005, 59(1): 117–125. DOI: 10.1016/j.chemosphere.2004.09.080 |
| [9] | Yang J, Yu M, Qiu T. Adsorption thermodynamics and kinetics of Cr(Ⅵ) on KIP210 resin[J]. Journal of Industrial & Engineering Chemistry, 2014, 20(2): 480–486. |
| [10] | Stefan D S, Meghea I. Mechanism of simultaneous removal of Ca2+, Ni2+, Pb2+ and Al3+ ions from aqueous solutions using Purolite® S930 ion exchange resin[J]. Comptes Rendus Chimie, 2014, 17(5): 496–502. DOI: 10.1016/j.crci.2013.09.010 |
| [11] | Caliskan N, Kul A R, Alkan S, et al. Adsorption of Zinc(Ⅱ) on diatomite and manganese-oxide-modified diatomite: a kinetic and equilibrium study[J]. Journal of Hazardous Materials, 2011, 193(20): 27–36. |
| [12] | Pérez M A, Bringué R, Iborra M, et al. Ion exchange resins as catalysts for the liquid-phase dehydration of 1-butanol to di-n-butyl ether[J]. Applied Catalysis A General, 2014, 482(28): 38–48. |
| [13] | Umar M, Patel D, Saha B. Kinetic studies of liquid phase ethyl tert-butyl ether (ETBE) synthesis using macroporous and gelular ion exchange resin catalysts[J]. Chemical Engineering Science, 2009, 64(21): 4 424–4 432. DOI: 10.1016/j.ces.2009.07.015 |
| [14] | 何丽娟. 负载型树脂催化剂的制备及其在苯酚羟基化反应中的应用[D]. 天津: 天津大学, 2007 He Lijuan. Preparation of the supported resin catalysts and the application in the hydroxylation of phenol using H2O2 as an oxidation agent [D]. Tianjin: Tianjin University, 2007 (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10056-2008186650.htm |
| [15] | Wang D, Liu Z, Liu F, et al. Fe2O3/macroporous resin nanocomposites: Some novel highly efficient catalysts for hydroxylation of phenol with H2O2[J]. Applied Catalysis A General, 1998, 174(1): 25–32. |
| [16] | Mckevitt B, Dreisinger D, Mckevitt B, et al. A comparison of various ion exchange resins for the removal of ferric from copper electrowinning electrolyte solutions. Part Ⅰ: Electrolytes containing no other impurities[J]. Hydrometallurgy, 2009, 98(1): 116–121. |
| [17] |
张敬畅, 刘海峰, 王瑞, 等. 低负载量Fe基固体酸催化剂的制备及应用于苯酚羟基化[J].
石油化工, 2013, 42(2): 134–140.
Zhang Jingchang, Liu Haifeng, Wang Rui, et al. Preparation of Fe-based solid acid catalyst with low loading and its application to hydroxylation of phenol[J]. Petrochemical Technology, 2013, 42(2): 134–140. |
| [18] | Shi F, Luo Y, Wang W, et al. Hydroxylation of phenol with H2O2 over binary Cu-Pd-alginate catalyst in the fixed-bed flow reactor[J]. Reaction Kinetics Mechanisms & Catalysis, 2015, 115(1): 187–199. |
| [19] |
陈君华, 丁志杰, 郭雨, 等. Fe-HMS的合成、表征及催化苯酚羟基化[J].
精细化工, 2010, 27(4): 346–352.
Chen Junhua, Ding Zhijie, Guo Yu, et al. Synthesis, characterization and catalytic phenol hydroxylation performance of iron-modified hexagonal mesoporous silica[J]. Fine Chemicals, 2010, 27(4): 346–352. |
| [20] |
韶晖, 陈霞, 王彬彬, 等. MeAPO-11的合成及其在苯酚羟基化反应中的催化性能[J].
石油学报:石油加工, 2012, 28(6): 939–999.
Shao Hui, Chen Xia, Wang Binbin, et al. Synthesis and catalytic properties of MeAPO-11 molecular sieves for phenol hydroxylation[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2012, 28(6): 939–999. |
| [21] |
吕爱霞, 伏再辉, 唐春林, 等. 微波法制备HMS包络合铁配合物催化剂催化苯酚羟基化反应[J].
工业催化, 2012, 20(5): 58–63.
Lv Aixia, Fu Zaihui, Tang Chunlin, et al. Preparation of iron complexes-encapsulated HMS catalysts by microwave irradiation method and their catalytic performance in phenol hydroxylation[J]. Industrial Catalysis, 2012, 20(5): 58–63. |
 2017, Vol. 34
2017, Vol. 34





