近年来,多种凝胶因子的设计及合成引起了人们的广泛关注[1-4]。有机凝胶是一种特殊的软物质材料,一般由1个或多个凝胶因子在有机溶剂中通过氢键、π-π堆积、范德华力、偶极-偶极作用等相互作用自组装形成[5]。有机凝胶既是由液体组成的热可逆材料,同时又由于存在能够自发组装成纤维结构的凝胶因子而表现出固态黏弹性[6],某些智能凝胶还可以对光、温度、离子、电场等刺激作出响应[7-8]。这些特性使其在光电设备、药物传输、控释制剂和分子传感等新功能材料领域得到了很好的应用[9-10]。因此,新型凝胶因子的设计与合成成为了新功能材料领域的重要研究方向。
吡啶基团由于具有良好的叔胺特性和芳香性,常常被引入到有机凝胶结构中[11]。吡啶衍生物也因此表现出诸多优良性质,比如亲溶剂性、季胺盐化、π-π堆积倾向性及可修饰性,这使得其可以调节在溶剂中的溶解-聚集平衡,是一种优良的凝胶因子。而酰胺类化合物因具有氢键结合位点也备受关注[12],本研究以吡啶环为中心,以烷基侧链修饰合成并测试对比了5种酰胺类化合物在16种有机溶剂中的凝胶性能,分析了侧链种类对成胶驱动的不同影响,旨在为设计新型吡啶类凝胶因子提供一定的数据支持。通过汉森溶解度参数法对凝胶因子9与溶剂之间相互作用力的探究,成功预测了其在未知溶剂中的成胶能力,并验证了预测结果,提供了一种有效的分析手段。
1 实验部分 1.1 试剂与仪器实验所用试剂均为分析纯,DMF、苯、氯化亚砜(SOCl2),天津市大茂化学试剂厂;无水K2CO3、无水硫酸镁、石墨、乙醇、水合肼、二氯甲烷、三氯甲烷,天津市江天化工技术有限公司;对硝基苯酚,天津市光复精细化工有限公司;焦性没食子酸,阿拉丁试剂(上海)有限公司;溴代十二烷、溴代十四烷、溴代十六烷,梯希爱(上海)化成工业发展有限公司。实验用乙醇、水合肼和三氯甲烷均做了无水处理。绝对乙醇是通过向乙醇中加入镁条形成格式试剂回流5 h后蒸馏得到;水合肼需要用二甲苯蒸馏得到;三氯甲烷需加入分子筛除水。
AVANCE Ⅲ 400M型液体核磁共振谱仪,瑞士Bruker公司;X-4型显微熔点仪,北京泰克仪器有限公司;ZF7型三用紫外分析仪,天津医疗设备厂;LCQ型液相色谱质谱联用仪,美国Thermo Fisher公司;FTS 6000型傅里叶红外光谱仪,美国Bio-Rad公司;S-4800型场发射扫描电子显微镜,日本日立公司。
1.2 凝胶化合物的合成吡啶二酰胺类化合物的合成路线如图 1所示。
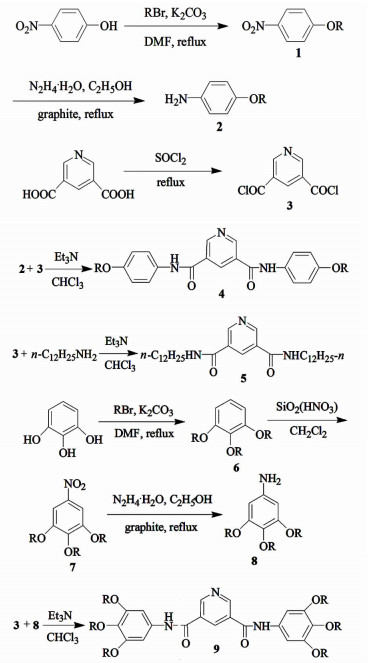
|
| 图 1 吡啶二酰胺衍生物的合成路线 Figure 1 Synthetic routes of pyridinedicarboxamide derivatives |
| |
以1a的合成为例:将8.34 g(0.06 mol)对硝基苯酚与60 mL DMF溶液混合于250 mL三口瓶中,搅拌使其溶解,加入12.42 g(0.09 mol)无水K2CO3,室温搅拌40 min,缓慢滴加22.00 mL(0.09 mol)溴代十二烷,70~80 ℃下回流反应6 h。TLC检测反应结束后,抽滤,滤液用二氯甲烷萃取3次,水反洗3次,无水硫酸镁干燥后旋蒸,再经柱层析分离(石油醚与乙酸乙酯体积比为20:1) 得到纯品,产率约为91%。
1a:1HNMR (400 MHz, CDCl3, TMS): δ 8.19 (d, J=8.8 Hz, 2H, H-Ar), 6.93 (d, J=8.8 Hz, 2H, H-Ar), 4.04 (t, J=6.5 Hz, 2H, —OCH2), 1.88~1.28 (m, 20H, —CH2), 0.91 (m, 3H, —O(CH2)5CH3)
1b: 1HNMR (400 MHz, CDCl3, TMS): δ 8.19 (d, J=8.8 Hz, 2H, H-Ar), 6.92 (d, J=8.8 Hz, 2H, H-Ar), 4.03 (t, J=6.5 Hz, 2H, —OCH2), 1.88~1.28 (m, 24H, —CH2), 0.91 (m, 3H, —O(CH2)5CH3)
1c: 1HNMR (400 MHz, CDCl3, TMS): δ 8.18 (d, J=8.8 Hz, 2H, H-Ar), 6.91 (d, J=8.8 Hz, 2H, H-Ar), 4.02 (t, J=6.5 Hz, 2H, —OCH2), 1.88~1.28 (m, 28H, —CH2), 0.91 (m, 3H, —O(CH2)5CH3)
1.2.2 对烷氧基苯胺(2a~2c)的合成以2a的合成为例:在250 mL三口瓶中,将12.28 g (0.04 moL)对十二烷氧基硝基苯和24.0 g(2.00 moL)石墨加入到100 mL绝对乙醇中,N2保护下缓慢加入9.72 mL(0.20 moL)除水水合肼,回流反应48 h。TLC检测反应结束后,趁热抽滤,滤液用二氯甲烷萃取3次,水反洗3次,无水硫酸镁干燥后旋蒸得到产物,产率约为90%。
2a: 1HNMR (400 MHz, CDCl3, TMS): δ 6.73 (d, J=8.8 Hz, 2H, H-Ar), 6.62 (d, J=8.8 Hz, 2H, H-Ar), 4.04 (t, J=6.5 Hz, 2H, —OCH2), 3.39 (s, 2H, NH2), 1.88~1.28 (m, 20H, —CH2), 0.91 (m, 3H, —O(CH2)5CH3)。
2b: 1HNMR (400 MHz, CDCl3, TMS): δ 6.72 (d, J=8.8 Hz, 2H, H-Ar), 6.62 (d, J=8.8 Hz, 2H, H-Ar), 4.03 (t, J=6.5 Hz, 2H, —OCH2), 3.37 (s, 2H, NH2), 1.88~1.28 (m, 24H, —CH2), 0.91 (m, 3H, —O(CH2)5CH3)。
2c: 1HNMR (400 MHz, CDCl3, TMS): δ 6.72 (d, J=8.8 Hz, 2H, H-Ar), 6.61 (d, J=8.8 Hz, 2H, H-Ar), 4.02 (t, J=6.5 Hz, 2H, —OCH2), 3.39 (s, 2H, NH2), 1.88~1.28 (m, 28H, —CH2), 0.91 (m, 3H, —O(CH2)5CH3)。
1.2.3 3, 5-吡啶二甲酰氯(3) 的合成在50 mL三口瓶中,将0.33 g(1.97 mmoL)3, 5-吡啶二羧酸加入到10 mL苯中,缓慢加入5 mL SOCl2,回流反应7 h后,减压蒸馏除去苯及剩余的SOCl2,得到3, 5-吡啶二甲酰氯粗品,产率约为99%。1HNMR (400 MHz, CDCl3, TMS): δ 9.43 (s, 2H, H-Py), 9.02 (s, 1H, H-Py)。
1.2.4 化合物(4a~4c)的合成以4a的合成为例:在250 mL三口瓶中,将对十二烷氧基苯胺(2.5eq),三乙胺(6eq)加入到60 mL无水CHCl3中,在冰水浴中,N2保护下逐滴加入3, 5-吡啶二甲酰氯的CHCl3溶液,反应4 h后,加入20 mL无水乙醇搅拌0.5 h,抽滤干燥得到产物,产率约为49%。
4a: mp:173~175 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 8.42 (s, 2H, H-Py), 8.25 (s, 2H, —CONH), 7.36 (d, 4H, J=8.8 Hz, H-Ar), 6.97 (s, 1H, H-Py), 6.94 (d, 4H, J=8.8 Hz, H-Ar), 3.86 (t, J=5.2 Hz, 4H, —OCH2), 1.86~1.44 (m, 40H, —CH2), 0.81 (m, 6H, —O(CH2)5CH3)。
4b: mp:182~184 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 8.42 (s, 2H, H-Py), 8.26 (s, 2H, —CONH), 7.36 (d, 4H, J=8.8 Hz, H-Ar), 6.98 (s, 1H, H-Py), 6.94 (d, 4H, J=8.8 Hz, H-Ar), 3.86 (t, J=5.2 Hz, 4H, —OCH2), 1.87~1.48 (m, 48H, —CH2), 0.81 (m, 6H, —O(CH2)5CH3)。
4c: mp:195~196 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 8.42 (s, 2H, H-Py), 8.25 (s, 2H, —CONH), 7.36 (d, 4H, J=8.8 Hz, H-Ar), 6.97 (s, 1H, H-Py), 6.93 (d, 4H, J=8.8 Hz, H-Ar), 3.86 (t, J=5.2 Hz, 4H, —OCH2), 1.86~1.45 (m, 56H, —CH2), 0.81 (m, 6H, —O(CH2)5CH3)。
1.2.5 化合物(5) 的合成合成方法同1.2.4。
mp: 138~140 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 9.17 (s, 2H, H-Py), 8.72 (s, 1H, H-Py), 7.0 (t, 2H, —CONH), 3.47 (t, 4H, —NCH2), 1.65 (m, 4H, —CH2), 1.43~1.24 (m, 36H, —CH2), 0.87 (t, J=6.8Hz, 6H, —O(CH2)11CH3)
1.2.6 3, 4, 5-三(十四烷氧基)苯(6) 的合成将3.00 g (0.02 mol)焦性没食子酸与60 mL DMF溶液混合于250 mL三口瓶中,搅拌溶解,加入10.00 g(0.07 mol)无水K2CO3,室温搅拌40 min,缓慢滴加23.85 mL(0.08 mol)溴代十四烷,70~80 ℃下回流反应48 h。TLC检测反应结束后,抽滤液用二氯甲烷萃取3次,水反洗3次,无水硫酸镁干燥后旋蒸,再经柱层析分离(石油醚与乙酸乙酯体积比为50:1) 得到纯品,产率约为94%。
mp: 55~57 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 6.90 (t, 1H, J=8.0 Hz, H-Ar), 6.54 (d, 2H, J=8.0 Hz, H-Ar), 3.99~3.91 (m, 6H, —OCH2), 1.86~1.27 (m, 72H, —CH2), 0.88 (t, 9H, J=6.0 Hz, —CH3)。
1.2.7 3, 4, 5-三(十四烷氧基)硝基苯(7) 的合成在250 mL三口瓶中,加入100 mL二氯甲烷,然后加入浸有浓硝酸的硅胶,室温搅拌条件下逐滴加用二氯甲烷溶解的3, 4, 5-三(十四烷氧基)苯,搅拌反应5 h,TLC检测反应结束后,抽滤,将滤饼用二氯甲烷洗涤后,合并滤液并旋蒸浓缩,向浓缩液中加入40 mL冷甲醇析出产物,抽滤得滤饼产物,产率约为92%。
mp: 66~72 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 7.47 (s, 2H, H-Ar), 4.10~4.00 (m, 6H, —OCH2), 1.84~0.85 (m, 72H, —CH2), 0.91 (t, 9H, J=6.0 Hz, —CH3)。
1.2.8 3, 4, 5-三(十四烷氧基)苯胺(8) 的合成合成方法同1.2.2。
mp: 73~76 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 5.91 (s, 2H, H-Ar), 3.92~3.81 (m, 6H, —OCH2), 3.5 (bd s, 2H, NH2), 1.84~1.28 (m, 72H, —CH2), 0.89 (t, 9H, J=6.4 Hz, —CH3)。
1.2.9 化合物(9) 的合成合成方法同1.2.4。
mp: 113~115 ℃; 1HNMR (400 MHz, CDCl3, TMS): δ 9.28 (s, 2H, H-Py), 9.05 (s, 1H, H-Py), 8.99 (s, 2H, —CONH), 7.11 (s, 4H, H-Ar), 3.98 (t, J=6.4 Hz, 8H, —OCH2), 3.93 (t, J=6.4 Hz, 4H, —OCH2), 1.80~1.26 (m, 144H, —CH2), 0.88 (m, 18H, —O(CH2)5CH3)。
2 结果与讨论 2.1 凝胶性能分析测试了凝胶因子4a、4b、4c、5、9在16种常见有机溶剂中的凝胶性能并利用“翻转倒置法”[13]对其临界凝胶浓度进行了对比,结果见表 1所示。
| 溶剂 | 4a | 4b | 4c | 5 | 9 |
| 二氯甲烷 | Ins | Ins | Ins | 33 | 17 |
| 三氯甲烷 | Ins | Ins | Ins | 100 | 75 |
| 石油醚 | Ins | Ins | Ins | Ins | 20 |
| 丙酮 | Ins | Ins | Ins | 60 | 37 |
| 甲醇 | Ins | Ins | Ins | Ins | Ins |
| 四氢呋喃 | Ins | Ins | Ins | SP | 50 |
| 正己烷 | Ins | Ins | Ins | SP | 8 |
| 乙醇 | Ins | Ins | Ins | 30 | PG |
| 乙酸乙酯 | Ins | Ins | Ins | 37 | 35 |
| 四氯化碳 | Ins | Ins | Ins | 75 | S |
| 异丙醇 | Ins | Ins | Ins | S | 37 |
| 1, 2-二氯乙烷 | Ins | Ins | Ins | 100 | PG |
| DMFb | S | 90 | 75 | 100 | 95b |
| 乙腈 | Ins | Ins | Ins | 21 | SP |
| 苯b | Ins | Ins | Ins | 30 | 20b |
| DMSO | 25 | 20 | 17 | 100 | S |
| a DMF:N, N-二甲基甲酰胺;DMSO:二甲基亚砜;S:溶液;PG:部分凝胶;Ins:不溶;SP:加热溶解,冷却后沉淀。b梯式参数图验证溶剂及相应的MGC值。 | |||||
随着碳链的增长,烷基间的范德华力作用会逐渐增强,凝胶性能也会变得更好[14-15]。由表 1可以看出,单链吡啶二酰胺类系列化合物4a、4b、4c虽只有在DMF和DMSO中有凝胶性能,但随着碳链长度的增加,化合物的临界凝胶浓度值逐渐减小,凝胶性能也越来越好,由此说明了范德华力在其形成过程中的驱动作用。而三链化合物9可以在芳香烃类、烷烃类、醇类、酯类等多种有机溶剂中形成凝胶,凝胶性能明显优于单链化合物。这表明烷基链数的增加可以驱动凝胶因子更紧密地聚集组装,得到性能更好的凝胶。另一方面,对比凝胶因子5和9发现,在其均可成胶的溶剂中,化合物9的凝胶性更好。这是由于化合物9苯环的π-π相互作用力使得凝胶因子更有序地堆积排列。
凝胶的相转变温度(Tgel)可以很好的反映其热稳定性,因此本研究对不同因素影响下的凝胶-溶胶Tgel值进行了测定。测定方法参考文献[16]进行:将所配制的凝胶装在密闭小瓶中,缓慢升温(速度为1 ℃·min-1),倾斜小瓶,当凝胶开始移动时的温度值记为Tgel。
据文献报道,溶剂与凝胶因子之间的相互作用力对于凝胶的热稳定性有重要作用[17]。本研究分别测试了不同浓度凝胶因子9在二氯甲烷、正己烷和石油醚三种溶剂中的Tgel值,结果如图 2a)所示。观察发现,相同浓度凝胶因子9在不同种类的溶剂中,其Tgel值具有一定差异,表明了不同溶剂对凝胶稳定性的影响。显然由图 2a)分析可知,随凝胶浓度的增加凝胶因子的堆积会变得更加密集,因而凝胶的热稳定性增强。
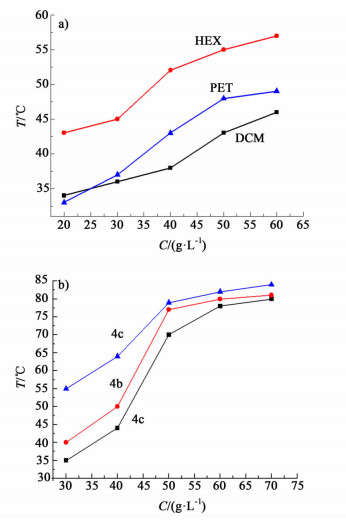
|
| 图 2 a)化合物9在二氯甲烷(DCM)、正己烷(HEX)、石油醚(PET)溶液不同浓度下的相转变温度b) 4a、4b、4c在DMSO溶液不同浓度下的相转变温度 Figure 2 Plots of Tgel against the concentration of a) 9 in dichloromethane/n-hexane/petroleum ether; b) 4a/4b/4c in DMSO |
| |
同时,考虑到凝胶因子烷基链链长对凝胶热稳定性的影响,本研究分别测定了化合物4a、4b、4c在DMSO溶剂中的Tgel值,结果如图 2b)所示。从图 2b)中可以看出,在同一溶剂同一浓度下,化合物4c具有更高的Tgel值。说明随着碳链的增长,凝胶的热稳定性提高,性能提高,这是由于范德华力作用随着碳链增长而增强所引起的。
2.2 凝胶微观形貌研究对凝胶因子9在二氯甲烷、石油醚、乙酸乙酯和异丙醇中形成的凝胶在室温下自然干燥得到了相应的干凝胶,对其进行了扫描电镜(SEM)测试以观察其微观形貌,结果如图 3所示。
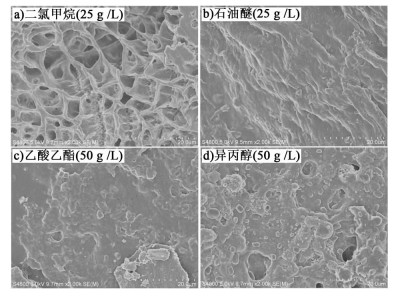
|
| 图 3 凝胶因子9在不同溶剂中的干凝胶扫描电镜图:a)二氯甲烷(25 g·L-1); b)石油醚(25 g·L-1); c)乙酸乙酯(50 g·L-1); d)异丙醇(50 g·L-1) Figure 3 SEM images of xerogels of 9 in different solvents a) dichloromethane(25 g·L-1); b) petroleum ether (25 g·L-1); c) ethyl acetate(50 g·L-1); d) isopropanol(50 g·L-1) |
| |
凝胶因子与溶剂间的相互作用不仅会影响凝胶的形成,还会影响凝胶的微观形貌[18]。由图像看出,凝胶因子9在二氯甲烷中形成的凝胶呈三维交叉纤维状,在石油醚中形成的凝胶有呈纤维状的趋势,而在乙酸乙酯和异丙醇中则为片状堆积。这说明同一凝胶因子与不同溶剂间的相互作用确实对凝胶的微观结构有一定的影响,而对比可知呈纤维状排列的凝胶其性能更优。
2.3 成胶驱动力研究为了研究该类化合物的成胶机理,对凝胶因子9进行了紫外光谱和红外光谱测试,并测试其对阴离子的响应性,理论上分析验证了该系列凝胶因子的成胶驱动力。
2.3.1 紫外光谱分析紫外吸收光谱可用于验证凝胶形成过程中的π-π堆积作用[19]。本研究对凝胶因子9在氯仿溶剂中的溶液及凝胶状态下进行了紫外吸收测试,结果如图 4所示。
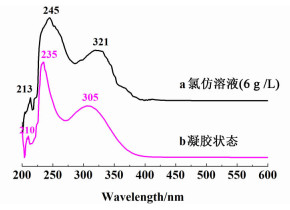
|
| 图 4 化合物9在氯仿溶液(6 g·L-1)和凝胶状态下的紫外图谱(80 g·L-1) Figure 4 UV spectroscopy of 9 in the solution of chloroform (6 g·L-1) and in the gel states(80 g·L-1) |
| |
观察发现,凝胶因子9在溶液和凝胶状态下的3个吸收峰分别为224、232、305 nm和245、254、335 nm,对比可知凝胶状态下吸收峰较溶液状态下发生了明显的红移,这表明在该凝胶因子中π-π堆积作用是重要的成胶驱动力。
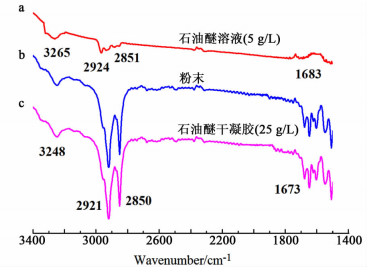
2.3.2 红外光谱分析本研究对凝胶因子9在固体粉末状态、石油醚溶液状态及石油醚干凝胶(室温下自然干燥)状态下的进行了红外光谱测试,结果如图 5所示。
|
| 图 5 化合物9在不同状态下的红外图谱 Figure 5 IR spectra of 9 in different physical states |
| |
观察凝胶因子9在2种状态下(固体粉末状态和干凝胶状态)的红外光谱图发现,其吸收峰基本相同,这表明化合物在该2种状态下也具有相同的作用力;这与文献报道的结果相似[20]。而其在干凝胶和溶液状态下的谱图则有很大不同,对于干凝胶状态下的凝胶因子,N—H伸缩振动,C=O的伸缩振动,CH2的对称伸缩振动,CH2的不对称伸缩振动的吸收峰分别位于3 248、1 673、2 921和2 850 cm-1处,对于石油醚溶液状态下的凝胶因子,其相应的吸收峰分别出现在3 265、1 683、2 924和2 851 cm-1处,对比看出,凝胶因子的干凝胶相对于溶液状态下,N—H伸缩振动和C=O的伸缩振动的吸收峰发生了明显红移,由相关理论[21]可知氢键作用对于该凝胶形成有重要的驱动作用。而CH2的对称伸缩振动,CH2的不对称伸缩振动的吸收峰基本不变,这表明烷基在凝胶形成过程中通过范德华力紧密堆积,烷基链部分有序排列。另外,根据文献[22]报道,其在3 400~3 500 cm-1处NH游离伸缩振动吸收峰的缺失,也进一步说明了成胶过程中氢键作用的存在。
2.3.3 凝胶的阴离子响应研究氢键型凝胶因子在某些特定的离子条件下易实现凝胶-溶液的转变[23-24],表现出阴离子响应性。本研究分别选取四丁基氟化铵、四丁基溴化铵、四丁基氯化铵、四丁基碘化铵对化合物4c、5、9的阴离子响应性进行了测试。以凝胶因子9为例,具体测试方法是,首先称取4组5 mg的化合物9并分别置于小瓶中,加入0.5 mL石油醚后加热溶解,冷却形成凝胶。然后分别向4组凝胶中加入2 eq.的四丁基氟化铵、四丁基溴化铵、四丁基氯化铵、四丁基碘化铵,静置并观察现象。结果发现,静置约2 h后,加入四丁基氟化铵的凝胶逐渐塌陷至溶液状态,而其他3组凝胶无任何变化,如图 6所示。此时若再向该溶液中滴加甲醇,其又逐渐恢复为凝胶。类似地,对化合物4c和5的测试也呈现出相同的现象。

|
| 图 6 化合物9在石油醚中凝胶的阴离子测试 Figure 6 The anion response test of 9 in petroleum ether gel |
| |
F-可以破坏凝胶因子4c、5、9的分子间氢键,因此向其所在的凝胶中加入四丁基氟化铵后,会使凝胶驱动力减弱进而塌陷成溶液,而Cl-、Br-、I-的加入无法破坏分子间氢键,故其凝胶状态得以保持。而当向前者所形成的溶液中加入甲醇等质子性溶剂后,溶液中的F-被夺走,氢键得以恢复,凝胶因子重新组装形成凝胶。实验结果表明了该系列凝胶因子的阴离子响应特性,同时也再次证明了氢键作用是该系列化合物形成凝胶的重要驱动力。
2.4 梯氏参数分析在凝胶体系中,对于凝胶因子与溶剂间相互作用力的研究,已经延伸出诸多的方法,其中,汉森溶解度参数法应用较为成功[25]。梯氏参数由梯氏通过对汉森溶解度参数进行变换得到,包含fd、fp、fh 3个参数。
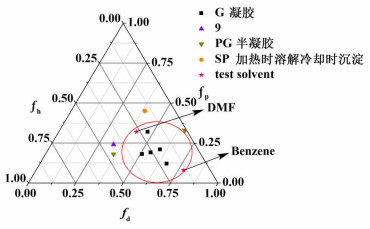
本研究利用梯氏参数,通过梯氏三角图对凝胶因子与溶剂之间的相互作用进行了分析。首先计算得到了凝胶因子9及溶剂的梯氏参数,并结合化合物9在各溶剂中的凝胶测试结果(见表 1),绘制出如图 7所示的梯氏三角图。
|
| 图 7 化合物9溶解度参数梯氏图 Figure 7 Teas plot of solubility parameters of 9 |
| |
分析图 7看出,凝胶因子在其梯氏参数与溶剂梯氏参数距离较近的区域内形成部分凝胶,而在距离较远的区域形成沉淀,仅在二者距离适中的区域内(图中椭圆形区域)形成凝胶。这说明,二者距离太近时并不利于该系列凝胶因子形成凝胶,只有当凝胶因子与溶剂之间的作用力适中时才会诱导凝胶形成。据此,可将图中椭圆形区域作为化合物9在某一溶剂中成胶与否的预测区域。
为了验证该预测依据的有效性,本研究选取了DMF和苯作为验证溶剂(test solvent),分别计算了其各自的梯氏参数,DMF(0.41/0.32/0.27)、苯(0.78/0.08/0.14),并标于图 7中(图 7中五角星所示)。2种溶剂的梯氏参数均位于预测区域内,因此可以推测凝胶因子9在苯和DMF中可以形成凝胶。而实际的测试证明凝胶因子9在2种溶剂中确实可成胶,与预测结果吻合,证实了该预测区域的有效性。综上所述,可以看出利用梯氏三角图可以较为方便地预测凝胶因子在未知溶剂中的凝胶性能,同时进一步说明了凝胶因子与溶剂间的相互作用是影响凝胶形成的一个重要因素。
3 结论1) 合成的系列吡啶酰胺类衍生物在多种有机溶剂中可成胶,而增加侧链长度、个数以及苯环的引入均可提高其热稳定性。
2) 合成的系列化合物的成胶驱动力包括π-π堆积、氢键作用和范德华作用力等。所得凝胶为氢键型凝胶,对F-有响应性。SEM观察表明凝胶因子与溶剂作用可影响其微观形貌,呈纤维状排列的凝胶性能较好。
3) 利用梯氏参数法预测了系列凝胶因子在未知溶剂中的成胶能力,证明了凝胶因子与溶剂间相互作用力对凝胶形成的影响。
| [1] | Obuchi K, Sato Y, Osaki Y, et al. Preparation of highly swellable organogel using waste windshield polyvinyl butyral interlayer[J]. Kobunshi Ronbunshu, 2015, 72(12): 726–730. DOI: 10.1295/koron.2015-0025 |
| [2] | Nikiforidis C V, Gilbert E P, Scholten E. Organogel formation via supramolecular assembly of oleic acid and sodium oleate[J]. Rsc Advances, 2015, 5(59): 47 466–47 475. DOI: 10.1039/C5RA05336F |
| [3] | Ran X, Wang H, Lou J, et al. Morphology and wettability tunable organogel system based on an 1, 3, 4-oxadiazole derivative[J]. Soft Materials, 2014, 12(4): 396–402. DOI: 10.1080/1539445X.2014.937494 |
| [4] | Zhou C, Gao W, Yang K, et al. A novel glucose/pH responsive low-molecular-weight organogel of easy recycling[J]. Langmuir, 2013, 29(44): 13 568–13 575. DOI: 10.1021/la4033578 |
| [5] | Yu X, Chen L, Zhang M, et al. Low-Molecular-Mass gels responding to ultrasound and mechanical stress: Towards self-healing materials[J]. Chem Soc Rev, 2014, 43(15): 5 346–5 371. DOI: 10.1039/C4CS00066H |
| [6] | Huang Y, Zhang Y, Yuan Y, et al. Organogelators based on iodo 1, 2, 3-triazole functionalized with coumarin: Properties and gelator-solvent interaction[J]. Tetrahedron, 2015, 71(14): 2 124–2 133. DOI: 10.1016/j.tet.2015.02.044 |
| [7] | Bai B, Mao X, Wei J, et al. Selective anion-responsive organogels based on a gelator containing hydrazide and azobenzene units[J]. Sensors and Actuators B: Chemical, 2015, 211(3): 268–274. |
| [8] |
周义锋. 环境响应的智能小分子有机凝胶材料[J].
化学进展, 2011, 23(1): 125–135.
Zhou Yifeng. Environmental responsive smart low molecule organogel materials[J]. Progress in Chemistry, 2011, 23(1): 125–135. |
| [9] | Felisilda B M, Alvarez d E E, Arrigan D W, et al. Investigation of a solvent-cast organogel to form a liquid-gel microinterface array for electrochemical detection of lysozyme[J]. Analytica Chimica Acta, 2015, 893(17): 34–40. |
| [10] | Skilling K J, Citossi F, Bradshaw T D, et al. Insights into low molecular mass organic gelators: A focus on drug delivery and tissue engineering applications[J]. Soft Matter, 2014, 10(2): 237–256. DOI: 10.1039/C3SM52244J |
| [11] | Ngoc T N, Liu J H. Wet chemical synthesis of silver nanowires based on a soft template of cholesteryl pyridine carbamate organogel[J]. Science of Advanced Materials, 2015, 7(7): 1 282–1 290. DOI: 10.1166/sam.2015.2042 |
| [12] | Yang X, Zeng X, Zhao Y, et al. Silica gel-mediated amide bond formation: An environmentally benign method for liquid-phase synthesis and cytotoxic activities of amides[J]. J Comb Chem, 2010, 12(3): 307–310. DOI: 10.1021/cc900135f |
| [13] | Sun Z, Dong X, Zhai Y, et al. 2, 5-Dialkoxylphenyl-1, 3, 4-oxadiazoles as efficient organogelators and their self-assembling property[J]. Front Chem Sci Eng, 2014, 8(2): 219–224. DOI: 10.1007/s11705-014-1418-x |
| [14] | Mohan Z, Sermadurai S. Structural and solubility parameter correlations of gelation abilities for dihydroxylated derivatives of long-chain, naturally occurring fatty acids[J]. Chem-Eur J, 2015, 21(23): 8 530–8 543. DOI: 10.1002/chem.201500096 |
| [15] | Suzuki M, Nakajima Y, Yumoto M. Effects of hydrogen bonding and van der Waals interactions on organogelation using designed low-molecular-weight gelators and gel formation at room temperature[J]. Langmuir, 2003, 19(21): 8 622–8 624. DOI: 10.1021/la034772v |
| [16] | Tomoaki A, Kazuaki I. Gelation properties of poly(arylether)dendrons bearing long alkyl chains[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2014, 80(3): 285–294. |
| [17] | Xu H, Song J, Tian T, et al. Estimation of organogel formation and influence of solvent viscosity and molecular size on gel properties and aggregate structures[J]. Soft Matter, 2012, 8(12): 3 478–3 486. DOI: 10.1039/c2sm07387k |
| [18] | Boaz P, Emil Z. Microstructure of natural plywood-like ceramics: A study by high-resolution electron microscopy and energy-variable X-ray diffraction[J]. J Mater Chem, 2003, 13(4): 682–688. DOI: 10.1039/b300167a |
| [19] | Huang Y, Yuan Y, Tu W, et al. Preparation of efficient organogelators based on pyrazine-2, 5-dicarboxylic acid showing room temperature mesophase[J]. Tetrahedron, 2015, 71(21): 3 221–3 230. DOI: 10.1016/j.tet.2015.04.010 |
| [20] | George M, Tan G, John V T. Urea and thiourea derivatives as low molecular-mass organogelators[J]. Chem-Eur J, 2005, 11(11): 3 243–3 254. DOI: 10.1002/(ISSN)1521-3765 |
| [21] | Baddi S, Madugula S S, Soujanya Y, et al. Combined experimental and computational study of the gelation of cyclohexane-based bis(acyl-semicarbazides) and the multi-stimuli-responsive properties of their gels[J]. Langmuir, 2016, 32(3): 889–899. DOI: 10.1021/acs.langmuir.5b03987 |
| [22] | Dou C, Wang C, Zhang H, et al. Novel urea-functionalized quinacridone derivatives: Ultrasound and thermo effects on supramolecular organogels[J]. Chem-Eur J, 2010, 16(35): 10 744–10 751. DOI: 10.1002/chem.200903575 |
| [23] | Yao H, You X, Lin Q, et al. Metal-Organic gels based on carboxyl functionalized benzimidazole and their stimuli responsivenesses[J]. Chin J Chem, 2014, 32(7): 607–612. DOI: 10.1002/cjoc.201400180 |
| [24] | Lu J, Hu J, Song Y, et al. A new dual-responsive organogel based on uracil-appended glycyrrhetinic acid[J]. Org Lett, 2011, 13(13): 3 372–3 375. DOI: 10.1021/ol201129y |
| [25] | Bonnet J, Suissa G. Organogel formation rationalized by Hasen solubility parameters: Dos and don'ts[J]. Soft Matter, 2014, 10(18): 3 154–3 160. DOI: 10.1039/c4sm00244j |
 2017, Vol. 34
2017, Vol. 34





