纳米材料是指尺寸小于100 nm(1~100 nm)的超细颗粒组成的具有小尺寸效应的零维、一维、二维和三维材料的总称。基于纳米材料能表现出优异的光、电、磁、热、力学和机械性能,纳米技术迅速的渗透到材料制造的各个领域,成为当前世界科学研究的热点[1-2]。
纳米氧化铝具有高强度、高硬度、热膨胀系数小、耐腐蚀和耐磨等优良的物理化学性能,是迄今工业中用量最大的陶瓷材料之一[3]。Al2O3有很多晶型,目前已发现10多种,其中α-纳米氧化铝具有高强度、高硬度、热膨胀系数小、耐腐蚀和耐磨等优良的物理化学性能,是迄今工业中用量最大的陶瓷材料之一[3]。α-Al2O3是热稳定晶型,其余皆为非稳定的Al2O3过渡相,在1 100~1 300 ℃煅烧处理后都不可逆转的的转变为α-Al2O3[4]。
高纯纳米Al2O3粉体的制备方法有很多种,如气相法、溶胶-凝胶法、机械球磨法、等离子体法、沉淀法、微乳液法、醇盐水解法、硫酸铝铵热解法、碳酸铝铵热解法等。上述纳米Al2O3粉体制备方法中,等离子体法制备的纳米Al2O3粉体纯度高、性能优良,但制备成本较高,产率低,粉体的收集相对困难,其产品的大规模生成受限[5]。溶胶-凝胶法制备的产品具有粒径分布窄、纯度高、单分散性良好等优点,但其缺点是制备成本较高,毒性大,制备周期过长[6]。硫酸铝铵热解法,是目前国内生产高纯超细氧化铝的主要方法,该方法设备简单,操作容易,但其分解过程中产生SO2、NH3等气体,造成环境污染[7]。利用碳酸铝铵热解法生产的α-Al2O3粒径容易控制,其烧结性能好且分解中不产生污染环境的SO2气体等,但该方法的过程复杂且技术条件不易控制[8]。
本研究以铝-空气放电产物为原料,以浓硫酸为浸取剂制备硫酸铝晶体,然后以碳酸铵为沉淀剂制备碳酸铝铵前驱体,最后分步煅烧得到纳米氧化铝,过程简单,重现性良好。通过X射线衍射仪和透射电镜对原材料、前驱体及纳米产物的物相与形貌进行表征,最后得到单分散的α-Al2O3。
1 试验部分 1.1 原料与试剂试验试剂主要有铝-空气电池放电产物、浓H2SO4(分析纯)、(NH4)2CO3(分析纯)、聚乙二醇(PEG)2000、氨水(分析纯)、无水乙醇(分析纯)等。
1.2 试验方法用硫酸溶解一定量的铝-空气电池放电产物,多次结晶得到硫酸铝,然后将制备的硫酸铝配成0.2 mol/L的溶液。配制2.0 mol/L的碳酸铵溶液并向其中加入一定量的分散剂PEG2000,然后将上述制备的硫酸铝溶液缓缓加入其中,加入完毕后搅拌1 h,然后陈化、抽滤。在抽滤过程中先用蒸馏水洗涤数次,然后用无水乙醇洗涤数次。将得到的滤饼放入烘箱中干燥,得到碳酸铝铵前驱体。最后,经不同的煅烧程序处理得到纳米氧化铝粉体。制备过程中的工艺流程如图 1所示。
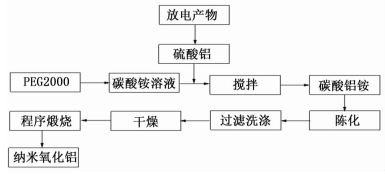
|
| 图 1 纳米氧化铝制备工艺流程图 Figure 1 The preparation flow diagram of nanometer alumina |
| |
放电产物、碳酸铝铵前驱体与纳米氧化铝的晶体结构采用德国布鲁克AXS有限公司生产的D8-Focus型X射线衍射仪进行分析。通过日本电子公司生产的JEM100CXII型透射电子显微镜对碳酸铝铵前驱体与纳米氧化铝的形貌进行表征。
2 结果与讨论 2.1 铝-空气电池放电产物物相分析图 2为铝-空气电池放电产物的XRD谱图。
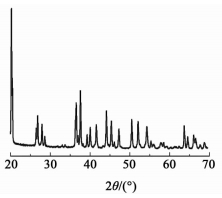
|
| 图 2 铝-空气电池放电产物的XRD谱图 Figure 2 XRD spectra of aluminum-air battery discharge product |
| |
由图 2可见,样品在20.229°(110)、36.615°(021)、37.683°(311)、44.166°(31-3) 左右均出现强峰,对比查找晶体标准PDF卡片,与三水铝石晶体(PDF#33-0018) 的特征峰相吻合,证明该样品的主要成分为三水铝石。由于在铝-空气电池体系中采用碱性电解液,电解液中含有各种添加剂以保证电池的效率与使用寿命,铝阳极在放电过程中失去电子形成Al3+,Al3+在一定的条件下能与电解液中的OH-形成各式各样的铝的碱式水合物,有的较易溶于强酸而有的在常温常压下较难溶于强酸。经过XRD分析得出放电产物主要为为三水铝石,三水铝石在一定温度下能完全溶于强酸这使得后续处理较为容易。
2.2 高纯硫酸铝的制备 2.2.1 温度对铝-空气电池放电产物浸出率的影响将16 g铝-空气电池放电产物与50 g浓硫酸分别在25、50、75、90、100和125 ℃下反应3 h,反应后,过滤并充分的洗涤剩余的氢氧化铝,烘干称量,然后计算出放电产物的浸出率,结果如图 3所示。

|
| 图 3 温度对铝-空气电池放电产物浸出率的影响 Figure 3 Influence of temperatures on the aluminum-air battery discharge product reaction |
| |
由图 3可以看出随着浸出温度的升高,放电产物的浸出率逐渐增大,在100 ℃下浸出率达到最大,所以在常压条件下,浸出反应温度在100 ℃时最适宜。
2.2.2 浓硫酸用量对铝-空气电池放电产物浸出率的影响将16 g放电产物在100 ℃加热条件下分别与25、30、35、40和45 g浓硫酸反应3 h。反应后,过滤并充分的洗涤剩余的氢氧化铝,烘干称量,然后计算出放电产物的浸出率。结果如图 4所示。
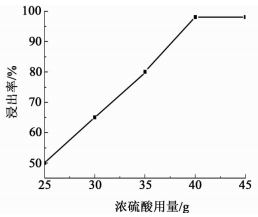
|
| 图 4 浓硫酸用量对铝-空气电池放电产物浸出率的影响 Figure 4 Influence of sulfuric acid dosage on the aluminum-air battery discharge product reaction |
| |
由图 4可知随着浓硫酸量的提高,放电产物转化为硫酸铝的转化率也随之提高。当浓硫酸用量大于40 g时放电产物的转化率达到最大,此时m(浓硫酸):m(放电产物)=5:2。所以,在常压、100 ℃加热条件下,m(浓硫酸):m(放电产物)=5:2时最适宜。
2.3 硫酸铝溶液滴加速度对碳酸铝铵形貌的影响图 5为在反应条件为pH=10、温度30 ℃、铝盐浓度为0.2 mol/L、(NH4)2CO3浓度2.0 mol/L,PEG2000质量分数为1%时采用反滴法,铝盐不同滴定速度下生成前驱体的的XRD谱图。
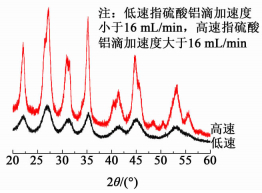
|
| 图 5 硫酸铝在不同滴定速度下生成前驱体的的XRD谱图 Figure 5 XRD spectra of precursor generated at different titration speed of aluminum sulfate |
| |
由图 5可见在高速滴加条件下与低速滴加条件下生成物均在26.79°(220)、34.942°(321)、45.353°(006) 左右出现强峰,对比查找晶体PDF卡片,与碳酸铝铵晶体(PDF#29-0106) 的特征峰相吻合,由此得出产物的主要成分为碳酸铝铵。通过对比高速滴加与低速滴加产物的XRD谱图还可以看出在高速滴加下制得产物在48.412°(131)、50.493°(041)、55.916°(141) 处出现较为明显的衍射峰,对比标准卡片发现均为AlO(OH)(PDF#05-0355) 的衍射峰,可见当硫酸铝铵滴加速度超过某一限度时会有部分AlO(OH)生成。实验表明在上述条件下硫酸铝溶液滴加速度小于16 mL/min时全部生成碳酸铝铵。
当把铝盐加入到(NH4)2CO3溶液时,由于体系的pH值与反应物的浓度的不同可以得到不同的反应产物[9]。
| $ \begin{array}{c} {\rm{A}}{{\rm{l}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ + 3}}{\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O = }}\\ {\rm{2AlO}}\left( {{\rm{OH}}} \right){\rm{ + 3}}{\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 3C}}{{\rm{O}}_{\rm{2}}} \uparrow \end{array} $ | (1) |
| $ \begin{array}{c} {\rm{A}}{{\rm{l}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ + 4}}{\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} = \\ {\rm{2N}}{{\rm{H}}_{\rm{4}}}{\rm{AlO}}\left( {{\rm{OH}}} \right){\rm{HC}}{{\rm{O}}_{\rm{3}}}{\rm{ + 3}}{\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + C}}{{\rm{O}}_{\rm{2}}} \uparrow \end{array} $ | (2) |
反应(1) 产生AlO(OH)沉淀,沉淀形成时常为凝胶状,若采用普通的干燥方式,则干燥产物常为坚硬的团聚体,煅烧后生成的为应团聚的块状氧化铝。反应(2) 生成碳酸铝铵沉淀,通过加入表面活性剂和有机溶液洗涤处理能得到疏松的碳酸铝铵粉末,碳酸铝铵在煅烧时产生大量的气体,使得生成的纳米颗粒进一步分散,故可得到分散的纳米氧化铝。因此,制得疏松、分散的前驱体是试验成功的关键。根据文献[10]报道,碳酸铝铵的形成经历以下2步:
| $ {\rm{AlOOH + }}{\left( {{\rm{OH}}} \right)^{\rm{ - }}}{\rm{ = AlO}}{\left( {{\rm{OH}}} \right)^{\rm{ - }}}_{\rm{2}} $ | (3) |
| $ \begin{array}{c} {\rm{N}}{{\rm{H}}^{\rm{ + }}}_{\rm{4}}{\rm{ + AlO}}{\left( {{\rm{OH}}} \right)^{\rm{ - }}}_{\rm{2}}{\rm{ + HC}}{{\rm{O}}^{\rm{ - }}}_{\rm{3}}{\rm{ = }}\\ {\rm{N}}{{\rm{H}}_{\rm{4}}}{\rm{Al}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \end{array} $ | (4) |
通过(3) 和(4) 式看以看出,如果使得溶液中NH4+、HCO3-的浓度足够大,沉淀时则可以得到碳酸铝铵。要使反应物为碳酸铝铵必须保证Al3+周围存在足量的NH4+、HCO3-存在,所以必须采用反滴法缓慢的将硫酸铝向碳酸铵溶液中滴加,使得反应(2) 顺利进行,生成大小分布均匀的前驱体。在低速滴加和较大的pH值条件下能够生成纯的碳酸铝铵。当硫酸铝滴加过快时在溶液中的某一区域会造成Al3+浓度相对过大,导致部分AlO(OH)沉淀的生成。
图 6a)和图 6b)分别为在反应条件为pH=10、温度为30 ℃、铝盐浓度为0.2 mol/L、(NH4)2CO3浓度为2.0 mol/L,PEG2000质量分数为1%时采用反滴法铝盐的滴加速度对生成前驱体碳酸铝铵形貌的影响。

|
| 图 6 硫酸铝不同滴定速度下生成前驱体的TEM形貌 Figure 6 TEM morphology of precursors generated at different titration speed aluminum sulfate |
| |
由图 6可以看出低速滴加条件下生成碳酸铝铵纳米棒,纳米棒基本呈单分散,长度在100 nm附近,宽度在20 nm附近。当滴加速度变快时,除有纳米棒生成外还存在许多大的团聚体,大团聚体的尺度在500 nm以上,形状不规整。这是因为当硫酸铝滴加过快时会有部分的AlO(OH)沉淀生成,AlO(OH)的黏度较大使得生成的碳酸铝铵前驱体在黏结力的作用下相互团聚,生成大的团聚体。
2.4 煅烧条件对生成纳米颗粒分散度的影响 2.4.1 碳酸铝铵的差热及热重分析图 7是在最适宜制备条件得到的碳酸铝铵的TG-DTA曲线。

|
| 图 7 前驱体的TG-DTA曲线 Figure 7 TG-DTA curve of precursor |
| |
由图 7中所示上的热重曲线可以得到前驱体在加热至恒量的过程中质量损失为85%,与理论质量63.3%相差较远,这说明前驱体中含有结晶水,结晶水在加热过程中蒸发使得前驱体的失量较大。从图 7中还可以看出前驱体在室温至200 ℃左右失量剧烈,200~650 ℃之间失量速率比较平稳,200 ℃之前可能是前驱体重结晶水的逐渐失去过程。200~650 ℃之间的失量可能是碳酸铝铵热解为氨气与二氧化碳的过程。650 ℃后几乎没有失量,这表明650 ℃以后的煅烧过程中反应物只有晶型的变化而无净质量的变化。从图 7中的差热曲线可以看出在200 ℃附近有1处明显的吸热峰,这主要是碳酸铝铵的热分解所致,这与TG曲线上的200 ℃附近的热失量相对应。以上结果表明前驱体在煅烧过程中先失去结晶水变为无水碳酸铝铵,再逐步热解变为氧化铝。
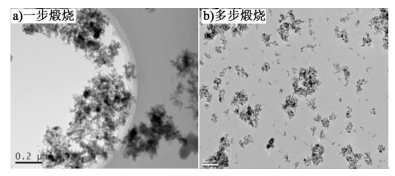
2.4.2 煅烧工艺对纳米产物分散性能的影响图 8a)和图 8b)分别为在最适宜制备条件得到的碳酸铝铵前驱体经过一步煅烧(1 200 ℃直接煅烧)和经过多步煅烧(先300 ℃低温煅烧再1 200 ℃高温煅烧)后生成纳米α-Al2O3的TEM形貌。
|
| 图 8 纳米氧化铝的TEM形貌 Figure 8 TEM morphologies of nanometer alumina |
| |
由图 8a)可以看出,前驱体经过一步煅烧后得到的产物为纳米颗粒,部分颗粒与颗粒之间存在聚集现象,分散性能较差。由图 8b)可以看出,前驱体经过多步煅烧后得到的产物为50 nm左右的颗粒,颗粒的分散度较一步煅烧有了显著的提高,基本达到单分散。由于前驱体在煅烧过程中结晶水的失去会导致前驱体发生自溶解作用,引起碳酸铝铵纳米棒发生软团聚,在随后的高温煅烧过程中相互团聚的纳米棒会烧结在一起形成硬团聚。因此,应采取多步煅烧法,先在300 ℃低温条件下得到无水的无定形氧化铝,然后将软团聚打开1 200 ℃高温煅烧得到单分散的纳米α-Al2O3。
3 结论利用铝-空气电池放电产物制备了纳米氧化铝。研究了放电产物溶解所需的最适宜温度和酸的用量,反应物滴定速度、煅烧条件对前驱体与纳米氧化铝分散性的影响。结果表明,当m(浓硫酸):m(放电产物)=5:2,反应温度为100 ℃时放电产物能够完全浸出,硫酸铝的滴定速度小于16 mL/min时能够得到较纯净的碳酸铝铵前驱体,前驱体先经300 ℃低温加热,然后经过1 200 ℃高温煅烧可以得到粒径在50 nm左右,单分散的α-Al2O3。
| [1] |
张立德. 我国纳米材料技术应用的现状和产业化的机遇[J].
材料导报, 2001, 15(7): 2–5.
Zhang Lide. Nanomaterials and nanotechnology in China:Current status of application and opportunities for commercialization[J]. Materials Review, 2001, 15(7): 2–5. |
| [2] | Levin I, Brandon D. Metastable alumina polymorphs: Crystal structures and transition sequences[J]. J Am Ceram Soc, 1998, 81(8): 1995–2012. |
| [3] | Liu Y, Min F, Zhu J, et al. Effect of nanometer Al2O3 powder on microstructure and properties of alumina ceramics by microwave sintering[J]. Mater Sci Eng, A, 2012, 546: 328–331. DOI: 10.1016/j.msea.2012.03.072 |
| [4] |
余忠清, 赵秦生. 溶胶-凝胶法制备超细球形纳米氧化铝粉末[J].
无机材料学报, 1994, 9(4): 475–479.
Yu Zhongqing, Zhao Qinsheng. Preparation of ultrafine spherical alumina powders by sol-gel process[J]. Journal of Inorganic Materials, 1994, 9(4): 475–479. |
| [5] |
付高峰, 毕诗文, 孙旭东, 等. 超细氧化铝粉末制备技术[J].
有色矿冶, 2000, 16(1): 39–41.
Fu Gaofeng, Bi Shiwen, Sun Xudong, et al. The preparation technique of ultrafine alumina powders[J]. Non-Ferrous Mining and Metallurgy, 2000, 16(1): 39–41. |
| [6] |
李继光, 孙旭东, 张民, 等. 碳酸铝铵分解制备α-Al2O3超细粉[J].
无机材料学报, 1998, 13(6): 803–807.
Li Jiguang, Sun Xudong, Zhang Min, et al. Synthesis of utlra-fine α-Al2O3 powder by pyrolysis of ammonium aluminium carbonate hydroxide[J]. Journal of Inorganic Materials, 1998, 13(6): 803–807. |
| [7] | Su Y, Fei G, Zhang Y, et al. Controllable preparation of the ordered pore arrays anodic alumina with high-quality photonic band gaps[J]. Mater Lett, 2011, 65: 2693–2695. DOI: 10.1016/j.matlet.2011.05.112 |
| [8] |
林元华, 张中太, 黄传勇, 等. 前驱体热解法制备高纯超细α-Al2O3粉末[J].
硅酸盐学报, 2000, 28(3): 268–271.
Lin Yuanhua, Zhang Zhongtai, Huang Chuanyong, et al. Preparation of high purity and ultra-fine α-Al2O3 powders by pyrolysis of NH4AlO(OH)HCO3[J]. Journal of the Chinese Ceramic Society, 2000, 28(3): 268–271. |
| [9] |
陈俊彦.
最新精细陶瓷技术[M]. 北京: 中国建筑工业出版社, 1998 Chen Junyan. Fine ceramics with the latest technology[M]. Beijing: The Chinese Press of Building Industry, 1998. |
| [10] |
许并社.
纳米材料应用技术[M]. 北京: 化学工业出版社, 2004 Xu Bingshe. Development and application technology of nanometer materials[M]. Beijing: Chemical Industry Press, 2004. |
 2017, Vol. 34
2017, Vol. 34





