2. 洛阳烟草公司, 河南 洛阳 471000;
3. 浙江中烟工业有限责任公司, 杭州 310008
2. Luoyang Tobacco Company, Luoyang Henan 471100, China;
3. China Tobacco Zhejiang Industrial Co. Ltd, Hangzhou 310008, China
我国是世界上最大的烟草生产国,每年有大约25%的烟叶被废弃[1],不仅造成了巨额经济损失,也带来了巨大的生态环境污染。废弃烟叶中含有大量有效成分,不仅有重要的经济价值,还有重要的医药价值。合理的利用废弃烟叶是我国烟叶产业可持续发展的重要保障[2]。常用的烟叶致香成分提取方法有:水蒸气蒸馏[3]、溶剂萃取[4]、同时蒸馏萃取(SE-SD)[5]、微波辅助溶剂萃取(MASE)[6-7]等。高宏建等[8]对烟草精油的水蒸气蒸馏法提取工艺进行了研究,通过单因素试验及正交试验的方法得到最适宜提取条件,并获得了1.7%的精油收率。杨再波等[9]采用同时蒸馏萃取方法,研究了烤烟烟梗中挥发性香气成分的组成,鉴定出39种香气成分。张献忠等[10]采用溶剂提取法对废弃烟叶进行了萃取研究,共鉴定致香物质91种,得到浸膏产率约为3.38%。以上研究均取得了较为显著的成果,但这些研究均未提及到烟叶中含量较高的α-维生素E(α-Tocopherol)的提取。周等[11]研究了微波辅助溶剂提取法提取烟叶中茄尼醇的工艺,但并未报道发现天然维生素E。尽管同时蒸馏萃取和微波辅助溶剂提取法相比溶剂提取法有诸多优势,但不适合烟叶中天然维生素E的提取。为了更好地利用废弃烟叶资源,选取溶剂提取法对烟叶精油以及天然维生素E进行了提取研究,并采取响应面法对提取工艺进行优化。
1 材料与方法 1.1 实验材料和分析方法实验所用废弃烟叶产自洛阳地区,于35 ℃下真空干燥4 h。粉碎后过30、40、50、60和70目筛密封保存备用。
所有有机试剂(N, N-二甲基甲酰胺、乙醇、丙酮、乙醚、环己烷)均购自天津市江天化工科技有限公司,分析纯。
实验中定性分析由安捷伦公司气质联用仪(GC-MS,Agilent 7890A-5975)、定量分析由气相色谱仪(GC,Agilent 7890B)完成。色谱条件:色谱柱为HP-5MS(30 m×0.25 mm×0.25 μm);进样口温度选定为260 ℃,进样量选定为1 μL,分流比选定为5:1,载气为氦气,载气流量选定为5 mL/min,升温程序选定为50 ℃保持2 min,4 ℃/min升温至230 ℃,1 ℃/min升温至255 ℃。
1.2 单因素实验设计所有单因素对实验结果的影响用提取率评定:
| $ Y = \frac{m}{M} \times 100\% $ | (1) |
其中Y为提取率,%;m为所得精油质量,g;M为所用烟末质量,g。
称取烟末15 g,放置于250 mL三口烧瓶中,并置入一定量萃取剂,在一定温度下水浴搅拌萃取一定时间。合并萃取液,脱除提取剂之后计算提取率,重复3次实验,并进行定性、定量分析。单因素实验安排如表 1所示。单因素实验所得最适宜实验条件将被选为下一单因素实验条件。
| Extraction parameters | Units | Levels of parameters | ||||
| Temperature | ℃ | 30 | 40 | 50 | 60 | 70 |
| Particles size of powder | mesh | 30 | 40 | 50 | 60 | 70 |
| Time | h | 4.0 | 5.0 | 6.0 | 7.0 | 8.0 |
| Ratio of liquid to solid | mL/g | 6:1 | 8:1 | 10:1 | 12:1 | 14:1 |
| Extraction times | none | 1 | 2 | 3 | ||
提取次数单因素实验其他实验条件为:提取温度40 ℃,物料细度60目,提取时间6.0 h,物料比10 mL/g。提取温度单因素实验其他实验条件为:物料细度60目,提取时间6.0 h,物料比10 mL/g。物料细度单因素实验其他实验条件为:提取温度40 ℃,提取时间6.0 h,物料比10 mL/g。提取时间单因素实验其他实验条件为:提取温度40 ℃,物料细度50目,物料比10 mL/g。物料比单因素实验其他实验条件为:提取温度40 ℃,物料细度50目,提取时间6.0 h。
1.3 响应面法优化提取工艺根据单因素实验结果,选取提取温度、提取时间、提取物料比为独立变量(分别以A、B、C表示)进行响应面法实验优化提取工艺。如表 2所示,根据BBD方法设计三因素三水平共计17组实验。
| Independent variables | Codeunits | Coded variable level | ||
| -1 | 0 | 1 | ||
| Temperature/℃ | A | 34 | 40 | 45 |
| Extraction Time/h | B | 5.5 | 6.0 | 6.5 |
| Liquid-solid ratio/(mL·g-1) | C | 11 | 12 | 13 |
实验通过Design-Expert 8.0.6设计,以A、B、C为自变量,以提取率Y为响应值,实验结果通过式(2) 进行多元拟合回归。
| $ Y = {\beta _0} + \sum\limits_{k = 1}^3 {{\beta _k}{X_k}} + \sum\limits_{k = 1}^3 {{\beta _{kk}}{X^2}_k} + \sum\limits_{k = 1}^2 {\sum\limits_{j = 2}^3 {{\beta _{kj}}{X_k}{X_j}} } $ | (2) |
其中Y为响应值,Xk与Xj为独立变量;i与j为实验设计变量;β0为模型距;βk,βkk与βkj为自变量的回归系数、线性和二元交互系数。
2 结果与讨论 2.1 提取溶剂的选择N, N-二甲基甲酰胺(DMF),乙醇、丙酮、乙醚和环己烷的提取效果如图 1和图 2所示。
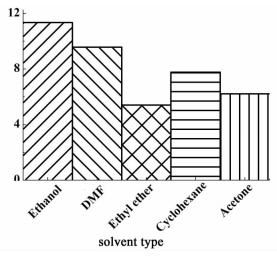
|
| 图 1 不同溶剂提取效率 Figure 1 Extraction yields of different solvents |
| |
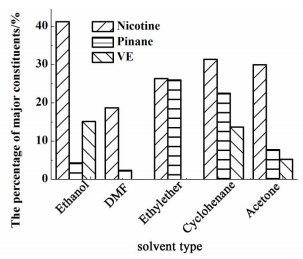
|
| 图 2 不同溶剂提取物主要成分表 Figure 2 Major constituents of tobacco oleoresin extracted |
| |
从图 1和图 2中可以看出,乙醇做溶剂时,浸膏提取率以及烟碱和维生素E的提取效率均达到最大。同样,DMF作为萃取剂,虽然浸膏提取率较高,但是DMF本身黏度较大,不利于后期脱除溶剂、保护热敏性物质,而且在DMF提取物中并未发现维生素E。乙醚和丙酮作为提取剂时,提取率较低,且提取物中不含维生素E或含有量较少。张献忠等[12]研究了乙醚作为溶剂对烟叶中有效物质的提取效果,结果未发现提取物中含有维生素E,并发现乙醚对烟碱有一定的提取效果。环己烷作为提取剂,提取效率较高,烟碱、蒎烷、维生素E的收率均较高,且溶剂回收率较高。刘悍等[13]考察了乙醇和环己烷对烟叶中维生素E的提取效果,研究结果表明,2种溶剂对维生素E的提取效果相当。相比5种溶剂提取效果,选择环己烷作为最佳提取剂。用环己烷得到的提取物中烟碱、蒎烷、维生素E所占提取物比例超过70%。
2.2 单因素实验结果分析当提取次数增至2次,提取率从6.50%上升至7.45%。当提取次数增至3次,提取率再次提升为7.59%,提升效果不明显。为减少溶剂、能源消耗以及简化提取工艺,选取2次为最适宜提取次数。
提取温度对提取率的影响如图 3所示。为了避免热敏性物质的损失,提取温度区间选择为30~70 ℃。图 3中所示,当温度提升至40 ℃时,提取率迅速增加至最高,随着温度的进一步提升,提取率稍有下降并基本维持稳定。这是由于温度提升加大了溶剂的分子运动[14-15]并增强了传质速率所以导致提取率增加。但是过高的温度会导致热敏性物质的损失,最佳提取温度必须同时考虑到能源消耗和提取率,因此选取35~45 ℃进行下一步研究。

|
| 图 3 提取温度对提取率的影响 Figure 3 Effect of temperature on the yield of the extract |
| |
物料细度对提取效率的影响如图 4所示。当物料细度由30目提升至50目时,提取率一直上升。这是由于物料越细,烟叶中溶质的溶解速度提升,同时固液两相之间的有效接触面增大使传质速度加快提升了提取率。然而当物料目数增加至70目,由于物料过细导致吸附作用过强,降低了提取率。因此最适宜物料目数定为50目。

|
| 图 4 物料细度对提取率的影响 Figure 4 Effect of particles size of powder on the yield of the extract |
| |
提取时间对提取率的影响如图 5所示,提取率随提取时间增加而增加,并在6.0 h出达到最大值,随后基本维持稳定。当提取时间达到6.0 h时,溶质与溶剂之间已达到溶解平衡,再增加提取时间并不能提升提取率。因此选取提取时间5.5~6.5 h进行下一步研究。
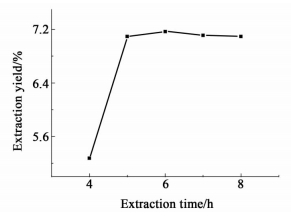
|
| 图 5 提取时间对提取率的影响 Figure 5 Effect of extraction time on the yield of the extract |
| |
物料比对提取效率的影响如图 6所示。提取率随物料比增加而增加,并在物料比增加至12以后基本维持稳定。这是由于当物料比为12时,烟叶中所含物质已达到最低水平,增加物料比已不能再有效提升提取率。因此,选择物料比11~13进行下一步研究。
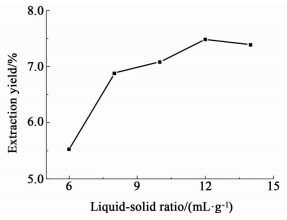
|
| 图 6 提取物料比对提取率的影响 Figure 6 Effect of ratio of liquid to solid (mL/g) on the yield of the extract |
| |
实验设计以及结果如表 3所示。经过Design-Expert软件对数据进行二次多项式回归,得模型如下。
| $ \begin{array}{c} Y = - 159.4127 + 1.66019A + 22.57298B + \\ 10.49193C - 0.051018AB - 0.0062635AC - \\ 0.35495BC - 0.014908{A^2} - 1.33684{B^2} - \\ 0.33149{C^2} \end{array} $ | (3) |
| Standard | Run | A Temperature/℃ | B Extraction time/h | C Liquid-solid ratio/(mL·g-1) | Extraction yield/% |
| 2 | 1 | 45(1) | 5.50(-1) | 12(0) | 7.504 |
| 17 | 2 | 40(0) | 6.00(0) | 12(0) | 7.865 |
| 1 | 3 | 35(-1) | 5.50(-1) | 12(0) | 6.361 |
| 11 | 4 | 40(0) | 5.50(-1) | 13(1) | 7.561 |
| 3 | 5 | 35(-1) | 6.50(1) | 12(0) | 6.968 |
| 4 | 6 | 45(1) | 6.50(1) | 12(0) | 7.601 |
| 12 | 7 | 40(0) | 6.50(1) | 13(1) | 7.315 |
| 10 | 8 | 40(0) | 6.50(1) | 11(-1) | 8.093 |
| 5 | 9 | 35(-1) | 6.00(0) | 11(-1) | 6.638 |
| 13 | 10 | 40(0) | 6.00(0) | 12(0) | 7.913 |
| 6 | 11 | 45(1) | 6.00(0) | 11(-1) | 7.538 |
| 9 | 12 | 40(0) | 5.50(1) | 11(-1) | 6.629 |
| 16 | 13 | 40(0) | 6.00(0) | 12(0) | 7.870 |
| 15 | 14 | 40(0) | 6.00(0) | 12(0) | 7.796 |
| 7 | 15 | 35(-1) | 6.00(0) | 13(1) | 6.747 |
| 8 | 16 | 45(1) | 6.00(0) | 13(1) | 7.522 |
| 14 | 17 | 40(0) | 6.00(0) | 12(0) | 7.632 |
式(3) 方差分析如表 4所示。表 4中可见,该模型P值为0.0014( < 0.01),R2=0.9435,失拟项(Lack of fit)值为0.0851( > 0.05) 不显著,证明该模型拟合程度好,实验误差小,为可靠模型。在此模型中,A、C、A2、B2、C2为显著项。与单因素实验结果相吻合。
| Source | Coefficientfactor | Sum ofsquares | df | Meansquare | F value | p-valueProb > F |
| Model | -159.4127000 | 3.68000 | 9 | 0.41000 | 12.99 | 0.0014a |
| A-Temperature | 1.6601900 | 1.49000 | 1 | 1.49000 | 47.30 | 0.0002a |
| B-Time | 22.5729800 | 0.11000 | 1 | 0.11000 | 3.38 | 0.1085b |
| C-Liquid-solid | 10.4919300 | 0.19000 | 1 | 0.19000 | 6.18 | 0.0418a |
| AB | -0.0510180 | 0.06500 | 1 | 0.06500 | 2.07 | 0.1936b |
| AC | -0.0062635 | 0.00392 | 1 | 0.00392 | 0.12 | 0.7344b |
| BC | -0.3549500 | 0.13000 | 1 | 0.13000 | 4.00 | 0.0855b |
| A2 | -0.0149080 | 0.58000 | 1 | 0.58000 | 18.59 | 0.0035a |
| B2 | -1.3368400 | 0.47000 | 1 | 0.47000 | 14.95 | 0.0062a |
| C2 | -0.3314900 | 0.46000 | 1 | 0.46000 | 14.70 | 0.0064a |
| Residual | 0.22000 | 7 | 0.03100 | |||
| Lack of Fit | 0.1700000 | 3 | 0.05700 | 4.68 | 0.0851b | |
| Pure Error | 0.0490000 | 4 | 0.01200 | |||
| Cor Total | 3.9000000 | 16 | ||||
| Std. Dev.: 0.18; R2=0.9435;Adj R2=0.8709. a Significant. bNot significant. | ||||||
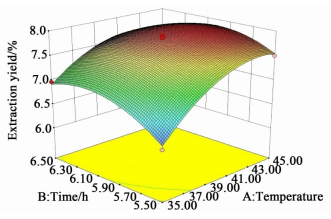
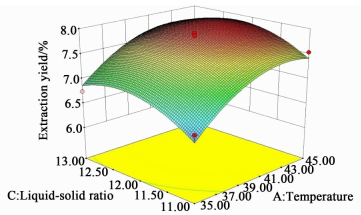
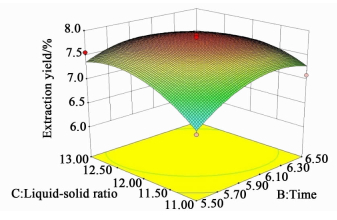
响应面图可以很好的反映自变量之间的交互作用,并确定各个自变量的最大响应值[16]。各自变量的交互作用对提取率的影响如图 7、图 8和图 9所示。
|
| 图 7 提取时间与温度对提取率的影响 Figure 7 Response surface plot for the effect of time-temperature on extraction |
| |
|
| 图 8 提取物料比与温度对提取率的影响 Figure 8 Response surface plot for the effect of liquid-solid ratio and temperature on extraction |
| |
|
| 图 9 提取时间与物料比对提取率的影响 Figure 9 Response surface plot for the effect of time and liquid-solid ratio on extraction |
| |
提取时间和提取温度的交互影响如图 7所示。从表 3可以看出,提取温度和时间的交互作用影响显著(P < 0.05),并且二者对提取率影响均显著。随着提取温度和时间的增加,提取率出现增加,但随着继续增加,提取率出现下降。这可能是由于热敏性物质的损失以及提取剂提取性能随着温度变化而变化引起。
如图 8及表 3所示,提取温度对提取率的影响显著(P < 0.05),然而物料比以及提取温度和物料比的交互作用对提取率影响效果不显著(P > 0.05)。提取温度和物料比对提取率的影响同提取温度和时间对提取率的影响类似。
提取时间及物料比交互作用对提取率的影响如图 9所示,提取物料比及时间的增长可以促进提取率的增加。但是过度的增加会导致提取率的降低。当提取物料比和时间超过一定值之后,烟叶内所含溶质处于可提取的最低水平。表 3中方差分析可以证实二者交互作用对提取率影响不显著(P > 0.05),同样,物料比对提取率影响不显著(P > 0.05),而提取时间显著(P < 0.05)。
2.3.2 模型验证模型验证试验在提取温度42.54 ℃、物料比12.31 mL/g、时间6.0 h下进行,所得收率为7.95%,与模型预测值7.94%相差无几,表明此模型可靠。
3 结论通过考察不同提取剂对提取率的影响,其中环己烷作提取剂有较高的提取率,且对烟碱、蒎烷、维生素E有较强的提取能力。选用环己烷作为提取剂,得到烟叶致香物质提取率较之前张献忠[10]研究所得3.38%的提取率高出许多,并且所得致香物质中维生素E的含量较高。实验证明提取时间、温度、物料比对提取率有较大影响。通过响应面法对三因素进行提取工艺优化,所得最适宜提取工艺条件为:提取温度42.54 ℃,物料比为12.31 mL/g,时间6.0 h,在此条件下可得收率7.95%。其中含烟碱为32.25%、蒎烷为23.14%、维生素E为14.11%。
| [1] |
董占能, 白聚川, 张皓东. 烟草废弃物资源化[J].
中国烟草科学, 2008, 29(1): 39–42.
Dong Zhanneng, Bai Juchuan, Zhang Haodong. Comprehensive utilization of tobacco waste[J]. China Tobacco Science, 2008, 29(1): 39–42. |
| [2] |
景延秋, 官长荣, 张月华, 等. 烟草香味物质分析研究进展[J].
中国烟草科学, 2005, 26: 44–48.
Jing Yanqiu, Gong Changrong, Zhang Yuehua, et al. Research progress of aroma compositions of tobacco[J]. China Tobacco Science, 2005, 26: 44–48. DOI: 10.3969/j.issn.1007-5119.2005.02.014 |
| [3] | Golmakani M T, Rezaei K. Comparison of microwave-assisted hydrodistillation with the traditional hydrodistillation method in the extractionof essential oils from Thymus vulgaris, L.[J]. Food Chemistry, 2008, 109(4): 925–930. DOI: 10.1016/j.foodchem.2007.12.084 |
| [4] | Niu G, Xie Y, Lou J, et al. Isolation and purification of glycyrrhizic acid with solvent extraction[J]. Separation and Purification Technology, 2005, 44(3): 189–196. DOI: 10.1016/j.seppur.2004.05.011 |
| [5] | Blanch G P, Tabera J, Herraiz M, et al. Preconcentration of volatile components of foods: Optimization of the steam distillation-solvent extraction at normal pressure[J]. Journal of Chromatography A, 1993, 628(93): 261–268. |
| [6] | Tomaniova M, Hajslova J, Pavelka J, et al. Microwave-assisted solvent extraction——A new method for isolation of polynuclear aromatic hydrocarbons from plants[J]. Journal of Chromatography A, 1998, 827(98): 21–29. |
| [7] | Kaufmann B. Recent extraction techniques for natural products: Microwave-assisted extraction and pressurised solvent extraction[J]. Phytochem Anal, 2002, 13(2): 105–113. DOI: 10.1002/(ISSN)1099-1565 |
| [8] | Gao H, Zhang X, Zhong J, et al. Research on extraction tobacco essential oils by steam distillation[J]. Science and Technology of Food Industry, 2011, 32(10): 388–390. |
| [9] |
杨再波, 彭黔荣, 赖东辉, 等. 烤烟烟梗中挥发性中性香味成分的分析研究[J].
贵州工业大学学报:自然科学版, 2005, 34: 31–34.
Yang Zaibo, Peng Qianrong, Lai Donghui, et al. Studies and analysis on the volatile neutral aroma components in stem of flue-cured tobacco[J]. Journal of Guizhou University of Technology: Natural Science Edition, 2005, 34: 31–34. |
| [10] | Zhang X, Gao H, Zhang L, et al. Extraction of essential oil from discarded tobacco leaves by solvent extraction and steam distillation, and identification of its chemical composition[J]. Industrial Crops and Products, 2012, 39: 162–169. DOI: 10.1016/j.indcrop.2012.02.029 |
| [11] | Zhou H, Liu C. Microwave-Assisted extraction of solanesol from tobacco leaves[J]. Journal of Chromatography, 2006, 1129(1): 135–139. DOI: 10.1016/j.chroma.2006.07.083 |
| [12] | 张献忠. 废次烟末中烟草香味物质提取、应用及生物活性[D]. 杭州: 浙江大学, 2013 Zhang Xianzhong. Extraction of tobacco flavor compounds from discarded tobacco leaves and their application in cigarettes and in vitro bioactivities[D]. Hangzhou: Zhejiang University, 2013(in Chinese) |
| [13] |
刘悍, 汤建国, 李正风, 等. 高效液相色谱测定烟草制品中的维生素E[J].
化学分析计量, 2009, 18(6): 9–30.
Liu Han, Tang Jianguo, Li Zhengfeng, et al. Determination of Vitamin E in tobacco by HPLC[J]. Chemical Analysis and Meterage, 2009, 18(6): 9–30. |
| [14] | Elbashir N O, Al-Zahrani S M, Mutalib M I A, et al. A method of predicting effective solvent extraction parameters for recycling of used lubricating oils[J]. Chemical Engineering & Processing Process Intensification, 2002, 41(9): 765–769. |
| [15] | Matsuhiro B, Lillo L E, Sáenz C, et al. Chemical characterization of the mucilage from fruits of Opuntia Ficus Indica[J]. Carbohydrate Polymers, 2006, 63(2): 263–267. DOI: 10.1016/j.carbpol.2005.08.062 |
| [16] | Ballard T S, Mallikarjunan P, Zhou K, et al. Optimizing the extraction of phenolic antioxidants from peanut skins using response surface methodology[J]. J Agric Food Chem, 2009, 57(8): 3064–3072. DOI: 10.1021/jf8030925 |
 2017, Vol. 34
2017, Vol. 34





