自1968年被发现以来[1],氟硼二吡咯(BODIPY)类染料就展示出了极其广阔的应用前景,目前已被广泛用于生物分子标记[2-3]、离子探针[4-6]、光开关[7]、电致发光材料[8-9]、激光染料[10]、太阳能电池[11-12]等方面。BODIPY具有较高的稳定性及荧光量子产率,这类染料的光子与电子性质可通过在分子中引入取代基进行调控,从而备受研究者重视[13]。BODIPY的核心化学结构如图 1所示。BODIPY分子的独特共轭结构使其在聚合物中既可作为电子供体又可作为电子受体存在,当相邻基团存在较强的给电子特性时,BODIPY基团就表现出受电子的特性,反之亦然[14]。BODIPY既具有很强的自聚合能力,又可与其它单体形成共聚物,得到功能丰富、性质多样的聚合物染料。尽管BODIPY染料已被广泛研究,但BODIPY共轭聚合物的制备和应用则是近年来的研究热点。

|
| 图 1 氟硼二吡咯染料的核心 Figure 1 Structure of the BODIPY core |
| |
钯催化的交叉偶联反应如Stille、Suzuki、Sonogashira等反应可用于BODIPY共轭聚合物的制备,并可合成出聚合度最高约为40的聚合物。Meng等[15]采用Suzuki反应制备出3种BIDOPY与芴的衍生物交替排列为主链的共轭聚合物(图 2),产率高达69%。此法反应条件成熟,产率较高,较电化学聚合(见1.3),其优点是可进行较大规模的制备,缺点是反应后处理相对复杂,要进行多步的分离纯化。
在此方法中,BODIPY在氧化剂作用下偶合脱去2个氢原子形成二聚物,二聚物再次发生偶合使链增长,最终得到长链的BODIPY共轭聚合物。Nepomnyashchii等[16]采用FeCl3作为氧化剂,使BODIPY单体在2, 6位发生偶联反应,制备了二聚体、三聚体和聚合物(图 3)。此类聚合反应亦可通过电化学聚合(见1.3)实现,但化学氧化法对装置要求简单、操作简便,而且可通过加入表面活性剂的方法来控制其生长形态;较电化学聚合,脱离了电极单向生长的限制,可获得不同的聚合物形貌。
该聚合法是以电极电位作为聚合反应的驱动力,在电极表面直接沉积BODIPY聚合物,一般用于BODIPY分子的自聚,是制备BODIPY共轭聚合物采用较多的方法。电化学法一般可分为循环伏安法与固定电位法。循环伏安法是不断改变电位,让电位从0到最大值反复变化,同时记录电流的变化。在刚开始实验的时候,为了确定反应电位应使用循环伏安法来扫描以得到不同电位下的反应情况。固定电位法是将电位固定后,让反应在最适合的电位下进行,往往固定的反应电位略高于刚开始进行聚合的电位,能够让反应在理想电位下进行,可以得到较多的产物。Algi等[17]使用循环伏安法对有3个活性位点的BODIPY单体进行电聚合,得到网状聚合物(图 4)。采用铂电极为工作电极、对电极,Ag/AgCl电极为参比电极,电解质为四丁基六氟磷酸铵的二氯甲烷溶液(0.1 mol/L),扫速100 mV/s。
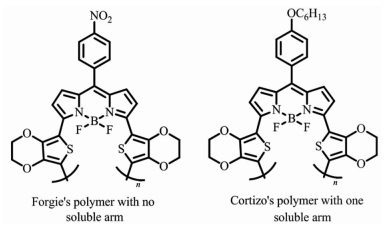
3种共轭聚合物的合成方法可相互补充,采用何种方法主要取决于单体的结构以及实验目的。Forgie等[18]将BODIPY与EDOT的锡试剂通过Stille反应合成出相应单体,再用电化学聚合法制备出共聚物(图 5,左);Cortizo等[19]以BODIPY为受体,EDOT为给体,用化学聚合法,通过Stille反应直接制备出共轭聚合物(图 5,右);两者本质的区别是后者在BODIPY的8位增加了助溶侧链,有助于提升聚合物在溶液中的加工性能。
|
| 图 5 2种用不同方法制备的BODIPY共轭聚合物 Figure 5 BODIPY polymers prepared with two different methods |
| |
随着分子聚合度的增加,BODIPY聚合物的π-共轭体系增大。Nepomnyashchii等[16]分别检测了单体与3种聚合物的性质(图 3)。研究发现在单体变成聚合物的过程中,聚合物的紫外吸收和荧光发射光谱较单体会发生一定的红移,而随着聚合度的增加,BODIPY共聚物的带隙呈现出逐渐减小的趋势。
BODIPY共轭聚合物位阻因素决定着聚合物共轭的程度,较小的空间位阻有利于共轭单元的共平面,从而有利于π-电子的离域,达到提升光吸收能力和电子传递性能的目的。Usta等[20]设计了四甲基与二甲基取代的BODIPY单体,分别与噻吩或二噻吩的锡试剂进行Stille反应制备成4种共聚物(图 6)。研究发现二甲基取代的BODIPY具有较小的基团位阻,所组成的聚合物主链更趋于平面化,具备更小的带隙和更高的电子迁移率。与四甲基取代BODIPY共聚物24~87 nm的光谱红移相比,二甲基取代BODIPY的共聚物产生了高达135~255 nm的红移。Cihaner等[21]通过电化学聚合制备了β位BODIPY共聚物,其带隙为1.33 eV(图 7左);而Forgie等[18]用电化学聚合法制备的α位聚合物的带隙仅为0.8 eV(图 7右)。可以看出,空间效应是BODIPY共轭聚合物设计过程中必须考虑的因素。

|
| 图 7 2种不同结构的BODIPY聚合物 Figure 7 Two types of BODIPY-EDOT copolymers with different structures |
| |
BODIPY共轭聚合物中能级的变化与给-受体单元有关,一般HOMO能级依赖于给体单元的变化,而LUMO能级依赖于受体单元的变化。BODIPY基团也会根据所共聚基团的电性,充当给体基团或受体基团。Popere等[14]通过Sonogashira反应,将BODIPY作为给体基团制备出4种共轭聚合物(图 8)。研究发现与BODIPY电子亲和力相当的受体基团不能改变材料的带隙,而强受体基团如苝二酰亚胺(PDI)及萘二酰亚胺(NDI)能使BODIPY显示出给体特性,从而通过给体-受体相互作用使共轭聚合物的HOMO能级降低,减小了材料的带隙。
2.3 侧链的影响在BODIPY结构中的4位引入取代基,不能有效地与二吡咯平面共轭,但可显著提高聚合物的溶解性。众所周知,随分子聚合度的增加,其溶解性会大幅降低,而在有机溶剂中良好的溶解性是功能染料可加工的保障。在4位或8位引入烷基链等助溶基团是设计BODIPY共轭聚合物的单体时就需要考虑的因素;此外,在另一种参与共聚的单体上引入助溶基团亦是可取的。
2.4 聚集效应相同物质的不同形态会表现出不同的性质,因此BODIPY聚合物在溶液中的自聚集和自组装行为也是影响其性质的重要因素。Nagai等[22]通过Sonogashira-Hagihara反应,得到的共轭聚合物不但有较好的荧光性能(图 9),并且因其“棒-卷”(rod-coil)结构和分子内的π-π堆积,形成自组装的纳米粒子,具备进一步加工成纳米结构的可能性。在分析这3种聚合物的结构后,可得出基团的空间位阻越大越会阻碍其自组装行为的结论。
3 BODIPY共轭聚合物的应用 3.1 有机半导体材料Usta等[20]制备的BODIPY共轭聚合物(图 6)具备作为有机薄膜晶体管的优良潜质,其用溶液加工成的有机薄膜晶体管具有高于0.1 cm2/(V·s)的空穴传导率和高达105~106的开关比。Popere等[14]发现通过改变共聚基团可获得不同类型的半导体:BODIPY/苯并吡嗪共聚物与BODIPY/苯并噻二唑共聚物可作为p-型半导体材料;而BODIPY与PDI、NDI的共聚体则可作为n-型半导体材料(图 8)。
3.2 化学及生物探针利用BODIPY共轭聚合物与不同的离子络合后的荧光响应,可制备化学传感器。Meng等[15]研究的BODIPY与芴衍生物的共轭聚合物(图 2)对氟离子和氰离子有特殊的荧光响应,可用于检测环境中的氟离子与氰离子。在生物领域,Thivierge等[24]将BODIPY/芴共聚物(图 10)通过溶剂介导法处理成直径约为40 nm的颗粒,经过组织培养进入克隆鼠的肝细胞中并发出强烈的荧光,并且不会被细胞的溶酶体吞噬,为BODIPY共轭聚合物在生物检测领域的应用创造了有利条件。
3.3 有机太阳能电池领域的应用在有机光伏组件的研究领域中,降低给体材料的带隙、扩大光吸收范围,并提高激子的扩散能力是提高能量转化率的关键。BODIPY共轭聚合物的分子内Donor-Acceptor(D-A)结构有可能同时解决以上问题。首先BODIPY可作为分子内的受体单元,与给体单元形成的共轭结构可有效降低聚合物分子的带隙;其次分子内的D-A结构能够有效增强电子和空穴的传递,提升激子的扩散距离,同时增强氧化还原过程中的稳定性。Forgie等[18]制备的BODIPY/EDOT共聚物(图 7右)的带隙仅为0.8 eV,而Usta等[20]制备的BODIPY/噻吩共聚物(图 6)的空穴传导率高达0.1 cm2/(V·s),由此可见BODIPY共轭聚合物作为有机光伏材料具有相对较高的研究价值。Kim等[25]利用Donuru等[23]的研究成果制备出2种带隙为1.6 eV,最大吸收峰超过700 nm的BODIPY共轭聚合物(图 11,上),并通过溶液加工的方法制备成体异质结光伏器件;该器件具有接近2%的能量转化率,开路电压为0.8 eV,短路电流为4.8 mA·cm-2。He等[26]实现了BODIPY与2价金属铂的共聚(图 11,下),形成的共轭聚合物带隙为1.7 eV,制备的太阳能电池器件的能量转化率接近1%。

|
| 图 11 用于制备光伏器件的BODIPY共轭聚合物 Figure 11 BODIPY copolymers for OPV |
| |
一般来说,BODIPY单体聚合后其荧光发射峰会因共轭程度的增加而产生一定的红移。Donuru等[23]发现BODIPY与炔共轭聚合后,其荧光发射峰较聚合前的单体红移了160~170 nm,达到了680 nm的深红色区,而且在BODIPY共聚上其他发色团后,可以综合几种发色团的发射波长,覆盖更大的色域。Takamizu等[27]利用含有芴、苯乙烯衍生物与BODIPY 3种发色团的共聚物实现了白光发射,说明该聚合物的荧光发射覆盖了可见光范围的大部分波长。Alemdaroglu等[28]检测了BODIPY自聚物、BODIPY/苯共聚物、BODIPY/对二乙炔基苯共聚物的荧光性质(图 12),发现单个BODIPY自聚物分子的荧光发射强度比罗丹明6G分子强数倍,荧光量子产率可达57%,有作为激光染料的应用前景。Nepomnyashchii等[16]在制备出3种BODIPY聚合物后又研究了它们的电致发光机理(图 2),发现聚合物电致发光的发射峰与荧光发射峰偏差不大,具备作为有机电致发光二极管的潜力。
4 结论综上所述,可总结出BODIPY共轭聚合物的设计要点:1) 将BODIPY设计成聚合物的主要目的是通过扩展体系的共轭程度来增强材料的性能,包括低带隙、宽吸光范围及优良的电子传导率等。在设计聚合物的时候优先选择BODIPY的3, 5位进行聚合,若在2, 6位聚合,则尽量减少BODIPY上的取代基,以减小位阻。2) 根据需要选择具有不同光吸收范围、发射波长、电子推-拉能力的共聚单体,从而实现聚合物光学与电子性质的调节。3) 聚合物的侧链修饰有利于提高其溶解性,为了保证聚合物材料可加工性,可在BODIPY或其他共聚单元上引入一定数量的助溶侧链。
在未来的研究中,新型BODIPY共轭聚合物的设计与合成将是一个重要内容,特别是水溶性的BODIPY共轭聚合物目前还鲜有报道,因为生物应用的研究多在水体系中进行。此外,研发具有高效电子和能量传递性能的BODIPY共轭聚合物也具有重要的价值。考虑到分子自组装为聚合物带来的新特性,在设计此类共轭聚合物时,可从超分子化学的角度出发,制备出具有特定聚集形态的聚合物材料,并由此实现对材料性能的优化。
| [1] | Treibs A, Kreuzer F H. Difluorboryl-Komplexe von di-und tripyrrylmethenen[J]. Justus Liebigs Annalen der Chemie, 1968, 718(1): 208–223. DOI: 10.1002/(ISSN)1099-0690 |
| [2] | Haugland R P. Handbook of molecular probes and research products molecular probes inc[M]. 9th edition, Eugene, OR: Molecular Probes, Inc., 2002 |
| [3] | Jameson E E, Cunliffe J M, Neubig R R, et al. Detection of G proteins by affinity probe capillary Electrophoresis using a fluorescently labeled GTP analogue[J]. Analytical Chemistry, 2003, 75(16): 4297–4304. DOI: 10.1021/ac0342976 |
| [4] | Wagner R W, Lindsey J S. Boron-Dipyrromethene dyes for incorporation in synthetic multi-pigment light-harvesting arrays[J]. Pure and Applied Chemistry, 1996, 68(7): 1373–1380. |
| [5] | Beer G, Rurack K, Daub J. Chiral discrimination with a fluorescent boron-dipyrromethene dye[J]. Chemical Communications, 2001(12): 1138–1139. DOI: 10.1039/b102376b |
| [6] | Gabe Y, Urano Y, Kikuchi K, et al. Highly sensitive fluorescence probes for nitric oxide based on boron dipyrromethene chromophore rational design of potentially useful bioimaging fluorescence probe[J]. Journal of the American Chemical Society, 2004, 126(10): 3357–3367. DOI: 10.1021/ja037944j |
| [7] | Golovkova T A, Kozlov D V, Neckers D C. Synthesis and properties of novel fluorescent switches[J]. The Journal of Organic Chemistry, 2005, 70(14): 5545–5549. DOI: 10.1021/jo050540k |
| [8] | Lai R Y, Bard A J. Electrogenerated chemiluminescence 71. Photophysical, electrochemical, and electrogenerated chemiluminescent properties of selected dipyrromethene-BF2 dyes[J]. The Journal of Physical Chemistry B, 2003, 107(21): 5036–5042. DOI: 10.1021/jp034578h |
| [9] | Hepp A, Ulrich G, Schmechel R, et al. Highly efficient energy transfer to a novel organic dye in OLED devices[J]. Synthetic Metals, 2004, 146(1): 11–15. DOI: 10.1016/j.synthmet.2004.06.016 |
| [10] | Chen T, Boyer J H, Trudell M L. Synthesis of 2, 6-diethyl-3-methacroyloxymethyl-1, 5, 7, 8-tetramethylpyrromethene-BF2 for the preparation of new solid-state laser dyes[J]. Heteroatom Chemistry, 1997, 8(1): 51–54. DOI: 10.1002/(ISSN)1098-1071 |
| [11] | Ambroise A, Kirmaier C, Wagner R W, et al. Weakly coupled molecular photonic wires:Synthesis and excited-state energy-transfer dynamics[J]. The Journal of Organic Chemistry, 2002, 67(11): 3811–3826. DOI: 10.1021/jo025561i |
| [12] | Hattori S, Ohkubo K, Urano Y, et al. Charge separation in a nonfluorescent donor-acceptor dyad derived from boron dipyrromethene dye, leading to photocurrent generation[J]. The Journal of Physical Chemistry B, 2005, 109(32): 15368–15375. DOI: 10.1021/jp050952x |
| [13] | Ziessel R, Ulrich G, Harriman A. The chemistry of Bodipy: A new El Dorado for fluorescence tools[J]. New Journal of Chemistry, 2007, 31(4): 496–501. DOI: 10.1039/b617972j |
| [14] | Popere B C, Della P A M, Thayumanavan S. BODIPY-based donor-acceptor π-conjugated alternating copolymers[J]. Macromolecules, 2011, 44(12): 4767–4776. DOI: 10.1021/ma200839q |
| [15] | Meng G, Velayudham S, Smith A, et al. Color tuning of polyfluorene emission with BODIPY monomers[J]. Macromolecules, 2009, 42(6): 1995–2001. DOI: 10.1021/ma8023975 |
| [16] | Nepomnyashchii A B, Bröring M, Ahrens J, et al. Chemical and electrochemical dimerization of BODIPY compounds: Electrogenerated chemiluminescent detection of dimer formation[J]. Journal of the American Chemical Society, 2011, 133(48): 19498–19504. DOI: 10.1021/ja207545t |
| [17] | Algi M P, Tirkes S, Ertan S, et al. Design and synthesis of new 4, 4'-difluoro-4-bora-3a, 4a-diaza-s-indacene based electrochromic polymers[J]. Electrochimica Acta, 2013, 109: 766–774. DOI: 10.1016/j.electacta.2013.07.179 |
| [18] | Forgie J C, Skabara P J, Stibor I, et al. New redox stable low band gap conjugated polymer based on an EDOT-BODIPY-EDOT repeat unit[J]. Chemistry of Materials, 2009, 21(9): 1784–1786. DOI: 10.1021/cm9004823 |
| [19] | Cortizo-Lacalle D, Howells C T, Gambino S, et al. BODIPY-based conjugated polymers for broadband light sensing and harvesting applications[J]. Journal of Materials Chemistry, 2012, 22(28): 14119–14126. DOI: 10.1039/c2jm32374e |
| [20] | Usta H, Yilmaz M D, Avestro A J, et al. BODIPY-thiophene copolymers as p-channel semiconductors for organic thin-film transistors[J]. Advanced Materials, 2013, 25(31): 4327–4334. DOI: 10.1002/adma.v25.31 |
| [21] | Algı F, Cihaner A. An ambipolar low band gap material based on BODIPY and EDOT[J]. Organic Electronics, 2009, 10(3): 453–458. DOI: 10.1016/j.orgel.2009.01.010 |
| [22] | Nagai A, Miyake J, Kokado K, et al. Highly luminescent BODIPY-based organoboron polymer exhibiting supramolecular self-assemble structure[J]. Journal of the American Chemical Society, 2008, 130(46): 15276–15278. DOI: 10.1021/ja806939w |
| [23] | Donuru V R, Vegesna G K, Velayudham S, et al. Synthesis and optical properties of red and deep-red emissive polymeric and copolymeric BODIPY dyes[J]. Chemistry of Materials, 2009, 21(10): 2130–2138. DOI: 10.1021/cm900276r |
| [24] | Thivierge C, Loudet A, Burgess K. Brilliant BODIPY-fluorene copolymers with dispersed absorption and emission maxima[J]. Macromolecules, 2011, 44(10): 4012–4015. DOI: 10.1021/ma200174w |
| [25] | Kim B S, Ma B, Donuru V R, et al. Bodipy-Backboned polymers as electron donor in bulk heterojunction solar cells[J]. Chemical Communications, 2010, 46(23): 4148–4150. DOI: 10.1039/b927350f |
| [26] | He W, Jiang Y, Qin Y. Synthesis and photovoltaic properties of a low bandgap BODIPY-Pt conjugated polymer[J]. Polymer Chemistry, 2014, 5(4): 1298–1304. DOI: 10.1039/C3PY01396K |
| [27] | Takamizu K, Inagaki A, Nomura K. Precise synthesis of poly(fluorene vinylene)s capped with chromophores: Efficient fluorescent polymers modified by conjugation length and end-groups[J]. ACS Macro Lett, 2013, 2(11): 980–984. DOI: 10.1021/mz400455b |
| [28] | Alemdaroglu F E, Alexander S C, Ji Dongmei, et al. Poly(BODIPY)s: A new class of tunable polymeric dyes[J]. Macromolecules, 2009, 42(17): 6529–6536. DOI: 10.1021/ma900727k |
 2017, Vol. 34
2017, Vol. 34













