近年来,IMO不断提高船舶生活污水的排放标准以降低对海洋环境的危害。船舶生活污水水质和水量通常变化较大,而且处理过程要考虑船舶自身舱室温度、地理和空间位置等影响[1]。传统的船舶生活污水处理多为单一方法,如物化法、生物法等都存在自身难以克服的缺陷,较难满足IMO新的排放标准。目前,污水处理已不再局限于对单一处理方法进行改进,而是把不同技术合理有效地进行组合,取长补短来开发出耐冲击负荷,管理操作要求低,占地面积小且能快速高效处理的新型工艺与装置[2]。
高级氧化技术 (Advanced Oxidation Processes,AOPs) 是通过光电声磁等物理化学过程产生大量的活性自由基 (·OH),该自由基具有很高的氧化还原反应电位 (E=2.80 V),能无选择性的直接与废水中的有机物发生反应,且不会产生二次污染。·OH属于游离基反应,反应速度很快,反应常数比普通化学反应高7个数量级,极大地降低了设备要求,从而缩减了工艺流程。由于高级氧化技术降解有机物具有普遍性、高效性和彻底性的特点,可以从源头上解决水污染治理中的再污染问题,因而在污水处理工艺技术开发中具有独特的优势和潜在的应用前景[3-4]。
电芬顿和臭氧氧化是两种常见的高级氧化技术,电芬顿主要依靠电化学法产生的Fe2+或H2O2作为芬顿试剂的持续来源,通过芬顿反应产生·OH来降解有机物的一种处理技术。臭氧氧化主要依靠臭氧的强氧化性,直接氧化降解有机物,但由于臭氧氧化具有一定选择性,且氧化能力有限,通常需要通过其它辅助手段 (如O3/UV,O3/H2O2) 来提高处理效率。本研究在对电芬顿和臭氧氧化作用原理进行分析的基础上,尝试利用电芬顿-臭氧一体化工艺对船舶生活污水进行处理,以期为生活污水处理提供实用技术。
1 实验部分 1.1 材料与仪器KW-10kW大功率直流稳压/恒流开关电源 (深圳科安特电子有限公司),FE20型实验室pH计 (梅特勒-托利多仪器有限公司),蠕动泵2台 (BT01-Y2515型,天津协达伟业电子有限公司;BT600-2J型,保定兰格恒流泵厂),3S-A10臭氧发生器 (北京同林科技),DRB200型数字式消解器 (美国HACH),DR3900型台式可见分光光度计 (美国HACH)。
实验所用的主要试剂FeCl2·4H2O, H2O2(30%),NaOH,浓硫酸 (98%) 均为分析纯 (天津光复有限公司);实验所用污水取自天津大学石化中心下水道,并添加6 g/L海盐作为模拟船舶生活污水,初始pH值为7.52~7.83,初始COD为1 300~1 400 mg/L。
1.2 实验原理在电芬顿过程中,向电解槽中添加少量的芬顿试剂,Fe2+与H2O2发生反应,如式 (1)。利用曝气的方法,O2在阴极发生还原反应产生H2O2,如式 (2) 所示。同时在电芬顿过程中,部分Fe2+可借助阴极电极反应 (3) 再生,从而促成一个循环过程,保证了芬顿反应的持续进行;在臭氧氧化过程中,O3与H2O2具有协同作用,如反应 (4) 所示,同时在催化臭氧化过程中,有报道指出Fe2+可以通过反应 (5)~(8) 催化O3产生·OH。因此,本实验采用电芬顿和臭氧耦合处理工艺,可以有效利用整个体系中各物质的相互作用,提高Fe2+和H2O2的利用率,产生较多的·OH,并有效改善臭氧单独作用时的局限性,增强装置的氧化降解能力[5-7]。
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to \cdot {\rm{OH + O}}{{\rm{H}}^ - }{\rm{ + F}}{{\rm{e}}^{{\rm{3 + }}}} $ | (1) |
| $ {{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2}}{{\rm{e}}^ - } \to {{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} $ | (2) |
| $ {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}{{\rm{e}}^ - } \to {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}} $ | (3) |
| $ {\rm{2}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{2}} \cdot {\rm{OH + 3}}{O_2} $ | (4) |
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{O}}_{\rm{3}}} \to {\rm{Fe}}{{\rm{O}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}} $ | (5) |
| $ {\rm{Fe}}{{\rm{O}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + O}}{{\rm{H}}^ - }{\rm{ + }} \cdot {\rm{OH}} $ | (6) |
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{O}}_{\rm{3}}} \to {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}{{\rm{O}}_{\rm{3}}}{ \cdot ^ - } $ | (7) |
| $ {{\rm{O}}_{\rm{3}}}{ \cdot ^ - }{\rm{ + }}{{\rm{H}}^{\rm{ + }}} \to {{\rm{O}}_{\rm{2}}}{\rm{ + }} \cdot {\rm{OH}} $ | (8) |
实验工艺流程如图 1所示。

|
| 图 1 电芬顿臭氧一体化处理废水工艺流程 Figure 1 The process of wastewater treatment with integrated E-Fenton/O3 |
| |
采用自制电解槽 (16 cm×12 cm×22 cm),3块多孔石墨作为阴极 (100 mm×100 mm×3 mm),阳极为3块Ti/IrO2-RuO2-SnO2 (100 mm×100 mm×1 mm) 电极,平行放置于电解槽中,电极之间采用并联连接。臭氧发生器采用纯氧作氧气源产生臭氧。工艺流程设计中,在通入电解槽前,利用蠕动泵将废液与O3在气液分布器中提前混合,可有效改善臭氧在水溶液中溶解度较差的状况,提高臭氧的利用率。
将3 L废水加入自制的电解槽中,向装置中加入0.01 mol/L Fe2+,并用硫酸将溶液pH值调至3左右,打开氧气罐开启臭氧发生器,同时开启蠕动泵将过氧化氢持续加入电解槽中。打开电源启动整个反应,电解120 min,在每个预设时间段,取样加入离心管中,并用NaOH将试样pH值调至8中止体系内的反应,静置30 min,使过氧化氢在碱性条件下自分解,避免对COD测定的影响,离心取上清液适量稀释测定COD。
1.4 分析方法COD采用HJ/T399-2007快速消解分光光度法进行测定 (取2 mL试样加入哈希消解管中,试样可酌情进行稀释,150 ℃下在哈希DRB200消解器中反应2 h,冷却至室温后,在430 nm下利用哈希DR3900分光光度计测定吸光度,根据吸光度与COD的线性关系读取相应的COD值),通过COD值按式 (9) 计算COD去除率。
| $ {\rm{COD}}去除率 = \frac{{{\rm{CO}}{{\rm{D}}_0} - {\rm{CO}}{{\rm{D}}_{\rm{t}}}}}{{{\rm{CO}}{{\rm{D}}_0}}} \times 100\% $ | (9) |
在臭氧氧化过程中,芬顿试剂经常用来提高氧化降解效率,因此,在整个工艺过程中,合适的芬顿试剂量对废水COD的去除至关重要。采用不同的Fe2+和H2O2浓度来探究芬顿试剂对COD去除的影响,以确定合适的芬顿试剂加入量以及比例。图 2为不同浓度的Fe2+对COD去除的影响。
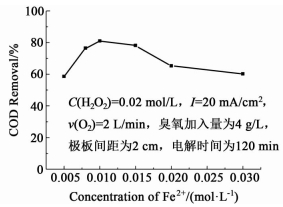
|
| 图 2 不同亚铁离子浓度对COD去除率的影响 Figure 2 Effect of the concentration of ferrous ions on COD removal efficiency |
| |
从图 2中可以看出,在Fe2+含量较低时,随着Fe2+浓度增大,COD去除率有明显提高,在0.01 mol/L时去除率达到最大,为81.9%。作为过氧化氢的催化剂,Fe2+的加入,能显著催化芬顿反应产生自由基,提高降解效率,同时Fe2+作为催化臭氧化的催化剂,能有效激发臭氧发生自由基链反应,增强COD去除率,但继续增大Fe2+的浓度,会导致COD去除率降低,这主要是因为过量Fe2+会同有机物竞争,参与反应 (10) 降低自由基的氧化效率,同时部Fe2+还有可能参与反应 (11),使催化臭氧化效率降低[8-9]。
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }} \cdot {\rm{OH}} \to {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + O}}{{\rm{H}}^ - } $ | (10) |
| $ {\rm{Fe}}{{\rm{O}}^{{\rm{2 + }}}}{\rm{ + F}}{{\rm{e}}^{{\rm{2 + }}}} + 2{{\rm{H}}^ + } \to {\rm{2F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (11) |
图 3表示了过氧化氢浓度对COD去除率的影响,过氧化氢浓度为0时,COD去除率为39.8%, 主要依靠阴极产生的少量H2O2以及Fe2+参与催化臭氧化,来实现对有机物的去除;随着过氧化氢浓度的提高,COD去除率逐渐增大,但去除速率逐渐降低。作为整个体系中的核心试剂,过氧化氢浓度增大,有利于促进芬顿反应的发生以及O3与H2O2的相互作用,提升·OH的产量,但当过氧化氢超过0.03 mol/L时,COD去除率有轻微的下降,表明增加的H2O2有可能参与了体系中存在的副反应[10]如反应 (12),因此确定过氧化氢加入量为0.03 mol/L。
| $ {{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}{\rm{ + }} \cdot {\rm{OH}} \to {\rm{H}}{{\rm{O}}_{\rm{2}}} \cdot {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (12) |
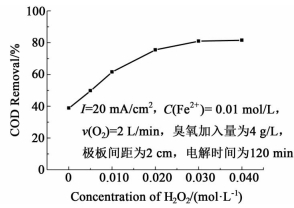
|
| 图 3 不同H2O2浓度对COD去除率的影响 Figure 3 Effect of hydrogen peroxide on COD removal efficiency |
| |
在电芬顿-臭氧一体化处理过程中,极板间距是影响COD去除率的另一个重要因素。图 4为不同极板间距对COD去除率的影响。当极板间距从1.5 cm增大到2.0 cm时,COD的去除率增大了约8%,极板间距太小,Fe2+很容易在阳极被氧化成Fe3+,不利于芬顿反应。然而极板间距继续增大,Fe3+不利于转移到阴极表面,使Fe2+的再生反应受阻,同时较大的极板面积将导致能耗增大,因此选用适中的极板间距 (2.0 cm),有利于改善COD去除效率,同时降低能耗。
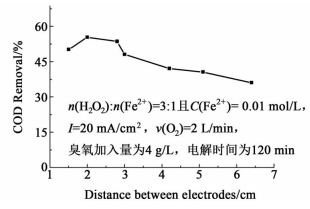
|
| 图 4 不同极板间距对COD去除率的影响 Figure 4 Effect of the distance between the electrodes on COD removal efficiency |
| |
在既定的芬顿试剂加入量下,电流密度分别选取5,10,15,20,25,30 mA/cm2,各个电流密度对COD去除率的影响如图 5。

|
| 图 5 不同电流密度对COD去除率的影响 Figure 5 COD removal efficiency at different electrical currents |
| |
从图 5中可以看出,随着时间的延长,COD去除率不断提高,反应刚开始30 min内,COD降解较快,30 min以后,有机物降解速率有所减慢,主要是因为自由基的产生以及反应速度非常快,大部分有机物可以在短时间内降解,随着电解时间的延长,后续副反应的加入以及有机物降解后产生的羧酸类物质较难降解等因素,使处理速率有所降低[9, 11-12]。
图 5表明,当电流密度从5 mA/cm2提高到20 mA/cm2时,COD去除率由71.6%提高到83.2%,主要是因为电流密度的提高有助于反应 (3) 的进行,部分Fe3+在阴极得电子被还原为Fe2+,从而使芬顿反应持续进行,但当电流密度继续从20 mA/cm2增加到40 mA/cm2时,COD去除率并没有明显升高,尽管电流密度增大有利于反应 (4),但O3受传质作用限制,无法有效地与H2O2反应[13],同时电流密度增大会促进副反应的发生,引起能耗增加,因此本研究选择20 mA/cm2为合适的电流密度[9, 11-12]。
2.4 不同氧气速率对COD去除率的影响图 6为不同的供氧速率对COD去除率的影响。
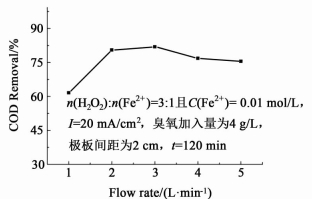
|
| 图 6 不同氧气速率对COD去除率的影响 Figure 6 Effect of flow rate of O2 on COD removal efficiency |
| |
由图 6可见,随着供氧速率增加,COD去除率提高。氧气流量的提高有利于提高O2转化为O3的效率,增加O3在水中的溶解量;同时提高氧气速率,有助于加入的芬顿试剂快速与废水混合,增强传质作用,从而提高处理效率;但当氧气速率从2 L/min增加到3 L/min时,COD去除率只有微小增加,而供氧速率从3 L/min增加到5 L/min时,COD去除率反而有所下降,主要是供氧速率过大,臭氧的形成效率降低,产生的臭氧通常混有O2,同时供氧速率的增加使水中鼓气速率过快,不利于极板进行反应 (2) 和 (3),而且O3与废水的接触时间减少[14-15],从而导致处理效率降低。结合实际需要以及处理效果,本研究选择供氧速率为2 L/min。
2.5 臭氧投加量对COD去除率的影响臭氧的投加量与整个电芬顿-臭氧一体化技术的处理效率息息相关,从图 7可以看出,随着臭氧浓度的增加,处理效率提高,COD去除率增加,臭氧的加入有利于促进过氧化氢的转化,提高亚铁离子的催化效率,从而提升整个装置的处理能力。臭氧加入量为6 g/L时,处理效率达到最高,COD去除率为83.6%,但继续增加臭氧浓度,COD去除率有所下降,这是因为,在一定的氧气速率下,臭氧在水中的溶解度有限,持续增加臭氧的投加量并不能及时有效地与芬顿试剂作用,而且过高的臭氧浓度可能会消耗部分自由基[16],如反应 (13) 所示,导致处理效率降低。
| $ \cdot {\rm{OH + }}{{\rm{O}}_{\rm{3}}} \to {{\rm{O}}_{\rm{2}}}{\rm{ + H}}{{\rm{O}}_{\rm{2}}} \cdot $ | (13) |

|
| 图 7 不同臭氧投加量对COD去除率的影响 Figure 7 COD removal efficiency at various dosage of O3 |
| |
图 8为几种不同工艺处理生活污水时,COD去除率的情况。

|
| 图 8 不同工艺对生活污水COD去除率的比较 Figure 8 Comparison of COD removal by electrochemical oxidation, E-Fenton, ozone alone and integrated E-Fenton/O3 |
| |
从图 8中可以看出,电化学氧化和臭氧单独作用时效率较低,因为2种工艺并非主要依靠·OH去除有机物,因此氧化能力有限,对COD去除率较低;而电芬顿明显优于前两者,在pH=3时,芬顿反应活性最强,通过产生·OH实现对有机物的降解。但是,对于生活污水而言,单纯采用电芬顿,对COD的去除率 (67.2%) 并不足以令人满意,而电芬顿-臭氧一体化处理相对于前3者,对COD的去除率有较大提升 (86.4%),而且从图 7可知去除率并不是简单的电芬顿和臭氧单独作用时对COD去除率的加和,而是略高于2者之和,这表明电芬顿和臭氧之间有较强的协同作用,在装置底部通入O3,可有效辅助芬顿试剂反应[17],提升芬顿反应的效率,同时O3与H2O2以及O3和Fe2+的反应能显著增大·OH的产生量[18],而电场的作用可保证整个反应链的循环持续,从而极大地提高了COD的去除率。
3 结论1) 电芬顿臭氧一体化水处理技术能有效降解生活污水,确定工艺参数为电流密度I=20 mA/cm2,芬顿试剂比例n(H2O2):n(Fe2+)=3:1,C(Fe2+) 为0.01 mol/L,供氧速率2 L/min,臭氧投加量6 g/L,在此条件下,对于初始COD为1 320 mg/L的模拟船舶生活污水,处理120 min,COD去除率高达86.4%。
2) 将电芬顿和臭氧氧化技术合理组合在一个装置中,发挥各自优势,在处理废水时,2种工艺有明显的协同作用,处理速度快、周期短、效率高,且几乎不产生对环境有害的物质,中途停止后启动恢复快,因而在需要快速、高效处理废水,且占地面积有要求的场合 (如船舶生活污水的处理等),具有很好的应用前景。
| [1] |
王晓侠. 舰船生活污水排放面临的问题及解决措施[J].
船舶工程, 2010, 32(5) : 23–26.
KG3*4] Wang Xiaoxia. Problems lying ahead of ship sewage discharge and relevant solving measures[J]. Ship Engineering, 2010, 32(5) : 23–26. |
| [2] |
张丽丽, 管运涛, 赵婉婉, 等. 用一体化生物膜反应器处理生活污水[J].
清华大学学报:自然科学版, 2007, 47(6) : 822–825.
Zhang Lili, Guan Yuntao, Zhao Wanwan, et al. Use of integrative biofilm reactor for domestic wastewater treatment[J]. Journal of Tsinghua University:Sci & Tech, 2007, 47(6) : 822–825. |
| [3] |
白敏菂, 冷宏, 张启岳, 等. 高级氧化技术研究现状及其发展趋势[J].
科技导报, 2011, 29(35) : 74–79.
Bai Mindi, Leng Hong, Zhang Qiyue, et al. Application experimentation and development tendency of advanced oxidation processes[J]. Science & Technology Review, 2011, 29(35) : 74–79. |
| [4] |
刘晶冰, 燕磊, 白文荣, 等. 高级氧化技术在水处理的研究进展[J].
水处理技术, 2011, 37(3) : 11–17.
Liu Jingbing, Cai Lei, Bai Wenrong, et al. The development of advanced oxidation processes on wastewater treatment[J]. Technology of Water Treatment, 2011, 37(3) : 11–17. |
| [5] | Wu Y, Zhao C, Wang Q, et al. Integrated effects of selected ions on 2, 4, 6-trinitrotoluene-removal by O3/H2O2[J]. J Hazard Mater, 2006, 132(2/3) : 232–236. |
| [6] |
班福忱, 刘炯天, 程琳, 等. 阴极电芬顿法处理苯酚废水的研究[J].
工业安全与环保, 2009, 35(9) : 25–27.
Ban Fuchen, Liu Jiongtian, Cheng Lin, et al. Study oil the trealment of phenol wastewater by cathode electro-fenton method[J]. Industrial Safety and Environmental Protection, 2009, 35(9) : 25–27. |
| [7] | Li M, Zeng Z, Li Y, et al. Treatment of amoxicillin by O3/Fenton process in a rotating packed bed[J]. J Environ Manage, 2015, 150 : 404–411. DOI: 10.1016/j.jenvman.2014.12.019 |
| [8] | Zeng Z, Zou H, Li X, et al. Ozonation of acidic phenol wastewater with O3/Fe (Ⅱ) in a rotating packed bed reactor:Optimization by response surface methodology[J]. Chemical Engineering and Processing:Process Intensification, 2012, 60 : 1–8. DOI: 10.1016/j.cep.2012.06.006 |
| [9] | Zhang H, Zhang D, Zhou J. Removal of COD from landfill leachate by electro-Fenton method[J]. Journal of Hazardous Materials, 2006, 135(1) : 106–111. |
| [10] | Wang Y, Li X, Zhen L, et al. Electro-Fenton treatment of concentrates generated in nanofiltration of biologically pretreated landfill leachate[J]. J Hazard Mater, 2012(229/230) : 115–121. |
| [11] | Bakheet B, Yuan S, Li Z, et al. Electro-Peroxone treatment of Orange Ⅱ dye wastewater[J]. Water Res, 2013, 47(16) : 6234–6243. DOI: 10.1016/j.watres.2013.07.042 |
| [12] | Şahinkaya S. COD and color removal from synthetic textile wastewater by ultrasound assisted electro-Fenton oxidation process[J]. Journal of Industrial and Engineering Chemistry, 2013, 19(2) : 601–605. DOI: 10.1016/j.jiec.2012.09.023 |
| [13] | García-Morales M A, Roa-Morales G, Barrera-Díaz C, et al. Synergy of electrochemical oxidation using boron-doped diamond (BDD) electrodes and ozone (O3) in industrial wastewater treatment[J]. Electrochemistry Communications, 2013, 27 : 34–37. DOI: 10.1016/j.elecom.2012.10.028 |
| [14] |
刘金泉, 李天增, 王发珍, 等. O3, H2O2/O3及UV/O3在焦化废水深度处理中的应用[J].
环境工程学报, 2009, 3(3) : 501–505.
Liu Jinquan, Li Tianzeng, Wang Fazhen, et al. Application of O3, H2O2/O3 and UV/O3 in advanced treatment of coking wastewater[J]. Chinese Journal of Environmental Engineering, 2009, 3(3) : 501–505. |
| [15] |
彭人勇, 邱晓. O3-H2O2氧化法处理印染废水[J].
化工环保, 2013, 33(4) : 308–311.
Peng Renyong, Qiu Xiao. Treatment of dyeing wastewater by O3-H2O2 oxidation process[J]. Environmental Protection of Chemical Industry, 2013, 33(4) : 308–311. |
| [16] | Lucas M S, Peres J A, Li P G. Treatment of winery wastewater by ozone-based advanced oxidation processes (O3, O3/UV and O3/UV/H2O2) in a pilot-scale bubble column reactor and process economics[J]. Separation and Purification Technology, 2010, 72(3) : 235–241. DOI: 10.1016/j.seppur.2010.01.016 |
| [17] | Abu A S S, Aziz H A. New treatment of stabilized leachate by ozone/Fenton in the advanced oxidation process[J]. Waste Manag, 2012, 32(9) : 1693–1700. DOI: 10.1016/j.wasman.2012.04.009 |
| [18] | Balcıoğlu I A, Ötker M. Treatment of pharmaceutical wastewater containing antibiotics by O3 and O3/H2O2 processes[J]. Chemosphere, 2003, 50(1) : 85–95. DOI: 10.1016/S0045-6535(02)00534-9 |
 2017, Vol. 34
2017, Vol. 34





