乙醇作为重要的化工产品,在白酒和燃料两大领域消费量非常大。在汽油中加入一定比例的乙醇可作车用燃料,乙醇/汽油燃料能有效降低汽车尾气中CO含量,减少对环境的污染,同时部分代替石油能源,因此燃料乙醇成为21世纪车用燃料的重要替代产品[1]。我国燃料乙醇消费量从2005年的102万t增加到2010年的180万t。根据国家规划,2020年我国燃料乙醇的消费量将达到1 000万t,可见我国乙醇市场潜力巨大[2]。
与我国乙醇市场发展相矛盾的是我国乙醇生产成本较高,我国生产乙醇的方法主要是发酵法 (占96.5%),随着粮食价格的上涨,发酵法生产乙醇受到越来越大的限制。近年来,随着醋酸行业的产能扩张,我国醋酸行业出现严重的产能过剩[3],用醋酸来生产乙醇既能缓解醋酸的过剩也能使乙醇的生产成本降低。醋酸加氢制备乙醇的方法有直接法和间接法:直接法是醋酸直接和氢气反应制备乙醇;间接法是先把醋酸酯化成醋酸甲酯或醋酸乙酯,然后再与氢气反应制备乙醇。其化学反应式如 (1)~(3) 所示。
| $ {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH + 2}}{{\rm{H}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (1) |
| $ {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH + 2}}{{\rm{H}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH + C}}{{\rm{H}}_{\rm{3}}}{\rm{OH}} $ | (2) |
| $ {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOC}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}} \to {\rm{2C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH}} $ | (3) |
目前针对醋酸或醋酸酯加氢制乙醇工艺的研究多集中在催化剂改性上[4-7],而针对反应热力学计算和分析的报道较少。任何化学反应都是受热力学约束的,热力学研究的是平衡状态下的反应体系,通过热力学的研究可以得到影响反应平衡的因素,从而得到影响产物收率的因素以及这些因素对产物收率的影响程度。通过热力学研究还能更加清楚地认识到所开发催化剂潜力空间,为科学工作者提供一个衡量现有催化剂与最理想催化剂之间差距的标准,避免盲目追求高效率催化剂。
本工作对醋酸或醋酸甲酯及醋酸乙酯制乙醇这3条路线进行了热力学计算和分析,从而为相应催化剂的研发以及反应工艺条件的优化提供理论依据。
1 热力学算法 1.1 标准摩尔焓变和标准平衡常数的计算标准摩尔焓变ΔrHmθ和标准平衡常数Kθ的算法如下[8-9]:
| $ {\Delta _{\rm{r}}}H_{\rm{m}}^\theta \left( T \right) = {\Delta _{\rm{r}}}H_{\rm{m}}^\theta (298K) + \int_{298K}^T {{\Delta _{\rm{r}}}{C_{p,{\rm{m}}}}{\rm{d}}T} $ | (4) |
| $ {\Delta _{\rm{r}}}S_{\rm{m}}^\theta \left( T \right) = {\Delta _{\rm{r}}}S_{\rm{m}}^\theta (298K) + \int_{298K}^T {\frac{{{\Delta _{\rm{r}}}{C_{p,{\rm{m}}}}}}{T}{\rm{d}}T} $ | (5) |
| $ {\Delta _{\rm{r}}}{C_{p,m}} = \Delta a + \Delta b \cdot T + \Delta c\cdot{T^2} + \Delta d\cdot{T^3} $ | (6) |
| $ {\Delta _{\rm{r}}}G_{\rm{m}}^\theta \left( T \right) = {\Delta _{\rm{r}}}H_{\rm{m}}^\theta \left( T \right) - T\cdot{\Delta _{\rm{r}}}S_{\rm{m}}^\theta \left( T \right) $ | (7) |
| $ {K^\theta } = {\rm{exp}}( - {\Delta _{\rm{r}}}G_{\rm{m}}^\theta /RT) $ | (8) |
由式 (4) 可以算出标准摩尔焓变,结合式 (5)~(8) 可以算出反应 (1)~(3) 在不同温度下的标准平衡常数,计算中所需的热力学数据可从参考文献[10]中查得,将其汇总到表 1以便进行计算。
| Components | ΔfHmθ(298K)/ (kJ·mol-1) |
Smθ(298K)/ (J·mol-1·K-1) |
Cp, m/R=a+bT+cT2+dT3 | |||
| a | b×103/K-1 | c×105/K-2 | d×108/K-3 | |||
| CH3COOCH3 | -411.90 | 324.38 | 4.242 | 14.388 | 3.338 | -4.930 |
| H2 | 0 | 130.68 | 2.883 | 3.680 | -0.772 | 0.692 |
| CH3CH2OH | -234.01 | 280.64 | 4.396 | 0.628 | 5.546 | -7.024 |
| CH3COOCH2CH3 | -443.42 | 359.40 | 10.228 | -14.948 | 13.033 | -15.740 |
| CH3OH | -201.50 | 239.88 | 4.714 | -6.986 | 4.211 | -4.443 |
| CH3COOH | -432.54 | 283.47 | 4.375 | -2.397 | 6.757 | -8.764 |
| H2O | -241.80 | 188.82 | 4.395 | -4.186 | 1.405 | -1.564 |
在醋酸或醋酸酯加氢的反应中,人们希望得到的产物是乙醇,也就是说,只希望主反应 (1) 或 (2) 或 (3) 进行,其他的副反应没有进行。在催化剂效率极大提高的情况下,催化剂只对主反应 (1) 或 (2) 或 (3) 有促进作用,并且达到了平衡,而没有其他副反应进行,在这种理想催化剂下,可以得到醋酸或醋酸酯加氢反应制乙醇收率的极限,通过和这种极限的比较能看出所制催化剂的提升空间[11]。
为了便于计算醋酸或醋酸酯的平衡转化率,做如下假设:1) 反应体系开始只有气态醋酸或醋酸酯和氢气;2) 反应是在恒温恒压下进行。
在醋酸加氢的反应中,设反应体系的压力为P,温度为T,起始的氢气和醋酸的物质的量之比 (氢酸比) 为n,反应开始时以1 mol醋酸为基准,平衡时反应 (1) 生成了ζ mol的乙醇。反应平衡时体系总的气体物质的量为r=1+n-ζ,标准平衡常数与各组分平衡组成的关系[12]如式 (9) 所示。
| $ K_1^\theta = \frac{{{\zeta ^2}{P^\theta }r}}{{\left( {1 - \zeta } \right){{\left( {n - 2\zeta } \right)}^2}P}} $ | (9) |
标准平衡常数可依据式子 (4)~(8) 算出,再结合式 (9) 就可以算出醋酸加氢反应体系的平衡组成,进而算出醋酸的平衡转化率。
用同样的方法可以算出醋酸甲酯或醋酸乙酯的平衡转化率。
2 结果与讨论 2.1 标准摩尔焓变和标准平衡常数分析图 1给出了反应 (1)~(3) 的标准摩尔焓变随温度的变化关系。

|
| 图 1 标准摩尔焓变随温度的变化 Figure 1 Changes of standard enthalpies at different temperatures |
| |
从图 1中可以看到,在423~723 K的温度范围内,3个反应的标准摩尔焓变都小于0,因此3个反应都是放热反应;从图 1还可以看出他们所放的热量都是随着温度的升高而变大,且反应 (1) 的热效应最大,反应 (2) 和 (3) 的热效应比较接近且远小于反应 (1) 的热效应。对于放热反应,温度升高通常会使反应平衡向左移动,因而实际反应中温度不宜太高。
图 2给出了反应 (1)~(3) 的标准平衡常数随温度的变化关系。

|
| 图 2 标准平衡常数随温度的变化 Figure 2 Effects of reaction temperature on standard equilibrium constants |
| |
从图 2可知,反应 (1)~(3) 的标准平衡常数都是随温度的升高而减小,说明降低温度有利于反应 (1)~(3) 的进行。在温度低于550 K时,反应 (1) 的平衡常数远远大于反应 (2) 和 (3) 的平衡常数;当温度高于550 K后反应 (1) 的平衡常数小于1,但仍然大于反应 (2) 和 (3) 的平衡常数。在423~723 K的温度范围内,反应 (2) 和反应 (3) 的标准平衡常数都小于0.7,说明若没有适当的氢酯比和反应压力,醋酸甲酯或醋酸乙酯加氢制乙醇的反应将很难进行。
2.2 醋酸和醋酸酯平衡转化率分析对于醋酸或醋酸酯加氢的反应,影响醋酸或醋酸酯的平衡转化率的主要因素是温度、压力和反应物的配比。
温度是影响化学平衡的重要因素。因为标准平衡常数只是温度的函数,不同温度下标准平衡常数值不同,从而化学平衡时体系的组成不同。
在有气体参与的反应中,压力往往会对反应体系的平衡组成产生影响。对于气体分子数增加的反应,增加系统的总压,平衡会向左移,不利于正反应进行,这时减压将有利于正反应。对于气体分子数减小的反应,增加系统的总压,平衡会向右移动,有利于正反应进行。对于气体分子数不变的反应,压力的变化不引起平衡的移动。
对于不止一种反应物参加的反应,往往通过改变反应物的配比 (氢酯比或氢酸比) 来改变反应的平衡组成。醋酸 (或醋酸酯) 加氢的反应有两种原料,氢气容易从混合气中分离,为了充分利用醋酸,可使氢气过量,以尽量提高醋酸的平衡转化率。
本工作对温度、压力及反应物配比这3个因素对醋酸和醋酸甲酯及醋酸乙酯平衡转化率影响进行了分析。
2.2.1 温度影响在氢酯比 (或氢酸比) 为10,反应压力为2 MPa的情况下,醋酸和醋酸酯平衡转化率随温度的变化关系如图 3所示。
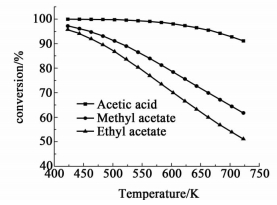
|
| 图 3 不同温度下反应物的转化率 Figure 3 Effects of reaction temperature on equilibrium conversions |
| |
从图 3可知,醋酸和醋酸酯的平衡转化率都是随着温度的升高而下降,说明低温有利于3个反应热力学上进行。在423~723 K的温度范围内,醋酸的平衡转化率都高于90%;在温度低于550 K时,醋酸的平衡转化率高于99%;醋酸的平衡转化率始终高于醋酸甲酯和醋酸乙酯的平衡转化率,且随着温度的升高这种差距越来越大。在温度低于423~500 K时,醋酸甲酯和醋酸乙酯平衡转化率随温度的升高下降比较慢,温度大于500 K以后,两者的平衡转化率随温度的升高快速下降。从图 3中还可以看出,醋酸甲酯的平衡转化率始终高于醋酸乙酯的平衡转化率,但是从图 2中可以看出醋酸甲酯的平衡常数小于醋酸乙酯的平衡常数,造成这种现象的原因是反应 (2) 生成了1个甲醇和1个乙醇而反应 (3) 生成了2个乙醇。
由以上分析可知,对于醋酸加氢反应,温度对化学平衡影响比较小。对于醋酸酯加氢反应,温度对化学平衡的影响比较显著,低温有利于提高醋酸甲酯或醋酸乙酯的平衡转化率,但温度太低可能会使反应速率太慢,因此选择一个适当的反应温度具有重要意义。
2.2.2 压力影响在氢酯比 (或氢酸比) 为10,反应温度为470 K的情况下,醋酸和醋酸酯的平衡转化率随压力的变化关系如图 4所示。
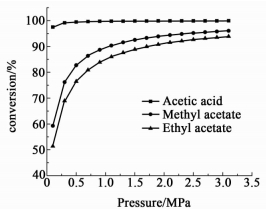
|
| 图 4 不同压力下反应物的平衡转化率 Figure 4 Effects of reaction pressure on equilibrium conversions |
| |
从图 4可以看到,醋酸和醋酸酯的平衡转化率都随着压力的升高变大,说明高压有利于醋酸或醋酸酯加氢制乙醇的反应。醋酸的平衡转化率受压力影响很小,压力为0.1 MPa时,其平衡转化率已大于97%。醋酸甲酯和醋酸乙酯的平衡转化率都是随着压力的升高而上升;在压力为0.1 MPa时,醋酸甲酯的平衡转化率不足60%,醋酸乙酯的平衡转化率不足55%,说明醋酸甲酯或醋酸乙酯加氢制乙醇的反应不宜在常压下进行;当压力低于2.5 MPa时,醋酸甲酯和醋酸乙酯的平衡转化率随压力的升高增加比较快;随着压力的进一步升高,其平衡转化率提高比较缓慢。
由以上分析可知,对于醋酸加氢制乙醇的反应,压力对醋酸平衡转化率影响很小。对于醋酸甲酯或醋酸乙酯加氢制乙醇的反应,反应适宜的压力是2~3 MPa。
2.2.3 反应物配比影响在反应温度为470 K,压力为2 MPa的情况下,醋酸和醋酸酯的平衡转化率随氢酸比 (氢酯比) 的变化关系如图 5所示。

|
| 图 5 不同配比下反应物的平衡转化率 Figure 5 Effects of H2/(ester or acid) molar ratio on equilibrium conversions |
| |
从图 5可以看到,醋酸和醋酸酯的平衡转化率都是随着氢酸比 (氢酯比) 的变大而升高。当氢酸比为1时,由于反应体系中氢气不足,醋酸的平衡转化率不到50%;当氢酸比达到3时,醋酸的平衡转化率超过了97%。当氢酯比低于10时,醋酸甲酯的和醋酸乙酯的平衡转化率都随氢酯比的变大快速提高;氢酯比超过10后,醋酸甲酯和醋酸乙酯的平衡转化率随氢酯比的增大缓慢提高;当氢酯比达到20时,两者的平衡转化率都超过了95%。
由以上分析可知,对于醋酸加氢制乙醇反应,在氢酸比大于3以后,氢酸比对醋酸的平衡转化率影响很小。对于醋酸甲酯或醋酸乙酯加氢制乙醇反应,反应体系应维持在一个适当的氢酯比,氢酯比太低不利于酯的转化,氢酯比太高则会造成原料氢气的浪费,反应适宜的氢酯比为10~20。
3 结论先计算和分析了醋酸和醋酸酯加氢反应的标准摩尔反应焓变和标准平衡常数,随后讨论了反应温度、压力、氢酯比 (或氢酸比) 对醋酸和醋酸酯平衡转化率的影响,可以得出如下结论:
1) 醋酸或醋酸酯加氢制乙醇的反应都是放热反应,且他们的放热量都随着温度的升高而变大。
2) 醋酸加氢制乙醇反应的平衡常数比较大。醋酸甲酯或醋酸乙酯加氢的反应平衡常数都小于0.7,若没有适当的氢酯比和反应压力,醋酸甲酯或醋酸乙酯加氢制乙醇的反应将很难进行。
3) 反应工艺条件 (温度、压力和氢酸比) 对醋酸的平衡转化率影响比较小;对于醋酸甲酯和醋酸乙酯的平衡转化率影响较大,较低的温度和较高的压力有助于提高醋酸甲酯和醋酸乙酯的平衡转化率,反应适宜的温度为423~550 K,适宜的压力为2~3 MPa,适宜的氢酯比为10~20。
符号说明:
a, b, c, d—摩尔定压热容计算系数;
Cp, m—摩尔定压热容,J/(mol·K);
Kθ—标准平衡常数;
n—氢气与醋酸甲酯的物质的量之比;
Pθ—标准压力;100 kPa;
P—反应体系的压力,Pa;
R—气体常数,8.314 J/(mol·K);
r—物质的量,mol;
Smθ—标准摩尔熵,J/(mol·K);
T—反应体系的温度,K;
ΔrCp, m—反应过程的摩尔定压热容变,J/(mol·K);
ΔrGmθ—标准摩尔反应吉布斯自由能,J/mol;
ΔfHmθ—标准摩尔生成焓,J/mol;
ΔrHmθ—标准摩尔反应焓变,J/mol;
ΔrSmθ—标准摩尔反应熵变,J/mol;
ζ—反应产物的生成量,mol。
| [1] |
李振宇, 黄格省, 杨延翔, 等. 燃料乙醇生产技术路线分析及产业发展建议[J].
现代化工, 2011, 31(8) : 1–5.
Li Zhenyu, Huang Gesheng, Yang Yanxiang, et al. Analysis and development proposal on fuel grade alcohol production technique process[J]. Modern Chemical Industry, 2011, 31(8) : 1–5. |
| [2] |
孙陆晶. 燃料乙醇产业前景[J].
化学工业, 2011, 29(1) : 8–11.
Sun Lujing. Alcohol fuel industry prospect[J]. Chemical Industry, 2011, 29(1) : 8–11. |
| [3] |
周颖霏, 钱伯章. 醋酸生产技术进展及市场分析[J].
化学工业, 2010, 28(9) : 19–45.
Zhou Yingfei, Qian Bozhang. Process technology of acetate acid and market analysis[J]. Chemical Industry, 2010, 28(9) : 19–45. |
| [4] | Claus P, Lucas M, Liicke B. Selective hydrogenolysis of methyl and ethyl acetate in the gas phase on copper and supported Group Ⅷ metal catalysts[J]. Appl Catal A, 1991, 79(1) : 1–18. DOI: 10.1016/0926-860X(91)85002-F |
| [5] | Scheur F T V D, Staal L H. Effects of zinc addition to silica supported copper catalysts for the hydrogenolysis of esters[J]. Appl Catal A, 1994, 108(1) : 63–83. DOI: 10.1016/0926-860X(94)85181-6 |
| [6] | Brands D S, Poels E K, Bliek A. Ester hydrogenolysis over promoted Cu/SiO2catalysts[J]. Appl Catal A, 1999, 184(2) : 279–289. DOI: 10.1016/S0926-860X(99)00106-4 |
| [7] |
雷陈明, 顾顺超, 阎建民, 等. Cu/SiO2的表征及其在乙酸乙酯加氢合成乙醇中的催化性能[J].
石油化工, 2013, 42(6) : 615–619.
Lei Chenming, Gu Shunchao, Yan Jianmin, et al. Characterization of Cu/SiO2 catalyst and its performance in hydrogenation of ethyl acetate to ethanol[J]. Petrochemical Technology, 2013, 42(6) : 615–619. |
| [8] |
尹安远, 戴维林, 范康年. 草酸二甲酯催化加氢合成乙二醇过程的热力学计算与分析[J].
石油化工, 2008, 37(1) : 62–66.
Yin Anyuan, Dai weilin, Fan Kangnian. Thermodynamics of ethylene glycol synthesis via hydrogenation of dimethyl oxalate[J]. Petrochemical Technology, 2008, 37(1) : 62–66. |
| [9] |
左玉帮, 刘永健, 李江涛, 等. 合成气甲烷化制替代天然气热力学分析[J].
化学工业与工程, 2011, 28(6) : 47–53.
Zuo Yubang, Liu Yongjian, LI Jiangtao, et al. Thermodynamic analysis for methanation of synthesis gas to substitute natural gas[J]. Chemcial Industry and Engineering, 2011, 28(6) : 47–53. |
| [10] | Natal-Santiago M A, Sanchez-Castillo M A, Cortright R D, et al. Catalytic reduction of acetic acid, methyl acetate, and ethyl acetate over silica-supported copper[J]. Journal of Catalysis, 2000, 193(1) : 16–28. DOI: 10.1006/jcat.2000.2883 |
| [10] | 马沛生, 李永红. 化工热力学[M]. 北京: 化学工业出版社, 2009 |
| [11] |
刘业奎, 王黎, 侯栋, 等. 二氧化碳加氢合成低碳烯烃反应平衡体系热力学研究[J].
催化学报, 2004, 25(3) : 210–218.
Liu Yekui, Wang Li, Hou Dong, et al. Study on thermodynamics of balanceable reaction system for hydrogenation of carbon dioxide to light alkenes[J]. Chinese Journal of Catalysis, 2004, 25(3) : 210–218. |
| [12] | 刘俊吉, 周亚平, 李松林. 物理化学[M]. 北京: 高等教育出版社, 2009 |
 2017, Vol. 34
2017, Vol. 34





