氮氧化物 (NOx) 污染物的消除是环境保护中的热点研究问题[1]。目前应用较广的技术包括NO直接消除[2-3]、选择催化还原 (SCR)[4-5]和NOx储存还原 (NSR)[6-8]等。NSR技术常用的催化剂类型是“活性组分-储存组分-载体”型三相催化剂,已经得到较为广泛的应用[9-10],但是存在贵金属活性组分成本高昂、高温易烧结等问题。钙钛矿型ABO3复合氧化物由于其成本较低、热稳定性良好以及氧化还原性能可调变,备受人们关注[11]。
钙钛矿型氧化物的A位离子一般是半径较大的碱土或者稀土离子,B位一般是具有多种价态的过渡金属离子。人们已经发现,对A位或者B位进行一定程度的离子掺杂,会有效改进氧化物的应用性能。由于钙钛矿整体呈电中性,所以不同价态的A位离子的掺杂就会影响B位离子的价态或者导致晶体产生氧空位,从而影响其催化活性。
在众多钙钛矿型氧化物中,LaCoO3经研究显示,具有比较良好的NO氧化性能。而以Sr部分取代La时,氧化物的催化活性也随之增强[12]。经研究发现,La1-xSrxCoO3具有较好的NOx储存能力[13],但在NSR过程中,其NOx还原性能仍然有待提高。将贵金属掺入钙钛矿结构、部分取代Co离子,可以与Co产生协同效应,有效提高催化剂的NOx还原性能[14]。本研究使用贵金属Ru对La0.7Sr0.3CoO3进行掺杂,通过溶胶凝胶法制备催化剂,对其进行表征以及NOx储存与储存还原的测试。
1 实验部分 1.1 溶胶-凝胶法制备催化剂将La (NO3)3·6H2O、Sr (NO3)2和Co (NO3)2·6H2O (均产自天津市光复试剂厂) 按照化学计量比称取,溶解于去离子水中,再用吸量管依计量比量取一定体积的含Ru质量分数为10%的硝酸钌溶液 (贵研铂业有限公司生产) 加入其中,以EDTA和柠檬酸 (光复试剂厂) 为络合剂,在80 ℃下水浴搅拌,直至形成紫色的干凝胶。将干凝胶置于120 ℃烘箱内过夜干燥,然后在700 ℃下焙烧6 h,就得到了La0.7Sr0.3Co1-xRuxO3系列催化剂。按照Ru的计量比掺杂分数,将催化剂样品依次标记为Ru0.01、Ru0.03和Ru0.05;而将没有掺杂Ru的La0.7Sr0.3CoO3催化剂标记为LSC。
1.2 催化剂表征催化剂样品的X射线粉末衍射分析使用了德国的Brucker AXS公司的D8-S4衍射分析仪,操作电压为40 kV,电流为40 mA,射线源为Cu_Kα(λ=0.154184 nm);采集数据的2θ范围为10°~90°,步长为0.02°,扫描速度为每步0.2 s。
样品的氢气程序升温还原 (H2-TPR) 表征是在天津先权工贸发展有限公司生产的TP-5079型吸附仪上进行的,测试方法是将30 mg样品置于石英反应器内,在纯O2气氛下从室温升温到500 ℃,之后停留30 min进行预处理,然后在分数为8%的H2(载气为N2) 气氛中升温至900 ℃为止。
1.3 催化剂活性测试 1.3.1 储存活性测试催化剂的NOx储存活性测试是在内径4 mm的不锈钢固定床反应器中进行的,反应温度设定为325 ℃,使用催化剂的质量为0.4 g,模拟气体的组成包括体积分数为500×10-6 NO和5% O2,以N2为平衡气体,总流速为400 mL/min,空速约为100 000 h-1。实验步骤如下:1) 升温至反应温度,然后用O2/N2气氛对催化剂吹扫,直至出口气体的CO2浓度降至0为止;2) 切换至旁路,再打开NO气体阀门,进行配气,待NOx浓度达到所需值并且CO2浓度为0时,再切换通道,使气体通过催化剂,同时开始记录数据;3) 储存饱和之后,停止记录。
实验使用Thermo Scientific公司的42i-HL型化学发光检测仪检测NOx浓度与NO浓度,以北分集团谱齐中心的GXH-104C型红外气体分析仪检测CO2的浓度。
实验考察催化剂样品的NOx转化率 (conversion,C) 以及NOx储存容量 (NOx storage capacity,NSC),分别按式 (1) 和 (2) 计算。
| $ C = \frac{{c({\rm{N}}{{\rm{O}}_x}) - c({\rm{NO}})}}{{c({\rm{N}}{{\rm{O}}_x})}} \times 100\% $ | (1) |
| $ {\rm{NSC}} = \frac{{{V_{{\rm{toc}}}}({c_0}t - \int_0^t {c\left( t \right){\rm{d}}t} )}}{{m{V_{\rm{m}}}}} \times {\rm{ }}{10^{ - 3}} $ | (2) |
其中,c(NOx) (x=1和/或2) 是NOx的浓度 (×10-6);vtot为气体的总流速 (mL/min),t为储存经过的时间 (min),c0为起始的NOx浓度,m为催化剂的质量 (g),Vm=22.4 L/mol,从而NSC的单位为μmol/g。NSC的计算公式 (2) 可用图 1来辅助理解。代入各已知数据,则从图 1可知,样品的NSC值即为S2的面积。

|
| 图 1 NSC计算说明 Figure 1 Illustration of NSC measurement |
| |
测试在内径4 mm的不锈钢固定床反应器中进行,使用催化剂的质量为0.4 g。稀燃和富燃的时间分别设为2 min和1 min。稀燃的模拟气体组分为500×10-6 NO和6.67% O2,以N2为平衡气体,总流速150 mL/min,空速约32 000 h-1;富燃的模拟气体组分则为500×10-6 NO和1 000×10-6丙烯,平衡气同。对NOx和CO2的检测仪器与1.3.1节相同。实验步骤如下:1) 升温至反应温度,然后用O2/N2气氛对催化剂吹扫,直至出口气体的CO2浓度降至0为止;2) 切换至旁路,再打开NO气体阀门,进行配气,待NOx浓度达到所需值并且CO2浓度为0时,再切换通道,使气体通过催化剂,开始2 min/1 min的储存还原循环,同时开始记录数据;3) 当储存还原达到稳态后,停止记录。
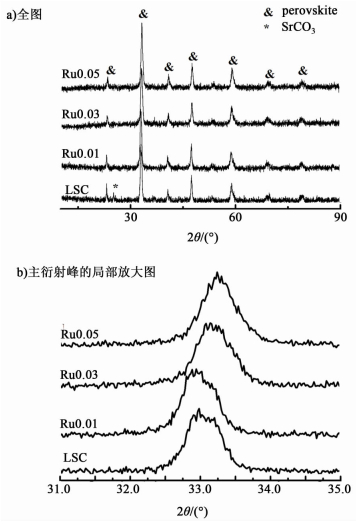
2 结果与讨论 2.1 催化剂表征 2.1.1 XRD分析Ru0.01到Ru0.05样品的XRD分析及其与未掺杂Ru的相同制备方法制得的La0.7Sr0.3CoO3样品 (标记为LSC) 的谱图对比如图 2a) 所示,图 2b) 则是钙钛矿样品在33°左右的主衍射峰的放大图。
|
| 图 2 样品的XRD谱图 Figure 2 XRD spectrum of the samples |
| |
从图 2可以看出,3种Ru掺杂的样品都显示出了完整良好的典型钙钛矿晶体结构,图 2b) 显示,随着Ru的掺入,主衍射峰往大角度方向发生了偏移。这证明了Ru已经掺入了钙钛矿的晶格中。由于Sr对La的取代掺杂,钙钛矿型样品的整体不再保持电中性,并且需要金属离子价态升高以保持电荷平衡;掺杂Ru之后,由于Ru的掺杂量比较小,因此其可以出现较高的价态,例如5+甚至7+价态。经查阅,5+价的Ru离子半径为0.0565 nm,比常温下的Co3+离子的半径 (0.0610 nm) 要小,因此,随着Ru的掺杂以及升价,晶体会出现晶格收缩现象,由Bragg公式可知,对应的衍射角就增大了。此外,从图 2a) 看出,LSC在2θ为25.15°处存在1个较为明显的碳酸锶的衍射峰,该衍射峰在掺Ru的样品中减弱了,这证明Ru的掺杂抑制了由于Sr对La的取代所造成的生成碳酸锶。
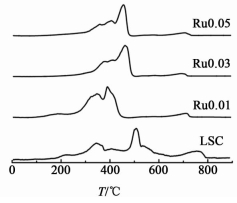
2.1.2 H2-TPR分析图 3是Ru掺杂样品与LSC样品的H2-TPR表征结果对比。
|
| 图 3 样品的H2-TPR谱图 Figure 3 H2-TPR profiles of the samples |
| |
在LSC的H2-TPR结果中,存在2个主要的耗氢还原峰,350 ℃左右的峰归属为Co离子在其简单氧化物中的还原,500 ℃左右的峰则归为Co在钙钛矿结构中的还原;而在750 ℃左右还有1个峰包,对比文献报道可知,这可归属为碳酸盐分解释放的CO2对信号干扰所致[14]。
由图 3可以看出,掺杂Ru之后,催化剂最强的耗氢峰向低温方向移动了,而较低温的Co还原峰则趋于减弱;此外,碳酸盐的分解干扰峰随着Ru的掺杂也减弱了很多。通过H2-TPR的测试结果及其变化趋势,可以推测得出,Ru的掺杂不仅抑制了碳酸锶的生成,也同样抑制了Co的单一氧化物,也就是强化了钙钛矿结构,有效抑制了其中组分由于La的部分取代而向单一氧化物偏析的趋势;同时,作为贵金属,Ru离子氧化能力较强,容易使其临近的晶格结构中的钴离子或氧离子被氧化到具有较强氧化性的较高的价态,从而降低了它们与氢反应的难度,进而使得钙钛矿的主还原峰向低温方向发生了移动。
2.2 催化剂活性测试评价 2.2.1 储存性能图 4是掺杂了Ru的3个催化剂样品在325 ℃下的NOx储存曲线和实验过程中CO2浓度随储存时间的变化曲线。NOx分为NO和NO2 2种成分,仪器同时检测NO和总NO2的浓度,以NOx浓度值减去NO的值,即得到NO2的浓度曲线。

|
| 图 4 在325 ℃时样品在NOx储存过程中的NOx以及CO2浓度曲线 Figure 4 NOxand CO2 concentration profiles of the samples during NOx storage at 325 ℃ |
| |
从图 4看出,在这一温度下,Ru掺杂的催化剂都具有相当宽度的NOx吸附阱,Ru0.01和Ru0.03的吸附阱都在30 min左右,而Ru0.05的吸附阱变窄为约15 min。这样的吸附阱宽度是比较良好的,能够通过足够长的时间实现有效的NOx吸附;但Ru掺杂分数过大,会对吸附起到抑制作用。Ru的掺杂对催化剂的NO氧化能力影响并不大,NO转化为NO2的转化率都在82%左右。而由1.3.1节的计算公式可知,在储存已达饱和、吸附阱变窄的情况下,NSC是随之下降的。而我们也计算得到3个样品在60 min的NSC值,从Ru0.01到Ru0.05,样品的NSC值依次是1 036、1 028和818 μmol/g,与吸附阱基本能够一一对应。
从元素周期表可知,在组成本系列催化剂的几种金属元素中,Sr的碱性最强,从而其NOx储存能力也最强,是NOx的优先吸附位。因此,1 g催化剂中的所有Sr物种全部转化为硝酸盐/亚硝酸盐所消耗的NOx的物质的量,即为催化剂的理论NSC,记为NSC (T)。本系列的催化剂中,Sr的计量比皆为0.3,从而可以得出1 g无掺杂LSC催化剂的NSC (T) 计算方法及结果如式 (3)。
| $ \begin{array}{l} {\rm{NSC}}\left( {\rm{T}} \right) = 2 \times 0.3 \times \frac{1}{M} = \frac{{0.6}}{{230.453}} = \\ \;\;\;\;2.604 \times {10^{ - 3}}\;{\rm{mol}}/{\rm{g}} = 2604\;{\rm{\mu mol}}/{\rm{g}} \end{array} $ | (3) |
Ru掺杂的系列催化剂的储存效率并没有达到理论值的相当水平,表现比较良好的Ru0.01和Ru0.03的NSC大约是理论值的40%。由于Sr掺杂的催化剂显示出了良好的钙钛矿晶体结构,因此可知Sr很好地掺入了晶格之中,从而会有相当比例的Sr离子处于体相中,并未暴露至表面,从而难以参与NOx的吸附,这是实验值比理论值偏低的重要原因。
从2.1节的XRD表征可以得知,溶胶凝胶法制备的LSC催化剂存在碳酸锶的物种。NOx吸附会将碳酸盐置换出来,从而逸出CO2被仪器检测到。由于价态关系,1 mol被置换出来的CO2对应2 mol被吸附的NOx,因此对CO2检测浓度的翻倍可以等效于碳酸盐对NOx储存的贡献,这就是图 4中对CO2浓度数据翻倍的原因。
从图 4的翻倍CO2曲线可以看出,在操作温度下,碳酸盐分解很快,翻倍CO2浓度一开始处于200×10-6~300×10-6,而CO2曲线的走低与NOx曲线的走高基本上是同步进行的,并且2条曲线的切线斜率基本保持互为相反数。这说明,生成了碳酸锶的Sr离子是NOx的主要吸附位置。而随着Ru掺杂分数的增加,CO2的起始浓度随之降低,降为0的趋势也变快了,这说明碳酸盐物种的含量随着Ru的增加而减少了。由XRD和H2-TPR的表征结果可知,Ru的掺杂会抑制钙钛矿化合物的偏析,从而Sr和Co的单一氧化物以及碳酸盐等物种的比例会降低。
2.2.2 储存还原性能图 5是Ru掺杂系列催化剂在325 ℃下的NOx储存还原曲线。

|
| 图 5 在325 ℃时样品的NOx储存还原曲线 Figure 5 NOx storage-reduction profiles of the samples at 325 ℃ |
| |
从图 5可以看出,在贫燃条件下,3个催化剂样品都能够很好地吸附NOx,同时CO2被置换出来,NOx浓度几乎为0,而CO2浓度大幅上升;富燃条件下,一部分NOx被C3H6还原生成N2和CO2,产生的CO2重新被催化剂吸收,另一部分NOx则直接脱附出来,NOx浓度瞬时上升,而CO2浓度大幅下降。可以看出,富燃条件下催化剂对NOx的脱附性能比较良好,从而保证了催化剂可以在吸附和脱附中循环工作。
通过与同类催化剂的比较,我们发现,已报道的Pd掺杂的催化剂在相同的操作条件下,NSR性能比本研究的催化剂要优良。本研究的Ru系列催化剂样品的碳酸盐物种受到了有效的抑制,对比文献报道可知,碳酸盐含量的降低,可能对催化剂的抗硫性能有较大的促进作用[15]。
2.3 NOx储存过程的碳/氮比的评价根据图 4,可将1 g催化剂在储存过程中释放的CO2的物质的量定义为CO2脱附容量 (CO2 desorption capacity, CDDC),单位也是μmol/g。为与NSC作有效对比,CDDC的值也被翻倍。CDDC与NSC的比值简称为碳/氮比,记为C/N,是考察碳酸盐物种对NOx储存的贡献大小的重要参数,比值越大,则碳酸盐对NOx储存的贡献越大。根据图 4,可分析出325 ℃下0~60 min的各个时段内Ru掺杂系列各催化剂样品的CDDC、NSC以及C/N值,如表 1至表 3所示。
| 时段 | 0~5 | 6~10 | 11~20 | 21~30 | 31~60 | 0~60 |
| Ru0.01 | 100 | 100 | 200 | 200 | 436 | 1 036 |
| Ru0.03 | 100 | 100 | 200 | 200 | 428 | 1 028 |
| Ru0.05 | 100 | 100 | 183 | 139 | 266 | 818 |
| 时段 | 0~5 | 6~10 | 11~20 | 21~30 | 31~60 | 0~60 |
| Ru0.01 | 40 | 65 | 122 | 107 | 139 | 473 |
| Ru0.03 | 21 | 47 | 94 | 94 | 153 | 409 |
| Ru0.05 | 32 | 51 | 93 | 66 | 37 | 279 |
| 时段 | 0~5 | 6~10 | 11~20 | 21~30 | 31~60 | 0~60 |
| Ru0.01 | 0.40 | 0.65 | 0.61 | 0.54 | 0.32 | 0.46 |
| Ru0.03 | 0.21 | 0.47 | 0.47 | 0.47 | 0.36 | 0.40 |
| Ru0.05 | 0.32 | 0.51 | 0.51 | 0.47 | 0.14 | 0.34 |
表 3是根据表 1和表 2的结果而得出,从表 3可以看出,Ru掺杂的催化剂的C/N比值并不是特别高,这意味着碳酸盐对该系列催化剂的NOx吸附的贡献并不是特别大。这也是因为Ru的掺杂限制了碳酸锶的生成,Sr离子偏析出钙钛矿结构的比例比较小,但由于碱性的原因,NOx仍然吸附在其他形式的Sr物种上。
3 结论溶胶-凝胶法制备的贵金属Ru对钙钛矿型La0.7Sr0.3CoO3催化剂的掺杂使得催化剂保持更加完整的钙钛矿结构,并且抑制各金属离子的单一氧化物以及进一步得到的碳酸盐等物种的偏析。在325 ℃下,Ru掺杂的催化剂具有比较宽的NOx吸附阱,当Ru掺杂分数过大时,NOx吸附会受到抑制。在储存还原测试中,催化剂能够一直保持对NOx的良好吸附。通过对比CO2浓度与NOx浓度的消长,得知碳酸盐物种是NOx的主要吸附位。Ru掺杂抑制了碳酸盐的生成,从而使得催化剂的C/N值处于较低水平,碳酸盐对NOx吸附的贡献减小。由于碳酸盐生成受到了抑制,催化剂的抗硫性能可能会得到提高。
| [1] |
杨新兴, 冯丽华, 尉鹏. 汽车尾气污染及其危害[J].
前沿科学, 2012, 6 : 10–21.
Yang Xinxing, Feng Lihua, Wei Peng. Pollution of car exhaust and its harm[J]. Frontier Science, 2012, 6 : 10–21. |
| [2] | Fritz A, Pitchon V. The current status of research on automotive lean NOx catalysis[J]. Appl Catal B, 1997, 13(1) : 1–25. DOI: 10.1016/S0926-3373(96)00102-6 |
| [3] | Amimazmi A, Benson J E, Boudart M, et al. Oxygen inhibition in the decomposition of NO on metal oxide and plati-Burn[J]. J Catal, 1973, 30(1) : 138–145. |
| [4] | Nova I, Lietti L, Casagrande L, et al. Characterization and reactivity of TiO2-supported MoO3 De-NOx SCR catalysts[J]. Appl Catal B, 1998, 17(4) : 245–254. |
| [5] | Sullivan J A, Cunningham J, Morris M A, et al. Conditions in which Cu-ZSM-5 outperforms supported vanadia catalysts in SCR of NOx by NH3[J]. Appl Catal B, 1995, 7(1) : 137–151. |
| [6] | Liu Z, Woo S I. Recent advances in catalytic DeNOx science and technology[J]. Catal Rev, 2006, 48 : 43–89. DOI: 10.1080/01614940500439891 |
| [7] | Roy S, Baiker A. NOx storage-reduction catalysis:From mechanism and materials properties to storage-reduction performance[J]. Chem Rev, 2009, 109 : 4054–4091. DOI: 10.1021/cr800496f |
| [8] | Abdulhamid H, Fridell E, Skoglun M. The reduction phase in NOx storage catalysis:Effect of type of precious metal and reducing agent[J]. Appl Catal B, 2006, 62 : 319–328. DOI: 10.1016/j.apcatb.2005.08.014 |
| [9] | Takeuchi M, Matsumoto S. NOx storage-reduction catalysts for gasoline engines[J]. Top Catal, 2004, 28 : 151–156. DOI: 10.1023/B:TOCA.0000024344.91688.e4 |
| [10] | Westerberg B, Fridell E. A transient FTIR study of species formed during NOx storage in the Pt/BaO/Al2O3 system[J]. J Mol Catal A, 2001, 165 : 249–263. DOI: 10.1016/S1381-1169(00)00431-3 |
| [11] | Hodjati S, Vaezzadeh K, Petit C, et al. NOx sorption-desorption study:Application to diesel and lean-burn exhaust gas (selective NOx recirculation technique)[J]. Catal Today, 2000, 59(3/4) : 323–334. |
| [12] |
耿其博, 黄晓林, 黄庆, 等. 钴系钙钛矿型氧化物催化剂的抗硫性能研究[J].
催化学报, 1989, 10(1) : 79–82.
Geng Qibo, Huang Xiaolin, Huang Qing, et al. Studies on the SO2 resistance of Co-containing perovskite type oxidation catalysts[J]. Chinese Journal of Catalysis, 1989, 10(1) : 79–82. |
| [13] | Li X, Dong Y, Xian H, et al. De-NOx in alternative lean-rich atmospheres on La1-xSrxCoO3 perovskites[J]. Energy Environ Sci, 2011, 4 : 3351–3354. DOI: 10.1039/c1ee01726h |
| [14] | Li X, Chen C, Liu C, et al. An effective catalysis for removal of NOx from lean-burn exhausts with high sulfur resistance[J]. ACS Catal, 2013, 3(6) : 1071–1075. DOI: 10.1021/cs400136t |
| [15] | Ma A, Wang S, Liu C, et al. Effects of Fe dopants and residual carbonates on the catalytic activities of the perovskite-type La0.7Sr0.3Co1-xFexO3 NOx storage catalyst[J]. Appl Catal B:Environ, 2014, 146 : 24–34. DOI: 10.1016/j.apcatb.2013.06.005 |
 2017, Vol. 34
2017, Vol. 34





