氢气作为一种清洁高效的能量载体受到了越来越多的关注[1]。通过电化学的方法分解水被认为是可持续获取氢气的有效方法[2]。为了提高电解水的反应速度、降低过电位,我们需要高效的析氢催化剂。目前,Pt族贵金属已表现出较高的催化活性和稳定性[3-4],但是贵金属高昂的价格和有限的储量限制了其大规模用于制氢。
最近,越来越多的非贵金属化合物,如MoS2[5-7]、Mo2C[8]、CoSe2[9]、WS2[10]、CoP[11-13]和Ni2P[14]等,被报道具有较高的析氢催化活性。其中,MoS2的催化活性不仅有理论计算的预测[15],同时还得到了实验结果的验证[16]。为了增加MoS2的催化活性位点数量,提高催化剂的导电性,通常以碳材料为载体合成纳米结构的MoS2。Dai等[17]通过RGO与MoS2的复合,提高了MoS2的分散性和电催化剂的整体导电性。另外,CNT[18]、碳布[19]和多孔碳[20]等材料也都作为MoS2的载体进行了研究,结果显示其对催化性能的提高有一定的促进作用。除了引入载体这种手段以外,引入助催化剂也能提高电催化剂的性能。例如,WC纳米颗粒和MoS2的混合物的对析氢反应的催化活性要远高于单独的MoS2[21]。Hu等[22]向无定形硫化钼中加入Fe、Co或Ni等过渡金属元素作为助催化剂,提高了催化剂的活性。但是这些掺杂物在酸性条件下容易发生腐蚀。
MoS2和Ni2P在催化加氢脱硫 (HDS) 反应中有广泛的应用。Li等[23]报道了这2种物质在催化加氢脱硫反应中的协同作用。HER和HDS反应过程都需要吸附氢原子作为反应中间产物,2种不同的反应对表面氢吸附能的要求比较相近。因此,优秀的HDS催化剂也很有可能会具有良好的析氢性能[24]。本研究先将Ni2P纳米颗粒加入氧化石墨烯 (GO) 溶液,再加入 (NH4)2MoS4和N2H4·H2O,通过溶剂热反应合成了MoS2-Ni2P/RGO复合材料。该材料在0.5 mol/L H2SO4中进行析氢性能测试,表现出优异的催化活性和稳定性。
1 实验方法与测试 1.1 实验试剂(NH4)2MoS4,AR,阿法埃莎化学有限公司;NaH2PO2,AR,天津希恩思生化科技有限公司;NiCl2·6H2O,AR,天津希恩思生化科技有限公司;N-N二甲基甲酰胺,AR,天津市科密欧化学试剂有限公司;N2H4·H2O,AR,天津市科密欧化学试剂有限公司。
1.2 实验仪器管式炉,GSL-1300X,合肥科晶材料技术有限公司;真空干燥箱,2K-3S,中环实验电炉有限公司;超级恒温油浴锅,HH-SA,金坛市岸头国瑞实验仪器厂;电化学工作站,PARSTAT-2273;水热反应釜,20 mL,东台市中凯亚不锈钢制品厂。
1.3 材料的合成氧化石墨烯和Ni2P纳米颗粒的合成:通过改进的哈默法把天然鳞片石墨转化成氧化石墨,并超声获得氧化石墨烯。Ni2P纳米颗粒通过固相法合成。向5.0 mL水中加入0.66 g NaH2PO2和0.3 g NiCl2·6H2O,充分搅拌溶解。将溶液置于80 ℃真空下,使水分逐渐蒸干,用研钵把得到的黄色固体研成粉末。N2气保护下,将上述前驱体混合物置于在管式炉中250 ℃下反应1 h,并自然冷却。得到的产物水洗过滤,在60 ℃下真空干燥。
MoS2-Ni2P/RGO和MoS2/RGO的合成:将10 mg GO加入到10 mL的N, N-二甲基甲酰胺中,超声分散0.5 h,再将2 mg的Ni2P纳米颗粒加入到上述分散液中继续超声0.5 h。继续加入22 mg (NH4)2MoS4,超声至分散液澄清。最后加入0.1 mL N2H4·H2O,超声0.5 h。得到的分散液转入20 mL的水热反应釜,在200 ℃下反应10 h。反应结束,将反应产物过滤水洗,最后在60 ℃下真空干燥。合成MoS2/RGO的方法与MoS2-Ni2P/RGO相同,只是没有加入Ni2P纳米颗粒。
1.4 电化学性能测试取4 mg催化剂、30 μL Nafion (质量分数为%) 溶液,加入1 mL乙醇水溶液[V(乙醇):V(水) 为1:4]。将分散液超声1 h制成催化剂墨水。将5 μL的催化剂墨水滴加到玻碳电极 (直径3 mm) 上,室温下晾干。以催化剂修饰的玻碳电极为工作电极,2 cm×2 cm的铂片为辅助电极,饱和甘汞电极为参比电极,组成三电极体系,在普林斯顿2273电化学工作站上进行电化学性能测试。所有材料的电催化活性都是在0.5 mol/L H2SO4中测试,稳态极化曲线的扫描速度是2 mV/s。
1.5 表征材料的形貌及结构分析:各样品的形貌用扫描电子显微镜 (SEM,日立S-4800型) 和透射电子显微镜 (TEM,Tecnai G2-F20型) 观察。采用XRD (D/Max-2500V-PC, Rigaku) 对样品的晶体结构进行分析,2θ扫描范围为10°~80°。
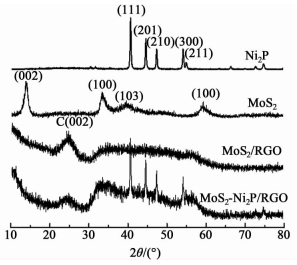
2 结果与讨论 2.1 XRD谱图分析图 1为Ni2P、MoS2、MoS2/RGO和MoS2-Ni2P/RGO的XRD谱图。
|
| 图 1 Ni2P、MoS2、MoS2/RGO和MoS2-Ni2P/RGO的XRD谱图 Figure 1 XRD patterns of Ni2P, MoS2, MoS2/RGO and MoS2-Ni2P/RGO |
| |
Ni2P纳米颗粒的谱图中出现了2θ为40.72°、44.61°、47.36°和54.20°的衍射峰,分别对应Ni2P的 (111)、(201)、(210) 和 (300) 晶面,说明固相法成功的合成了Ni2P。Ni2P的部分衍射峰也出现在MoS2-Ni2P/RGO的XRD谱图中,说明Ni2P纳米颗粒经过溶剂热反应依然存在。对比纯MoS2的衍射峰,MoS2/RGO和MoS2-Ni2P/RGO的XRD谱图中MoS2的衍射峰较弱,说明RGO载体的加入降低了MoS2的结晶度。在MoS2/RGO和MoS2-Ni2P/RGO的XRD谱图中2θ=25.10°位置处出现的衍射峰是石墨的 (002) 衍射峰,说明GO在溶剂热反应过程中得到了一定程度的还原。
2.2 SEM和TEM分析图 2分别是Ni2P纳米颗粒、MoS2、MoS2/RGO和MoS2-Ni2P/RGO的SEM图片。

|
| 图 2 a) Ni2P的SEM图片,b) MoS2的SEM图片,c) MoS2/RGO的SEM图片,d) MoS2-Ni2P/RGO的SEM图片 Figure 2 SEM images of a) Ni2P nanoparticles, b) MoS2 nanoparticles, c) MoS2/RGO and d) MoS2-Ni2P/RGO |
| |
从图 2a) 中可以看出,Ni2P是直径100~200 nm的纳米颗粒,与MoS2纳米颗粒相比,Ni2P表面比较光滑。从图 2b) 中可以看出,MoS2纳米颗粒的粒径在50~100 nm之间。如果溶剂热反应过程中有GO的存在,MoS2会在GO的表面选择性生长。另外还有少部分MoS2未在RGO的表面生长,而是形成了独立的纳米颗粒,形貌与未负载的MoS2相似,颗粒的表面略显粗糙。MoS2-Ni2P/RGO [图 2d)]复合物中,可以看到Ni2P纳米颗粒与RGO混合在一起,并基本保持了溶剂热反应前的形态。通过SEM观察样品的同时,利用能谱仪 (EDS) 对MoS2/RGO样品中C、S和Mo 3种元素的含量进行了测试。结果见图 3。

|
| 图 3 MoS2/RGO的EDS谱图 Figure 3 EDX spectrum of MoS2/RGO |
| |
如图 3所示,C、S和Mo 3种元素的原子数分别占70.29%、19.15%和10.56%,通过计算可知m(石墨烯):m(MoS2) 约为2:1。
图 4所示为分别为MoS2/RGO和MoS2-Ni2P/RGO的TEM图片。

|
| 图 4 MoS2/RGO的a) TEM和b) HR-TEM图片,MoS2-Ni2P/RGO的c) TEM和d) HR-TEM图片 Figure 4 a) TEM and b) High resolution TEM images of MoS2/RGO, c) TEM and d) High resolution TEM images of MoS2-Ni2P/RGO |
| |
从图 4c) 中可以看到RGO上的Ni2P纳米颗粒。把RGO表面部分区域放大,在高倍TEM图片[图 4d)]可以看出间距0.27 nm的六角原子晶格,该晶格中的原子面是MoS2的 (100) 晶面。此结果证明了MoS2纳米片在RGO表面的生长。对比图 4b) 和图 4d) 可知,MoS2/RGO与MoS2-Ni2P/RGO中的MoS2在RGO上的分布基本相同。
2.3 电化学性能分析Ni2P、MoS2、MoS2/RGO和MoS2-Ni2P/RGO析氢电催化剂的极化曲线如图 5所示。

|
| 图 5 不同电催化剂的析氢极化曲线 Figure 5 Polarization curves of several catalysts as indicated |
| |
作为对比,我们还测试了商品Pt/C (质量分数为20%) 的析氢极化曲线。Pt/C显示出极高的电催化活性,起始电位几乎为0。纯MoS2表现出较低的催化活性,当电流密度为1 mA/cm2时,电极电位为-192 mV。MoS2/RGO在催化析氢反应时表现出较高的催化活性,电流密度达到1和10 mA/cm2时对应的电极电位分别为-140和-183 mV。加入Ni2P纳米颗粒后,得到的MoS2-Ni2P/RGO复合催化剂的析氢催化性能有了进一步的提高。当电流密度达到1和10 mA/cm2时,电极电位只有-124和-160 mV。电极电位在-200 mV时,MoS2-Ni2P/RGO的电流密度是MoS2/RGO的3倍左右。通过对比MoS2/RGO和MoS2-Ni2P/RGO的极化曲线可知,Ni2P对MoS2/RGO的析氢催化性能的提高起到了一定的促进作用。
一般认为,酸性条件下的HER反应有3种基元反应[17]。首先是氢离子与催化剂表面吸附并结合1个电子的电化学反应 (Volmer reaction):
| $ {{\rm{H}}_{\rm{3}}}{{\rm{O}}^{\rm{ + }}}{\rm{ + }}{{\rm{e}}^{\rm{ - }}} \to {{\rm{H}}_{{\rm{ads}}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (1) |
接下来的是电化学脱附反应 (Heyrovsky reaction):
| $ {{\rm{H}}_{{\rm{ads}}}}{\rm{ + }}{{\rm{H}}_{\rm{3}}}{{\rm{O}}^{\rm{ + }}}{\rm{ + }}{{\rm{e}}^{\rm{ - }}} \to {{\rm{H}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (2) |
或者是复合脱附反应 (Tafel reaction):
| $ {{\rm{H}}_{{\rm{ads}}}}{\rm{ + }}{{\rm{H}}_{{\rm{ads}}}} \to {{\rm{H}}_{\rm{2}}} $ | (3) |
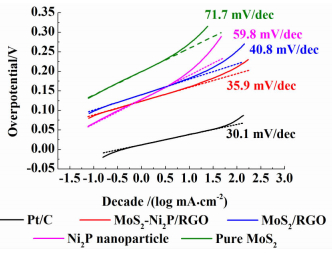
图 6所示为各析氢催化剂的塔菲尔曲线。塔菲尔斜率可以用来探究HER过程的内在反应机理。通过理论计算可知,Volmer反应作为析氢反应的速率控制步骤时,塔菲尔斜率是120 mV·dec-1,当Heyrovsky反应或者Tafel反应作为速率控制步骤时,对应的塔菲尔斜率分别为30或者40 mV·dec-1。由塔菲尔曲线可得Pt/C、MoS2-Ni2P/RGO、MoS2/RGO、Ni2P和MoS2的塔菲尔斜率分别为30.1、35.9、40.8、59.8和71.7 mV·dec-1。Pt/C的塔菲尔斜率表明其析氢反应经历的是Volmer-Tafel途径,并且速率控制步骤是2个Hads复合脱附。该结论与前人的研究结果[3]相符。从得到的MoS2和MoS2/RGO的塔菲尔斜率可以推断,两者的析氢反应都是经历的Volmer-Heyrovsky途径。随着Ni2P纳米颗粒的加入,MoS2-Ni2P/RGO的塔菲尔斜率降低到35.9 mV·dec-1,这一斜率值说明很有可能反应过程中部分的Hads是经过类似于Tafel反应的过程转化成H2的。
|
| 图 6 不同析氢催化剂的塔菲尔曲线 Figure 6 Tafel plots of several catalysts as indicated |
| |
图 7对比了Ni2P掺杂量分别为0.5、2.0和8.0 mg的3种MoS2-Ni2P/RGO对析氢反应的催化活性。结果显示,3种MoS2-Ni2P/RGO对析氢反应的催化活性均高于不含Ni2P纳米颗粒的MoS2/RGO。当Ni2P的掺杂量从0.5 mg提高到2.0 mg时,MoS2-Ni2P/RGO催化活性有所提高,随着Ni2P的掺杂量继续增加到8.0 mg催化活性开始降低。

|
| 图 7 不同Ni2P掺杂量的MoS2-Ni2P/RGO的析氢极化曲线 Figure 7 Polarization curves of several catalysts with different contents of Ni2P |
| |
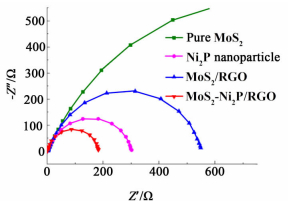
4种析氢催化剂的交流阻抗谱图成很好的半圆形 (见图 8),半圆的直径代表的是电荷传递电阻Rct。
|
| 图 8 不同析氢催化剂的交流阻抗谱图 Figure 8 Electrochemical impedance spectra of several catalysts as indicated |
| |
与其他几种电催化剂相比,MoS2-Ni2P/RGO的交流阻抗谱图的半径最小,意味着其Rct最小。MoS2-Ni2P/RGO催化剂性能的提高可能由以下3个原因引起:1) 复合材料中的RGO具有极高的导电性,促进了催化层中电子的传递,同时RGO做为载体使MoS2分散成极小的纳米片层附着在载体表面,从而暴露出大量的活性位点;2) 溶剂热反应过程中,Ni2P可以充当分散剂的角色阻止GO在还原过程中的团聚,这样增多了RGO片层之间的孔隙,这些孔隙在析氢反应过程中对离子传递和质量传递都会起到一定的促进作用;3) Ni2P本身具有较高的析氢催化活性,另外MoS2和Ni2P在催化析氢反应时很可能存在一定的协同作用。最近有研究报道了MoS2和Ni2P在催化HDS反应时具有协同作用,并用氢溢流效应解释了二者之间的协同效应[23]。根据MoS2和Ni2P共同催化HDS的过程推测,当MoS2和Ni2P共同催化析氢反应时很可能会经过以下过程:首先,氢离子吸附在Ni2P表面,并结合1个电子转化成活性氢原子;活性氢原子通过氢溢流效应从Ni2P表面转移到MoS2的边缘;如果MoS2的边缘已经结合了1个氢原子,该原子与从Ni2P表面转移来的活性氢原子通过一种类似于Tafel反应的途径直接结合成氢分子,然后从MoS2边缘脱附。而当MoS2单独催化析氢反应时,由于氢原子在MoS2边缘的覆盖率较低,被吸附的氢原子只能和溶液中的氢离子结合,即通过电化学脱附反应完成析氢反应。
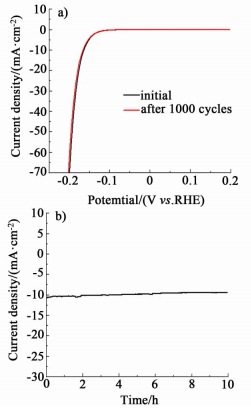
催化剂的稳定性是实际应用时需考虑的另一个重要因素。为了测试催化剂的稳定性,MoS2-Ni2P/RGO在0.5 mol/L H2SO4中以50 mV/s的扫速在+0.275~-0.235 V (vs. RHE) 之间循环1 000圈。如图 9a) 所示,循环结束后电催化剂的催化活性只有极小的下降,析氢极化曲线几乎与原始极化曲线重合。MoS2-Ni2P/RGO在-175 mV的恒定电位下催化析氢反应10 h,如图 9b) 所示,经过10 h的测试,电流密度与起始值比仅降低了约1 mA·cm2。这些结果都说明MoS2-Ni2P/RGO在酸性条件下作为析氢催化剂具有良好的稳定性。
|
| 图 9 MoS2-Ni2P/RGO a) 初始和经过1 000圈循环伏安扫描的极化曲线,b)-175 mV过电位下的计时电流曲线 Figure 9 Polarization curves for MoS2-Ni2P/RGO before and after 1000 cycles between +0.275 and-0.235 V. b) Time dependence of the current density for MoS2-Ni2P/RGO at a static overpotential of-175 mV for 10 hours |
| |
通过溶剂热反应,合成了MoS2-Ni2P/RGO复合材料。该复合材料表现出较高的析氢催化活性,电流密度为10 mA·cm2时的电极电位只有-160 mV,塔菲尔斜率为35.9 mV·dec-1。催化剂的高催化活性可以归因于高导电率的RGO对整体催化剂导电性能的改善、高分散性的MoS2提供更多的反应活性位点以及Ni2P对GO还原过程中团聚的抑制作用。另外,Ni2P和MoS2之间很有可能存在氢溢流效应,该效应促进了析氢反应的进行。
| [1] | Dresselhaus M S, Thomas I L. Alternative energy technologies[J]. Nature, 2001, 414(6861) : 332–337. DOI: 10.1038/35104599 |
| [2] | Carmo M, Fritz D L, Mergel J. A comprehensive review on PEM water electrolysis[J]. International Journal of Hydrogen Energy, 2013, 38(12) : 4901–4934. DOI: 10.1016/j.ijhydene.2013.01.151 |
| [3] | Esposito D V, Hunt S T, Kimmel Y C. A new class of electrocatalysts for hydrogen production from water electrolysis:Metal monolayers supported on low-cost transition metal carbides[J]. J Am Chem Soc, 2012, 134(6) : 3025–3033. DOI: 10.1021/ja208656v |
| [4] | Zeng Z, Tan C, Huang X. Growth of noble metal nanoparticles on single-layer TiS2 and TaS2 nanosheets for hydrogen evolution reaction[J]. Energy Environ Sci, 2014, 7(2) : 797–803. DOI: 10.1039/C3EE42620C |
| [5] | Voiry D, Salehi M, Silva R. Conducting MoS (2) nanosheets as catalysts for hydrogen evolution reaction[J]. Nano Lett, 2013, 13(12) : 6222–6227. DOI: 10.1021/nl403661s |
| [6] | Wang D, Pan Z, Wu Z. Hydrothermal synthesis of MoS2 nanoflowers as highly efficient hydrogen evolution reaction catalysts[J]. Journal of Power Sources, 2014, 264 : 229–234. DOI: 10.1016/j.jpowsour.2014.04.066 |
| [7] | Wang T, Liu L, Zhu Z. Enhanced electrocatalytic activity for hydrogen evolution reaction from self-assembled monodispersed molybdenum sulfide nanoparticles on an Au electrode[J]. Energy Environ Sci, 2013, 6(2) : 625–633. DOI: 10.1039/C2EE23513G |
| [8] | Chen W, Wang C, Sasaki K. Highly active and durable nanostructured molybdenum carbide electrocatalysts for hydrogen production[J]. Energy & Environmental Science, 2013, 6(3) : 943–951. |
| [9] | Kong D, Wang H, Lu Z. CoSe2 nanoparticles grown on carbon fiber paper:An efficient and stable electrocatalyst for hydrogen evolution reaction[J]. J Am Chem Soc, 2014, 136(13) : 4897–4900. DOI: 10.1021/ja501497n |
| [10] | Cheng L, Huang W, Gong Q. Ultrathin WS2 nanoflakes as a high-performance electrocatalyst for the hydrogen evolution reaction[J]. Angew Chem Int Ed Engl, 2014, 53(30) : 7860–7863. DOI: 10.1002/anie.201402315 |
| [11] | Liu Q, Tian J, Cui W. Carbon nanotubes decorated with CoP nanocrystals:A highly active non-noble-metal nanohybrid electrocatalyst for hydrogen evolution[J]. Angew Chem Int Ed Engl, 2014, 53(26) : 6710–6714. DOI: 10.1002/anie.201404161 |
| [12] | Tian J, Liu Q, Asiri A M. Self-Supported nanoporous cobalt phosphide nanowire arrays:An efficient 3D hydrogen-evolving cathode over the wide range of pH 0-14[J]. J Am Chem Soc, 2014, 136(21) : 7587–7590. DOI: 10.1021/ja503372r |
| [13] | Gu S, Du H, Asiri A M. Three-Dimensional interconnected network of nanoporous CoP nanowires as an efficient hydrogen evolution cathode[J]. Phys Chem Chem Phys, 2014, 16(32) : 16909–16913. DOI: 10.1039/C4CP02613F |
| [14] | Feng L, Vrubel H, Bensimon M. Easily-Prepared dinickel phosphide (Ni2P) nanoparticles as an efficient and robust electrocatalyst for hydrogen evolution[J]. Phys Chem Chem Phys, 2014, 16(13) : 5917–5921. DOI: 10.1039/c4cp00482e |
| [15] | Hinnemann B, Moses P G, Bonde J. Biomimetic hydrogen evolution:MoS2 nanoparticles as catalyst for hydrogen evolution[J]. J Am Chem Soc, 2005, 127(15) : 5308–5309. DOI: 10.1021/ja0504690 |
| [16] | Jaramillo T F, Jorgensen K P, Bonde J. Identification of active edge sites for electrochemical H2 evolution from MoS2 nanocatalysts[J]. Science, 2007, 317(5834) : 100–102. DOI: 10.1126/science.1141483 |
| [17] | Li Y, Wang H, Xie L. MoS2 nanoparticles grown on graphene:An advanced catalyst for the hydrogen evolution reaction[J]. J Am Chem Soc, 2011, 133(19) : 7296–7299. DOI: 10.1021/ja201269b |
| [18] | Li D, Maiti U N, Lim J. Molybdenum sulfide/N-doped CNT forest hybrid catalysts for high-performance hydrogen evolution reaction[J]. Nano Lett, 2014, 14(3) : 1228–1233. DOI: 10.1021/nl404108a |
| [19] | Hsu C, Chang Y, Chen T. Enhancing the electrocatalytic water splitting efficiency for amorphous MoSx[J]. International Journal of Hydrogen Energy, 2014, 39(10) : 4788–4793. DOI: 10.1016/j.ijhydene.2014.01.090 |
| [20] | Bian X, Zhu J, Liao L. Nanocomposite of MoS2 on ordered mesoporous carbon nanospheres:A highly active catalyst for electrochemical hydrogen evolution[J]. Electrochemistry Communications, 2012, 22 : 128–132. DOI: 10.1016/j.elecom.2012.06.009 |
| [21] | Yan Y, Xia B, Qi X. Nano-Tungsten carbide decorated graphene as co-catalysts for enhanced hydrogen evolution on molybdenum disulfide[J]. Chem Commun (Camb), 2013, 49(43) : 4884–4886. DOI: 10.1039/c3cc41031e |
| [22] | Duncan M M, Evans J M, Goodrichmahoney J W, et al. Fe, Co, and Ni ions promote the catalytic activity of amorphous molybdenum sulfide films for hydrogen evolution[M]//The use of chemicals in food production, processing, storage, and distribution:National Academy of Sciences, 1973:2515-2525 |
| [23] | Guan Q, Li W. The synthesis and evaluation of highly active Ni2-MoS2 catalysts using the decomposition of hypophosphites[J]. Catalysis Science & Technology, 2012, 2(11) : 2356–2360. |
| [24] | Morales-Guio C G, Stern L A, Hu X. Nanostructured hydrotreating catalysts for electrochemical hydrogen evolution[J]. Chem Soc Rev, 2014, 43(18) : 6555–6569. DOI: 10.1039/C3CS60468C |
 2017, Vol. 34
2017, Vol. 34





