2. 天津化学化工协同创新中心, 天津 300072
2. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China
自2004年FDA公布“工业指南”以来,过程分析技术 (Process analytical technology/tools,PAT) 在很多产品的研发和生产中变得越来越流行[1],广泛应用于材料合成、物质分析、生物工程和工业结晶等过程[2]。PAT是一个通过实时测量原料、过程中物料以及过程本身的关键质量指标和性能参数来实现过程开发、优化、设计、分析和调控的技术集成分析测量系统。PAT技术的应用可以保证过程的可靠性以及最终产品的质量[3]。结晶是一个复杂的多相传质和传热过程,其作为重要的单元操作过程之一,被广泛应用于固体物质的分离和提纯[4]。作为固体产物与液体溶液分离的关键一步,结晶也是调整固体产品性质 (如晶体粒度分布、形状、多晶型和纯度) 的关键过程[5]。近年来,应用PAT工具对结晶过程进行实时监测,促进了研究人员对结晶过程机理的进一步理解。同时,将PAT工具应用于结晶过程的开发、优化、设计、分析和调控,有助于确保原材料、工艺参数和最终产品的关键质量和性能属性达到设计指标,从而最终实现质量源于设计 (QBD) 的理念[6-7]。
对固体类物质而言,其多晶型现象在自然界中十分常见,广泛存在于药物、染料、食品添加剂、农业化学品和材料等领域中[8-11]。据统计,约有1/3的有机物、80%的药物存在有多晶型现象[12]。即使对于原来认为不存在多晶型现象的化合物,随着科学的进步,人们又陆续发现了该物质存在的其他新晶型[8]。对于同类物质的不同多晶型,不同晶型的很多物理化学性质以及制备工艺往往存在很大的不同,比如稳定性、溶解性、机械性能、光学性能等。同时,同一种物质的不同晶型之间还有相互转变的可能。因此,对固体物质的多晶型及其形成机理进行研究,对于控制固体产品的质量具有重要意义。正是在上述背景下,本论文首先对各种常见的PAT工具及其工作原理进行了简单介绍,然后对PAT工具在功能晶体多晶型热力学、成核和生长及转晶方面的应用进行了详细总结和讨论。
1 功能晶体多晶型早在1832年,乌勒和列别克就发现苯甲胺化合物中存在多晶型现象[13]。但是,直到1965年多晶型的概念才由McCrone提出[14]。他指出同一种元素或者化合物,由于制备条件差异而得到不同晶体结构的现象称为多晶型现象。从更严格的意义上讲[15-16],多晶型是指具有相同化学结构式的纯物质,因为晶格中分子不同的排列方式或者不同的构象而出现的不同结晶形式。多晶型的实质是由于同一种元素或化合物在不同生成条件下质子 (原子、离子或分子) 排列的空间对称性不同,而导致其在外观形态、理化性质和生物活性上的差异,进而形成不同的晶体结构。不同的晶型意味着晶体的晶胞参数和分子间的作用力不同,因此,其各种物理化学性质和性能方面也有很大的差异,从而展现出不同的热力学、机械和光电性质,如熔点、密度、硬度、溶解性、稳定性、晶习、吸湿性、流动性、溶出度和生物利用度等[17]。
根据晶体结构形成机理的不同,可以将多晶型分为堆积多晶型 (packing polymorphism) 和构象多晶型 (conformation polymorphism) 以及假多晶型 (pseudopolymorphism)。堆积多晶型是由构象稳定的分子在晶格中以不同的三维排列方式堆积形成的,主要以氢键、范德华力和静电作用等分子间作用力来维持其空间排列的稳定性。构象多晶型是由于晶体结构中分子共振结构的变化以及某些共价键的旋转、键长或键角的微小变化,导致晶格中的分子以不同的构象出现,从而形成构象多晶型。在结晶过程中,通常刚性分子易于形成堆积多晶型而柔性分子易于形成构象多晶型。假多晶型一般指溶剂化合物,若溶剂为水,又可称之为水合物。根据不同晶型的稳定性,可以将多晶型分为单变多晶型 (monotropic polymorphism) 和互变多晶型 (enantiotropic polymorphism)。单变多晶型是指在低于熔点的温度下,某一晶型比任何其他晶型的Gibbs自由能都小,是热力学上的最稳态。互变多晶型是指不同晶型之间在转变温度点处,其Gibbs自由能是相同的,当高于转变温度时,其中一种晶型稳定,低于转变温度时,另一种晶型稳定。在不同的温度下,介稳晶型会有向稳定晶型转变的趋势[18]。
2 过程分析技术/工具 (PAT)过程分析技术/工具 (Process Analysis Technology/Tools, PAT) 是指为达到保证最终产品质量的目的,通过实时的测量原料、过程中物料以及过程本身的关键质量指标和性能参数来实现过程开发、优化、设计、分析和调控的集成分析测量系统[3]。具体而言,PAT工具就是利用物质理化性质或者生物性质的不同,通过相应的连接软件进行数据分析,获得被监测 (或检测) 物质或过程的结构性质、量化信息及过程关键参数,进而达到优化和控制系统或过程的目的。常用的过程分析技术有衰减全反射傅里叶变换红外光谱仪 (Attenuated Total Reflection Fourier Transformed Infrared Spectroscopy, ATR-FTIR)、拉曼光谱仪 (Raman Spectroscopy)、聚光束反射测量仪 (Focused Beam Reflectance Measurement, FBEM),和粒子影像测量系统 (Particle Vision Measurement, PVM) 等。具体应用过程见图 1。
衰减全反射傅里叶变换红外光谱仪 (Attenuated Total Reflection Fourier Transformed Infrared Spectroscopy, ATR-FTIR),其工作原理是通过探头附近微区内样品表面的红外反射信号来获得样品表层成分的结构信息[20]。ATR-FTIR的一大优点就是它可以原位测定、实时跟踪,这对某些物质的物理或化学变化、动力学过程及机理的研究非常有利[21]。它具有以下特点:1) 无破坏性,对样品的大小、形状、含水量没有特殊要求;2) 可以实现原位测试、实时跟踪;3) 检测灵敏度高,测量区域小,检测点可为数微米;4) 能得到测量位置处物质分子的结构信息;5) 能进行红外光谱数据库检索以及化学官能团辅助分析,确定物质的种类和性质。傅里叶变换红外光谱仪没有色散元件,主要由光源 (硅碳棒、高压汞灯)、迈克尔逊干涉仪、试样插入装置、检测器 (DTGS或MCT)、计算机和记录仪等部分组成[22]。ATR-FTIR能对结晶过程中的物质浓度和过饱和度等进行高灵敏度的测量。
拉曼光谱仪 (Raman Spectroscopy, Raman),是利用光的散射原理,通过检测特征频率的分子振动来确定物质化学结构的一种原位测量手段。当单色激光光源照射样品时,由于光子与样品分子振动的相互作用,光子发生能级跃迁,使得散射光的激光波长与入射光的波长不同,发生了光的非弹性散射,由此而产生特征的Raman光谱。过程Raman可以同时监测液体和固体样品[23]。关于Raman工作原理和操作方式可参考文献[10, 24]。Raman光谱谱带的强度与待测物浓度的关系遵守比尔定律,因此,Raman光谱还可用于化合物定量分析。Raman光谱法无需特殊制样,可直接检测,避免了制样过程对晶型的影响[25]。在众多的在线监测分析技术中,Raman光谱被誉为是鉴定药物产品的晶型及监测药物的相变过程最合适、快捷、可靠的手段[26]。
聚光束反射测量仪 (Focused Beam Reflectance Measurement, FBEM),是一种基于探针监测的技术,其工作原理是通过一个快速旋转的激光在接触晶体前后光的反射时间的长短来判断被检测颗粒的尺寸并通过反射数量来判断晶体数量,其测量得到的一般为晶体的弦长分布 (CLD)。FBRM被广泛应用于溶液中颗粒数量和尺寸的原位表征。在结晶过程中,FBRM一般可以用于检测成核过程、粒子的溶解过程以及粒子尺寸和数量的测量等。FBRM在使用时无需对样品进行稀释或处理。因此,其已被成功应用于监测成核和表征介稳区宽度,还可被用于检测粒子生长、聚结、微观或介观尺度混合等[27]。
粒子影像测量系统 (Particle Vision Measurement, PVM),是一种基于探针的高分辨率原位视频显微镜,它可以实时监测结晶器内的某一固定区域,提供该区域内晶体或液滴的实时图像。PVM使用六个独立的激光源照射悬浮溶液,悬浮溶液散射回来的散射光被CCD接受,并产生图像,显示在配套软件上[28]。在结晶过程中,PVM一般被用于检测成核、固体粒子溶解以及粒子尺寸、数量和形状的测量,可以非常直观有效地反映出结晶体系内的真实情况。
3 PAT在多晶型研究中的应用 3.1 PAT在多晶型溶解度研究方面的应用由于多晶型内部分子排列不同,不同晶型很可能会有不同的表观溶解度和溶解速率[29]。对于多晶型系统热力学性质的充分了解,有助于优化和确定目标晶型结晶的最优过程以及最佳存储条件。对于互变多晶型来说,其确定转晶温度的最可靠和最直接的方法就是测量不同晶型的溶解度[30-31]。同时,由于过饱和度是结晶过程的主要推动力,因此,了解溶液的过饱和度,也可以帮助我们了解和优化结晶工艺[28]。通常可以通过静态法或动态法获得晶体的热力学性质 (主要是溶解度和介稳区),但是上述方法一般比较耗时耗力。同时,对于介稳晶型溶解度数据的获得而言,由于介稳晶型在溶解度测量过程中可能会发生转晶过程,从而导致测量得到的溶解度数据不是真正的介稳晶型的溶解度。因此,一般情况下,静态法是不合适的。而借助PAT工具 (比如FBRM),一方面可以方便快捷的获得相应晶型的热力学性质;另一方面,利用过程Raman等技术,还能实时监测过程中固相的结构,确保没有晶型转变的发生,从而保证测量数据的准确性和可靠性。
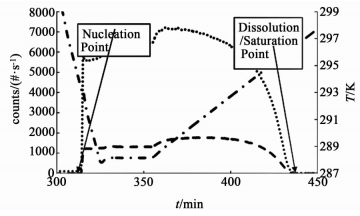
Barrett等[28]选用已知热力学数据的明矾水溶液作为研究对象,联用FBRM和PVM测定了明矾水溶液在一定条件下的溶解度、介稳区宽度和成核初始点,得到了与文献值几乎一致的结果:首先配制某一温度下的饱和溶液,然后以一定的速率匀速降温至FBRM开始检测到有固体出现的温度点,记录该温度点,同时使用PVM监测出现固体的形貌,由此得到该浓度下的介稳区宽度;之后,以一定的升温速率升温至FBRM检测不到固体的温度点,即为溶解度。Tully等[32]采用和Barrett相似的方法和原理,使用FBRM得到了苯甲酸 (Benzoic Acid) 和乙酰水杨酸 (Aspirin) 在七种不同的纯溶剂中的溶解度数据,实验值与文献值吻合良好,示意图见图 2。
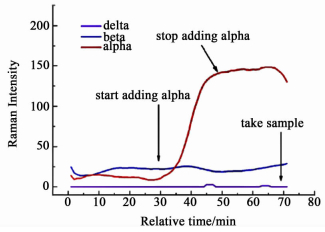
Su等[33]使用Raman辅助质量法,测定了D-甘露醇 (D-Mannitol) 介稳晶型α晶型和δ晶型的溶解度。实验中,他们采用过程Raman检测固相的结构,在Raman监测到介稳晶型的转晶点处即刻取样称量、干燥样品,从而得到2种介稳晶型的溶解度曲线。该方法克服了在测量介稳晶型溶解度的过程中发生介稳晶型向稳定晶型转变的缺点,其工作原理见图 3。
上述工作者[34]在他们的另一篇文献中使用Raman光谱技术并采用偏最小二乘法 (PLS) 成功定量分析了D-甘露醇 (D-Mannitol) 多晶型及其混晶水溶液的溶解度。而Hao等[23]直接通过Raman监测悬浮溶液在缓慢加热过程中相对Raman强度的变化,简单快速的得到甘露醇 (D-Mannitol) 在水溶液中的溶解度数据,并通过以不同降温速率冷却甘露醇澄清溶液结合相对Raman强度数据的方法,获得了不同降温速率及有无晶种加入等状态下的过饱和数据,发现不加晶种以及较快的降温速率可以得到较宽的介稳区。Feng等[35]利用ATR-FTIR测定了琥珀酸 (Succinic Acid) 稳定晶型α晶型在水中的溶解度,并利用ATR-FTIR建立了适当的溶解度校正曲线,得到了最终的溶解度数据和曲线。利用该方法得到的数据不仅准确度高,而且上述校正曲线和方法还可用于工业生产中。在研究对氨基苯甲酸 (p-Aminobenzoic Acid, PABA) 互变多晶型 (晶型α和晶型β) 转晶过程中,Hao等[36]联用多种在线分析仪器,使用与Barrett等相似的方法,利用FBRM首次测定并得到了PABA 2种晶型在乙醇中的溶解度,借助多项式拟合的溶解度曲线及合理的转晶实验,较为准确的确定了2种晶型稳定性的转变温度为13.8 ℃。
3.2 PAT在多晶型成核研究方面的应用晶核是过饱和溶液中新生成的微小晶体粒子,是晶体生长过程中必不可少的核心,成核速率是决定晶体产品粒度分布的首要动力学因素[37]。同时,在多晶型结晶过程中,开始成核时形成的晶型直接影响着最终产品的晶型、纯度和质量[33]。虽然通常可以利用肉眼观察法和浊度法等方法来检测晶体成核的开始,但是这些方法都存在一定的局限性和滞后性[28]。尤其对于具有多晶型现象的晶体成核过程而言,上述方法并不能及时准确的判断出成核得到的是哪种晶型的产品。
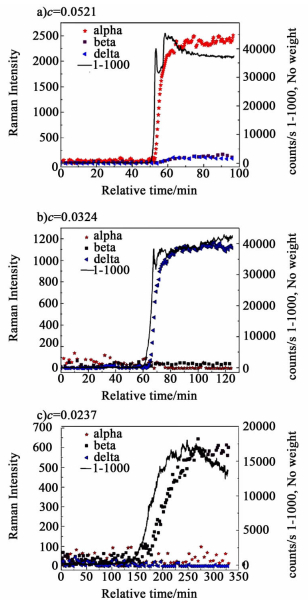
Mohd等[38]联用FBRM和UV/vis研究了不同温度下磺胺噻唑 (Sulfathiazole) 多晶型的成核过程。他们使用FBRM检测成核过程中溶液中总粒子数的变化;使用UV/vis检测成核过程中溶液浓度的变化,发现不同晶型在成核时,虽然成核温度不同,但是趋势几乎一样,即总粒子数急剧增多 (FBRM急剧上升),溶液浓度急剧下降 (UV/vis吸光度急剧下降)。Du等[39]使用Raman研究了不同溶剂对盐酸普拉格雷 (Prasugrel Hydrochloride) 多晶型成核和转晶过程的影响,发现影响盐酸普拉格雷晶型Ⅰ和晶型Ⅱ非均相成核的因素不仅仅是因为溶解度的不同,更重要的是由于溶剂-溶质间的不同作用:当溶剂-溶质间的范德华力占主导地位时,利于晶型Ⅰ成核;反之,当溶质-溶剂间的氢键作用处于主导地位时,利于晶型Ⅱ的成核和生长。Barrett等[40]联用Raman、ATR-FTIR和FBRM研究了吡乙酰胺 (Piracetam) 在间歇结晶过程中的多晶型结晶现象。他们利用Raman检测晶体晶型,ATR-FTIR检测溶液浓度、过饱和度及介稳区宽度,利用FBRM确定出晶点,其研究发现:在较快的降温速率下,介稳区比较宽,多晶型成核受动力学控制且成核能垒较低的介稳晶型FⅡ更易结晶析出;在较慢的降温速率下,介稳区相对较窄,结晶过程受热力学控制,稳定晶型FⅢ更易结晶析出;在非常高的过饱和度下,稳定晶型FⅢ的晶种也可以诱导介稳晶型FⅡ的成核。Jeroen等[41]以D-甘露醇为研究对象,使用Raman检测D-甘露醇溶液在不同过饱和程度下的成核及转晶过程,发现当初溶液始过饱和度S0, α≥1.27时,只有介稳晶型α晶型成核;当初始溶液过饱和度S0, α≤1.26时,稳定晶型γ晶型直接成核。同样,Su等[33]也以D-甘露醇为研究对象,联用Raman和FBRM 2种在线监测仪器,研究了D-甘露醇在水溶液中的自发成核过程并测定了成核的诱导期。其将D-甘露醇的饱和溶液快速降温至终温,同时在降温过程中使用FBRM监测成核和测定诱导期,并使用Raman确定成核晶型。其研究发现,在较低的初始浓度时,利于稳定晶型β晶型的自发成核;在较高的初始浓度时,利于介稳晶型α晶型的自发成核;在中等初始浓度时,利于介稳晶型δ晶型的自发成核。其具体结果可见图 4[33]。(注:对于不同的文献,D-甘露醇的3种晶型的命名不同[41]。)
对于多晶型而言,在合适的条件下,介稳晶型会向稳定晶型转变。其转变机理可以归纳为固-固相转晶和溶剂介导转晶两种。影响多晶型转变的因素也有很多,如温度、湿度、溶剂和pH值等。因为PAT工具可以进行原位检测,可以实时反映出体系中固相和液相组成以及浓度的变化,因此在多晶型转晶研究方面的应用十分广泛。
作为一种最有效的分析工具,Raman可以定性和定量的分析结晶过程中出现的不同晶型,因此众多研究者[31, 42]都依赖于使用Raman研究多晶型转晶过程。Caillet等[26]于2006年使用Raman研究了15 ℃恒温状态下,柠檬酸 (Citric Acid) 无水物 (亚稳晶型) 向一水物 (稳定晶型) 转晶过程。他们发现,溶液中固体粒子的浓度对转晶速率并无显著地影响。随后,他们[43]又于2008年再次使用Raman定量研究了柠檬酸在15 ℃水溶液中的溶剂介导转晶过程并建立了双校准模型来关联悬浮液中的固相组成以及溶液浓度。研究中,他们选取15 ℃下固相组成及总固体中所含无水物的含量为主要检测指标,虽然并未找到明确的转晶机理,但是他们利用Raman建立的转晶双校准模型可以用于指导工业生产。在以D-甘露醇为转晶研究对象的试验中 (注:对于不同的文献,D-甘露醇的3种晶型的命名不同[41]),Jeroen等[41]利用Raman监测转晶过程发现在溶剂介导转晶过程中,介稳晶型β晶型可以直接转变为稳定的γ晶型,而介稳晶型α晶型要先转变为介稳晶型β,然后β晶型再快速的转变为稳定晶型γ。Hao等[23]使用Raman监测了甘露醇在水溶液中的转晶过程,将作为晶种的亚稳晶型α晶型加入到稳定晶型β晶型的饱和溶液中,同时使用Raman监测不同物质的相对Raman强度,成功的证明了亚稳晶型α晶型可以向稳定晶型β晶型转变。Su等[18]联用Raman、FBRM和PVM研究了温度和溶剂因素对甘露醇介稳晶型α晶型向稳定晶型β转变过程的影响。Yang等[44]联用Raman和FTIR研究了操作温度、NaCl含量、晶种粒度和搅拌速率对甘氨酸α晶型向γ晶型转变速率的影响。Simone等[1, 45-46]联用Raman、ATR-FTIR、FBRM和PVM研究了邻氨基苯甲酸 (OABA) 晶型Ⅱ在冷却结晶过程中向晶型Ⅰ转化的过程;同年及次年,又联用Raman、(ATR-) UV/vis、NIR、Mid-IR、(PVM) 和FBRM监测了OABA多晶型转晶过程。Shi等[47]联用FBRM、PVM和FTIR,研究了莫昔克丁 (Moxidectin) 乙醇化合物在乙醇-水的混合溶液中向晶型Ⅰ转变的过程并研究了操作温度及混合溶剂中水含量对转晶的影响。Christelle等[48]联用Raman、FBRM和ATR-FTIR研究了甲醇溶液中乙吡醋胺 (Etiracetam) 的转变机理。Pataki等[49]利用在线Raman研究了卡维地洛 (Carvedilol) 热力学上较稳定的晶型Ⅰ与动力学上优先结晶的晶型Ⅱ在乙酸乙酯溶液中的转变过程,并将测得的Raman数据反馈至控制系统,实现控制系统对多晶型转化的控制。Barrett等[40]联用Raman、ATR-FTIR和FBRM研究了在降温结晶过程中吡乙酰胺 (Piracetam) 在乙醇中的多晶型转化机理,指出在低过饱和度时,利于稳定晶型FⅢ的成核和生长;在高过饱和度时,利于介稳晶型FⅡ的优先成核;在更高的过饱和度下,作为晶种的晶型FⅢ还会诱导介稳晶型FⅡ的成核,但在足够长的时间后,最终都会转化为稳定晶型FⅢ。
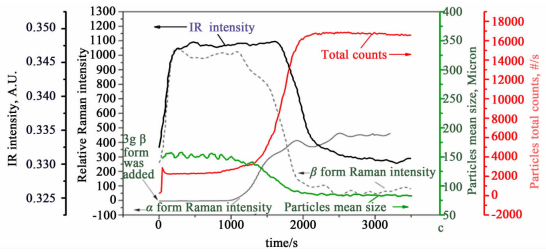
Hao等[36]在研究PABA互变多晶型 (晶型α和β) 转晶过程中,联用了多种PAT工具。他们利用Raman和ATR-FTIR分别监测固相和液相浓度及晶型,利用FBRM并辅以PVM来监测粒子尺寸及形貌的变化。通过上述方法,准确快速的获得了不同晶型在乙醇中的溶解度数据并确定了溶剂介导转晶的机理,发现β晶型向α晶型转变时,β晶型的溶解和α晶型的成核占主导地位;而α晶型向β晶型转变时,α晶型的溶解和β晶型的生长占主导地位。在研究β晶型向α晶型转变时,固定试验温度为35 ℃(此时α晶型是稳定晶型),将一定量的β晶型加入到饱和的α晶型乙醇溶液中后,ATR-FTIR检测到β晶型的含量急剧增大、FBRM检测到体系中总粒子数也呈现快速上升的趋势、Raman可以检测到β晶型但检测不到α晶型。这是因为在溶剂介导转晶中,存在介稳晶型的溶解以及稳定晶型的成核和生长过程,当α晶型的过饱和度未累积到一定程度时,不会形成α晶型,因而Raman检测不到。15 min后,FBRM检测到体系的总粒子数增多,而粒子的平均弦长降低,意味着α晶型开始成核和生长了,同时Raman和ATR-FTIR出现相应的变化趋势,PVM也监测到了过程中固体形貌的变化。α晶型向β晶型的转变实验在0 ℃进行,变化趋势与β晶型向α晶型转变几乎一致。过程中PAT工具监测到的数据结果见图 5[36]。
PAT技术在过程分析和控制方面应用十分广泛。本论文特别总结和讨论了PAT技术在功能晶体多晶型研究方面的应用。详细介绍的ATR-FTIR、Raman、FBRM和PVM这4种实验室常用的过程分析技术在多晶型溶解度的测量、成核以及转晶方面的应用,可以看到,PAT技术的应用不仅有助于快速准确的得到结晶过程的热力学和动力学等基础数据,而且还有助于进一步了解结晶过程的机理,从而为开发功能晶体材料不同晶型的优化结晶工艺提供了强有力的辅助工具。上述工具的成功应用,将有助于科研人员最终实现功能晶体产品质量源于设计 (QBD) 的目标。
5 致谢感谢科技部国家重点研发计划项目 (2016YFB0600504) 对本研究的资助。
| [1] | Simone E, Saleemi A N, Nagy Z K. Application of quantitative Raman spectroscopy for the monitoring of polymorphic transformation in crystallization processes using a good calibration practice procedure[J]. Chemical Engineering Research and Design, 2014, 92(4) : 594–611. DOI: 10.1016/j.cherd.2013.11.004 |
| [2] | Joseph S A. Bioprocess control:Advances and challenges[J]. Computers and Chemical Engineering, 2006, 30(10/12) : 1464–1475. |
| [3] | Simone E, Zhang W, Nagy Z K. Analysis of the crystallization process of a biopharmaceutical compound in the presence of impurities using process analytical technology (PAT) tools[J]. Journal of Chemical Technology and Biotechnology, 2016, 91(5) : 1461–1470. DOI: 10.1002/jctb.2016.91.issue-5 |
| [4] | Lee M J, Chun N H, Kim M J, et al. In situ monitoring of antisolventcocrystallization by combining near-Infrared and Raman spectroscopies[J]. Crystal Growth & Design, 2015, 15(9) : 4385–4393. |
| [5] | Nagy Z K, Fevotte G, Kramer H, et al. Recent advances in the monitoring modelling and control of crystallization systems[J]. Chemical Engineering Research and Design, 2013, 91(10) : 1903–1922. DOI: 10.1016/j.cherd.2013.07.018 |
| [6] | Duffy D, Cremin N, Napier M, et al. In situ monitoring, control and optimization of a liquid-liquid phase separation crystallization[J]. Chemical Engineering Science, 2012, 77(1) : 112–121. |
| [7] | Ulrich J, Frohberg P. Problems, potentials and future of industrial crystallization[J]. Frontiers of Chemical Science and Engineering, 2013, 7(1) : 1–8. DOI: 10.1007/s11705-013-1304-y |
| [8] |
王哲清. 药物多晶型与有效性[J].
中国医药工业杂志, 2005, 36(7) : 442–446.
Wang Zheqing. Polymorphism and drug availability[J]. Chinese Journal of Pharmaceuticals, 2005, 36(7) : 442–446. |
| [9] | Aulakh D, Varghese J R, Wriedt M. The importance of polymorphism in metal-organic framework studies[J]. Inorganic Chemistry, 2015, 54(17) : 8679–8684. DOI: 10.1021/acs.inorgchem.5b01311 |
| [10] | Li Y, Church J S. Raman spectroscopy in the analysis of food and pharmaceutical nanomaterials[J]. Journal of Food and Drug Analysis, 2014, 22(1) : 29–48. DOI: 10.1016/j.jfda.2014.01.003 |
| [11] | In J, Yoon I, Seo K, et al. Polymorph-Tuned synthesis of alpha-and beta-Bi2O3 nanowires and determination of their growth direction from polarized Raman single nanowire microscopy[J]. Chemistry-A European Journal, 2011, 17(4) : 1304–1309. DOI: 10.1002/chem.v17.4 |
| [12] | Chieng N, Rades T, Asltonen J. An overview of recent studies on the analysis of pharmaceutical polymorphs[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 55(4) : 618–644. DOI: 10.1016/j.jpba.2010.12.020 |
| [13] |
冒莉, 郑启泰, 吕杨. 固体药物多晶型的研究进展[J].
天然药物研究与开发, 2005, 17(3) : 371–375.
Mao Li, Zheng Qitai, Lu Yang. Progress on the study of solid drug polymorphism[J]. Natural Product Research and Development, 2005, 17(3) : 371–375. |
| [14] | Threlfall T L. Analysis of organic polymorphs[J]. A review J Analyst, 1995, 120(10) : 2435–2460. DOI: 10.1039/an9952002435 |
| [15] | John H, Walter M. Pharmaceutical applications of polymorphism[J]. Journal of Pharmaceutical Science, 1969, 58(8) : 911–929. DOI: 10.1002/jps.2600580802 |
| [16] | Masao H, Setsuo K, Ryoichi K, et al. The monoclinic form of p-hydroxyacetanilide[J]. ActaCrystallographica, B32, 1976 : 1283–1285. |
| [17] |
唐万军, 陈栋华, 张健, 等. 热分析技术在药物研究中的应用[J].
化学研究与应用, 2001, 13(1) : 16–20.
Tang Wanjun, Chen Donghua, Zhang Jian, et al. Application of thermal analysis in pharmaceutical research[J]. Chemical Research and Application, 2001, 13(1) : 16–20. |
| [18] | Su W, Hao H, Barrett M, et al. The impact of operating parameters on the polymorphic transformation of D-mannitol characterized in situ with Raman spectroscopy, FBRM, and PVM[J]. Organic Process Research & Development, 2010, 14(6) : 1432–1437. |
| [19] | Powell K A, Croker D M, Rielly C D, et al. PAT-based design of agrochemical co-crystallization processes:A case-study for the selective crystallization of 1:1 and 3:2 co-crystals of p-oluenesulfonamide/triphenylphosphineoxide[J]. Chemical Engineering Science, 2016, 152 : 95–108. DOI: 10.1016/j.ces.2016.06.005 |
| [20] | 薛奇. 高分子结构研究中的光谱方法[M]. 北京: 高等教育出版社, 1995 |
| [21] |
刘敏娜, 王桂清, 卢其斌. 红外光谱技术的进展及其应用[J].
精细化工中间体, 2001, 6(31) : 9–12.
Liu Minna, Wang Guiqing, Lu Qibing. The application and technologies of fourier transform infrared spectroscopy (FTIR)[J]. Fine Chemical Intermediates, 2001, 6(31) : 9–12. |
| [22] |
黄红英, 尹齐和. 傅里叶变换衰减全反射红外光谱法 (ATR-FTIR) 的原理与应用进展[J].
中山大学研究生学刊:自然科学·医学版, 2011, 32(1) : 20–31.
Huang Hongying, Yin Qihe. Fundamentals and application advances in attenuated total internal reflectance Fourier transform infrared spectroscopy (ATR-FTIR)[J]. Journal of the Graduates Sun Yat-Sen University:Natural Sciences Medicine, 2011, 32(1) : 20–31. |
| [23] | Hao H, Su W, Barrett M, et al. A calibration-free application of Raman spectroscopy to the monitoring of Mannitol crystallization and its polymorphic transformation[J]. Organic Process Research & Development, 2010, 14(5) : 1209–1214. |
| [24] | 杨序纲, 吴琪琳. 拉曼光谱的分析与应用[M]. 北京: 国防工业出版社, 2008 |
| [25] |
叶晓霞, 刘茜, 耿志旺, 等. 拉曼光谱法检测拉米夫定晶型Ⅰ[J].
中国医药工业杂志, 2013, 44(1) : 60–63.
Ye Xiaoxia, Liu Qian, Geng Zhiwang, et al. Determination of Lamivudine monomorphic form Ⅰ by Raman spectroscopy[J]. Chinese Journal of Pharmaceuticals, 2013, 44(1) : 60–63. |
| [26] | Caillet A, Puel F, Fevotte G. In-line monitoring of partial and overall solid concentration during solvent-mediated phase transition using Raman spectroscopy[J]. International Journal of Pharmaceutics, 2006, 307(2) : 201–208. DOI: 10.1016/j.ijpharm.2005.10.009 |
| [27] | Barrett P, Smith B, Worlitschek J, et al. A review of the use of process analytical technology for the understanding and optimization of production batch crystallization processes[J]. Organic Process Research & Development, 2005, 9(3) : 348–355. |
| [28] | Barrett P, Glennon B. Characterizing the metastable zone width and solubility curve using lasentec FBRM and PVM[J]. Chemical Engineering Research & Design, 2002, 80(A7) : 799–805. |
| [29] |
张鹏, 杨春华, 刘静涵, 等. 药物多晶型研究进展[J].
海峡药学, 2013, 25(12) : 5–8.
Zhang Peng, Yang Chunhua, Liu Jinghan, et al. Advances in the studies on the drug polymoerphs[J]. Strait Pharmaceutical Journal, 2013, 25(12) : 5–8. |
| [30] | Sun Z, Hao H, Xie C, et al. Thermodynamic properties of form A and form B of florfenicol[J]. Industrial & Engineering Chemistry Research, 2014, 53(34) : 13506–13512. |
| [31] | Yang L, Yin Q, Hou B, et al. Solubility and thermodynamic stability of the enantiotropic polymorphs of 2, 3, 5-trimethyl-1, 4-diacetoxybenzene[J]. Industrial & Engineering Chemistry Research, 2013, 52(7) : 2477–2485. |
| [32] | Tully G, Hou G, Glennon B. Solubility of benzoic acid and aspirin in pure solvents using focused beam reflective measurement[J]. Journal of Chemical & Engineering Data, 2016, 61(1) : 594–601. |
| [33] | Su W, Hao H, Glennon B, et al. Spontaneous polymorphic nucleation of d-mannitol in aqueous solution monitored with Ramanspectroscopy and FBRM[J]. Crystal Growth & Design, 2013, 13(12) : 5179–5187. |
| [34] | Su W, Li C, Hao H, et al. Monitoring the liquid phase concentration by Raman spectroscopy in a polymorphic system[J]. Journal of Raman Spectroscopy, 2015, 46(11) : 1150–1156. DOI: 10.1002/jrs.4745 |
| [35] | Feng L, Berglund K A. ATR-FTIR for determining optimal cooling curves for batch crystallization of succinic acid[J]. Crystal Growth & Design, 2002, 2(5) : 449–452. |
| [36] | Hong H, Barrett M, Hu Y, et al. The use of in situ tools to monitor the enantiotropic transformation of p-aminobenzoic acid polymorphs[J]. Organic Process Research & Development, 2012, 16(1) : 35–41. |
| [37] | 丁绪淮, 谈遒. 工业结晶[M]. 北京: 化学工业出版社, 1985 |
| [38] | Abu B, Mohd R, Nagy Z K, et al. Investigation of the riddle of sulfathiazole polymorphism[J]. International Journal of Pharmaceutics, 2011, 414(1/2) : 86–103. |
| [39] | Du W, Yin Q, Gong J, et al. Effects of solvent on polymorph formation and nucleation of prasugrel hydrochloride[J]. Crystal Growth & Design, 2014, 14(9) : 4519–4525. |
| [40] | Barrett M, Hong H, Maher A, et al. In situ monitoring of supersaturation and polymorphic form of piracetam during batch cooling crystallization[J]. Organic Process Research & Development, 2011, 15(3) : 681–687. |
| [41] | Jeroen C, Piran K, Marco M. Precipitation and transformation of the three polymorphs of d-mannitol[J]. Industrial & Engineering Chemistry Research, 2010, 49(12) : 5854–5862. |
| [42] | Wang G, Ma Y, Wang Y, et al. Investigation of solution-mediated phase transformation of cefuroxime acid to its acetonitrile solvate[J]. Organic Process Research & Development, 2015, 19(12) : 1820–1825. |
| [43] | Caillet A, Puel F, Fevotte G. Quantitative in situ monitoring of citric acid phase transition in water using Raman spectroscopy[J]. Chemical Engineering & Processing Process Intensification, 2008, 47(3) : 377–382. |
| [44] | Yang X, Lu J, Wang X, et al. In situ monitoring of the solution-mediated polymorphic transformation of glycine:Characterization of the polymorphs and observation of the transformation rate using Raman spectroscopy and microscopy[J]. Journal of Raman Spectroscopy, 2008, 39(10) : 1433–1439. DOI: 10.1002/jrs.v39:10 |
| [45] | Simone E, Saleemi A N, Nagy Z K. Raman, UV, NIR, and Mid-IR spectroscopy with focused beam reflectance measurement in monitoring polymorphic transformations[J]. Chemical Engineering & Technology, 2014, 37(8) : 1305–1313. |
| [46] | Simone E, Saleemi A N, Nagy Z K. In situ monitoring of polymorphic transformations using a composite sensor array of Raman, NIR, and ATR-UV/vis spectroscopy, FBRM, and PVM for an intelligent decision support system[J]. Organic Process Research & Development, 2015, 19(1) : 167–177. |
| [47] | Shi Z, Wang Z, Zhang T, et al. The in situ monitoring of the transformation of moxidectin ethanol solvate to form Ⅰ in an ethanol-water mixture[J]. RSC Advances, 2015, 5(119) : 98050–98056. DOI: 10.1039/C5RA13935J |
| [48] | Christelle H, Benoît H, Sélim D, et al. Use of in situ Raman, FBRM, and ATR-FTIR probes for the understanding of the solvent-mediated polymorphic transformation of Ⅱ-Ⅰ etiracetam in methanol[J]. Organic Process Research & Development, 2012, 16(1) : 49–56. |
| [49] | Pataki H, Csontos I, Nagy Z K, et al. Implementation of Raman signal feedback to perform controlled crystallization of carvedilol[J]. Organic Process Research & Development, 2013, 17(3) : 493–499. |
 2017, Vol. 34
2017, Vol. 34