草酸(Oxalic acid, OA)是一种重要的有机化工原料,广泛的应用于医药、纺织、稀有金属提炼、净化金属设备、催化剂制备等工业[1-5]。草酸的主要生产方法有:甲酸钠法、碳水化合物氧化法等[6-7]。传统的生产工艺存在着成本高、污染严重等缺点。近年来,随着C1化学的发展,由一氧化碳偶联法制备草酸新工艺受到了人们的广泛关注。该工艺操作安全、对环境无污染,具有广阔的发展前景[8-11]。因此,开展有关草酸酯水解研究有重要的意义。
目前,关于以制备草酸为目的的草酸酯非均相催化水解方面的研究,尚无文献报道。草酸二乙酯(DEO)均相催化水解研究[12-13]结果显示,在无外加催化剂条件下,草酸二乙酯水解速率缓慢;当选择硫酸、氢氧化钠为催化剂时,虽然能提高水解反应速率,但由此也带来了腐蚀性和产品分离等问题。为了提高草酸二乙酯的水解速率,同时避免使用均相催化剂所带来的问题,选择Amberlyst-15离子交换树脂为催化剂,对草酸二乙酯的水解过程进行了研究。
本论文主要对以离子交换树脂为催化剂的草酸二乙酯的水解动力学进行研究。考察了催化剂用量、水酯比(RW/DEO)及温度对反应的影响。提出了以Amberlyst-15为催化剂的草酸二乙酯水解动力学模型,研究结果可作为水解过程放大模拟的数据基础。
1 试验部分 1.1 仪器与试剂超级恒温水浴;数显无极恒速搅拌器;Agilent 1100型高效液相色谱仪;Agilent 6890GC-5975N气/质联用仪,电子天平。
草酸二乙酯(分析纯,质量分数大于99.5%),乙腈(色谱纯/分析纯),磷酸(分析纯),无水乙醇(分析纯,质量分数大于99.7%),天津市光复精细化工研究所;草酸(基准试剂),天津市科密欧化学试剂有限公司;去离子水;Amberlyst-15离子交换树脂,上海罗门哈斯化工有限公司。树脂的相关性质如表 1所示。
| physical properties | Amberlyst-15 |
| exchange capacity/(mmol·g-1) | 4.75 |
| w(water) | 52%~57% |
| surface area/(m2·g-1) | 53 |
| pore size/nm | 30 |
| particle size/mm | 0. 60~0. 85 |
| maximum operating temp/K | 393.15 |
实验在装有冷凝器的250 mL四口烧瓶中进行,反应温度控制精度为±0.5 K。实验时,先将准确称量的去离子水、无水乙醇、离子交换树脂加入烧瓶,置于恒温水浴中加热,开启搅拌器并将转速调至400 r/min。当达到指定温度时,再将一定量的并已预热到相同温度的草酸二乙酯迅速加入到烧瓶中,开始记录反应时间。反应过程中定时取样,分析反应物系组成变化。
1.3 分析方法分析方法采用高效液相色谱法。色谱型号:Agilent 1100型(安捷伦科技有限公司);色谱柱:ZORBAX SB-C18;检测器:紫外(UV)检测器。流动相为乙腈和磷酸缓冲液(pH=2.4±0.1),乙腈与磷酸缓冲液的流量比为3:7,流速为1.0 mL/min,紫外检测波长为220 nm。对草酸和草酸二乙酯的标准样品进行检测,可以确定两者的保留时间。根据标准曲线可确定草酸和草酸二乙酯的浓度,而其他组分的浓度通过化学计量关系计算得到。
2 结果与讨论 2.1 草酸二乙酯水解的反应历程早期研究中将草酸二乙酯水解反应按单一反应处理,但根据目前高效液相色谱法分析结果以及进一步的质谱分析,确定草酸二乙酯水解产物为乙醇(EtOH)、草酸单乙酯(MEO)和草酸。即草酸二乙酯的水解反应为复杂反应。
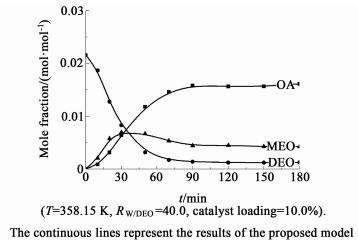
图 1所示为水解过程中各主要组分浓度随时间的变化曲线。
|
| 图 1 不同反应时刻各物质的摩尔分数 Figure 1 Mole fractions of the main components versus time |
| |
在反应的初始阶段(反应的前10 min)草酸单乙酯的浓度迅速增加,而此时体系中草酸的浓度较低。当反应进行到10~30 min,草酸的浓度开始明显增加,与此同时草酸单乙酯的浓度也有所增加。当反应进行到30 min以后,草酸单乙酯的浓度达到顶峰后开始逐渐下降,而草酸的浓度继续增加,直到反应达到平衡趋于一个定值。
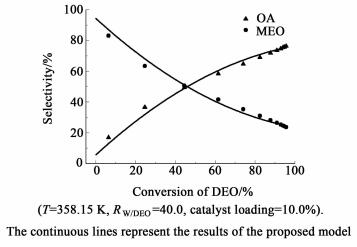
图 2所示为草酸单乙酯和草酸的选择性与草酸二乙酯转化率的变化曲线。
|
| 图 2 产物的选择性对DEO的转化率 Figure 2 Plot of selectivity versus DEO conversion |
| |
图 2中可以看出在反应的初始阶段,当草酸二乙酯转化率相同时,草酸单乙酯的选择性要远远大于草酸的选择性,且草酸单乙酯在y轴方向具有一个较大的截距,而草酸在y轴的截距近似为0,根据Klein等[14-15]提出的Delplot方法推断,草酸单乙酯来自于草酸二乙酯,而草酸来自于草酸单乙酯。即草酸二乙酯的水解反应为连串反应。
草酸二乙酯水解反应方程式可表示为:
| $ {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OOCCOO}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \leftrightarrow {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OOCCOOH + }}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}} $ | (1) |
| $ {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OOCCOOH + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \leftrightarrow {\rm{HOOCCOOH + }}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}} $ | (2) |
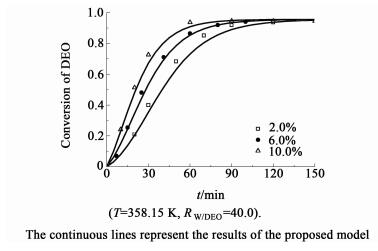
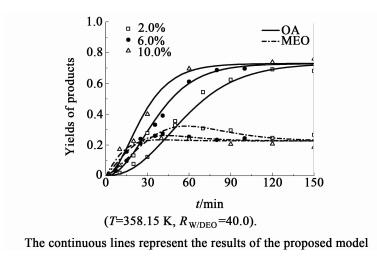
在相同的温度和水酯比条件下,考察了催化剂用量(2.0%~10.0%)对草酸二乙酯水解过程的影响。如图 3和图 4所示,为不同催化剂用量条件下,草酸二乙酯转化率和产物收率随时间的变化曲线。
|
| 图 3 催化剂用量对转化率的影响 Figure 3 Effects of catalyst loading on the conversion of DEO |
| |
|
| 图 4 催化剂用量对收率的影响 Figure 4 Effects of catalyst loading on the yields of products |
| |
如图 3和图 4所示,随着催化剂用量的增加,反应达到平衡的时间明显缩短,催化剂Amberlyst-15的加入能明显提高水解速率。与草酸二乙酯自催化水解[12]相比,达到平衡的时间由180 min缩短到100 min左右,但反应的平衡没有改变。研究发现,反应到40 min时,当催化剂用量从2.0%提高到6.0%时,草酸二乙酯的转化率由40%增加到60%,而草酸的收率由20%增加到40%。如图 5所示,反应的初始速率(r0)与催化剂用量呈正比,即催化剂用量越多,单位体积内反应的活性位越多。
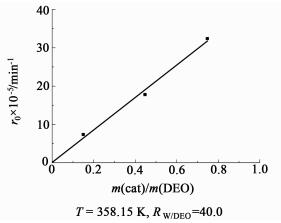
|
| 图 5 催化剂用量对初始速率的影响 Figure 5 The effect of catalyst loading on the initial rate (r0) |
| |
在相同温度和催化剂用量条件下,考察了不同的水酯比(15.0~60.0)对草酸二乙酯的转化率和产物收率的影响。
如图 6和图 7所示,草酸二乙酯的转化率和草酸的收率随着水酯比的增加而增加,而草酸单乙酯的收率随之减小,即水酯比的增加有利于草酸的生成。这主要是因为随着水酯比的增加,体系中存在过量的水有利于草酸二乙酯水解的进行,且随着反应的进行即乙醇的产生,草酸二乙酯、水及树脂之间的互溶程度会得到提高,单位体积内水、酯分子间的碰撞几率会相应的增加,从而增大了草酸二乙酯水解程度。

|
| 图 6 水酯比对转化率的影响 Figure 6 Effects of RW/DEO on the conversion of DEO |
| |
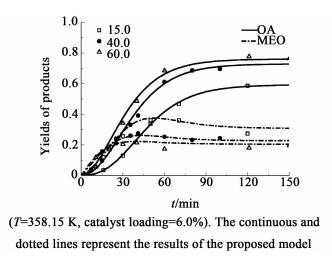
|
| 图 7 水酯比对收率的影响 Figure 7 Effects of RW/DEO on the yields of products |
| |
反应温度是影响化学反应速率的重要因素之一,因此在相同水酯比和催化剂用量条件下,考察了温度(338.15~358.15 K)对草酸二乙酯水解过程的影响,结果分别如图 8和图 9所示。

|
| 图 8 温度对转化率的影响 Figure 8 Effects of temperature on the conversion of DEO |
| |
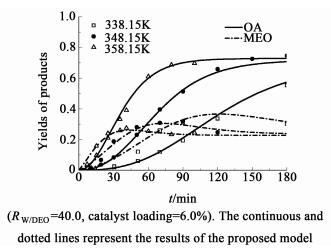
|
| 图 9 温度对收率的影响 Figure 9 Effects of temperature on the yields of products |
| |
如图 8和图 9所示,草酸二乙酯的转化率和草酸的收率随着温度的升高而明显增大,说明高温有利于水解的进行。并且在所考察范围内,温度对反应平衡转化率的影响并不显著。这一现象与Sanz等[16]研究乳酸甲酯水解的研究中的发现类似。
3 反应动力学 3.1 模型方程由于酯类水解反应是在过量的极性溶剂水中进行的,离子交换树脂完全膨胀,这使得活性磺酸基团完全解离,且溶剂化质子在聚合物相中分布均匀。因此,参与反应的化学物质可以很容易地渗入到催化剂的内部,并与溶剂化质子接触发生反应。因此,这里我们采用拟均相模型来简化动力学形式。则动力学方程可以表示为如下形式:
| $ {r_{{\rm{DEO}}}} = - \frac{{{\rm{d}}{y_{{\rm{DEO}}}}}}{{{\rm{d}}t}} = {f_1}\left( {{y_{{\rm{DEO}}}}{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} - \frac{{{y_{{\rm{MEO}}}}{y_{{\rm{EtOH}}}}}}{{{K_{{\rm{E1}}}}}}} \right) $ | (3) |
| $ {r_{{\rm{OA}}}} = \frac{{{\rm{d}}{y_{{\rm{OA}}}}}}{{{\rm{d}}t}} = {f_2}\left( {{y_{{\rm{MEO}}}}{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} - \frac{{{y_{{\rm{OA}}}}{y_{{\rm{EtOH}}}}}}{{{K_{{\rm{E2}}}}}}} \right) $ | (4) |
基于甲酸酯树脂催化水解[18]的研究的发现:反应产物(甲酸)的催化作用和离子交换树脂的催化作用在甲酸酯水解过程中并存,后者反应起主导作用,但水解产生的甲酸的催化作用也不能完全忽略。反应动力学模型中树脂的催化作用、产物甲酸的催化作用和水的引发作用,可以用其加和的形式表示。即:反应速率函数f=k+kautoCc+k′。
如图 5所示,水解初速率与树脂用量关系线基本通过原点,说明树脂催化条件下水的引发作用可以忽略。根据水解初速率与催化剂用量呈正比,结合草酸二甲酯自催化水解这一连串水解过程中[17]草酸的催化作用与其浓度的1/2次方呈正比这一结果,我们以式(5)和(6)所示形式表示草酸二乙酯水解动力学。
| $ \begin{array}{l} {r_{{\rm{DEO}}}} = - \frac{{{\rm{d}}{y_{{\rm{DEO}}}}}}{{{\rm{d}}t}} = \left( {{k_{0,1}}\frac{{{m_{{\rm{cat}}}}}}{{{m_{{\rm{DEO}}}}}} + {k_1}\sqrt {\frac{{{y_{{\rm{OA}}}}}}{{{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}} } \right)\\ \;\;\;\;\;\;{y_{{\rm{DEO}}}}{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} - \frac{{{y_{{\rm{MEO}}}}{y_{{\rm{EtOH}}}}}}{{{K_{{\rm{E1}}}}}} \end{array} $ | (5) |
| $ \begin{array}{l} {r_{{\rm{OA}}}} = \frac{{{\rm{d}}{y_{{\rm{OA}}}}}}{{{\rm{d}}t}} = \left( {{k_{0,2}}\frac{{{m_{{\rm{cat}}}}}}{{{m_{{\rm{DEO}}}}}} + {k_2}\sqrt {\frac{{{y_{{\rm{OA}}}}}}{{{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}} } \right)\\ \;\;\;\;\;\;\left( {{y_{{\rm{MEO}}}}{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} - \frac{{{y_{{\rm{OA}}}}{y_{{\rm{EtOH}}}}}}{{{K_{{\rm{E2}}}}}}} \right) \end{array} $ | (6) |
式(6)中,r为水解速率,min-1;k为反应速率常数,min-1;KE为反应平衡常数;mi为反应体系中i组分的质量(i=cat、DEO,分别表示催化剂和草酸二乙酯);yi为反应体系中i组分的摩尔分数(i=DEO、MEO、EtOH、H2O,分别表示草酸二乙酯、草酸单乙酯、乙醇、水)。
3.2 模型参数的估算根据草酸二乙酯水解的反应方程式(1)和(2),可得到相应反应的平衡常数的表达式:
| $ {K_{{\rm{E1}}}} = {\left( {\frac{{{y_{{\rm{MEO}}}}{y_{{\rm{EtOH}}}}}}{{{y_{{\rm{DEO}}}}{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}} \right)_{{\rm{eq}}}} $ | (7) |
| $ {K_{{\rm{E2}}}} = {\left( {\frac{{{y_{{\rm{OA}}}}{y_{{\rm{EtOH}}}}}}{{{y_{{\rm{MEO}}}}{y_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}} \right)_{{\rm{eq}}}} $ | (8) |
方程中各物质的摩尔分数为反应达到平衡时体系的组成,当动力学实验反应足够时间后,反应达到平衡,测量此时体系中各物质的组成。平衡常数KE仅为温度的函数,将得到的数据进行拟合可以得到反应平衡常数与温度的关系如下:
| $ {\rm{ln}}{K_{{\rm{E1}}}} = \frac{{ - 595.89}}{T} + 1.5169 $ | (9) |
| $ {\rm{ln}}{K_{{\rm{E2}}}} = \frac{{ - 763.10}}{T} + 1.5040 $ | (10) |
根据范特霍夫方程,可以计算得到草酸二乙酯水解各反应的标准反应焓分别为4.95 kJ/mol、6.34 kJ/mol。此结果表明,草酸二乙酯的两步水解反应均为可逆吸热反应。其相应的KE1和KE2与1/T的关系如图 10所示。
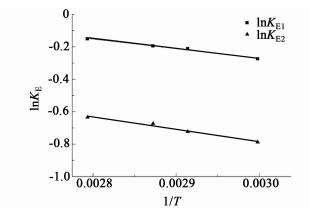
|
| 图 10 平衡常数K/E与1/T的关系 Figure 10 The relationship between KE and 1/T |
| |
对实验测得不同时刻草酸二乙酯和草酸的浓度,采用多项式微分法拟合分别获得草酸二乙酯浓度与时间和草酸浓度与时间的关系。通过对时间求导获得反应速率与时间的关系式。利用非线性回归分析,获得相应的动力学参数。模型方程中速率常数与温度的关系,如(11)~(14)所示。
| $ {\rm{ln}}{k_{0,1}} = \frac{{ - 13919.53}}{T} + 35.2887 $ | (11) |
| $ {\rm{ln}}{k_{0,2}} = \frac{{ - 9756.08}}{T} + 25.6611 $ | (12) |
| $ {\rm{ln}}{k_1} = \frac{{ - 2161.06}}{T} + 5.1213 $ | (13) |
| $ {\rm{ln}}{k_2} = \frac{{ - 2038.55}}{T} + 2.8127 $ | (14) |
对数据进行回归得到相应的动力学参数后,用Runge-Kutta法解此微分方程,即可得到草酸二乙酯和草酸摩尔分数的计算值,将此计算值与实验值进行比较,通过平均相对偏差值(15)~(16)对模型进行检验。
| $ {\rm{MR}}{{\rm{D}}_1} = \frac{1}{n}\left( {\sum\limits_{{\rm{all samples}}} {\left| {\frac{{{X_{{\rm{DEO,cale}}}} - {X_{{\rm{DEO,exp}}}}}}{{{X_{DEO,exp}}}}} \right.} } \right) $ | (15) |
| $ {\rm{MR}}{{\rm{D}}_2} = \frac{1}{n}\left( {\sum\limits_{{\rm{all samples}}} {\left| {\frac{{{Y_{{\rm{OA,calc}}}} - {Y_{{\rm{OA,exp}}}}}}{{{Y_{{\rm{OA,exp}}}}}}} \right.} } \right) $ | (16) |
式(15)和(16)中:n为实验数据的个数;X为转化率;Y为收率;exp表示实验值,calc表示计算值。
实验数据与模型计算结果的平均相对偏差分别为5.53%和5.97%。
4 结论在间歇反应器中对以离子交换树脂为催化剂的草酸二乙酯水解动力学进行了研究。实验发现,与自催化相比,树脂催化下的反应速率显著提高,达到平衡的时间明显缩短;草酸二乙酯的水解反应为一个连串反应,草酸二乙酯首先反应生成草酸单乙酯,草酸单乙酯进一步水解生成草酸。两步反应的标准反应焓分别为4.95和6.34 kJ/mol,该水解反应为可逆吸热反应,高温有利于草酸的生成。结合树脂催化反应特点,建立了一个包括草酸催化作用和离子交换树脂催化作用在内的动力学方程;其中草酸的催化作用与其浓度的1/2次方呈正比,树脂催化作用与单位质量草酸二乙酯的催化剂用量成线性关系。通过实验数据的回归获得动力学参数,模型计算与实验数据的平均相对偏差 < 0.06,表明该模型适用于草酸二乙酯树脂催化水解动力学规律的描述。
| [1] | Gürü M, Bilgesü A Y, Pamuk V. Production of oxalic acid from sugar beet molasses by formed nitrogen oxides[J]. Bioresource Technology, 2001, 77(1) : 81–86. DOI: 10.1016/S0960-8524(00)00122-X |
| [2] | Mandal S K, Banerjee P C. Submerged production of oalic aid from glucose by immobilized apergillus niger[J]. Process Biochemistry, 2005, 40(5) : 1605–1610. DOI: 10.1016/j.procbio.2004.06.013 |
| [3] | Prentice L H, Tyas M. The effect of oalic aid incorporation on the setting time and strength of a glass-ionomer cement[J]. Acta Biomaterialia, 2006, 2(1) : 109–112. DOI: 10.1016/j.actbio.2005.08.007 |
| [4] | Nath S K, Dutta R K. Acid-Enhanced limestone defluoridation in column reactor using oxalic acid[J]. Process Safety and Environmental Protection, 2012, 90(1) : 65–75. DOI: 10.1016/j.psep.2011.07.001 |
| [5] |
李安民, 李一兵, 耿书元, 等. 草酸的生产工艺评[J].
煤化工, 2006, 5 : 58–60.
Li Anmin, Li Yibing, Geng Shuyuan, et al. Production methods for oxalic acid[J]. Coal Chemical Industry, 2006, 5 : 58–60. |
| [6] | Levine L, Jackson L. Preparation of oxalic acid:US, 3652669[P]. 1972-03-28 |
| [7] | Isshiki T, Suzuki T, Yashima Y, et al. Process for the production of oxalic acid:US, 3678107[P]. 1972-07-18 |
| [8] |
吴英远, 张毅民, 徐艳, 等. 草酸酯制备草酸的研究进展[J].
河北化工, 2000, 1 : 18–21.
Wu Yingyuan, Zhang Yimin, Xu Yan, et al. Progress of making oxalic acid from oxalate[J]. Hebei Chemical Industry, 2000, 1 : 18–21. |
| [9] |
杨建一. 草酸二甲酯水解生产草酸工艺设计的研究[J].
河北工业科技, 2012, 29(3) : 135–137.
Yang Jianyi. Technological design for producing oxalic acid based on dimethyl oxalate hydrolysis[J]. Hebei Journal of Industrial Science and Technology, 2012, 29(3) : 135–137. |
| [10] | Gao X, Zhao Y, Wang S, et al. A Pd-Fe/α-Al2O3/cordierite monolithic catalyst for CO coupling to oxalate[J]. Chemical Engineering Science, 2011, 66(15) : 3513–3522. DOI: 10.1016/j.ces.2011.04.012 |
| [11] | Gao X, Zhu Y, Luo Z. CFD modeling of gas flow in porous medium and catalytic coupling reaction from carbon monoxide to diethyl oxalate in fixed-bed reactors[J]. Chemical Engineering Science, 2011, 66(23) : 6028–6038. DOI: 10.1016/j.ces.2011.08.031 |
| [12] |
徐艳, 吴英远, 张毅民, 等. 草酸二乙酯水解宏观动力学研究[J].
化学反应工程与工艺, 2000, 16(3) : 216–220.
Xu Yan, Wu Yingyuan, Zhang Yimin, et al. Studies on hydrolysis macroscopic kinetics of diethyl oxalate into oxalic acid[J]. Chemical Reaction Engineering and Technology, 2000, 16(3) : 216–220. |
| [13] |
陈锦文, 李璠. 草酸二乙酯水解反应动力学研究[J].
天然气化工, 1995, 20(4) : 13–17.
Chen Jinwen, Li Pan. Study of hydrolysis kinetics of diethyl oxalate[J]. Natural Gas Chemical Industry, 1995, 20(4) : 13–17. |
| [14] | Bhore N A, Klein M T, Bischoff K B. The delplot technique:A new method for reaction pathway analysis[J]. Industrial & Engineering Chemistry Research, 1990, 29(2) : 313–316. |
| [15] | Izzo B, Klein M T, LaMarca C, et al. Hydrothermal reaction of saturated and unsaturated nitriles:Reactivity and reaction pathway analysis[J]. Industrial & Engineering Chemistry Research, 1999, 38(4) : 1183–1191. |
| [16] | Sanz M T, Murga R, Beltrán S, et al. Kinetic study for the reactive system of lactic acid esterification with methanol:Methyl lactate hydrolysis reaction[J]. Industrial & Engineering Chemistry Research, 2004, 43(9) : 2049–2053. |
| [17] | Xu Y, Chen Q, Zhao Y, et al. Autocatalytic kinetic study of dimethyl oxalate consecutive hydrolysis[J]. Ind Eng Chem Res, 2014, 53(11) : 4207–4214. DOI: 10.1021/ie404253x |
| [18] | Jogunola O, Salmi T, Wärnå J, et al. Kinetic and diffusion study of acid-catalyzed liquid-phase alkyl formates hydrolysis[J]. Chemical Engineering Science, 2012, 69(1) : 201–210. DOI: 10.1016/j.ces.2011.10.028 |
 2017, Vol. 34
2017, Vol. 34





