自Fujishima和Honda[1]开创性地报道了在以TiO2为光电极的电池中,采用紫外光照射,可将水分解为氢气和氧气以来,人们对这一领域的研究从未间断过。TiO2纳米颗粒以其强氧化、低毒、成本低、易制备的特性被誉为21世纪最有前景的光催化材料[2-4]。但TiO2禁带较宽(3.2 eV),光生电子-空穴复合率较高,且氢气和氧气结合生成水的逆反应较快,因此利用TiO2光催化分解水制氢的效率较低[5-8]。
利用TiO2半导体材料光催化分解水制氢必须要解决以下问题:1)降低TiO2禁带宽度,使其激发光谱移向可见光段; 2)提高TiO2的激发电子效率,降低光生电子-空穴的复合率; 3)抑制氢气和氧气合成水的逆反应[9-11]。文献报道[12-14],Zn2+的掺杂能显著抑制了TiO2纳米颗粒的生长,增强了TiO2纳米颗粒的光催化性能。S与TiO2分子之间的离子作用能够降低TiO2禁带宽度,改善锐钛矿的几何结构,从而提高其光催化性能[15-16]。
本研究通过溶胶-凝胶法制备了一系列Zn、S共掺杂的TiO2纳米颗粒。研究了不同的n(Zn)/n(Ti)的Zn、S共掺杂对TiO2结构、光吸收性能以及紫外光及模拟太阳光照射下光催化分解甘油水溶液制取氢气性能的影响。
1 实验部分 1.1 催化剂的制备室温下,80 mL乙醇与20 mL钛酸丁酯混合,搅拌1 h,得到澄清溶液,命名为溶液A; 将一定量的硝酸锌和硫脲(Zn/S物质的量之比为1:1)溶解于15 mL醋酸、7 mL水和20 mL乙醇的混合溶液中,命名为溶液B。剧烈搅拌下,将溶液B缓慢加入到溶液A中。继续搅拌,得到透明均匀的溶胶。将该溶胶于50 ℃下陈化,直至成为透明凝胶。将凝胶在100 ℃下干燥24 h后,取出干凝胶颗粒进行研磨,最后将研磨后的粉末于50 0℃下煅烧4 h。制备Zn、S共掺杂TiO2颗粒,标记为x-Zn(S)-TiO2(x%为Zn/Ti物质的量之比)。
1.2 催化剂的表征催化剂颗粒的粒度大小及形貌在(JEM2100型日本电子JEOL)场发射透射电子显微镜(TEM)和美国FEI的Nanosem-430和Hitachi-S4800仪器(SEM)上获得。通过荷兰PANalytical公司X’pert Pro型X射线衍射仪(XRD)获得样品的晶相结构,实验条件为:辐射Cu_Kα,管电压40 kV,管电流200 mA,扫描范围为2θ=(10°~80°)。采用Perkin Elmer-Lambda 35 UV-vis Spectrometer,以BaSO4为标准白板测试本研究样品的光响应性能,扫描范围为200~1 100 nm,扫描狭缝为2.00 nm。样品的物质结构应用BRUKE RFS 100/S型拉曼光谱仪进行测试,扫描范围为1 000~100 cm-1,拉曼激光能量为300 mW,扫描狭缝为2.00 nm。X射线光电子能谱(XPS)在Perkin-Elmer公司的PHI-1600ESCA光谱仪上进行,Mg_Kα(1 253.6 eV)作为放射源,结合能以碳的C1s峰(BE=284.6 eV)为基准校正。
1.3 催化剂的活性测试催化剂光解水制氢的活性评价在连续流动气-固环隙光反应器中进行[17]。0.2 g催化剂与7 mL二氧化硅混合均匀后,置于石英套管的夹层中,然后向夹层中滴加10 mL体积分数为5%的甘油水溶液。为防止催化剂被载气吹走,同时优化载气的分布,在催化剂床层的上下两端装填一定厚度的石英砂。辐射光源为500 W氙灯。光源处于石英套管的中央,床层温度由温控仪及水冷进行控制。氩气以20 mL/min的速度通过催化剂床层,带出生成的气体,进入到气相色谱中(PE Auto-system XXL,热导池检测器)进行组成分析。
2 结果与讨论 2.1 Zn(S)-TiO2催化剂的表面形貌图 1为纯TiO2、Zn掺杂和Zn、S共掺杂的TiO2样品的SEM和TEM照片。

|
| 图 1 系列Zn、S共掺杂TiO2样品的TEM和SEM照片 Figure 1 SEM images of various codoped TiO2 samples |
| |
从图 1中可以看出,制备的样品整体上比较均匀。纯TiO2样品为不规则的球形颗粒,其粒径尺寸在20~30 nm。SEM图显示,TiO2纳米颗粒有部分团聚现象,颗粒粒径大小比较不明显,但从相应的TEM图中可以看出,Zn及Zn、S共掺杂之后,从TiO2颗粒尺寸降低为10~20 nm,同时颗粒也更加规整。随着Zn含量的提高,催化剂的粒径也逐渐减小。这表明,Zn的加入较大程度地抑制了TiO2的晶粒成长。离子掺杂量为3%时,共掺杂后TiO2颗粒粒径比单纯掺杂Zn时的要小,但是程度并不明显,说明Zn在抑制TiO2晶粒生长时起到了关键作用。
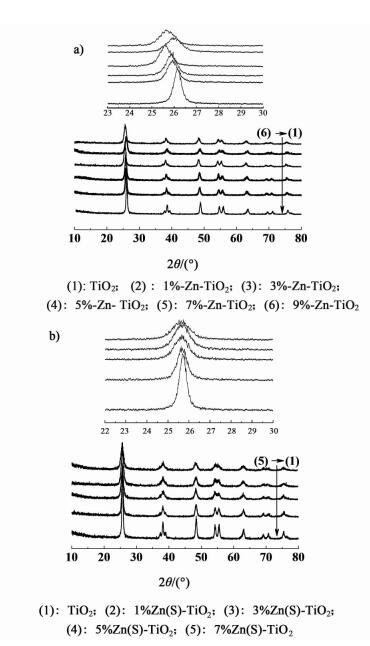
2.2 Zn(S)-TiO2催化剂的结构图 2a)为纯TiO2及Zn掺杂的TiO2样品的XRD谱图。图 2b)为纯TiO2及Zn、S共掺杂的TiO2样品的XRD谱图。
|
| 图 2 系列Zn或Zn,S共掺杂TiO2样品的XRD谱图 Figure 2 XRD patterns of various Zn-doped or Zn, S co-doped TiO2 samples |
| |
从图 2a)中可以看到,各催化剂样品在2θ为25.6°,37.9°,48.4°,54.1°,55.3°,63.0°,68.9°,70.7°和75.3°处均出现了TiO2锐钛矿的特征衍射峰,同时并未检测到金红石或含Zn化合物的特征衍射峰,表明Zn和S的掺杂并未破坏锐钛矿结构。Zn掺杂后各样品中锐钛矿相最强衍射峰(2θ=25.6°)有一定程度的宽化,这是TiO2晶粒粒径减小所致。利用谢乐公式计算的不同样品的颗粒粒径(表 1)表明,Zn2+的掺杂能抑制了TiO2晶粒的生长。此外,Zn掺杂后,锐钛矿相的衍射峰(2θ=25.6°)发生了明显的小角度偏移,并且偏移程序随Zn掺杂量的增加而逐渐增加,表明Zn2+进入TiO2的晶格中取代Ti4+。
| Catalyst | Atomic ratio/% | Crystallite size/nm |
|||
| Ti | S | Zn | O | ||
| TiO2 | 30.5 | ||||
| 1%-Zn-TiO2 | 25.5 | ||||
| 3%-Zn-TiO2 | 24.37 | 0 | 3.08 | 72.55 | 20.1 |
| 3%-Zn(S)-TiO2 | 21.20 | 2.16 | 7.00 | 69.64 | 18.2 |
| 5%-Zn(S)-TiO2 | 14.3 | ||||
| 7%-Zn(S)-TiO2 | 10.0 | ||||
由图 2b)可知,锐钛矿相的衍射峰(2θ=25.6°)的进一步宽化,这也能从表 1中计算的粒径颗粒得到证实,表明S的掺杂能进一步减小TiO2颗粒的粒径尺寸。但是,对比Zn单独掺杂和Zn,S共掺杂后TiO2衍射峰(2θ=25.6°)小角偏移程度可以发现,S的掺杂使衍射峰偏移减小,表明S掺杂后,进入TiO2晶格中的Zn在S掺杂后,从晶格中脱出。这可能与Zn和S之间或S与TiO2间的强化学作用有关。
为了研究制备的Zn掺杂及Zn、S共掺杂TiO2样品的表面组成和元素的价态,我们对其进行了XPS能谱分析。XPS结果显示,样品主要由S、Zn、Ti、O元素组成,具体比例见表 1所示。
由表 1可知,TiO2表面的O与Ti的物质的量之比远大于2,说明TiO2颗粒表面可能有羟基产生或者有水合物。同时,我们发现Zn与Ti的比例及S与Ti的比例都高于投料比,表明Zn与S在催化剂表面形成了富集[18]。富集于表面的Zn或S的加入能够有效地阻碍了晶粒的生长与聚结,降低了催化剂颗粒的粒径。对比S引入前后的Zn含量的数据发现,S掺杂后,Zn在表面上的含量明显增加,说明Zn由体相转移到表面,这与XRD分析结果一致。此外,我们还测定了Ti2p,Zn2p,S2p和O1s的结合能。
图 3为系列Zn、S共掺杂TiO2样品的XPS谱图。

|
| 图 3 系列Zn、S共掺杂TiO2样品的XPS谱图 Figure 3 XPS spectra of various codoped TiO2 samples |
| |
图 3a)中,结合能为458.5和464.5 eV处的峰归属于TiO2中Ti2p3/2和Ti2p1/2电子特征峰。这2个峰与纯TiO2锐钛矿特征峰吻合,表明Ti4+仍然以TiO2的形式存在。同时,S掺杂后,Ti2p的2个特征峰有向高结合能方向迁移的趋势,这表明掺杂的硫元素与TiO2发生了化学作用,破坏了原来体系的电荷平衡,使Ti元素的化学价态发生了轻微的改变。少量的Ti离子释放出多余的电子,向更高价态转变,从而使Ti2p的2个特征峰向高结合能迁移。图 3b)中,结合能为1 021.3和1 044.4 eV的峰,可归属于Zn2p3/2和Zn2p1/2电子特征峰,可知掺杂的Zn元素为Zn2+,以ZnO的形式存在[19]。图 3c)中结合能为169.5 eV的峰可归属于S6+,并未发现S2-和S4+的特征峰,说明硫元素以SO42-的形式存在[20-21]。这些硫元素一小部分取代了Ti4+形成O—S—O键,在TiO2结构中造成缺陷,而大部分硫元素在TiO2表面以SO键存在,对Ti元素产生不对称电荷的影响。另外,未能检测到S2-的存在,说明S元素没有取代TiO2晶格结构中的O元素。因此,硫元素的引入对TiO2光催化化活性的影响主要是由于酸性位的引入和部分晶格缺陷的形成。图 3d)中给出了O1s的XPS谱峰。O1s XPS谱峰较宽且不对称,说明在催化剂的表面有不同的氧存在。其中结合能为529.5 eV的峰对应于TiO2中的晶格氧。掺杂硫后,晶格氧峰有向高结合能迁移的趋势,说明SO42-与Ti和Zn有更强的作用。掺杂Zn、S后,O1s图在结合能为532 eV处有肩峰存在,此峰可能为羟基氧或者结合水,从而表明催化剂表面吸附活化水的能力增强,有利于强氧化性的OH·的形成。
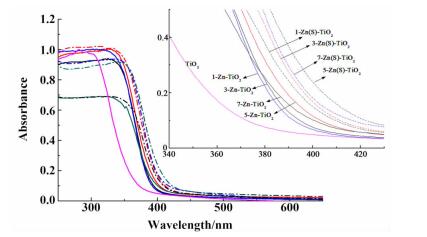
2.3 Zn(S)-TiO2催化剂的光吸收性能图 4为系列Zn掺杂或Zn、S共掺杂TiO2样品的UV-Vis DRS谱图。
|
| 图 4 系列Zn掺杂和Zn、S共掺杂TiO2样品的UV-Vis DRS谱图 Figure 4 UV-Vis DRS spectra of various Zn-doped and Zn, S-codoped TiO2 samples |
| |
掺杂Zn后的TiO2与纯TiO2相比,吸光带发生了比较明显的红移,而S共掺杂后,TiO2的吸光带边进一步红移,结果表明,Zn掺杂或Zn、S共掺杂能够改善TiO2的吸光性能。Zn、S的引入提高TiO2的吸光性能的原因可能有以下几个方面:1)掺杂Zn、S后,TiO2纳米颗粒的尺寸变小,比表面积增大; 2)Zn、S的加入引入了杂质能级,有效地降低了TiO2的禁带宽度; 3) SO42-中SO双键具有强电子诱导效应。这种强电子诱导效应降低了电子-空穴分离所需要的光子能量。
当Zn、S掺杂量较少时,样品的吸光性能随着掺杂元素含量的提高而增强,当Zn/Ti物质的量之比为5%时,吸光性能达到最大值。当掺杂量大于5%时,吸光性能会有所降低,原因可能为:1)掺杂量过大,锌氧化物在TiO2表面产生聚集态,提高了光生电子和空穴的复合率; 2)催化剂颗粒的粒径进一步变小,由于量子尺寸效应的影响,使TiO2的禁带宽度变宽。
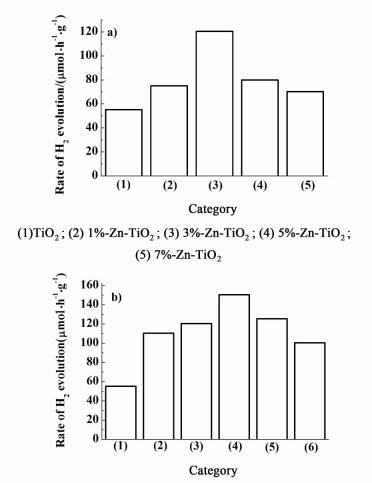
2.4 Zn(S)-TiO2光催化甘油水溶液制氢性能在氙灯的照射下,通过研究体积比为5%甘油水溶液分解水制氢的速率来考察系列Zn掺杂及Zn、S共掺杂TiO2的光催化性能,结果如图 5所示。
|
| 图 5 系列Zn及Zn,S共掺杂TiO2光催化甘油水溶液制氢性能 Figure 5 Rates of the photocatalytic H2 evolution from glycerol aqueous solution (5%) over various Zn-doped and Zn, S co-doped TiO2 under Xe lamp irradiation |
| |
纯TiO2的催化活性较低,而Zn掺杂的TiO2光催化性能大大优于纯TiO2。在Zn含量较低时,光解水的产氢速率随着掺杂Zn含量的提高而升高,当Zn/Ti物质的量之比大于3%时,产氢速率随Zn含量的提高而降低。Zn掺杂量的最适宜值为3%。此时,产氢效率可达到120.5 μmol/(h·g)。
此外,所有Zn、S共掺杂的TiO2光催化性能与单独Zn掺杂的TiO2相比,氢生成速率均有一定程度的提高。同样,当Zn(S)/Ti物质的量之比为3%时,其产氢速率最高。
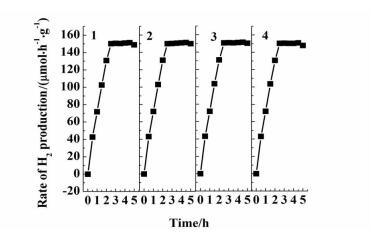
对3%Zn、S共掺杂TiO2光催化剂的稳循环使用性能进行了评价,实验结果如图 6所示。
|
| 图 6 3%Zn(S)共掺杂TiO2光催化甘油水溶液4周期内制氢性能 Figure 6 Rates of the photocatalytic H2 production from glycerol aqueous solution (5%) in cycles over 3%Zn, S co-doped TiO2 under Xe lamp irradiation |
| |
由图 6可知,该催化剂在甘油水溶液中光催化制氢的活性循环使用4次依旧保持很高的活性,表明此光催化剂的催化效率和稳定性较好。
通过前面的表征分析及光吸收性能的研究,我们推测掺杂Zn、S后,TiO2光催化性能提高的可能原因为:1) Zn的掺杂取代了一部分Ti4+,造成了晶格缺陷,降低了TiO2纳米颗粒的粒径,增大了催化剂颗粒的比表面积; 2) Zn2+取代Ti4+离子引入了杂质能级,降低了TiO2的禁带宽度; 3)硫的加入,一部分取代了Ti4+,大部分在催化剂表面形成了SO42-,提高了催化剂表面的酸性。4)S的加入,也起到了维持体系电荷平衡和增强可见光吸收的作用。共掺杂后TiO2光催化性能的提高,是Zn和S协同作用的结果。
3 结论1)Zn和S在TiO2纳米颗粒中均匀分布,Zn以ZnO形式存在,而S以SO42-形式存在,共掺杂未改变TiO2的锐钛矿结构; Zn和S共掺杂后,TiO2纳米颗粒的晶粒变小。
2)由于Zn的掺杂,在TiO2禁带中产生了杂质能级,降低了纳米材料的禁带宽度,抑制了光生电子和空穴的复合,从而提高了光吸收效率; 而S的掺杂,增加了催化剂表面的酸性位,有利于光催化活性的提高。
3)掺杂了Zn、S的TiO2光催化甘油水溶液制氢的效率远高于纯TiO2,在氙灯照射下,3%Zn、S共掺杂催化剂表现出最高的产氢速率,其可达到150.5 μmol/(h·g)。
| [1] | Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature , 1972, 238(5358) : 37–38. DOI: 10.1038/238037a0 |
| [2] | Song Z, Li Q, Gao L. Preparation and properties of nano-TiO2powders[J]. Journal of Material Science Technology , 1997, 13 : 321–323. |
| [3] | Liu K, Sakurai M, Liao M, et al. Giant improvement of the performance of ZnO nanowire photodetectors by Au nanoparticles[J]. Journal of Physical Chemistry , 2010, 114(46) : 19835–19839. |
| [4] | Mokhtarimehr M, Eshaghi A, Pakshir M. Self-Cleaning properties of vanadium doped TiO2 sol-gel derived thin films[J]. New Journal of Glass and Ceramics , 2013, 3 : 87–90. DOI: 10.4236/njgc.2013.33014 |
| [5] | Kiwi J, Graetzel M. Optimization of conditions for photochemical water cleavage aqueous platinum/TiO2 (anatase) dispersions under ultraviolet light[J]. Journal of Physical Chemistry , 1984, 88(7) : 1302–1307. DOI: 10.1021/j150651a012 |
| [6] | Kiwi J. The effect of promoters on the photochemical water cleavage in suspensions of Pt-loaded TiO2 with increased light to chemical conversion efficiency[J]. Homogeneous and Heterogeneous Photocatalysis , 1986, 174 : 275–302. |
| [7] | Yoshida Y, Matsuoka M, Moon S C, et al. Photocatalytic decomposition of liquid-water on the Pt-loaded TiO2 catalysts: Effects of the oxidation states of Pt species on the photocatalytic reactivity and the rate of the back reaction[J]. Research on Chemical Intermediates , 2000, 26(6) : 567–574. DOI: 10.1163/156856700X00534 |
| [8] | Fujishima A, Zhang X, Tryk D A. TiO2 photocatalysis and related surface phenomena[J]. Surface Science Reports , 2008, 63(12) : 515–582. DOI: 10.1016/j.surfrep.2008.10.001 |
| [9] | Shi J, Ma L, Wu P, et al. A novel Sn2Sb2O7 nanophotocatalyst for visible-light-driven H2evolution[J]. Nano Research , 2012, 5(8) : 576–583. DOI: 10.1007/s12274-012-0243-0 |
| [10] | Osterloh F E. Inorganic materials as catalysts for photochemical splitting of water[J]. Chemistry Material , 2008, 20 : 35–54. DOI: 10.1021/cm7024203 |
| [11] | Ni M, Leung M K H, Leung D Y C, et al. A review and recent developments in photocatalytic water-splitting using TiO2 for hydrogen production[J]. Renewable and Sustainable Energy Review , 2007, 11(3) : 401–425. DOI: 10.1016/j.rser.2005.01.009 |
| [12] | Liu G, Zhang X, Xu Y, et al. The preparation of Zn2+-doped TiO2 nanoparticles by sol-gel and solid phase reaction methods respectively and their photocatalytic activities[J]. Chemosphere , 2005, 59(9) : 1367–1371. DOI: 10.1016/j.chemosphere.2004.11.072 |
| [13] | Rehman S, Ullah R, Butt A M, et al. Strategies of making TiO2 and ZnO visible light active[J]. Journal of Hazard Material , 2009, 170(2/3) : 560–569. |
| [14] | Navarro R M, Valle F D, de la Mano J A V, et al. Photocatalytic water splitting under visible light: Concept and catalysts development[J]. Advances in Chemical Engineering , 2009, 36 : 111–143. DOI: 10.1016/S0065-2377(09)00404-9 |
| [15] | Hussain S T, Khan K, Hussain R. Size control synthesis of sulfur doped titanium dioxide (anatase) nanoparticles, its optical property and its photo catalytic reactivity for CO2+H2O conversion and phenol degradation[J]. Journal of Natural Gas Chemistry , 2009, 18(4) : 383–391. DOI: 10.1016/S1003-9953(08)60133-4 |
| [16] | Hidalgo M C, Maicu M, Navío J A, et al. Photocatalytic properties of surface modified platinised TiO2: Effects of particle size and structural composition[J]. Catalysis Today , 2007, 129(1/2) : 43–49. |
| [17] | 李秋叶, 吕功煊. 光催化分解水制氢研究新进展[J]. 李秋叶, 吕功煊. 2007. 光催化分解水制氢研究新进展[J]. 分子催化 , 2007 , 21 : 590–598. |
| [18] | Hwang S H, Song J, Jung J, et al. Electrospun ZnO/TiO2 composite nanofibers as a bactericidal agent[J]. Chemical Communications , 2011, 47(32) : 9164–9166. DOI: 10.1039/c1cc12872h |
| [19] | Wang N, Li X, Wang Y, et al. Synthesis of ZnO/TiO2nanotube composite film by a two-step route[J]. Materials Letters , 2008, 62(21/22) : 3691–3693. |
| [20] | Yan H, Yang Y, Tong D, et al. Catalytic conversion of glucose to 5-hydroxymethylfurfural over SO42-/ZrO2 and SO42-/ZrO2-Al2O3 solid acid catalysts[J]. Catalysis Communications , 2009, 10(11) : 1558–1563. DOI: 10.1016/j.catcom.2009.04.020 |
| [21] | Laokiat L, Khemthong P, Grisdanurak N, et al. Photocatalytic degradation of benzene, toluene, ethylbenzene, and xylene (BTEX) using transition metal-doped titanium dioxide immobilized on fiberglasscloth[J]. Korean Journal of Chemical Engineering , 2012, 29(3) : 377–383. DOI: 10.1007/s11814-011-0179-1 |
 2016, Vol. 33
2016, Vol. 33





