2. 天津化学化工协同创新中心, 天津 300072
2. The Collaborative Innovation Center of Chemistry and Chemical Engineering of Tianjin, Tianjin 300072, China
稀薄燃烧技术能够有效缓解汽车尾气对大气的污染,但在稀燃条件下尾气中氮氧化物(NOx,包含NO和NO2)的有效催化消除依然是个世界性难题[1, 2, 3, 4]。目前研究比较成熟的NOx消除技术有选择性催化还原(SCR)技术,同时在20世纪90年代中期日本丰田公司提出了利用NOx储存还原(NSR)技术来消除尾气中的NOx[5]。相比SCR技术,NSR技术无需在还原过程加入额外的还原剂,使用设备简单。
应用于NSR的常见催化剂主要分两种:贵金属催化剂和金属氧化物催化剂[6, 7, 8, 9]。贵金属催化剂Pt/BaO/Al2O3应用较为广泛[10, 11, 12],以其为例,NSR工作原理简述如下:在稀燃条件下,催化剂的活性组分Pt将NOx捕获并氧化为NO2,以NO-3或NO-2形式存储于催化剂的碱性组分上(如Ba);在富燃(贫氧)条件下,储存的硝酸盐或亚硝酸盐释放出来,然后于活性位上(Pt)被还原剂(CO、H2和HC)还原成N2,从而达到对NOx的消除。应用于NSR研究的金属氧化物催化剂有诸如BaO[13, 14]、BaAl2O4[7]、BaFeO3[15]、BaSnO3[9]等。上述常见的NSR催化剂主要适用于中高温下NOx的消除,而低温下使用NSR技术进行NOx消除的研究很少。汽车冷启动时,催化剂因为没有达到起燃温度而不起催化作用,从而导致大量NOx直接排放至大气。如何控制低温冷启动时机动车尾气NOx的排放成为研究重点之一。
低温下NOx催化消除技术主要有HC-SCR、NH3-SCR和NSR技术[16]。MnOx因为具有较好的低温氧化还原性能而应用于低温SCR反应之中[17, 18, 19],根据其反应机理可推测MnOx在NSR反应中亦可能具有一定的低温活性,而目前将MnOx应用于NSR反应的研究很少。据报道,Au/Al2O3催化剂在低温下能够将氮氧化物催化还原,其活性组分是Au0[20]。本研究通过将Au/Al2O3催化剂与Mn2O3球磨,得到Au/Al2O3/Mn2O3催化剂,利用X射线衍射(XRD),H2程序升温还原(H2-TPR)和场发射透射电子显微镜(FE-TEM)表征手段考察了催化剂的结构和物理化学性质,以及不同Au担载量对NSR催化活性的影响。
1 试验部分 1.1 催化剂的制备按照化学计量称取一定量的γ-Al2O3溶于水中,并于70 ℃下水浴搅拌均匀形成悬浮液。再将上述Al2O3悬浮液超声10 min后,滴入HAuCl4溶液,并用0.1 mol/L NaOH的溶液将其pH值调节至7,同时搅拌2 h,使得Au(OH)3充分均匀地沉积沉淀于Al2O3上[20],然后于常温下老化2 h。上述溶液经过洗涤并检测无Cl-离子后,将滤饼置入80 ℃恒温干燥箱中24 h。再在500 ℃下焙烧4 h(升温速率,5 ℃·min-1),得Au/Al2O3。利用上述方法制备出Au担载量不同的x%(质量分数) Au/Al2O3,其中:x=0.5,1.0,1.5,2.0。
同时利用共沉淀法制备Mn2O3。称取一定量的Mn(CH3COO)2样品溶于100 mL的去离子水中,然后滴入(NH4)2CO3溶液,并不断搅拌,将溶液pH值控制在9~10。上述样品常温下老化4 h后,过滤洗涤,然后将滤饼置于90 ℃的恒温干燥箱中干燥24 h。再于马弗炉中550 ℃焙烧4 h(升温速率,5 ℃·min-1),得Mn2O3样品。
然后分别称取等质量的Au/Al2O3和Mn2O3样品,放入球磨机中以257 r·min-1的转速机械混合5 h,得x% Au/Al2O3/Mn2O3,本研究中用x代表不同金担载量的催化剂,其中x=0,0.5,1.0,1.5,2.0。
1.2 催化剂的表征 1.2.1 X射线粉末衍射X射线粉末衍射是在德国布鲁克公司型号为D8 Fouces的多晶粉末衍射仪上进行,其操作电压为40 kV,电流为40 mA。以Cu_Kα作为射线源(λ=0.154 18 nm),采集2θ范围为10°~90°,采集步长0.02°。
1.2.2 H2程序升温还原测试(H2-TPR)样品测试在化学吸附仪(TPDRO 1100 SERIES,美国菲尼根公司)上进行。样品用量为30 mg,测试气体流速为30 mL·min-1(5%体积比H2的氢氮混合气),由室温升温至800 ℃(10 ℃·min-1),使用CaO+NaOH过滤器净化气体,确保通过样品的气体不含H2O和CO2等气体。
1.2.3 FE-TEM样品于JEM-2100F场发射透射电子显微镜(日本电子株式会社)上进行,其制备过程如下:将少量样品用乙醇溶液分散,并超声30 min,然后再滴于铜网支撑的碳膜上,于空气中风干,测定时加速电压为200 kV。
1.3 催化剂活性评价NOx储存-还原性能测试于不锈钢固定床反应器(内径4 mm)中进行。NOx储存-还原性能考察温度为150 ℃,利用四通阀达到稀燃和富燃气氛之间的循环切换(切换时间为稀燃2 min∶富燃1 min)。反应测试气路分两路:稀燃气氛模拟气体组成为500×10-6 NO,6.7%O2,N2作为平衡气,总流速150 mL·min-1,空速3.75×104 h-1;富燃气氛模拟气体组成为500×10-6 NO,1000×10-6 H2,N2作为平衡气,总流速和空速与稀燃气氛相同。汽车尾气模拟气为500×10-6 NO,6.7%O2,总流速150 mL·min-1,空速3.75×104 h-1,N2为平衡气。使用Model 42i-HL型氮氧化物分析仪(美国赛默飞世尔公司)在线检测尾气(NO,NO2和NOx),气体流速均由质量流量计控制。
2 结果与讨论 2.1 XRD结果图 1是不同Au担载量的样品、纯γ-Mn2O3(JCPDF No 41-1442)样品和纯Al2O3样品的XRD谱图。

|
| 图 1 不同Au担载量样品的XRD谱图 Fig. 1 XRD patterns of samples with different Au loadings |
| |
由图 1可知纯Al2O3(JCPDF No 01-1308)的XRD峰很弱,所以球磨混合后样品无明显的Al2O3峰出现;不同Au担载量样品锰的氧化物以γ-Mn2O3物相存在,且不含杂峰;球磨混合后的样品与纯的γ-Mn2O3对比,峰明显减弱,是因为Mn2O3的量减少;谱图中并没有检测到Au的氧化物衍射峰,说明Au分散度很高。
2.2 H2-TPR结果图 2是不同Au担载量的H2-TPR谱图。

|
| 图 2 不同Au担载量样品和Mn2O3样品的H2-TPR谱图 Fig. 2 H2-TPR profiles of samples with different Au loadings |
| |
由图 2可以看出,纯Mn2O3样品的H2-TPR谱图有2个明显的还原峰,分别出现在326 ℃和413 ℃。该样品的2个还原峰分别对应着Mn2O3→Mn3O4(327 ℃)的还原和Mn3O4→MnO(416 ℃)的还原[21]。未担载Au的Al2O3/Mn2O3样品的H2-TPR谱图也出现了2个明显的还原峰,分别出现于327 ℃和416 ℃。该样品的2个还原峰分别对应着Mn2O3→Mn3O4(327 ℃)的还原和Mn3O4→MnO(416 ℃)的还原。与纯Mn2O3样品的H2-TPR谱图对比,纯Al2O3/Mn2O3样品的还原峰位置无明显偏移,说明球磨混合Al2O3对其还原影响不大,还原峰强度减弱是由于Mn2O3量的减少。同时,由谱图可以看出,总体上,当担载贵金属Au后,H2-TPR还原峰向高温方向移动,并且当贵金属Au的担载量较低时(不大于1%),Mn2O3的H2-TPR还原峰向高温方向偏移幅度较大,随着贵金属Au担载量的进一步增加,其H2-TPR还原峰向高温方向偏移程度减小,说明当Au的担载量较低时(不大于1%),由于担载的Au的分散度高、颗粒小,Au与Mn2O3的相互作用力较强[22],使得Mn2O3的还原难度增加,而当贵金属Au的担载量进一步增加时,贵金属含量的增加,导致Au颗粒尺寸增大,Au与Mn2O3的相互作用力变弱,使得还原峰又开始向低温方向偏移。
2.3 FE-TEM结果图 3为不同Au担载量的TEM图片。

|
| 图 3 不同Au担载量样品的TEM图 Fig. 3 TEM images of the samples with different Au loadings |
| |
图 3a)为Au担载量为0的纯Al2O3/Mn2O3混合样品TEM图片,从中可以看到明显的Mn2O3晶格条纹,说明得到了结晶度良好的Mn2O3,与XRD结果相一致,而TEM上看不到明显的Al2O3晶格条纹,由XRD谱图可知(图 1)其峰强度很弱,结晶度差,所以看不到明显的Al2O3晶格条纹。同时,从图 3b)和图 3c)可以看到明显的担载于Al2O3载体上的Au2O3纳米颗粒,说明通过上述实验制备方法,可有效得到不同Au担载量的Au/Al2O3/Mn2O3混合样品。
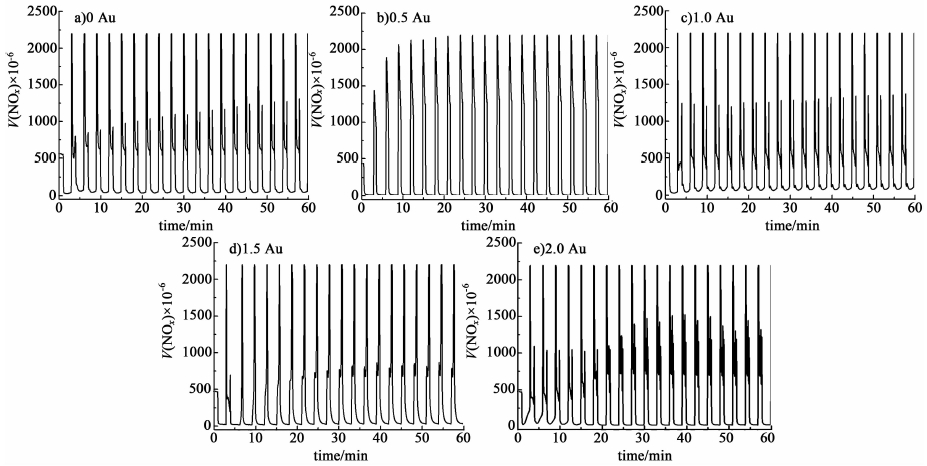
2.4 样品的活性测试图 4是150 ℃反应条件下催化剂的NSR循环曲线。
|
| 图 4 150 ℃下催化剂的NSR循环曲线 Fig. 4 NSR profiles of the catalysts at 150 ℃ |
| |
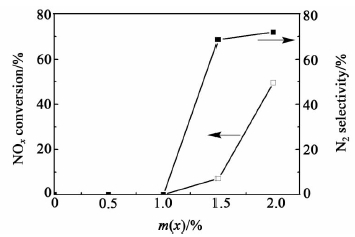
图 5为样品在150 ℃反应条件下的NOx转化率和N2选择性。
|
| 图 5 不同Au担载量催化剂的NOx转化率和N2选择性 Fig. 5 NOx conversion and N2 selectivity of the samples with different Au loadings |
| |
由图 4a)可以看出,该反应条件下,纯Al2O3/Mn2O3混合样品能够将NOx完全储存(稀燃条件下),但从图 5可知其NOx转化率和N2选择性几乎为0,活性很差,说明纯Al2O3/Mn2O3混合样品在150 ℃反应条件下具有良好的NOx氧化和储存能力,但还原性能很差,这点与本课题组先前实验结果一致[22]。同时结合图 4b)~图 4e)和图 5的结果可知,贵金属Au显著提升了催化剂的还原性能,说明贵金属的添加能够有效提高催化剂的低温NSR活性。
由图 5可知随着Au担载量的增加,NOx转化率和N2选择性得到提高。在150 ℃反应温度下,纯Al2O3/Mn2O3样品的NOx转化率和N2选择性几乎为0,当w(Au)担载量不大于1.0%时,Au/Al2O3/Mn2O3复合催化剂的NOx转化率和N2选择性也几乎为0,但当Au担载量达到1.5%时,NOx转化率和N2选择性有了显著提升。通过计算可知,当Au担载量达到2.0%时,NOx转化率和N2选择性分别可达49.6%和71.9%。上述实验结果做如下总结:1) 不含Au样品的还原能力很差(富燃条件下),150 ℃的低温反应条件不足以将其储存的NOx催化还原;2) 当Au担载量不大于1.0%时,样品基本也没有催化活性。一方面可能由于沉积沉淀法负载效率低,Au的实际担载量要低理论值,所以活性位数目较少;另一方面,由XRD和TPR结果可知:当Au的担载量不大于1.0%时,Au的分散度高,与载体Al2O3、Mn2O3存在强的相互作用力,导致在150 ℃条件下其氧化物难以被还原成活性组分Au0,所以没有活性。3) 当Au担载量大于1.0%时,NOx转化率和N2选择性有了显著提升,催化活性明显提高。这是由于Au负载量增加,其颗粒尺寸变大,使得Au与载体Al2O3、Mn2O3之间的相互作用力变弱,在150 ℃条件下Au的氧化物能够被还原成活性组分Au0,从而活性有了显著提升。上述结果说明贵金属的添加有助于NOx的还原,提高了催化剂NOx的消除效率。
3 结论从实验结果可知,贵金属Au能够显著提升催化剂的还原性能,Au/Al2O3/Mn2O3混合样品具有较高的低温NSR催化活性,且随着Au担载量的增加,其NSR催化活性呈上升趋势,当Au担载量达到2.0%时,NOx转化率和N2选择性分别可达49.6%和71.9%。同时Mn2O3的NOx存储能力较强,具有较高的氧化能力。通过将具有低温还原性能(Au催化剂)和氧化能力(Mn2O3)活性中心的有效组装,得到了具有应用前景的低温NSR催化剂。
| [1] | Dandl H, Emig G. Mechanistic approach for the kinetics of the decomposition of nitrous oxide over calcined hydrotalcites[J]. Appl Catal A,1998,168 (2) : 261–268 |
| [2] | Klingstedt F, Arve K, Eränen K, et al. Toward improved catalytic low-temperature NOx removal in diesel-powered vehicles[J]. Acc Chem Res,2006,39 (4) : 273–282 |
| [3] | 潘广宏, 孟明. 稀燃汽车尾气中氮氧化物的催化消除技术[J]. 化学工业与工程,2011,28 (3) : 67–73 Pan Guanghong, Meng Ming. Technology for the catalytic removal of nitrogen oxides in the lean-burn exhaust of vehicles[J]. Chemcial Industry and Engineering,2011,28 (3) : 67–73 |
| [4] | Xu L, Graham G, McCabe R. A NOx trap for low-temperature lean-burn-engine applications[J]. Catal Lett,2007,115 (3/4) : 108–113 |
| [5] | Tkahashi N, Shinjoh H, Ijima T, et al. The new concept 3-way catalyst for automotive lean-burn engine:NOx storage and reduction catalyst[J]. Catal Today,1996 : 63–69 |
| [6] | Hodjati S, Benrhardt P, Petit C, et al. Removal of NOx:Part I. Sorption/desorption processes on barium aluminate[J]. Appl Catal B,1998,19 (3/4) : 221–232 |
| [7] | 李新刚, 孟明, 林培琰, 等. NOx储存催化剂Pt/BaAl2O4-Al2O3的XAFS的研究[J]. 物理化学学报,2001,17 (12) : 1 072-1 076 Li Xingang, Meng Ming, Lin Peiyan, et al. The study of XAFS for the NOx storage catalyst Pt/BaAl2O4-Al2O3[J]. Acta Phys-China,2001,17 (12) : 1 072-1 076 |
| [8] | 李新刚, 孟明, 林培琰, 等. NOx储存催化剂Pt/Ba-Al-O的结构与性能研究[J]. 分子催化,2001,15 (3) : 165–169 Li Xingang, Meng Ming, Lin Peiyan, et al. Study of structure and property of NOx storage catalyst Pt/Ba-Al-O[J]. Journal of moleculer catalysis,2001,15 (3) : 165–169 |
| [9] | Hodjati S, Petit C, Pitchon V, et al. Absorption/Desorption of NOx process on perovskites:Impact of SO2 on the storage capacity of BaSnO3 and strategy to develop thioresistance[J]. Appl Catal B,2001,30 (3/4) : 247–257 |
| [10] | Kim D H, Chin Y H, Muntean G, et al. Design of a reaction protocol for decoupling sulfur removal and thermal aging effects during desulfation of Pt-BaO/Al2O3 lean NOx trap catalysts[J]. Ind Eng Chem Res,2007,46 (9) : 2 735-2 740 |
| [11] | Roedel E, Urakawa A, Kureti S, et al. On the local sensitivity of different IR techniques:Ba species relevant in NOx storage-reduction[J]. Phys Chem Chem Phys,2008 : 6 190-6 198 |
| [12] | Epling W S, Kisinger D, Everest C. NOx storage/reduction catalyst performance with oxygen in the regeneration phase[J]. Catal Today,2008,136 (1/2) : 156–163 |
| [13] | James D, Fourre E, Ishii M, et al. Catalytic decomposition/regeneration of Pt/Ba(NO3)2 catalysts:NOx storage and reduction[J]. Appl Catal,2003 : 147–159 |
| [14] | Brogan M S, Brisley R J, Moore J S, et al. Evaluation of NOx adsorber catalysts systems to reduce emissions of lean running gasoline engines[J]. SAE Paper,1996, doi:10.4271/962045 |
| [15] | Li X, Chen J, Lin P, et al. A study of the NOx storage catalyst of Ba-Fe-O complex oxide[J]. Catal Comm,2004,5 (1) : 25–28 |
| [16] | Skoglundh M, Fridell E. Strategies for enhancing low-temperature activity[J]. Top Catal,2004,28 (1/4) : 79–87 |
| [17] | Tang N, Liu Y, Wang H Q, et al. Mechanism study of NO catalytic oxidation over MnOx/TiO2 catalysts[J]. J Phys Chem C,2011 : 8 214-8 220 |
| [18] | Ko J H, Park S H, Jeoh J K, et al. Low temperature selective catalytic reduction of NO with NH3 over Mn supported on Ce0.65Zr0.35O2 prepared by supercritical method:Effect of Mn precursors on NO reduction[J]. Catal Today,2012 : 290–295 |
| [19] | Kijlstra W S, Brands D S, Poels E K., et al. Kinetics of the selective catalytic reduction of NO with NH3 over MnOx/Al2O3 catalysts at low temperature[J]. Catal Today,1999 : 133–140 |
| [20] | Atsushi U, Takeshi O, Masatake H. Reduction of nitrogen monoxide with propene in the presence of oxygen and moisture over gold supported on metal oxides[J]. Appl Catal B,1997 : 81–93 |
| [21] | Guo L, Xian H, Li Q, et al. NO adsorption behaviors of the MnOx catalysts in lean-burn atmospheres[J]. J Hazard Mater,2013 : 543–551 |
| [22] | Mitsutaka O, Shyunichi N, Susumu T, et al. Chemical vapor deposition of gold on Al2O3, SiO2, and TiO2 for the oxidation of CO and of H2[J]. Catal Lett,1998 : 53–58 |
 2016, Vol. 33
2016, Vol. 33





