钒电池因其具有高能量、成本低、循环寿命长、无污染等优点成为目前大规模储能主要研究的对象,已经成功应用于电网削峰填谷、应急电源和边远地区的供电[1]。电极材料、隔膜、电解液是钒电池关键的3个组成部分,其中电解液的问题较为突出,主要表现为电化学活性不高、稳定性较差等[2, 3]。目前钒电池广泛采用钒离子浓度为2 mol/L,硫酸浓度为2.0~2.5 mol/L的电解液[4]。为了解决电解液活性不高和不稳定性等问题,通常在溶液中加入添加剂在达到高活性和高稳定性的目的[5]。Skyllas-Kazacos等[6, 7, 8]在正极液中分别加入了K2SO4、Na2SO4、K3PO4等碱金属盐,发现能明显增大5价钒离子(文中用V5+表示)的溶液度,提高其热稳定性。Liu等[9, 10, 11]将含多羟基的化合物作为添加剂加入到钒电解液中,结果表明,分子结构中含有2个相反方向羟基的D-山梨醇对电解液电化学活性具有较好的催化作用。但是大多添加剂的选择都具有很大的盲目性。本研究选用几种含有特定官能团的添加剂分析和比较它们对电解液活性和稳定性的影响,得出含有羟基和羧基官能团的添加剂对电解液活性的提高明显优于单一官能团添加剂的结论。减少了实际生产中添加剂选择的盲目性,并且为钒电池复合官能团(含2种及以上)添加剂的选用开辟了新的研究方向。
1 实验部分 1.1 电解液的制备硫酸氧钒(VOSO4)溶液采用电解适量五氧化二钒(V2O5)制得。将22.8 g高纯V2O5粉末加入到4 mol/L 的H2SO4水溶液中,形成悬浊液。将上述悬浊液放入带隔膜电解槽的阴极室,阳极室放入相同浓度H2SO4水溶液,电解、过滤,最后定容至250 mL。电解处理过程中阴极采用面积为16 cm2(4 cm×4 cm)的石墨板,阳极采用面积为25 cm2(5 cm×5 cm)Pt网,电解电流为2 A。
1.2 电化学测试循环伏安测试:采用三电极两回路的测试体系,在上海辰华CHI660B电化学工作站上进行测试。研究电极为4 cm2(2.0 cm×2.0 cm)的石墨板,辅助电极为16 cm2(4.0 cm×4.0 cm)的铂网,参比电极为饱和甘汞电极(SCE),所用盐桥由饱和KCl和琼脂粉混合制成。文中除特别说明外,所列电位均为相对于饱和甘汞电极的电位。从开路电压处开始扫描,扫描范围为0~1.6 V,扫描速度为10 mV/s。测试前,石墨电极在待测溶液中静置30 min[12]。
交流阻抗测试:同样按上述方法组装三电极体系,在上海辰华CHI660B电化学工作站上进行测试。测试开始前,先将电极在电解液中浸泡30 min使开路电位趋于稳定。测试在含有0.01 mol/L 添加剂的0.25 mol/L VOSO4+0.75 mol/L H2SO4中进行。频率范围为 1.0×105~1.0×10-3 Hz,交流信号幅度为 5 mV,从高频区往低频区扫描,交流阻抗数据的拟合借助 ZSimpwin.exe软件进行[12]。
1.3 稳定性试验电解液(1.8 mol/L V5++3.0 mol/L H2SO4)添加不同浓度添加剂后,在50 ℃恒温水浴中放置,分别于第0、5、11、15和19 h观察电解液是否有沉淀生成,移开电解液,量取1 mL利用电位滴定分析法[13]测定上清液V5+的浓度,确定电解液中V5+浓度的变化。
2 结果与讨论 2.1 添加剂对正极液CV特性的影响分别测试了石墨电极在不同添加剂正极液中的CV曲线,结果如图 1所示,相应的电化学参数列于表 1。
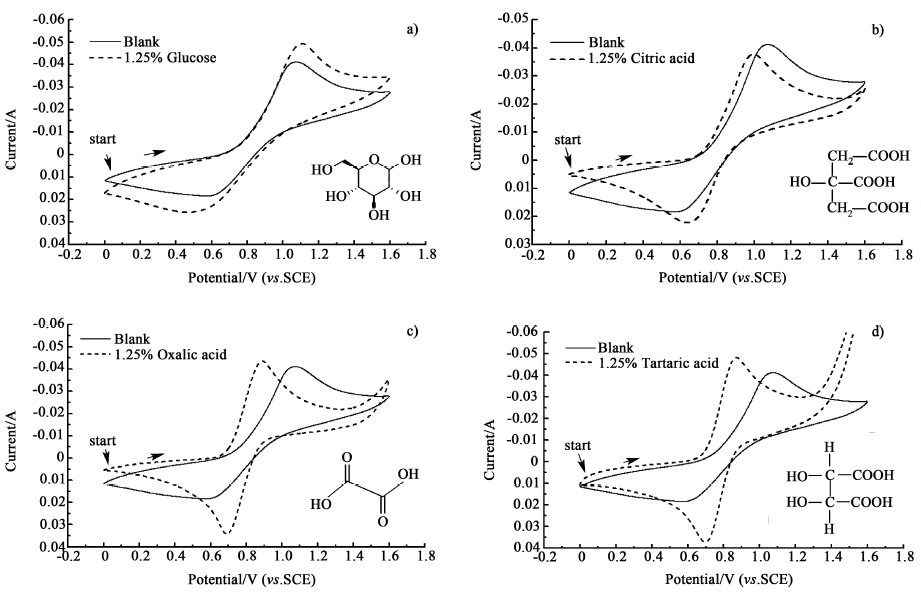
|
| 图 1 含有不同添加剂正极液的循环伏安曲线(CV) Fig.1 Cyclic voltammetry curve of anolyte with different additives |
| Additive | E Pa/V | E PC/V | Δ E P/V | - I Pa/mA | I PC/mA | I Pa/ I PC |
| Blank | 1.073 | 0.571 | 0.502 | 41.2 | 18.4 | 2.239 |
| Glucose | 1.106 | 0.462 | 0.644 | 49.3 | 25.7 | 1.918 |
| Citric acid | 0.996 | 0.641 | 0.355 | 37.7 | 22.2 | 1.698 |
| Oxalic acid | 0.890 | 0.690 | 0.200 | 44.5 | 34.1 | 1.305 |
| Tartaric acid | 0.870 | 0.692 | 0.178 | 48.5 | 37.1 | 1.290 |
由图 1和表 1可以看出,加入1.25%(质量分数,下同)只含有多—OH基团的葡萄糖后,如图 1a),氧化、还原峰电压差略有增大,ΔVP为644 mV,峰电流明显增大,分别提高了19.66%和39.67%。当加入1.25%含有1个—OH和多个—COOH基团的柠檬酸后[如图 1b)]氧化、还原峰电压差明显减小,ΔVP为355 mV,还原峰峰电流增大了20.65%,氧化峰电流减小了8.50%。当加入1.25%含有多—COOH基团的乙二酸后[如图c)],氧化、还原峰电压差ΔVP为200 mV,氧化峰电流基本不变,还原峰电流提高了85.33%,峰值电流之比为1.305,接近于1。当加入1.25%既含有多—COOH基团又含有多—OH基团的酒石酸后[如图d)],氧化、还原峰电压差减小最为明显,ΔVP为178 mV,氧化峰和还原峰电流显著提高,分别提高了85.33%和85.33%,峰值电流之比为1.29,最接近于1,可逆性最好且电化学活性最高。上述结果表明,含多—OH官能团的添加剂葡萄糖能提高正极液的阳极反应活性,对可逆性的提高效果不佳;含多—COOH官能团的添加剂乙二酸能提高正极液阴极反应活性,同时较大的改善了正极液的可逆性;而既含有多—COOH基团又含有多—OH基团的酒石酸能显著提高电极反应可逆性,同时对阴、阳极反应活性均有明显提高。
2.2 含不同添加剂正极液的交流阻抗分析测试了石墨电极在含有不同添加剂正极液中的交流阻抗,结果如图 3所示。高频段出现的圆弧对应电荷传递电阻,低频区表现为1条直线,对应溶液中VO2+和VO2+扩散的Warbrug阻抗。 采用ZSimpwin.exe交流阻抗拟合软件对两种交流阻抗图进行拟合,结果如图 2所示,选择出误差最小的模拟电路,如图 2所示。表 2分别列出了溶液电阻(RS)、电化学极化电阻(RP)和双电层电容(Cd)。由图 3表 2可知,在电解液中添加乙二酸,葡萄糖和酒石酸后,电荷传递电阻、溶液电阻和双电层电容均明显降低;添加酒石酸的正极液阻抗参数变化最为明显,电荷传递电阻由3.919 Ω/cm2减小为1.510 Ω/cm2,溶液电阻由1.706 Ω/cm2减小到1.555 Ω/cm2,电解液活性明显提高,上述结果进一步证明多—OH、多—COOH对正极液电化学反应有明显的催化作用,并且—OH和—COOH(酒石酸)可联合发挥作用。

|
| 图 2 溶液等效电路及其拟合曲线 Fig.2 Selection of the equivalent circuits for anolyte |

|
| 图 3 不同添加剂的正极液中的交流阻抗图谱 Fig.3 Impedance spectra for anolyte with different additives |
| additives | solution resistance R S/(Ω·cm 2) | polarization resistance R P/(Ω·cm 2) | capacitance C d/(F·cm 2) |
| Blank | 1.706 | 3.919 | 0.004256 |
| Oxalic acid | 1.653 | 2.386 | 0.003830 |
| Glucose | 1.645 | 2.123 | 0.003714 |
| Tartaric acid | 1.555 | 1.510 | 0.003442 |
测试了石墨电极在含有不同酒石酸浓度正极液中的CV曲线,结果如图 4所示,电化学参数列于表 3,将CV曲线上的峰电流之比IPa/IPC 和峰电压差ΔEP 随酒石酸浓度作图,如图 5所示。从图 4、图 5和表 3可以看出,氧化、还原峰的相对位置和强度随=酒石酸的的浓度的不同而发生明显变化,随着酒石酸的的浓度的增大还原峰和氧化峰电流表现出先增后减的变化规律,在酒石酸浓度为1.25%时氧化、还原峰电流达到最大,并且两峰电压差ΔEP最小,峰电流之比IPa/IPC 最接近1。上述结果表明,当酒石酸浓度在1.25%时,对提高正极液可逆性和电化学活性效果最好,少量使得提高效果不明显,过量使得造成不利影响。
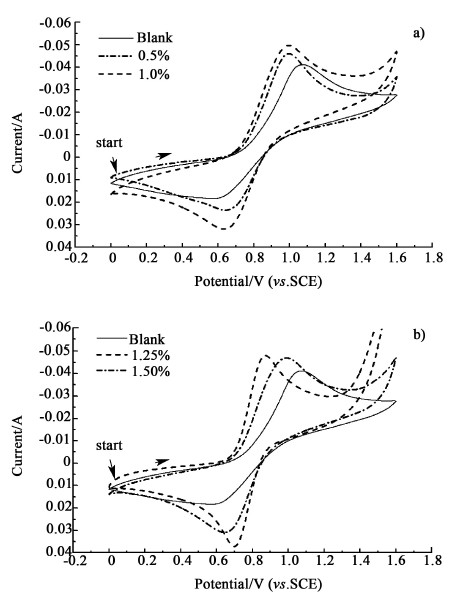
|
| 图 4 含有不同酒石酸浓度的正极液的循环伏安曲线 Fig.4 Cyclic voltammetry curve of anolyte with different concentration tartaric acid |
| concentration/% | E Pa/V | E PC/V | Δ E P/V | - I Pa/mA | I PC/mA | I Pa/ I PC |
| 0 | 1.073 | 0.571 | 0.502 | 41.2 | 18.4 | 2.239 |
| 0.50 | 0.996 | 0.640 | 0.356 | 46.0 | 23.4 | 1.966 |
| 1.00 | 0.992 | 0.663 | 0.329 | 48.1 | 31.9 | 1.508 |
| 1.25 | 0.870 | 0.692 | 0.178 | 48.5 | 37.1 | 1.290 |
| 1.50 | 0.989 | 0.664 | 0.325 | 46.8 | 30.8 | 1.519 |

|
| 图 5 循环伏安曲线上峰电流比和峰电位差 Fig.5 IPa/IPC and ΔEP of cyclic voltammetry curve |
在1.8 mol/L V(V)溶液中分别加入不同浓度的酒石酸作为添加剂,静置于50 ℃水浴中,考察溶液中V5+浓度随时间变化,结果如图 6所示,将放置17和19 h后溶液的浓度列于表 4。

|
| 图 6 含有不同浓度酒石酸V5+溶液的浓度随时间变化曲线 Fig.6 Curve of V5+ concentration changes with time in solution containing different concentration tartaric acid |
| c/(mol·L -1) | Blank | 0.008 | 0.012 | 0.018 |
| 15 h | 0.90 | 1.06 | 1.19 | 1.27 |
| 19 h | 0.72 | 0.92 | 1.05 | 1.12 |
从图 6和表 4可以看出,溶液中V5+浓度随时间的增加而降低,19 h后溶液浓度降低为0.72 mol/L。加入酒石酸后溶液中V5+的稳定性得到了较大改善,并且随着酒石酸浓度的提高,V5+溶液表现出更好的稳定性。上述结果表明,酒石酸能有效抑制V5+的沉淀,提高正极液的稳定性。这可能与酒石酸结构中的—OH和—COOH基团在溶液中与V5+作用有关,从而阻止了V5+的进一步聚合。
3 结论1)CV和EIS测试结果表明,有机官能团—OH更易于V4+结合吸附于电极表面,从而提高氧化反应的活性。—COOH则更易与V5+离子结合吸附于电极表面,从而提高还原反应活性,并且提高了电极过程可逆性。—COOH和—OH联合运用于溶液中,则对正极液的氧化还原反应均有明显提高,并且提高可逆性。
2)V(V)溶液稳定性实验表明,酒石酸在溶液中可与V5+结合,形成一种更为稳定的结构,从而阻止了V5+的进一步聚合,能有效抑制V5+的沉淀,提高正极液的稳定性。
| [1] | Ping Z, Zhang H, Zhou H, et al. Characteristics and performance of 10 kW class all-vanadium redox-flow battery stack[J]. Journal of Power Sources, 2006, 162(2): 1 416-1 420 |
| [2] | Skyllas-Kazacos M, Kasherman D, Hong R, et al. Characteristics and performance of 1 kW UNSW vanadium redox battery[J]. Journal of Power Sources, 1991, 35(4): 399-404 |
| [3] | Skyllas-Kazacos M, Rychcik M. New all vanadium redox flow cell[J]. J Electrochem Soc, 1986, 133(10): 1 057-1 058 |
| [4] | Sum E, Rychcik M. Investigation of the V(IV)/V(V) system for use in the positive half cell of a redox battery[J]. J Power Sources, 1985, 16(8): 85-95 |
| [5] | Rychcik M, Skyllas-Kazacos M. Characteristics of a new all-vanadium redox flow battery[J]. Journal of Power Sources, 1988, 22: 59-67 |
| [6] | Skyllas-Kazacos M. Stabilised electrolyte solutions, method of preparation thereof and redox cells and batteries containing stabilized electrolyte solutions: US, 61434437[P]. 2000 |
| [7] | Menictas C, Cheng M, Skyllas-Kazacos M. Evaluation of an NH4VO3 derived electrolyte for the vanadium-redox flow battery[J]. Journal of Power Sources, 1993, 45: 43-54 |
| [8] | Skyllas-Kazacos M, Peng Z C, Cheng M. Evaluation of precipitation inhibitors for supersaturated vanadyl electrolytes for the vanadium redox battery[J]. Electrochemical and Solid-State Letters, 1999, (3): 121-122 |
| [9] | Li S, Huang K, Liu S, et al. Effect of organic additives on positive electrolyte for vanadium redox battery[J]. Electrochimica Acta, 2011, 56: 5 483-5 487 |
| [10] | Chang F, Hu C, Liu X, et al. Coulter dispersant as positive electrolyte additive for the vanadium redox flow battery[J]. Electrochimica Acta, 2012, 60: 334-338 |
| [11] | Jia Z, Wang B, Song S, et al. Effect of polyhydroxy-alcohol on the electrochemical behavior of the positive electrolyte for vanadium redox flow batteries[J]. Journal of the Electrochemical Society, 2012,159(6): 843-847 |
| [12] | Skyllas-Kazacos M. State of charge monitoring methods for vanadium redox flow battery control[J]. Journal of Power Sources, 2011: 8 822-8 827 |
| [13] | 许国镇. 钒电池充电过程中钒价态及其变化的现场分析[J]. 理化检验-化学分册, 1997, 7(34): 291-294 Xu Guozheng. Field analysis of valency state of vanadium during the charging of vanadium battery[J]. PTCA, 1998, 34(7): 291-294(in Chinese) |
 2016, Vol. 33
2016, Vol. 33





