甲酸钙用途广泛,可用于高硫烟气脱硫助剂,也可作为制备草酸的中间体,此外还可用做饲料添加剂、食品工业添加助剂、石油工业钻探助剂、植物生长调节剂、煤砖黏合剂、润滑剂、建筑材料助剂、制革工业助剂和纤维的辅助材料[1, 2, 3]。目前甲酸钙的生产工艺主要有两大类:一类是甲酸钙作为生产多羟基醇的副产物,另一类是甲酸钙作为反应的主产物[4]。传统的多羟基醇的生产方式[5, 6, 7]是由甲醛和多羟基醛类在碱性(氢氧化钙)条件下生成多羟基醇和甲酸钙,其缺点是甲酸钙的产量受主产物多羟基醇产量的制约。甲酸钙作为反应主产物的生产工艺主要包括中和法甲酸钙生产工艺[8]、流沙状甲酸钙生产工艺[9]、氢氧化钙和甲醛催化合成甲酸钙工艺[10, 11]、复分解法生产甲酸钙工艺、渗析法制取甲酸钙工艺[12]等。以上生产工艺存在成本偏高、污染环境、产量受限等缺点。
随着绿色化学的发展,无毒材料和环境友好型生产工艺受到了广泛的关注[13]。CO已经被证实是一种合成羰基化合物(例如:酮类、醛类、羧酸类以及它们的衍生物)的羰基化的来源[14]。CO可由煤气化得到,也可来自工业废气,如在生产黄磷的尾气中含有80%~90%的CO,电石乙炔法生产聚氯乙烯(PVC)过程中产生的电石炉尾气含有80%以上的CO,此外,电石水解反应的副产物电石渣中含有90%以上的氢氧化钙。CO和氢氧化钙反应生成甲酸钙是一条原子经济性100%的反应,符合绿色化学的理念。因此,利用电石乙炔法生产PVC过程中产生的废弃物电石渣和电石炉尾气为原料制备甲酸钙符合循环经济原则,可变废为宝,提升电石乙炔法生产聚氯乙烯行业利润空间。其主反应方程式如式(1)。
| $ 2CO + Ca{(OH)_2}\buildrel {{H_2}O} \over \longrightarrow Ca{(HCOO)_2} $ | (1) |
目前利用CO与氢氧化钠合成甲酸钠工艺已经实现工业化[15, 16, 17],但是CO与氢氧化钙合成甲酸钙工艺处于基础研究阶段,虽然目前有一些关于氢氧化钙羰基化合成甲酸钙的生产工艺或装置方面的专利报道[18, 19, 20],但是该工艺还没有实现工业化。其中,合成反应动力学是反应器选择和设计计算的主要障碍。动力学方程采用幂函数形式,并估计动力学参数。所得反应动力学为工业上反应器设计及优化提供了依据。
本研究采用高压反应釜,反应开始时加入氢氧化钙,连续通入CO的半连续操作方式合成甲酸钙。在反应过程中通过CO的消耗量及最终氢氧化钙的转化率、甲酸钙的收率等来考察温度、压力、转速工艺条件对反应的影响,建立了动力学方程,并计算得出动力学参数。所得反应动力学可为工业上反应器设计及优化提供依据。
1 实验部分 1.1 试剂氢氧化钙、高锰酸钾、草酸钠、硫酸和盐酸均由天津市科密欧化学试剂开发中心提供;实验中所用的一氧化碳(质量分数99.99%)和氮气(质量分数99.99%)均由天津华北氧气厂提供,蒸馏水由天津大学提供。
1.2 实验装置及实验步骤 1.2.1 实验装置该反应实验仪器为GS-0.5 L高压反应釜,反应器的容积为0.5 L,设计压力20 MPa,设计温度573 K,由威海景弘化工机械有限责任公司提供。反应装置图如图 1所示。
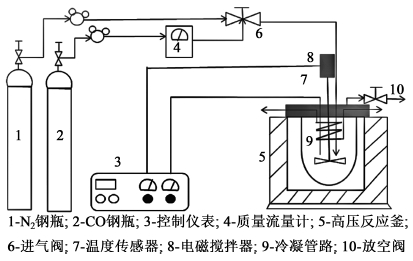
|
| 图 1 实验装置图 Fig.1 Experimental setup of the reaction |
采用高压反应釜,一次加入氢氧化钙,连续通入CO的半连续操作方式合成甲酸钙。反应过程中,通过压力表及温度指示仪表显示釜内压力和温度值,在温度和压力保持恒定的条件下,使用CO质量流量计测定CO流量用以计算CO的反应速率。反应结束后通过中和滴定及氧化还原滴定法测定反应产物中氢氧根离子及甲酸根离子含量,计算该反应的转化率及收率。具体实验步骤如下:1)配置一定浓度的氢氧化钙乳液加入到反应釜中,密封反应釜;2)通入3 MPa氮气,在实验前对装置进行密封性考核,如果5 h内压力降低值小于0.1 MPa即证明密封良好,方可开始实验,否则重新密封反应釜;3)检查反应釜与控制面板之间接触是否良好,检查无误后用CO气体吹扫反应釜2 min后放空反应釜内气体,开启搅拌转速至设定值,设置反应温度并开始加热;4)当温度升至设定值后,打开CO进气阀,通入一定压力的CO开始反应,在整个反应过程中,保持反应釜内压力恒定。记录不同反应时间釜内压力、温度及CO流量;5)CO流量为0时,表明反应已终止,关闭电源,当温度降至室温后,打开尾气阀,放空反应釜内气体,并用氮气吹扫;6)打开反应釜,取出料液,测定料液中甲酸钙与氢氧化钙浓度,计算氢氧化钙的转化率与收率;7)剩余料液取出后过滤,滤液经蒸发、干燥后得到甲酸钙产品。
1.3 分析方法 1.3.1 产物分析采用XRD分析干燥后的固体产品,实验条换为Cu_Kα石墨单色器,管电压为40 kV,管电流为200 mA,探测器为闪烁计数管连续扫描,扫描速度8(°)/min,扫描范围为2θ=10°~90°。
1.3.2 氢氧化钙含量的分析氢氧化钙含量测定使用酸碱滴定法,通过测定盐酸的消耗量计算其浓度。用移液管移取一定量的釜液,用蒸馏水稀释,根据酸碱滴定法测得稀释后釜液中氢氧化钙的浓度。
实验中发现,不同工艺条件下当反应中CO流量为零时,反应终止。此时,由酸碱滴定分析计算得到氢氧化钙的转化率均接近100%。
1.3.3 反应液中甲酸根离子的测定用移液管移取一定量的反应后清液至容量瓶中,用蒸馏水稀释、定容至刻度。然后用移液管移取V mL待测样品溶液和一定体积的高锰酸钾标准溶液(0.02 mol·L-1)于150 mL的碘量瓶中,在(75±5) ℃恒温水浴中加热10 min,取出后迅速加入一定量的硫酸(4 mol·L-1)和草酸钠溶液(0.015 mol·L-1),在(75±5) ℃恒温水浴中保持5 min,取出后用高锰酸钾标准溶液(0.02 mol·L-1)滴定至溶液由无色变为淡红色,且0.5 min不变色(保证滴定终点时溶液温度不低于65 ℃),记录高锰酸钾的消耗量V1。同时做空白实验。稀释后甲酸根含量按公式(2)计算。
| $ {C_{Ca{{(HCOO)}_2}}} = \frac{{({V_1} - {V_0}) \times 5 \times {C_{KMn{O_4}}}}}{{2 \times 2 \times V}} \times 100\% $ | (2) |
式(2)中:CCa(HCOO)2为甲酸钙稀释后浓度,mol·L-1;V0为空白试验中高锰酸钾标准溶液的消耗量,mL;V1为滴定样品时高锰酸钾标准溶液的消耗量,mL;V为待测样品的体积,mL;CKMnO4为高锰酸钾标准溶液的浓度,mol·L-1。反应结束时甲酸钙收率按公式(3)计算。
| $ Y = \frac{{Ca{{(HCOO)}_2} \times \beta \times {V_r} \times {M_{Ca{{(OH)}_2}}}}}{{{m_{Ca{{(OH)}_2}}} \times w}} \times 100\% $ | (3) |
式(3)中:Y为甲酸钙收率;β为釜液稀释的倍数;Vr为反应液体积,L;MCa(OH)2为氢氧化钙相对分子质量,g·mol-1;mCa(OH)2为初始加入氢氧化钙的质量,g;w为初始氢氧化钙原料质量分数。
1.3.4 反应过程中CO反应速率和甲酸钙收率计算反应过程中CO反应速率可由反应稳定后CO流量测定结果按式(4)计算得到。
| $ R = \frac{F}{{22400{V_r}}} $ | (4) |
式(4)中:R为CO反应速率,mol·L-1·min-1;F为CO流量,mL·min-1。
由于反应过程中,取出釜液会使得氢氧化钙同时取出,影响后续实验。因此反应过程中某一时刻的甲酸钙收率由CO累积消耗量计算,计算公式如(5)所示。由于有极少量副反应的发生,试验对比了反应结束时采用CO累计消耗量计算所得甲酸钙收率与测定甲酸根的量所得收率值,两者相差±1.5%,这表明由CO累积消耗量计算甲酸钙收率是可行的。
| $ Y = \frac{{R \times {V_r} \times t \times {M_{Ca{{(OH)}_2}}}}}{{2 \times {m_{Ca{{(OH)}_2}}} \times w}} \times 100\% $ | (5) |
式(5)中:t为反应时间,min。
2 结果与讨论 2.1 反应产物分析实验结束后,釜液经过自然结晶得到甲酸钙固体。固体产物由XRD分析,结果如图 2所示。
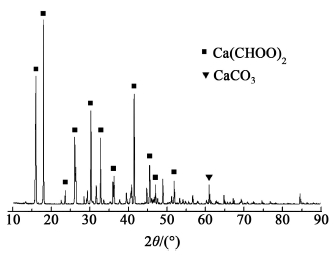
|
| 图 2 产物的XRD分析 Fig.2 The XRD result of the product |
由图 2可以看出所得产品中主要为甲酸钙,并有少量的碳酸钙。由反应产物、滤渣分析结果推测氢氧化钙羰基化合成甲酸钙可由以下反应途径得到:1)CO与水反应生成甲酸;2)反应生成的甲酸与氢氧化钙发生中和反应生成甲酸钙。另外,反应过程中也可能发生水煤气变换反应生成CO2,CO2与氢氧化钙反应会生成碳酸钙。由于水汽变换反应通常需要催化剂的参与,在本实验条件下水汽变换反应较弱,产物中含有较少量的碳酸钙,所以与生成甲酸钙的主反应相比,生成碳酸钙的副反应可以忽略不计。
2.2 传质阻力的影响由于该反应发生在气液相界面,CO由气相主体向液面扩散时存在液膜阻力,对氢氧化钙羰基化反应速率有一定的影响,因此为了获得该反应的动力学方程,需要考察不同搅拌转速下,传质阻力对反应速率的影响。本实验在反应压力为3 MPa,温度为443 K,氢氧化钙的初始浓度为0.097 g·mL-1的条件下,考察了4个不同的搅拌转速(400、600、800和1 000 r/min)对反应的影响。
如图 3所示,搅拌转速为400 r/min时,反应速率较小,搅拌转速增加到600 r/min后,反应速率随搅拌转速的增加基本不变。说明此时CO在气、液间的传质阻力可以忽略且CO与氢氧化钙混合充分。在本研究关于动力学的实验中,为了排除CO扩散阻力的影响,实验均在搅拌速率1 000 r/min下进行。

|
| 图 3 搅拌速率对反应的影响 Fig.3 The influence of stirring speed |
在反应压力为3 MPa、转速为1 000 r/min、温度为443 K下,考察了不同氢氧化钙浓度(0.097~0.145 g·mL-1)对反应速率及甲酸钙收率的影响,见图 4。

|
| 图 4 甲酸钙收率a)和CO消耗速率b)随时间变化 Fig.4 Calcium formate yield a) and CO reaction rate b) vs. time |
如图 4a)所示,随着氢氧化钙浓度的增加,反应达到终点的时间延长。图 4b)显示出了不同氢氧化钙初始浓度下CO反应速率随反应时间的变化。由图 4b)可以看出反应速率基本不随氢氧化钙初始浓度的变化而变化。因为氢氧化钙是难溶性物质,在一定的反应温度下,氢氧化钙的溶度积是一定的,提高氢氧化钙的浓度无法提高反应体系中钙离子的浓度,因此初始氢氧化钙浓度对反应基本没有影响。
2.4 反应压力的影响反应体系压力直接影响溶液中CO的浓度,所以压力是影响氢氧化钙羰基化合成甲酸钙工艺条件之一。在反应温度为443 K,转速为1 000 r/min,氢氧化钙初始浓度为0.097 g/mL的条件下,考察CO的压力(2.6~3.5 MPa)对反应的影响,见图 5。
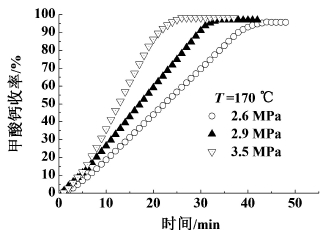
|
| 图 5 压力对反应的影响 Fig.5 Influence of pressure on yield of calcium formate |
图 5说明随着CO压力增大,反应速率增大,反应终止后甲酸钙收率基本不变,均可达到接近100%,只是达到最大收率所需的时间不同。由亨利定律可知,随着CO压力升高,CO在水中的溶解增大,因此其反应速率增大,达到反应完全所需的时间变短。但是考虑压力越高对设备的材质要求越高,因此适宜的反应压力为3 MPa。
2.5 反应温度的影响温度是影响氢氧化钙羰基化合成甲酸钙反应的工艺条件之一。在反应压力为2.9 MPa、转速为1 000 r/min、氢氧化钙的初始浓度为0.097 g/mL的条件下,考察了反应温度(T=423~453 K)对反应的影响,结果如图 6所示。
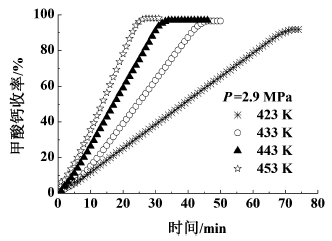
|
| 图 6 温度对反应的影响 Fig.6 The influence of reaction temperature on the yield of calcium formate |
由图 6可以看出,随着反应温度升高,反应速率明显加快,达到甲酸钙的最大收率所需时间缩短,从动力学角度进行分析,气液两相间的传质速率及羰基化反应速率随着温度的升高而增大,所以升高温度有利于反应的进行。另外,随着温度的升高,氢氧化钙在水中的溶解度变小,降低溶液中氢氧化钙的浓度,减小羰基化反应速率,所以从氢氧化钙浓度变化方面考虑,升高温度不利于反应的进行。但是从图 6可以看出,随着温度的升高,反应速率增大,这说明温度对反应速率常数的影响相比对氢氧化钙水中溶解度的影响要显著。有文献报道,当温度超过653 K时,甲酸钙会部分分解。工业放大时反应温度越高对反应釜的材质及能量要求越高,所以,适宜的反应温度为423~453 K。
2.6 动力学模型 2.6.1 动力学方程建立氢氧化钙羰基化合成甲酸钙的反应为不可逆反应,反应速率可用幂函数表达,如式(6)所示:
| $ R = {k_0}C_{Ca{{(OH)}_2}}^aC_{CO}^b $ | (6) |
CO在溶液中达到平衡时,其浓度可由亨利定律得出,即CCO=PCO/HCO,其中HCO为CO在水中的亨利系数,令k1=k0/HCOb,则式(6)可写成式(7):
| $ R = {k_1}C_{Ca{{(OH)}_2}}^aP_{CO}^b $ | (7) |
鉴于氢氧化钙在水中的溶解度很小,所以在整个反应过程中,液相中溶解的氢氧化钙浓度CCa(OH)2为恒定值,因此氢氧化钙在溶液中的浓度可视为常数,则式(7)可以写成式(8)。
| $ R = kP_{CO}^b $ | (8) |
对方程式(8)整理可得方程式(9)。
| $ \ln R = b\ln {P_{CO}} + \ln k $ | (9) |
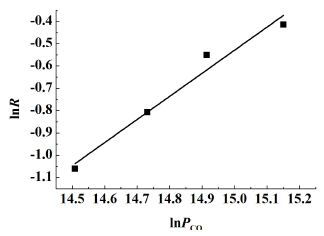
在反应温度为443 K,转速为1 000 r/min,氢氧化钙初始浓度为0.097 g/mL的条件下,考察CO的压力(2.0~3.5 MPa)对反应速率的影响。以lnR为纵坐标,lnPCO为横坐标作图,如图 7所示,得到1条直线,其斜率即为CO的反应级数。结果为CO的级数为1.0级,所以,氢氧化钙羰基化合成甲酸钙的宏观动力学方程为:
| $ R = k{P_{CO}} $ | (10) |
|
| 图 7 反应速率与压力的关系图 Fig.7 The plot of lnR vs. lnPCO |
方程式(10)中k为反应速率常数,其与温度T的函数符合Arrhenius方程(11):
| $ \ln k = \ln A - \frac{{{E_a}}}{R} \bullet \frac{1}{T} $ | (11) |
当压力为2.9 MPa,温度由423~463 K变化时,不同温度下反应速率常数如表 1所示,以lnk为纵坐标,1/T为横坐标,得到图 8,由该直线的斜率和截距求得反应活化能Ea=54.7 kJ·mol-1,指前因子A=0.7756 mol·L-1·min-1·Pa-1。
| T/K | k×108/(mol·L-1·min-1·Pa-1) | T-1/K-1 | lnk |
| 422.0 | 1.21 | 0.002370 | -18.234 |
| 434.0 | 2.18 | 0.002304 | -17.643 |
| 451.5 | 3.73 | 0.002215 | -17.104 |
| 459.0 | 4.22 | 0.002179 | -16.981 |
| 442.5 | 2.91 | 0.002260 | -17.351 |

|
| 图 8 反应速率常数与温度关系图 Fig.8 Relationship between reaction rate constant and temperature |
图 9为由动力学方程计算所得CO反应速率与实验所得CO反应速率的对比。

|
| 图 9 实验值与计算值对比图 Fig.9 The comparison of experimental and calculating rate |
由图 9可知,在转速为1 000 r/min,压力为2.0~3.5 MPa,温度为423~453 K范围内,CO反应速率的实验值与计算值相差在±10%以内,说明所建立的反应动力学可以较好地预测实验结果。
3 结论1)在水溶液中进行的氢氧化钙羰基化反应包含生成甲酸钙的主反应与生成碳酸钙的副反应,与主反应相比,副反应速率很小以致可以忽略。
2)通过考察不同反应温度、压力、转速和氢氧化钙初始浓度下合成甲酸钙的反应速率,得出了适宜的反应条件,由建立的宏观动力学方程可以得到关于CO反应级数为一级,该反应的活化能为54.7 kJ·mol-1,说明CO是影响该半连续反应的主要因素。
3)在转速为1 000 r/min,压力为2.0~3.5 MPa,温度为423~453 K范围内对宏观动力学计算值和实验值进行了比较,误差均在±10%以内,符合工业应用中模型精度要求,可为工程放大提供重要的基础依据。
| [1] | 王九思, 马思基. 甲酸钙的合成及应用研究[J]. 甘肃化工, 1993, (3): 14-15 Wang Jiusi, Ma Siji. The synthesis and application of calcium formate[J]. GanSu Chemical, 1993, (3): 14-15(in Chinese) |
| [2] | Reed R J. Novel method for the production of hydrogen and hydrogen-carbon monoxide mixtures: US, 4087373[P]. 1978-05-02 |
| [3] | 褚森泉. 黄磷尾气的综合利用[J]. 化肥工业, 1997, 24(3): 55-57 Zhe Senquan. Comprehensive utilization of phosphorus furnace tail gas[J]. Jounal of Chemical Fertilizer Industry, 1997, 24(3): 55-57(in Chinese) |
| [4] | 武红杰, 李振花, 马新宾. 氢氧化钙羰基化合成甲酸钙工艺研究[J]. 化学反应工程与工艺, 2007, 23(2): 168-172 Wu Hongjie, Li Zhenhua, Ma Xinbin. Study on synthesis of calcium formate by calcium hydroxide carbonylation[J]. Chemical Reaction Engineering and Technology, 2007, 23(2): 168-172(in Chinese) |
| [5] | 聂颖, 肖明. 季戊四醇的生产技术进展及市场分析[J]. 化工文摘, 2009, (6): 21-24 Nie Ying, Xiao Ming. Production technology advance and market analysis of pentaerythritol[J]. China Chemical, 2009, (6): 21-24(in Chinese) |
| [6] | 张健伟, 赫广田. 单,双季戊四醇的合成工艺研究[J]. 天然气化工: C1 化学与化工, 2007, 32(5): 40-42 Zhang Jianwei, Hao Guangtian. Study on the synthesis of pentaerythritol an dipentaerythritol[J]. Nature Gas Chemical Industry, 2007, 32(5): 40-42(in Chinese) |
| [7] | 贺楚华, 李珊, 肖志海, 等. 单,双,三季戊四醇的合成[J].化工时刊, 2005, 19(1): 11-13 He Chuhua, Li Shan, Xiao Zhihai, et al. Synthesis of mono-, di-and tri-pentaerythritol[J]. Chemical Industry Times, 2005, 19(1): 11-13(in Chinese) |
| [8] | 钟国清. 饲料添加剂甲酸钙的合成研究与应用[J]. 粮油食品科技, 2002, 10(1): 23-24 Zhong Guoqing. Synthesis and application of calcium formate used as feed additive[J]. Science and Technology of Cereals, Oils and Foods, 2002, 10(1): 23-24(in Chinese) |
| [9] | 李国庭, 潘福星, 冯树波. 流沙状甲酸钙的生产[J]. 饲料工业, 2005, 26(4): 45-46 Li Guoting, Pan Fuxing, Feng Shubo. The production of quick sand-like calcium formate[J]. Feed Industry, 2005, 26(4): 45-46(in Chinese) |
| [10] | 罗宗恬. 甲酸钙的合成[J]. 磷酸盐工业, 2000, (2): 24-26 Luo Zongtian. The synthesis of calcium formate[J]. Phosphate Industry, 2000, (2): 24-26(in Chinese) |
| [11] | Duderstadt U, Trageser M, Werle P. Process for the production of calcium formate: US, 5248818A[P]. 1993-09-28 |
| [12] | 薛强, 陈金芳, 陈启明, 等. 渗析法合成甲酸钙[J]. 武汉工程大学学报, 2009, 31(1): 10-12 Xue Qiang, Chen Jinfang, Chen Qiming, et al. Study on synthesis process of calcium formate by dialysis[J]. Journal of Wuhan Institute of Technology, 2009, 31(1): 10-12(in Chinese) |
| [13] | Yu Y, Liu X, Zhang W, et al. Electrosynthesis of dimethyl carbonate from methanol and carbon monoxide under mild conditions[J]. Ind Eng Chem Res, 2013, 52(21): 6 901-6 907 |
| [14] | Beller M. Catalytic carbonylation reactions[M]: Springer: Springer Berlin Heidelberg, 2006 |
| [15] | Zhang S, Yuan J. A new craftwork for producing sodium formate by carbon monoxide in the synthetic ammonia virgin gas: CN, 101033183A[P]. 2007-09-12 |
| [16] | Iwata M. Reaction rate of formation of sodium formate under low pressure (2-7 kg/cm2)[J]. Nagaoka Kogyo Tanki Daigaku Koto Semmon Gakko Kenkyu Kiyo, 1968, 4(4): 307-313 |
| [17] | Pohorecki R, Moniuk W, Kumur A, et al. Kinetics of sodium formate synthesis[J]. Inz Chem Procesowa, 1987, 8(3): 391-406 |
| [18] | 曹正祥, 曹勇. 一氧化碳与氢氧化钙连续羰基化制备甲酸钙装置: CN, 200820214570.0[P]. 2009-10-14 |
| [19] | 曾舟华, 黄春保, 陈年友, 等. 单级循环或多级串联式生产甲酸钙的装置: CN, 200920228830.4[P]. 2010-06-30 |
| [20] | 许风玉, 赵靖宇. 一种利用一氧化碳和氢氧化钙制备甲酸钙的方法: CN, 201010212519.8[P]. 2010-11-10 |
 2016, Vol. 33
2016, Vol. 33





