5-氟尿嘧啶(5-fluorouracil,5-FU)是治疗消化道癌症的首选药物,临床上主要用于治疗胃、肝、肠等多种癌症。但其本身存在治疗剂量大,不良反应多如胃肠道反应、骨髓抑制等[1, 2]安全性问题。另外5-FU的半衰期只有10~20 min,在体内滞留时间短,口服吸收不完全,生物利用度低[3, 4],故需要频繁给药。为了降低5-FU的毒性,延长半衰期,减少给药次数,提高生物利用度,本研究包含5-FU的可生物降解缓释微球的制备工艺。
复乳在药剂学、食品等领域有广阔的应用前景。W/O/W型复乳是具有两膜三相结构的多相体系,包括内水相、油相和外水相,在相界面处有内油水界面膜和外油水界面膜,可以将一些性质不同的物质溶解在不同的相中,起到隔离、保护、缓释、控释、靶向释放等效果[5, 6, 7]。本实验中将5-FU包入W/O/W型复乳中制备微球。
复乳本质上是热力学不稳定体系,储存和使用过程中极易发生絮凝、聚结和分层,同时还有很多因素会影响复乳的稳定性,使复乳的实际应用受到许多限制[8, 9, 10, 11]。本研究采用复乳溶剂挥发法,以乳层保留率为指标,单因素考察了第一相体积比、第二相体积比对复乳稳定性的影响。在此基础上,以包封率为指标,采用L9 (34)正交设计表优化处方组成与制备工艺,并对制备的5-FU复乳微球进行了考察。
1 实验部分 1.1 实验材料与仪器聚乳酸-羟基乙酸共聚物(PLGA),相对分子质量为30 000,单体比50∶50,济南岱罡生物科技有限公司;二氯甲烷,分析纯,天津大学科威新材料科技开发公司;泊洛萨姆188,药用级,山东聊城安信药用辅料有限公司。
JD 100-3多功能电子天平,沈阳龙腾电子有限公司;765紫外-可见分光光度计,上海精密仪器科技有限公司;XW-80A型旋涡混合器,上海医科大学仪器厂;85-2型数显恒温磁力搅拌器,上海司乐仪器有限公司;HZS-H超级恒温水浴振荡器,哈尔滨市东联电子科技开发有限公司;DT5-6型台式离心机,北京时代北利离心机有限公司;SCIENTZ-П D型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;BT-1600图像颗粒分析系统,丹东市百特仪器有限公司;ALPHA 1-2冷冻干燥机,德国CHRIST公司。
1.2 初乳和复乳制备将适量5-FU加入NaOH水溶液中,作为内水相,将其加入含PLGA的二氯甲烷油相中,超声1 min,制得初乳。将初乳加入1%泊洛萨姆水溶液中,190 Hz超声1 min,制得复乳,继续搅拌使二氯甲烷挥发。2 500 r/min离心10 min收集微球[12, 13, 14]。用蒸馏水洗涤后再次离心。移去上清液后,取下层沉淀物,真空冷冻干燥,即得5-FU PLGA微球。
1.3 复乳稳定性的初步研究复乳界面上的乳化剂容易在油相中迁移而重新分配,影响复乳稳定性。本研究采用单因素实验考察第一相体积比(内水相与油相)、第二相体积比(第一相与外水相)对复乳稳定性的影响。首先固定内水相的体积,按照1.2项下制备工艺,设定内水相、油相体积比分别为2∶1、1∶1、1∶2、1∶3和1∶4,855 Hz超声1 min,制得初乳。再向初乳中加入适量泊洛萨姆水溶液,设定初乳与外水相的体积比分别为1∶1、1∶2、1∶3、1∶4和1∶5,380 Hz超声1 min,制得复乳。将初乳和复乳分别离心,测定离心管中的总物料体积及析出的连续相体积,用离心后的乳层保留率评价其稳定性[15, 16, 17]。乳层保留率[18, 19, 20]的计算见式(1)。
| $乳层保留率 = \left( {\frac{{总体积 - 析出连续相体积}}{{总体积}}} \right) \times 100\% $ | (1) |
以包封率为评价指标,优化微球处方和工艺。通过紫外分光光度计测定残留水层中5-FU的吸光值,由标准曲线求出5-FU的含量,计算包封率,见式(2)。
| $包封率 = \left( {1 - \frac{{残留水层中5-FU的含量}}{{投入5-FU总量}}} \right) \times 100\% $ | (2) |
标准曲线的制备:精确称取5-FU 20.02 mg,用0.1 mol/L NaOH溶液溶解并定容,作为母液。将母液稀释配制成4.00、8.01、10.01、12.01、14.01和16.02 μg/mL一系列标准溶液,测定其在266 nm处的吸收值,以浓度(C)为横坐标、吸光值(A)为纵坐标制备标准曲线并进行线性回归,得回归方程:A=0.03317C+0.05451,r2=0.9991。结果表明5-FU浓度在4.00~16.02 μg/mL范围内线性关系良好。
1.4.2 工艺参数的优化在单因素考察的基础上,以包封率为评价指标,选择搅拌温度(A)、搅拌时间(B)、PLGA在有机相中浓度(C)、辅料浓度(D)4个因素,每个因素选择3水平,按L9(34)正交试验设计表设计9组实验,筛选最适宜处方组成和制备工艺。
1.5 微球质量考察 1.5.1 形态与粒度取1滴微球混悬液滴到载玻片上,显微镜下采集图片并用BT-1600型图像颗粒分析仪分析微球的形态、粒径及其粒度分布。
1.5.2 包封率和载药量精密称取10.03 mg微球溶于0.5 mL二氯甲烷中,完全溶解后加入4.5 mL NaOH溶液并混匀,然后14 500 r/min离心10 min除去载体材料,取上清液并用生理盐水(pH值为7.4)稀释10倍。用紫外分光光度计测定药物吸光值,以标准曲线计算5-FU含量,进而计算包封率和载药量,见式(3)。
| $载药量 = \left( {\frac{{微球中的5-FU含量}}{{微球的质量}}} \right) \times 100\% $ | (3) |
本实验采用恒温水浴振荡器,精密称取20.02 mg微球置于准备好的透析袋中,往透析袋中加5 mL生理盐水,放于含有45 mL生理盐水(pH值为7.4)的锥形瓶中,控制温度为37 ℃,转速为100 r/min,分别于30 min、1、2、3、4、5、10和24 h等时间点取5 mL释放介质于西林瓶中,补加同体积的同温生理盐水,在266 nm处测定吸光值。其中第n个点的累积释放率见式(4)。
| $Q = \frac{{50{c_n} + \sum\nolimits_{i = 1}^{n - 1} {2{c_i}} }}{m} \times 100\% $ | (4) |
其中m为所加样品中药物质量,Cn为第n个点的药物浓度。
2 结果与讨论 2.1 复乳的稳定性考察 2.1.1 第一相体积比的考察第一相的制备过程中未使用乳化剂,内水相与油相体积比对5-FU初乳稳定性的影响见表 1。
| 实验序号 | V(内水相)∶V(油相) | 乳层保留率/% |
| 1 | 2∶1 | 69.4 |
| 2 | 1∶1 | 81.8 |
| 3 | 1∶2 | 92.1 |
| 4 | 1∶3 | 87.7 |
| 5 | 1∶4 | 61.8 |
由表 1可知,随着内水相体积减小,初乳的稳定性先提高后降低,这是因为内水相体积过大时,油膜相对较薄,不能对内水相起到足够的保护作用,乳滴容易破裂,稳定性差。当内水相与油相的体积比减小到1∶2时,稳定性最好。体积比继续减小,有效油相流动性增强,使初乳稳定性降低,故最适宜第一相体积比为1∶2。
2.1.2 第二相体积比的考察第二相的制备过程中以泊洛沙姆作为乳化剂,初乳与外水相体积比对复乳的稳定性结果见表 2。
| 实验序号 | V(初乳)∶V(外水相) | 乳层保留率/% |
| 1 | 1∶1 | 87.3 |
| 2 | 1∶2 | 70.2 |
| 3 | 1∶3 | 65.9 |
| 4 | 1∶4 | 59.2 |
| 5 | 1∶5 | 50.4 |
由表 2可知,随着初乳相与外水相的体积比降低,复乳的稳定性下降。这是由于初乳体积分数较小时,乳液的黏度较小,不利于稳定;初乳体积分数逐渐增大,体系黏度增大,甚至表现出凝胶状态,复乳稳定性提高,但是流动性较差,且容易聚结、转相,使复乳的结构破坏;当初乳与外水相的体积比接近疏堆积的相体积分数时,乳液最稳定[19]。故为得到相对稳定的复乳微球,选择最适宜第二相体积比为1∶1。
2.2 处方制备与工艺优化 2.2.1 因素水平的确定在预实验中单因素考察的基础上,第一相体积比为1∶2,第二相体积比为1∶1。选定搅拌温度(A)、搅拌时间(B)、有机相载体材料浓度(C)和辅料浓度(D)为正交设计考察的因素。因素水平表见表 3。
采用L9(34)正交设计表安排9组实验,以包封率为评价指标,考察各因素对指标的影响,确定最优处方。正交试验结果见表 4。极差越大,表明各因素的影响越大。由此可知各因素对微球包封率的影响程度排序为A>D>C>B。
| 编号 | A/℃ | B/h | C/% | D/% | 包封率/% |
| 1 | 10 | 4 | 10 | 1.0 | 63.04 |
| 2 | 10 | 5 | 15 | 0.5 | 73.20 |
| 3 | 10 | 6 | 20 | 0.2 | 63.35 |
| 4 | 25 | 4 | 15 | 0.2 | 49.68 |
| 5 | 25 | 5 | 20 | 1.0 | 46.04 |
| 6 | 25 | 6 | 10 | 0.5 | 62.76 |
| 7 | 40 | 4 | 20 | 0.5 | 62.51 |
| 8 | 40 | 5 | 10 | 0.2 | 57.40 |
| 9 | 40 | 6 | 15 | 1.0 | 63.83 |
| 均值1 | 66.53 | 58.41 | 61.07 | 57.64 | |
| 均值2 | 52.83 | 58.88 | 62.24 | 66.16 | |
| 均值3 | 61.25 | 63.31 | 57.30 | 56.81 | |
| 极差 | 13.70 | 4.90 | 4.94 | 9.35 |
由表 3可知,搅拌温度对微球包封率的影响最大。随着外水相温度的升高,微球粒径有减小的趋势,原因可能是高温使分散相的黏度降低,有利于O/W乳滴的分散。升高温度,可加快溶剂挥发,微球包封率提高,结果与文献报道一致[21]。但是高温过高时,微球表面快速固化,易产生孔洞,导致包封率降低。
辅料的浓度在微球的稳定性过程中有一最佳值0.5%。当溶液中泊洛沙姆的浓度增大时,表面张力不断下降,有利于药物包封率的提高。若继续增大泊洛沙姆的浓度,其达到一定值后对微球质量影响不大,此时乳化剂分子在水溶液中可能会形成球状和棒状胶团,不再起到更好的乳化效果。
随着药酯比的增加,微球的包封率有增大趋势。但是当药物量超过其在二氯甲烷中的饱和浓度时,过量的药物形成沉淀不会被包入微球中。制备时间对微球粒径的影响最小。原因可能是微球表面的快速固化阻碍了药物向外水相的流失,因此即使延长固化时间,也不会有药物泄露。
制备微球的最适宜因素水平组合为:A1-B3-C2-D2,即搅拌温度10 ℃、搅拌时间6 h、PLGA在有机相中浓度为15%、辅料浓度为0.5%。
2.3 微球质量考察 2.3.1 形态与粒径按优选处方制备微球,所得微球为乳白色粉末状。目测冻干微球色泽为白色,颜色均匀,无花斑,表面光滑细腻,较疏松,流动性良好,再分散性良好。将微球溶于蒸馏水中,制成混悬液,滴1滴于载玻片,分布均匀,用BT-1600型图像颗粒分析仪分析微球形态。放大5倍,见清晰的复乳照片,如图 1。

|
| 图 1 微球的照片及放大5倍后微球的照片 Fig.1 Figures of the microspheres and (×5) of microspheres |
粒度分布结果和微球圆形度见图 2和图 3。
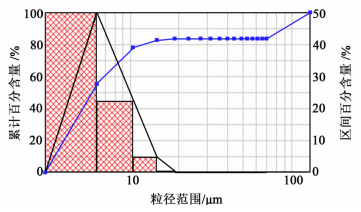
|
| 图 2 微球的粒径分布 Fig.2 The particle size distribution of the microspheres |
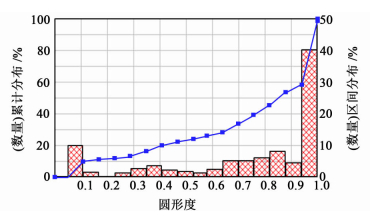
|
| 图 3 微球的圆形度 Fig.3 The sphericity of the microspheres |
由结果可知,最适宜处方的平均粒径为5.05 μm,图 2中颗粒数目477,最大颗粒60.39 μm,最小颗粒0.83 μm,圆形度0.72,长径比1.29。由此可见,优选处方的微球圆整度较好,且粒径较均匀。
2.3.2 包封率和载药量按照优选的处方制备3批微球,包封率和载药量结果见表 5。
| 批次 | 平均粒径/μm | 载药量/% | 包封率/% |
| 1 | 5.05 | 5.41 | 79.41 |
| 2 | 5.74 | 5.03 | 71.67 |
| 3 | 4.81 | 5.58 | 80.55 |
| 平均值 | 5.20 | 5.34 | 77.22 |
| RSD/% | 9.23 | 5.24 | 6.26 |
由表 5可知,最适宜工艺制备的5-FU PLGA微球重现性较好,平均粒径5.20 μm,载药量5.34%,包封率为77.22%。
2.3.3 体外释放微球体外释放结果见图 4。
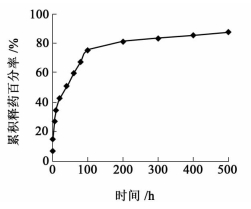
|
| 图 4 微球体外释放曲线 Fig.4 The in vitro release profile of microsphere |
微球在0.5 h的释药率为6.89%,不存在明显的突释现象。微球在48 h内释药速度相对较快,释放了约50%的药量,之后释药速度变慢。20 d的累积释放率为87.03%,而原药10 h已释放完全,表现出明显的缓释效果。
分别按零级、一级、Higuichi方程拟合释药行为,经回归处理得直线方程:
Q=0.0013t+0.3783,r=0.7939(零级)
In(1-Q)=-0.0038t-0.5085,r=0.9063(一级)
Q=0.0353t1/2 +0.2304,r=0.9204(Higuichi方程)
拟合结果表明微球体外释放行为较符合Higuchi模型,这与有关文献的报道[22, 23]一致。
3 结论本研究采用复乳溶剂挥发法制备5-FU-PLGA微球,采用单因素试验和正交设计考察处方与制备工艺对复乳稳定性和微球质量的影响。结果表明第一相体积比1∶2、第二相体积比1∶1时,可制备相对稳定的微球。PLGA浓度为15%、辅料浓度为0.5%、搅拌温度为10 ℃,搅拌时间为6 h时,制备的微球重现性好,粒径均匀,圆整度好,平均粒径5.20 μm,包封率在70%以上。微球体外释放实验显示释放行为符合Higuchi模型,具有较好的缓释特性。与文献[22, 23]中制备的微球比较,本研究制备的微球粒径更小(为5.20 μm),可进一步制成注射剂等,具有更广泛的用途。
| [1] | Parulekar W, Marsh R W D, Wong R, et al. Phase I study of 5-fluorouracil and leucovorin by continuous infusion chronotherapy and pelvic radiotherapy in patients with locally advanced or recurrent rectal cancer[J]. Int J Radia Oncol Biol Phys, 2004, 58(5): 1 487-1 495 |
| [2] | Diasio R B. Improving fluorouracil chemotherapy with novel orally administered fluoropyrimidines [J]. Drugs, 1999, 58(3): 119-126 |
| [3] | Cai T B, Tang X, Nagorski J, et al. Synthesis and cytotoxicity of 5-fluorouracil/diazeniumdiolate conjugates[J]. Bioorg Med Chem, 2003, 11(23): 4 971-4 975 |
| [4] | Peyman G A, Conway M, Khoobehi B. Clearance of microsphere-entrapped 5-fluorouracil and cytosine arabinoside from the vitreous of primates [J]. International Ophthalmology, 1992, 16: 109-113 |
| [5] | 卜书红, 肖斌. 5-氟尿嘧啶复乳的制备和质量控制[J]. 中国药房, 1999, 10(6): 257-258 Bu Shuhong, Xiao Bin. The preparation and quality control of 5-fluorouracil multiple emulsion[J]. China Pharmacy, 1999, 10(6): 257-258(in Chinese) |
| [6] | 吴琼珠, 平其能, 刘国华. 复乳处方设计及其物理稳定性的初步研究[J]. 中国医药工业杂志, 1990, 21(6): 252-255 Wu Qiongzhu, Ping Qineng, Liu Guohua. Formulation and physical stability of W/O/W multiple emulsion[J].Chinese Journal of Pharmaceuticals, 1990, 21(6): 252-255 (in Chinese) |
| [7] | 王浩, 顾吉晋, 邓英杰. 复乳-溶剂挥发法制备氧化苦参碱脂质体[J]. 成都医学院学报, 2010, 1(1): 21-23 Wang Hao, Gu Jijin, Deng Yingjei. Preparation of liposomal oxymatrine by multiple emulsification-solvent evaporation methed[J]. Journal of Chengdu Medical College, 2010, 1(1): 21-23(in Chinese) |
| [8] | 尹静波, 陈红丹, 罗坤, 等. 生物可降解5-氟尿嘧啶载药微球的制备及性能研究[J]. 高等学校化学学报, 2005, (26): 1 174-1 176 Yin Jingbo, Chen Hongdan, Luo Kun, et al. Preparation and properties of biodegradable microspheres containing 5-fluorouracil[J]. Chemical Research in Chinese Universities, 2005, (26): 1 174-1 176(in Chinese) |
| [9] | 武玉敏, 李大伟. 溶剂蒸发法在微球制备中的应用[J]. 食品与药品, 2005, 7(3): 43-46 Wu Yumin, Li Dawei. Application of solvent evaporation method in the preparation of microspheres[J]. Food and Drug, 2005, 7(3): 43-46(in Chinese) |
| [10] | Wang Z. A water-in-oil-in-water (W/O/O/W) method for producing drug-releasing double-walled microspheres[J]. Int J Pharmaceut, 2009, 374: 90-95 |
| [11] | 邱海霞, 田景振, 梅兴国. 氟尿嘧啶聚乳酸微球的制备工艺及体外释药特性[J]. 中国医药工业杂志, 2006, 37(4): 245-247 Qiu Hiaxia, Tian Jingzhen, Mei Xingguo. Preparation and in vitro release of fluorouracil PLA-microspheres[J]. Chinese Journal of Pharmaceuticals, 2006, 37(4): 245-247(in Chinese) |
| [12] | 沈正荣, 朱家蒽, 张伟军, 等. 5-Fu/PLGA微球的制备[J]. 现代应用药学, 1993, 10(3): 14-16 Shen Zhengrong, Zhu Jiahuei, Zhang Weijun, et al. Preparation of poly (DL-lactide-co-glycolide) microspheres containing 5-fluorouracile[J]. Application of Modern Medicine, 1993, 10(3): 14-16(in Chinese) |
| [13] | 谭红香, 叶建东. PLGA包埋硫酸庆大霉素缓释微球的制备及体外释放行为[J]. 中国抗生素杂志, 2007, 32 (11): 682-685 Tan Hongxiang, Ye Jiandong. Preparation and in vitro release behavior of the gentamicin sulfate-encapsulated PLGA microspheres[J]. Chinese Journal of Antibiotics, 2007, 32 (11): 682-685(in Chinese) |
| [14] | 王奎旗, 赵文, 陈梅, 等. 5-氟尿嘧啶缓释微囊的制备[J]. 山东医药工业, 2000, 19(4): 3-5 |
| [15] | 林军. 国内5-氟尿嘧啶新剂型的研究进展[J]. 综述报告, 2003, 12(4): 72-73 |
| [16] | Roullin V G, Deverre J R, Lemaire L, et al. Anti-Cancer drug diffusion within living rat brain tissue: An experimental study using [3H](6)-5-fluorouracil-loaded PLGA microspheres [J]. Eur J Pharmaceut Biopharm, 2002, 53: 293-299 |
| [17] | 凌立君, 魏慧华, 曾莉, 等. 盐酸川芎嗪微囊的制备及质量控制[J]. 中成药, 2006, 11(28): 1 692-1 699 |
| [18] | 熊素彬, 陆彬. 氟尿嘧啶微球的体外释药模式研究[J]. 中国药师, 2003, 6(5): 261-265 Xiong Subin, Lu Bin. Study on the release profile of fluorouracil microspheres in Vitro[J]. China Pharmacist, 2003, 6(5): 261-265(in Chinese) |
| [19] | 魏慧贤, 钟芳, 麻建国. 各相体积比对W/O/W复合乳状液性质的影响[J]. 食品与机械, 2007, 23(6): 35-38 Wei Huixian, Zhong Fang, Ma Jianguo. Influences of volume ratios on stability of W/O/W multiple emulsions[J]. Food & Machinery, 23(6): 35-38(in Chinese) |
| [20] | 郑爱萍, 刘海宏, 李宏斌, 等. 5-氟脲嘧啶壳聚糖微球的制备及体外释放特性[J]. 中国药科大学学报, 2004, 359(4): 318-323 Zheng Aiping, Liu Haihong, Li Hongbin. Preparation and in vitro release of 5-fluorouracil-loaded chitosan microspheres for the intranasal administration[J]. Journal of China Pharmaceutical University, 2004, 359(4): 318-323(in Chinese) |
| [21] | Miyazaki Y, Onuki Y, Yakou S, et al. Effect of temperature-increase rate on drug release characteristics of dextran microspheres prepared by emulsion solvent evaporation process [J]. International Journal of Pharmaceutics, 2006, 324: 144-151 |
| [22] | 李秀娟. 乳化-减压溶剂挥发法制备聚合物微球的研究[D]. 天津: 天津大学,2012 |
| [23] | 杨帆. 干扰素α聚乳酸乙醇酸微球的研究[D]. 广州: 广东药学院,2007 |
 2016, Vol. 33
2016, Vol. 33





