硫化银是一种窄能带半导体材料,具有很高的化学稳定性以及可见光吸收、主红外区透过、光致发光等光学特性,能够应用于光电池、光电导器件、红外检测器和离子导体等领域。当其尺寸接近纳米尺度时,由于表面效应和量子尺寸效应,纳米硫化银显示出优于常规大块材料的光物理及光化学性质,从而在光吸收、传感、催化等方面有着更为广泛的应用前景。因此,硫化银纳米材料的合成成为众学者研究的一个重要内容。
到目前为止,人们已经开发出许多制备纳米硫化银的方法[1, 2, 3, 4]。Lim等[5]通过加热分解十六烷基胺溶剂中的巯基苯酸银而得到方块状纳米硫化银;Liu等[6]采用EDTA为螯合剂,将聚乙二醇辛基苯基醚(Triton X-100)/环己烷/己醇/水的反相微乳液静置3 d得到蠕虫状纳米硫化银;Xiang等[7]采用水热法在180 ℃反应10 h制得球形纳米硫化银。这些方法虽可制备出不同形貌的硫化银纳米材料,但存在着需要使用有机溶剂及有毒化学试剂、反应时间较长或反应温度较高等问题,限制了硫化银纳米材料的放大研究及规模化应用。因此,寻找绿色、快捷、温和的方法制备硫化银纳米颗粒,对于进一步开发硫化银纳米材料的实际应用具有重要意义。
本研究报道了一种以月桂酸银、硫化钠为反应原料,聚乙烯吡咯烷酮(Polyvinyl Pyrrolidone,PVP)为保护剂,去离子水为溶剂,在温和条件下快速合成近单分散米粒状纳米硫化银的方法。在考察了硫源种类、硫源浓度、保护剂等对反应结果影响的基础上,采用该方法室温反应仅0.5 h即得到具有良好光学性能的长度约35 nm的米粒状纳米硫化银颗粒。
1 实验部分 1.1 实验试剂与仪器硝酸银(AgNO3)由中国乐凯胶片集团有限公司提供;月桂酸钠(C12H23O2Na)、九水硫化钠(Na2S·9H2O)、硫脲(CH4N2S)购于天津市光复精细化工研究所;正丁胺(C4H11N)购于阿拉丁试剂有限公司;聚乙烯吡咯烷酮(K10)购于美国Fluka公司。除非特别说明,所有试剂皆为分析纯。实验中所用水为去离子水。
日本理学公司D/MAX-2500型X射线衍射仪、日本岛津公司UV-2550型紫外-可见光谱仪、日本电子公司的JEM 100CXⅡ型透射电子显微镜、英国马尔文公司的Zetasizer Nano ZS-90型纳米粒度电位分析仪。
1.2 米粒状纳米硫化银的制备实验所需的月桂酸银是通过简单的离子交换反应制得的。常温下,按化学计量比称取适量的月桂酸钠和硝酸银,分别将其溶解于水和乙醇体积比为2∶1的混合液后混合搅拌,生成的白色沉淀产物即为月桂酸银。将产物用去离子水和乙醇洗涤若干次,30 ℃烘干后备用。制备过程中发生的化学反应如式(1)所示。
| $\begin{align} & \text{C}{{\text{H}}_{\text{3}}}{{\text{(C}{{\text{H}}_{\text{2}}}\text{)}}_{\text{10}}}\text{COONa+AgN}{{\text{O}}_{\text{3}}}\to \\ & \ \ \ \text{C}{{\text{H}}_{\text{3}}}{{\text{(C}{{\text{H}}_{\text{2}}}\text{)}}_{\text{10}}}\text{COOAg+NaN}{{\text{O}}_{\text{3}}} \\ \end{align}$ | (1) |
为了使反应能够在水相中顺利进行,本实验通过添加少量的胺,使月桂酸银与胺发生络合形成银胺络合物而增加其在水中的溶解度。具体制备过程为:将0.15 mmol的月桂酸银加入盛有10 mL去离子水的烧杯中,滴加少量正丁胺使月桂酸银溶解完全。随后将0.05 g PVP加至上述溶液,搅拌至完全溶解后,加入0.12 mol/L的硫化钠溶液5 mL。混合液颜色立即变为黑色,持续搅拌0.5 h,即可得到硫化银纳米溶胶。
1.3 表征将得到的纳米硫化银溶胶用水稀释,离心洗涤以除去吸附在颗粒表面的保护剂。将离心得到的沉淀在60 ℃烘干后用于X-射线衍射分析。而将得到的沉淀重新分散在水中,即得到纳米颗粒的分散液样品。将液体样品滴在带有碳膜的铜网上,在空气中自然干燥后用于透射电镜测试。将少量反应得到 的纳米硫化银溶胶用去离子水稀释后,在常温下直接用于紫外-可见吸收光谱测定和粒度分布分析。
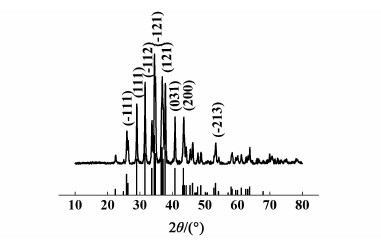
2 结果与讨论 2.1 结构与形貌图 1所示为所得硫化银的XRD谱图(λ=0.15406 nm,扫描角度10°~80°,扫描速率4(°)/min,产物的所有衍射峰指标均与硫化银JC-PDS卡(No.14-1072)中相一致,为单斜结构。图 1中没有杂质峰出现,表明产物纯净;衍射峰的宽化为材料尺寸纳米化所致。图 2a)为1.2所示实验步骤下所得纳米硫化银的TEM照片,观察显示产物为平均长度约35 nm、平均直径约10 nm的形貌较规则的米粒状硫化银纳米颗粒。粒度分布图[图 2b)]表明产物粒径分布较窄,30 nm左右的粒径分布可以与TEM表征结果相互印证。
|
| 图 1 硫化银纳米颗粒的XRD图谱 Fig.1 XRD pattern of as-prepared Ag2S nanoparticles |

|
| 图 2 硫化银纳米颗粒的a)TEM图及b)粒度分布图 Fig.2 a) TEM image and b) particle size distribution of as-prepared Ag2S nanoparticles |
室温下米粒状纳米硫化银的紫外吸收光谱如图 3a)所示。与大块硫化银相比,产物的紫外可见吸收边有明显蓝移。根据半导体禁带理论,半导体材料的禁带宽度与其对紫外可见光的吸收性质有关;通过材料的紫外可见吸收曲线可以简便地计算其禁带宽度[8, 9]。米粒状纳米硫化银的直接跃迁禁带宽度计算公式为:αhν=A(hν-Eg)1/2,其中α为吸收系数,A为比例系数,Eg为禁带宽度。将米粒状纳米硫化银的紫外可见吸收曲线转换可得到如图 3b)所示的(αhν)2~Ehν曲线。将曲线的直线部分外推至α=0,即得米粒状纳米硫化银的直接跃迁禁带宽度,其具体数值为4.4 eV。显然,与大块硫化银(Eg=1.0 eV)相比,本研究制备的米粒状纳米硫化银的禁带宽度明显增大。而半导体材料的禁带宽度与其光学、电学性能密切相关。宽禁带半导体材料可用于制作绿光、蓝光、光探测器件和紫外光器件等;而其因具有击穿电场高、热导率高等特点,非常适合于制作抗辐射、高频、大功率和高密度集成电子器件。

|
| 图 3 Ag2S纳米颗粒的a)紫外-可见吸收光谱和b)Eg计算图 Fig.3 a) UV-Vis spectrum of Ag2S nanoparticles and b) Eg calculation graph |
本研究推测,米粒状硫化银这种明显的禁带宽度增大的产生原因,应主要来自于以下两个方面:1)硫化银纳米颗粒的平均直径较小,仅为10 nm,具有明显的量子尺寸效应,可以增加材料的禁带宽度;2)作为非球形纳米颗粒,其光学性质与其最小部位的具体形貌有着密切的联系,其相应的半导体禁带宽度可受该部位几何尺寸大小的直接影响[10]。两相比较,米粒状纳米硫化银具有的尖端特征,应该是引起其禁带宽度明显增大的主要原因。
2.3 硫源种类及浓度的影响研究表明,硫源种类及浓度对纳米硫化银米粒状形貌的形成具有重要作用,硫化银的形貌随硫源种类及浓度的改变而改变。
例如,当采用硫脲为硫源时,保持其他反应条件不变,同样反应0.5 h后所得产物的形貌就与以硫化钠为硫源时所得的米粒状[图 2a)]截然不同,产物为具有空心结构的纳米颗粒如图 4a)所示。可见反应物硫源分子在结构上的特点与不同,可以对产物特征形貌的形成产生根本性的影响。结合本实验构建的制备体系可以推断,硫脲分子结构上的差异,导致其释放硫元素的具体途径与方式和硫化钠不同。例如在水溶液中,硫化钠分子可以简单地通过直接释放出硫离子的方式参与反应,而硫脲则就必须首先完成接近、附着于银源分子的步骤后,才能在银源分子的近距离直接作用下,进一步地通过断裂分子中的C—S键释放硫元素,完成后续的生成反应。两者在硫元素释放方式上的差异,导致硫化银晶体的成核、后续生长方式乃至相应的反应动力学步骤截然不同,致使由两者生成产物在形貌上也存在着本质上的差异[11]。因而,反应物硫源物质的具体分子结构,对其产物特征形貌的形成有着极为重要的影响。

|
| 图 4 不同条件下制备的纳米硫化银的TEM图 Fig.4 TEM images of Ag2S nanoparticles prepared with different experiment conditions |
而维持其他条件不变,仅将硫化钠浓度从原先的0.12 mol/L降低至0.03 mol/L,则反应0.5 h所得Ag2S颗粒的形貌为粒径大约仅为10 nm的实心近球形[图 4b)],对比图 2a)可见,硫源浓度对产物形貌有着明显的影响。一个可能的原因是,当硫源浓度较低为0.03 mol/L时,由于单位溶液体积内反应物浓度较低,不利于已生成的晶核去进一步捕获体系中的原料物质,以便其完成随后的整个生长过程,直至成长为具有特定形貌特征的纳米颗粒[12]。同时在另一方面,在硫化钠整体浓度较低(0.03 mol/L)的前提下,依旧维持0.5 h这样一个较短的反应历程,已生成晶核没有充足的反应时间成长为具有一定形貌特征的纳米颗粒;该反应条件下所获产物,实质上是仅具有反应初始阶段特征的、尺度较小的近球形纳米颗粒。硫化钠浓度为0.03 mol/L时,通过适当的延长反应时间最终也可得到米粒状硫化银,与上述分析相符合。
2.4 保护剂与银源的影响在纳米颗粒的制备过程中,保护剂通常可以起到分散、保护乃至形貌调节等方面的多重作用。为此,本文有针对性的设计了一个不含PVP的制备体系,以详细考察大分子PVP在本体系中所起的具体作用与影响。所获结果的TEM照片如图 5a)所示。对比此前含有PVP的制备体系所得产物的透射电镜图 2a)可以推断,PVP在本体系中所起的作用主要应该是体现在以下两个不同方面。首先,纳米颗粒轮廓清晰、饱满的米粒状特征的出现有赖于形成过程中PVP分子的现场存在;其次,所添加的PVP分子至少部分或不同程度地参与了构建颗粒形成所要求的一个基本化学环境、生长过程所需要的一个相对独立的纳米空间[13]。同时,仔细观察图 5a)可以发现,尽管原先特征的米粒状形貌已基本消失殆尽,部分产物甚至在局部呈现出轻微的团聚现象,但依然有为数众多的纳米尺度小颗粒能够正常生成,暗示除了PVP所提供的保护作用,体系中应该存在着一个基本的,且具有一定分散与保护效果的影响因素、分子或物种。根据本体系的组成特点可以推断,除了上述考察的硫源及PVP外,最有可能成为这一基本的影响因素或保护分子、物种的就只能是作为参与反应的银源月桂酸银了。为此,选择在维持其他实验条件不变的情况下,通过单纯地改变银源物质的种类与结构,来证明这一推测。研究显示,以硝酸银代替月桂酸银后,产物形貌与图 2a)相比,现了根本的改变,不但其特征尺度大为增加,形状也大多呈现不规则状态,且在不同区域出现了明显的团聚与长大现象,如图 5b)所示。由于实验中银源物种的改变仅涉及与银离子结合的荷负电部分的结构基团,因而出现上述现象的合理解释应该是,体系中大量存在的、具有较长碳链结构的月桂酸根基团,提供了颗粒形成所需的基本化学环境,阻止了已生成颗粒的进一步长大与团聚,构建了纳米尺度颗粒生成过程得以顺利完成的独立空间[14]。

|
| 图 5 纳米硫化银的TEM图 Fig.5 TEM images of Ag2S nanoparticles |
采用一种绿色、快捷、温和的合成方法,利用月桂酸银和硫化钠为原料,PVP为保护剂,常温常压下在水相中快速合成了具有良好光学性能的近单分散米粒状纳米硫化银颗粒。其中,硫化银米粒状特征的形成有赖于PVP的存在;硫化银的形貌随硫源的改变而改变;而且较高的硫化钠浓度可缩短米粒状硫化银的形成时间,当硫化钠浓度为0.12 mol/L时,仅需反应0.5 h即可得到米粒状硫化银。采用该方法无需严苛的反应条件,原料环保,为形貌可控硫化物纳米材料的制备提供了一条快捷有效的途径。
| [1] | Ma X, Chi H, Yue H, et al. Hydrogenation of dimethyl oxalate to ethylene glycol over mesoporous Cu-MCM-41 catalysts[J]. AIChE Journal, 2013, 59: 2 530-2 539 |
| [2] | Zhao S, Yue H, Zhao Y, et al. Chemoselective synthesis of ethanol via hydrogenation of dimethyl oxalate on Cu/SiO2: Enhanced stability with boron dopant[J]. Journal of Catalysis, 2013, 297(1): 142-150 |
| [3] | Zhao L, Zhao Y, Wang S, et al. Hydrogenation of dimethyl oxalate using extruded Cu/SiO2 catalysts: Mechanical strength and catalytic performance[J]. Industrial & Engineering Chemistry Research, 2012, 51(43): 13 935-13 943 |
| [4] | Gong J, Yue H, Zhao Y, et al. Synthesis of ethanol via syngas on Cu/SiO2 catalysts with balanced Cu-0-Cu+ sites[J].Journal of the American Chemical Society, 2012, 134(34): 13 922-13 925 |
| [5] | Yue H, Zhao Y, Ma X, et al. Ethylene glycol: Properties, synthesis, and applications[J]. Chemical Society Reviews, 2012, 41(11): 4 218-4 244 |
| [6] | Yue H, Zhao Y, Zhao L, et al. Hydrogenation of dimethyl oxalate to ethylene glycol on a Cu/SiO2/cordierite monolithic catalyst: Enhanced internal mass transfer and stability[J]. AIChE Journal, 2012, 58(9): 2 798-2 809 |
| [7] | Yin A, Wen C, Dai W, et al. Surface modification of HMS material with silica sol leading to a remarkable enhanced catalytic performance of Cu/SiO2[J]. Applied Surface Science, 2011, 257(13): 5 844-5 849 |
| [8] | Yin A, Guo X, Fan K, et al. Influence of copper precursors on the structure evolution and catalytic performance of Cu/HMS catalysts in the hydrogenation of dimethyl oxalate to ethylene glycol[J]. Applied Catalysis A: General, 2010, 377(1/2): 128-133 |
| [9] | Yin A, Guo X, Fan K, et al. Ion-Exchange temperature effect on Cu/HMS catalysts for the hydrogenation of dimethyl oxalate to ethylene glycol[J]. Chem Cat Chem, 2010, 2(2): 206-213 |
| [10] | Guo X, Yin A, Dai W, et al. One pot synthesis of ultra-high copper contented Cu/SBA-15 material as excellent catalyst in the hydrogenation of dimethyl oxalate to ethylene glycol[J]. Catalysis Letters, 2009, 132(1/2): 22-27 |
| [11] | Yin A, Guo X, Dai W, et al. The nature of active copper species in Cu-HMS catalyst for hydrogenation of dimethyl oxalate to ethylene glycol: New insights on the synergetic effect between Cu0 and Cu+[J]. Journal of Physical Chemistry C, 2009, 113(25): 11 003-11 013 |
| [12] | Chen L, Guo P, Qiao M, et al. Cu/SiO2 catalysts prepared by the ammonia-evaporation method: Texture, structure, and catalytic performance in hydrogenation of dimethyl oxalate to ethylene glycol[J]. Journal of Catalysis, 2008, 257(1): 172-180 |
| [13] | Yin A, Guo X, Dai W, et al. Highly active and selective copper-containing HMS catalyst in the hydrogenation of dimethyl oxalate to ethylene glycol[J]. Applied Catalysis A: General, 2008, 349(1/2): 91-99 |
| [14] | Van Der Grift C J G, Elber P A, Mulder A, et al. Preparation of silica-supported copper catalysts by means of deposition-precipitation[J]. Applied Catalysis, 1990, 59 (1): 275-289 |
| [15] | Toupance T, Kermarec M, Lambert J F, et al. Conditions of formation of copper phyllosilicates in silica-supported copper catalysts prepared by selective adsorption[J]. Journal of Physical Chemistry B, 2002, 106(9): 2 277-2 286 |
| [16] | Yue H, Zhao Y, Zhao S, et al. A copper-phyllosilicate core-sheath nanoreactor for carbon-oxygen hydrogenolysis reactions[J]. Nature Communications, 2013, 4(9): 2 339-2 339 |
| [17] | Poels E K, Brands D S. Modification of Cu/ZnO/SiO2 catalysts by high temperature reduction[J]. Applied Catalysis A: General, 2000, 191(1/2): 83-96 |
| [18] | Hidemitsu T, Yoshio O, Tominaga K. Spectroscopic study of Cu(II) ions supported on silica gel by cation exchange method[J]. Journal of Catalysis, 1975, 40(2): 197-202 |
 2016, Vol. 33
2016, Vol. 33





