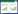甲氧基丙烯酸酯类杀菌剂是一类低毒、高效、广谱、内吸性杀菌剂,是世界农药界极具发展潜力和市场活力的新型农用杀菌剂[1]。吡唑醚菌酯(Pyraclostrobin)又名唑菌胺酯[2],是目前活性最高的甲氧基丙烯酸酯类杀菌剂,由德国巴斯夫公司于1993年开发研究,并于2002年在欧洲市场推出,与氟环唑复配用于防治谷物病害,在50多个国家登记100多种作物,也可用于非农作物[3]。该药具有高效、低毒、对环境友好、适用作物广泛等特点。自吡唑醚菌酯上市以来的短短几年,该品种的市场迅速飙升,销售额迅速上升,已列为所有菌剂品种市场的第2位,仅次于嘧菌酯[4]。
吡唑醚菌酯在美国、欧洲等国家拥有专利权,在我国也申请了专利,其合成技术尚未公开,研究其合成工艺对改善我国的落后的农药结构,降低传统杀菌剂对环境的污染有着非常重要意义。综合文献其合成方法主要归为以下两种,均以邻硝基甲苯和对氯苯胺为起始原料,反应主要包括环合、氧化、还原、酰化、甲基化、溴化和缩合共七步生成最终目标物[5, 6, 7, 8, 9, 10, 11]。合成路线主要有两种,如图1所示。

|
| 图 1 合成路线示意图 Fig.1 Schematic scheme of synthesis |
中间体1-(4-氯苯基)-3-吡唑醇的合成路线如图2所示[12, 13]。

|
| 图 2 中间体合成路线示意图 Fig.2 Schematic scheme of the synthesis of intermediate |
本研究采用了合成路线二,对邻硝基甲苯先进行还原、酰化、甲基化后进行溴化,由于强吸电子基团硝基消失,故路线二较路线一溴化更容易一些。本研究对整个工艺进行优化,并对关键步骤溴化进行了改进,提出溴化反应结束后未经提取产物,直接进入下一步缩合反应,原因是一溴代物与剩余原料及副产物二溴代物分离相当困难,而且通过研究表明对于下一步缩合和反应整体收率影响不大,且减少了操作程序,提高了效率。该工艺具有反应原料易得,条件温和,产品纯度高等优点,适合工业化生产。
1 试验部分 1.1 试剂与仪器对氯苯胺和氯甲酸甲酯为工业品,其他试剂均为市售分析纯。
1H-NMR由美国Burker AV500型核磁共振仪测定(TMS内标,CDCl3或CD3OD为溶剂);质谱由英国VG公司VGZAB-HS型质谱仪测定;熔点由YRT—3型药物熔点仪测定。
1.2 合成 1.2.1 1-(4-氯苯基)-3-吡唑醇的合成 1.2.1.1 对氯苯肼盐酸盐的合成250 mL三口瓶中依次加入对氯苯胺38.4 g(0.301 mol)、工业浓盐酸110 g(0.903 mol)、水144 g,5 ℃以下滴加亚硝酸钠溶液[亚硝酸钠22.8 g(0.330 mol)+水98 g],滴毕反应30 min,过滤得重氮盐溶液。
500 mL三口瓶中依次加入亚硫酸钠94.5 g(0.75 mol)、水400 g,10 ℃左右滴加重氮盐溶液,滴完反应30 min后,加锌粉2 g(0.0357 mol),升温至70 ℃反应3 h,热过滤,将滤液升至80 ℃,滴加工业浓盐酸进行酸化,滴毕80 ℃下反应2 h,冷却至室温,有白粉色固体析出,过滤得产品55.0 g,纯度97.5%(LC),收率99.5%,熔点223.5~ 228.5 ℃(分解),文献值225~230 ℃[14]。
对氯苯肼盐酸盐用氢氧化钠溶液中和制得对氯苯肼,核磁测试结果如下:1H-NMR(500 MHz,CD3Cl)δ:6.75(d,2H,—H—Ar),7.17(d,2H,—H—Ar),5.2(s,1H,—NH),3.57(s,2H,—NH2)。 对氯苯肼盐酸盐ESI(m/z):142.0(M+)。
1.2.1.2 1-(4-氯苯基)吡唑烷-3-酮(1)的合成250 mL三口瓶中加入无水乙醇200 g,称取固体钠10.5 g(0.456 mol),现制乙醇钠溶液,40 ℃下加入对氯苯肼盐酸盐27.5 g(0.153 mol),搅拌30 min后,滴加丙烯酸甲酯17.5 g(0.203 mol),30 min滴毕,保温反应1.5 h后升温回流反应4.0 h,减压去除溶剂得粗品,加适量水溶解固体,10%乙酸溶液调pH值至5~6,冷却过滤得产品19.0 g,纯度97.0%(LC),收率61.0%。
1H-NMR(500 MHz,CD3OD)δ:8.5(s,1H,—NH),7.0(d,2H,—H—Ar),7.3(d,2H,—H—Ar),3.9(t,2H,—CH2),2.5(t,2H,—CH2)。
1.2.1.3 1-(4-氯苯基)-3-吡唑醇(2)的合成500 mL三口瓶中依次加入吡唑酮19.65 g(0.1 mol),三氯化铁2.36 g(0.0145 mol),质量分数为5%的氢氧化钾溶液200 g,通空气,1.0 h升温至80 ℃,反应8.0 h氧化完全,加大量水,冷却至室温,用盐酸酸化至pH值为1~2,有浅黄色固体析出,冷却过滤得产品19.7 g,纯度97.7%(LC),收率99.0%。
1H-NMR(500 MHz,CD3OD)δ:10.3(w,1H,—OH),7.6(d,2H,—H—Ar),7.4(d,2H,—H—Ar),7.9(d,1H,—CH),5.8(d,1H,—CH)。
1.2.2 N-羟基-N-2-甲基苯基氨基甲酸甲酯(4)的合成500 mL三口瓶中依次加入邻硝基甲苯31.2 g(0.228 mol),二氯乙烷250 g,氮气保护下加入镍粉5.5 g(0.0932 mol),0~5 ℃下滴加水合肼32 g(0.467 mol),30 min滴毕,氮气保护搅拌反应6~7 h,过滤去除镍粉,盐酸调pH值至4~5,萃取分层取有机相,加100 g水,5~10 ℃下滴加氯甲酸甲酯21 g(0.222 mol),30 min滴毕,保温反应1.0 h,萃取分层取有机相,减压蒸干溶剂,50 ℃下加甲苯80 g,搅拌30 min,冷却析出固体,抽滤得白色固体36.5 g,纯度99.0%(LC),收率为87.6%。
1H-NMR(500 MHz,CD3Cl)δ:8.26(w,1H,—OH),7.2~7.4(m,4H,—H—Ar),3.77(s,3H,—CH3),2.33(s,3H,—CH3)。
1.2.3 N-甲氧基-N-2-甲基苯基氨基甲酸甲酯(5)的合成1 000 mL三口瓶中依次加入N-羟基-N-2-甲基苯基氨基甲酸甲酯31 g(0.171 mol),无水碳酸钾35 g(0.254 mol),二氯甲烷600 g,搅拌加热至58~60 ℃,滴加硫酸二甲酯23.7 g(0.188 mol),30 min滴毕,保温反应6.0 h后,加适量水,升温至70 ℃,保温1.0 h后停止加热,用水洗涤萃取3次,取有机层减压蒸溶剂,得橙黄色液体33.5 g,纯度98.2%(LC),收率99.3%。
1H-NMR(500 MHz,CD3Cl)δ: 7.2~7.4(m,4H,—H—Ar),3.74(s,3H,—CH3),3.69(s,3H,—CH3),2.25(s,3H,—CH3)。
1.2.4 N-甲氧基-N-2-溴甲苯氨基甲酸甲酯(6)的合成500 mL三口瓶中依次加入N-甲氧基-N-2-甲苯氨基甲酸甲酯19.5 g(0.1 mol),过氧化苯甲酰(BPO)1.21 g(0.05 mol),NBS18.15 g(0.102 mol),四氯化碳180 mL,回流反应5 h,抽滤,蒸干溶剂得橙黄色黏稠液体33.8 g,液相测目标产物含量为66.9%。
1.2.5 吡唑醚菌酯(7)的合成500 mL三口瓶中依次加入1-(4-氯苯基)-吡唑醇15.56 g(0.080 mol),无水碳酸钾20.7 g(0.15 mol),丙酮150 mL,四丁基溴化铵0.82 g(0.0030 mol),升温至回流,将上一步所得N-甲氧基-N-2-溴甲苯氨基甲酸甲酯溶于50 mL丙酮滴加至三口瓶中,3.0 h滴毕,回流反应6.0 h,抽滤,减压蒸干溶剂,加入无水甲醇90 mL,搅拌至全溶,冷却有晶体析出,过滤得浅黄色固体17.8 g,纯度98.4%(LC),收率56.5%,熔程61.5~62.9 ℃(文献值63.7~65.2 ℃[3])。
1H-NMR(500 MHz,CD3Cl)δ:7.36~7.67(m,8H,—H—Ar),7.69(d,1H,—CH),5.93(d,1H,—CH),5.35(s,2H,—CH2),3.80(s,3H,—CH3),3.77(s,3H,—CH3);ESI(m/z):315(M+1)。
2 结果与讨论 2.1 对氯苯肼盐酸盐的合成 2.1.1 还原反应还原反应中加入锌粉可以使还原完全,同时使副产物中偶氮化合物的氮氮双键还原为单键,使偶氮化合物颜色变浅,提高外观质量。本研究在其它条件不变情况下,考察了锌粉的加入量对反应的影响,结果见表1。
| m(锌粉)/ m(对氯苯胺) | 产物质量分数/% | 产物外观 |
| 0.03 | 93.1 | 粉红色 |
| 0.04 | 94.7 | 粉红色 |
| 0.05 | 97.5 | 白粉色 |
| 0.06 | 97.2 | 白粉色 |
实验表明,锌粉的加入量为对氯苯胺质量的0.05时,已能明显提高外观质量,少于0.03达不到外观要求,大于0.05无进一步改观。
2.1.2 酸化反应用盐酸进行酸析时,有明显的放热现象,同时反应放出大量的SO2气体,可使产物氧化,本研究考察了酸化温度对于产物的影响,结果见表2。
| 还原温度/℃ | 75 | 80 | 85 | 90 |
| 产物收率/% | 84 | 96 | 97 | 80 |
结果表明,酸析温度高于85 ℃使副产物明显增加,若温度低于80 ℃,酸析不完全,酸析温度为80~85 ℃时,产物收率最佳。
2.2 1-(4-氯苯基)-3-吡唑酮的合成1)溶剂的选择:在反应时间为6 h,其他条件不变的情况下,分别考察了甲苯、乙醇、甲苯和乙醇混合体作溶剂对反应的影响,结果见表3。
| 溶剂 | 产物质量分数/% | 产物收率/% |
| 甲苯 | 85.2 | 49.0 |
| 甲苯+乙醇 | 95.6 | 59.3 |
| 乙醇 | 97.0 | 64.3 |
结果表明乙醇作溶剂,所得产品质量含量及收率最高。由于甲苯沸点较乙醇沸点高,在乙醇回流温度下反应副产物少,反应速率快,回流反应4 h几乎完毕,而且乙醇相对较环保。对于甲苯和乙醇混合体系,所得产品质量含量和收率相对较低,而且单一溶剂有利于回收利用。
2)反应温度对收率的影响:吡唑酮是由苯肼和酯经过麦克加成、合环两步反应合成,对于合环反应的温度做了对比实验研究,结果见表4。
| 反应温度/℃ | 反应时间/h | 产物收率/% |
| 65~70 | 10 | 30.1 |
| 71~75 | 7 | 42.0 |
| 78~80 | 4 | 64.3 |
| 81~85 | 4 | 47.7 |
结果表明:反应在78~80 ℃下反应,产物收率较高。温度太低,苯肼和酯不能充分环合,反应不彻底。温度太高,反应物和溶剂容易分解且产物收率下降。
综上所述,较优反应条件为:乙醇作溶剂,在回流温度下反应4 h,产品含量97.0%(LC),收率61.0%。
2.3 1-(4-氯苯基)-3-吡唑醇合成的影响因素讨论1)溶剂的选择:此步反应属于氧化反应,对于反应溶剂本研究选用了不同质量分数的KOH水溶液,DMF和NaOH水溶液做了对比研究,结果见表5。
| 反应溶剂 | 产物质量分数/% | 产物收率/% |
| DMF | 98.0 | 81.8 |
| 5%KOH | 97.7 | 99.5 |
| 10%KOH | 97.5 | 99.1 |
| 15%KOH | 97.8 | 99.2 |
| 5%NaOH | 97.3 | 95.3 |
结果表明,当溶剂选用质量分数为5%的KOH水溶液时,产品纯度和收率较高,选用质量分数为10%和15%的KOH作溶剂时,产品质量含量和收率没有明显的提高。对于DMF作溶剂,产品含量及收率相对低,从环保的角度来考虑,水溶液更环保一些;这些溶剂反应所需时间基本相同,约7~8 h,故本实验选用质量分数为5%的KOH水溶液作溶剂。
2)催化剂三氯化铁用量的影响结果见表6。
| m(FeCl 3)/ m(吡唑酮) | 产物质量分数/% | 产物收率/% |
| 0.08 | 95.4 | 69.0 |
| 0.12 | 97.7 | 99.5 |
| 0.16 | 96.7 | 99.6 |
结果表明,m(FeCl3)/m(吡唑酮)为0.08时,产品含量及收率都相对较低,0.16时,产物含量及收率无近一步提升,0.12时产物含量及收率较高。
综上所述,较优反应条件为:5%KOH的水溶液作溶剂,m(FeCl3)/m(吡唑酮)为0.12,产品含量97.7%(LC),收率99.0%。
2.4 N-羟基-N-2-甲基苯基氨基甲酸甲酯合成的影响因素此步反应必须在氮气保护下进行,否则镍粉很容易被氧化从而失去活性。反应温度应在0~5 ℃,大于5 ℃硝基会被直接还原为氨基,使产品质量含量和收率低。催化剂镍粉的加入量对反应影响也很大,本研究考察了镍粉的加入量对反应时间的影响,结果见表7。
| n(镍粉)/ n(邻硝基甲苯) | 0.24 | 0.36 | 0.48 | 0.72 |
| 还原时间/h | 13.0 | 10.0 | 6.0 | 5.5 |
催化剂的量偏低会导致反应速率较慢,实验结果表明n(镍粉)/n(邻硝基甲苯)为0.48时,反应时间相对较短,大于0.48,时间没有明显缩短,小于0.48,反应较慢,时间较长。
综上所述,较优反应条件为0~5 ℃下,氮气保护,n(镍粉)/n(邻硝基甲苯)为0.48,产品含量99.0%(LC),收率87.6%。
2.5 N-甲氧基-N-2-甲基苯基氨基甲酸甲酯的合成常用的甲基化试剂有硫酸二甲酯和碳酸二甲酯,本研究考察了这两种甲基化试剂加入量对反应的影响,结果见表8。
| 甲基化试剂 | n(甲基化试剂)/ n(原料) | 反应时间/h | 产物质量分数/% | 产物收率/% |
| 碳酸二甲酯 | 1.1 | 20.0 | 50.7 | 45.3 |
| 硫酸二甲酯 | 1.0 | 20.0 | 96.8 | 97.4 |
| 硫酸二甲酯 | 1.1 | 6.0 | 97.2 | 98.6 |
| 硫酸二甲酯 | 1.2 | 5.5 | 93.4 | 98.0 |
实验结果表明,选用碳酸二甲酯因其活性低,故副反应多,产品质量含量和收率低,且反应时间较长。选用硫酸二甲酯,反应速度快,几乎没有副反应发生。n(硫酸二甲酯)/n(原料)为1.1时产品质量含量及收率高,产品颜色浅,反应时间短;为1.2时,反应时间没有太多的缩短,但因为其活性高而发生副反应,导致产品颜色较深;为1.0时,反应较慢,所用时间较长。
综上所述,硫酸二甲酯作甲基化试剂,n(硫酸二甲酯)/n(原料)为1.1,6 h反应完毕,所得产品含量98.2%(LC),收率99.5%。
2.6 N-甲氧基-N-2-溴甲苯氨基甲酸甲酯的合成此步反应属于自由基反应,对于自由基反应的影响因素很多,本研究从引发剂的种类及其用量,溴化剂这几个影响因素进行了研究。
1)在n(N-甲氧基-N-2-甲苯氨基甲酸甲酯)∶n(NBS)∶n(引发剂)=1.00∶1.02∶0.50,四氯化碳作溶剂,回流反应5 h的条件下考察了引发剂AIBN和BPO对反应的作用效果,结果见表9。
| 引发剂 | 原料转化率/% | 一溴代物生成率/% |
| AIBN | 51.1 | 48.3 |
| BPO | 90.0 | 80.2 |
因为AIBN分解温度是64 ℃,其使用温度范围一般在45~65 ℃,80 ℃左右会急剧分解,其1 h半衰期温度是82 ℃。而BPO一般在60~80 ℃分解,故在四氯化碳回流温度下引发剂BPO作用效果远比AIBN好。
2)在n(N-甲氧基-N-2-甲苯氨基甲酸甲酯)∶n(NBS)=1.00∶1.02,四氯化碳作溶剂,回流反应5 h的条件下考察了BPO的用量对反应的影响,结果见表10。
| n(BPO)/ n(原料) | 原料转化率/% | 一溴代物生成率/% | 二溴代物生成率/% |
| 0.03 | 68.6 | 60.4 | 1.5 |
| 0.04 | 82.2 | 75.8 | 3.5 |
| 0.05 | 90.0 | 80.2 | 4.3 |
| 0.06 | 91.3 | 78.3 | 5.2 |
| 0.07 | 92.2 | 73.5 | 6.2 |
结果表明,n(BPO)/n(原料)为0.05时,原料转化率及目标产物收率相对较高;大于0.05时,导致二溴代物的生成率提高;小于0.05时,原料转化率及一溴代物生成率都较低。因为自由基反应中,引发剂量不足会使自由基生成速率低,从而使反应速率慢,原料转化率低。过量则自由基生成速率快,反应速率也快,导致副产物二溴代物生成率提高,另外过量的引发剂也会导致自由基猝灭而影响反应。
3)溴化剂的选择:溴化剂常用的有溴素,溴化氢及NBS,本研究选用NBS,其特点是可以持续的提供低浓度的液溴。虽然可以用稀释的液溴代替,但液溴存取不方便,且稀释的程度不易控制,故选用NBS较适宜。n(NBS)/n(原料)为1.02,过量会导致二溴代物生成率增加,不足原料转化率低。由于未反应的原料、一溴代产物和二溴代产物不好分离,故将得到的粗品直接进入下一步反应,结果表明对最终产物的收率影响不大,且可以减少操作。
通过实验研究,较适宜物料配比为n(N-甲氧基-N-2-甲苯氨基甲酸甲酯)∶n(NBS)∶n(过氧化苯甲酰)=1.00∶1.02∶0.50,四氯化碳作溶剂,回流(79~80 ℃)反应5 h,过滤,蒸干溶剂得橙黄色黏稠液体33.8 g,液相测目标产物66.9%。
2.7 吡唑醚菌酯的合成对于产品的结晶溶剂,本研究选用异丙醇,乙醇,甲醇做了对比研究,结果见表11。
| 溶剂 | 产品质量分数/% | 产品收率/% |
| 异丙醇 | 98.2 | 52.0 |
| 乙醇 | 98.0 | 52.5 |
| 甲醇 | 98.4 | 53.6 |
结果表明,甲醇效果较佳,而且价格比异丙醇低,降低成本。
通过实验研究,最适宜物料配比为n(N-甲氧基-N-2-溴甲苯氨基甲酸甲酯)∶n(1-(4-氯苯基)-3-吡唑醇)∶n(无水碳酸钾)∶n(四丁基溴化铵)=1.00∶1.00∶1.50∶0.03,丙酮做溶剂,回流反应6 h,用甲醇后处理后所得产品纯度为98.4%(LC),收率58.5%。
3 结论对吡唑醚菌酯的合成工艺进行了研究改进:以对氯苯胺为原料经过重氮化、还原、酸化及氧化四步反应合成中间体1-(4-苯基)-3-吡唑醇,LC测得含量为97.7%,总收率为60.7%;以邻硝基甲苯为原料,经过还原,酰化,溴化后再与中间体1-(4-苯基)-3-吡唑醇反应生成目标化合物吡唑醚菌酯,LC测得纯度大于98.4%,总收率大于56.7%(以邻硝基甲苯计),比现有文献有了较大提高[5, 12],并对合成的关键步骤溴化做了优化改进,减少了副产物的生成,提高收率,降低成本,整个反应过程操作简单,较适合工业化生产,具有很好的应用前景。
| [1] | 张国生.甲氧基丙烯酸酯类杀菌剂的应用、开发现状及展望[J]. 农药科学与管理, 2003, (12): 30-34 Zhang Guosheng. Application, present development situation and prospects of the Strobilurins fungicides[J]. Pesticide Science and Administration, 2003, (12): 30-34 (in Chinese) |
| [2] | 柏亚罗.Strobilurins 类杀菌剂研究开发进展[J].农药, 2007, 46(5): 290-305 Bo Yaluo. Research and development progress of Strobilurins fungicides[J]. Pestices, 2007, 46(5): 290-305(in Chinese) |
| [3] | Ammermann E, Lorenz G, Scgekberger K. In the british crop protection council conference pest & disease[M]. British Crop Protection Council,Brighton UK, 2000, 541-548 |
| [4] | 赵平, 严秋旭, 李新, 等. 甲氧基丙烯酸酯类杀菌剂的开发及抗性发展现状[J]. 农药, 2011, (8): 547-551, 572 Zhao Ping, Yan Qiuxu, Li Xin, et al. Development and current situation of the resistance development of Strobilurins fungicides[J]. Pestices, 2011, (8): 547-551, 572 (in Chinese) |
| [5] | 陶贤鉴, 罗亮明, 黄超群, 等. 吡唑醚菌酯的合成研究[J]. 农药研究与应用, 2009, (1):16-17, 21 Tao Xianjian, Luo Liangming, Huang Chaoqun, et al. Synthesis of pyraclostrobin. [J]. Research and Application of Pesticides, 2009, (1):16-17, 21 (in Chinese) |
| [6] | Call H P. Process for deligification of a lignin containing pulp: US,6103509[P]. 2000-08-15 |
| [7] | Lorenz G,Muelller B. Canbamates and crop protection agents containing them: WO, 9315046[P].1993-08-05 |
| [8] | 李仲英, 李江胜, 刘卫东. N-甲氧基-N-2-甲基苯基氨基甲酸甲酯的合成工艺研究[J]. 湖南大学学报, 2004, 2(1): 4-6 Li Zhongying, Li Jiangsheng, Liu Weidong. Synthesis of N-methoxy-N-2-methyl phenyl carbamate [J]. Journal of Hunan University, 2004, 2(1): 4-6(in Chinese) |
| [9] | Freudenreich J, Stohrer J. Method for producing organic hydroxylamines: US, 6211410[P]. 2001-04-03 |
| [10] | Chapman D W, Caskey D C. Process for the preparation of arylhydroxylamines: EP, 0086363[P]. 1983-08-24 |
| [11] | 张永臣. 唑菌胺酯的合成工艺研究[D]. 哈尔滨:黑龙江大学, 2009 Zhang Yongchen. Synthesis of pyraclostrobin[D]. Haerbin: Hei Longjiang University, 2009 (in Chinese) |
| [12] | Henry H B. Improvement in the manufacture of hydroxyammo compounds: GB,493960[P].1938-10-18 |
| [13] | Davis G C. Moderated reduction reactions for producing arylhydroxvlamine: US, 4723030[P].1988-02-02 |
| [14] | 潘富友, 杨健国, 梁华定, 等. 对氯苯肼盐酸盐的合成工艺[J]. 应用化学, 2001, (12): 1 001-1 003 Pan Fuyou, Yang Jianguo, Liang Heading, et al. The synthesis of p-chlorophenylhydrazine hydrochloride[J]. Applied chemistry, 2001, (12): 1 001-1 003 (in Chinese) |
 2016, Vol. 33
2016, Vol. 33